Цитология, 2020, T. 62, № 10, стр. 745-752
Влияние мезенхимных стволовых клеток на реактивность гладкомышечных клеток пиальных артерий у нефрэктомированных крыс
И. Б. Соколова 1, *, Н. Н. Павличенко 2
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 ООО Транс-Технологии
192148 Санкт-Петербург, Россия
* E-mail: SokolovaIB@infran.ru
Поступила в редакцию 09.06.2020
После доработки 26.06.2020
Принята к публикации 02.07.2020
Аннотация
Цель исследования – оценить ухудшение сократительной функции гладкомышечных клеток пиальных артерий крыс после субтотальной нефрэктомии и возможность ее сохранения с помощью трансплантации мезенхимных стволовых клеток человека (МСКч). С помощью установки для изучения микроциркуляции (с увеличением в 160 раз) исследовали реактивность пиальных артерий сенсомоторной коры головного мозга нефрэктомированных, ложнооперированных и нефрэктомированных крыс после внутривенной трансплантации МСКч на воздействие сероводорода (H2S), неселективного ингибитора NO-синтазы L‑NAME и H2S на фоне L-NAME. Параллельно с помощью лазерного допплерографа “ЛАКК-М” определяли миогенный тонус церебральных сосудов. Результаты показали, что через 4 мес после нефрэктомии у крыс значительно ухудшалась реактивность пиальных артерий на H2S (количество расширившихся артерий уменьшилось в 1.2–1.7 раза) и L-NAME (степень уменьшения диаметра артерий была ниже на 6–17%). Миогенный тонус церебральных сосудов после нефрэктомии был в 1.5 раза выше, чем у контрольных крыс. Внутривенное введение МСКч нефрэктомированным крысам привело к сохранению миогенного тонуса и реактивности ГМК на уровне контрольных показателей. Можно заключить, что применение МСКч позволяет сохранить функции ГМК церебральных артерий после нефрэктомии.
Ауторегуляция мозгового кровотока осуществляется с помощью нейрональных, метаболических, эндотелиальных и миогенных механизмов. Ведущим звеном является миогенный ответ, на который другие вышеназванные факторы оказывают модулирующее действие (Александрин, 2007). Регуляция просвета кровеносного сосуда осуществляется за счет сокращения или расслабления гладкомышечных клеток (ГМК) средней оболочки сосудистой стенки. В молодых здоровых сосудах преобладают ГМК сократительного фенотипа. Хроническая болезнь почек (ХБП) приводит к накоплению в крови уремических токсинов (Assem et al., 2018), которые способствуют развитию в сосудистой стенке воспаления, окислительного стресса (Gouroju et al., 2017) и отложению солей кальция (Jono et al., 2006). Сократительный фенотип ГМК изменяется на синтетический: начинается секреция тромбоцитарного фактора роста и щелочного фактора роста фибробластов, усиливающих пролиферацию ГМК (Monroy et al., 2015). В результате имеют место все составляющие ремоделинга сосудистого русла: повреждение нативных ГМК, их кальцификация, развитие фиброза и гиперплазия интимы (Ikram et al., 2008; Hénaut et al., 2018), что приводит к значительному утолщению стенки сосуда, снижению ее эластичности и ухудшению газообменa между кровью и тканью.
В последнее десятилетие применение мезенхимных стволовых клеток (МСК) при ХБП рассматривают как перспективный метод лечения (Lin, 2008; Hu, Zou, 2017). Клеточная терапия направлена на сохранение структуры и функции почки (Choi et al., 2009; Asanuma et al., 2010). Вопрос о влиянии трансплантации МСК на микроциркуляцию в головном мозге пациентов с ХПБ практически не исследован.
Целью представленного исследования являлась оценка ухудшения сократительной функции ГМК пиальных артерий крыс после субтотальной нефрэктомии и возможность ее сохранения с помощью трансплантации мезенхимных стволовых клеток человека. Сократительную функцию ГМК исследовали при воздействии сероводорода (H2S). Раствор гидросульфида натрия, как донора H2S, широко используется в экспериментальной практике (Колесников и др., 2015). В большинстве работ при воздействии H2S было отмечено увеличение диаметра исследуемых сосудов (Streeter et al., 2012; Dunn et al., 2016; Patel et al., 2018; Hart, 2020).
МАТЕРИАЛ И МЕТОДИКА
Работа проведена на животных из биоколлекции “Коллекция лабораторных млекопитающих разной таксономической принадлежности” Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. Исследования проводили в соответствии с “Правилами лабораторной практики” МЗСР РФ № 708н от 23.08.10, Директивой 2010/63/EU Европейского парламента и Совета Европейского Союза по охране животных, используемых в научных целях, и рекомендациями биоэтической комиссии Института физиологии им. И.П. Павлова РАН.
Животные. Эксперименты проведены на самцах крыс Wistar (n = 61). Животных содержали в стандартных условиях вивария при естественном освещении и свободном доступе к воде и пище. В начале эксперимента возраст животных составлял 3 мес, масса 250–280 г. Для проведения исследований крысы были случайным образом распределены на 3 группы: 1) контрольная группа – ложнооперированные животные (n = 20); 2) крысы, которым проводили нефрэктомию (n = 30); 3) крысы, которым после нефрэктомии проводили внутривенную трансплантацию МСК человека (МСКч) (n = 11). В конце эксперимента, через 4 мес после хирургического воздействия, возраст животных составлял 7 мес, вес 400–500 г, артериальное давление (АД) 117 ± 1.5, 159 ± 3.5, 150 ± 1.7 мм рт. ст. соответственно. Все хирургические и экспериментальные действия были проведены на наркотизированных крысах (золетил в дозе 20 мг/кг внутрибрюшинно) (Virbac, Франция); эвтаназия проведена путем введения увеличенной дозы наркоза.
МСКч. Для внутривенной трансплантации использовали мезенхимные стволовые клетки человека (МСКч), полученные от одного донора. Имплантацию МСК из костного мозга, их культивирование и фенотипирование проводили в ООО “Транс-Технологии” по стандартным, общепринятым методикам (Pavlichenko et al., 2008). В частности, для культивирования МСКч использовали питательную среду α‑МЕМ (Hyclone, Новая Зеландия), с добавлением 20% сыворотки крови эмбрионов коров (Gibco, США) и 100 мкг/мл пенициллина/стрептомицина (Gibco, США). Фенотипирование МСКч проводили методом проточной цитофлуориметрии на проточном цитофлуориметре FACSscan (Beckton Dickinson, США). МСКч окрашивали антителами против позитивных маркеров CD90, CD105, CD44, CD73 и антителами против негативных маркеров CD45, CD34, CD14, CD11b, HLA-DR и 7AAD (Beckton Dickinson, США). В экспериментах были использованы МСКч на пассажах 2–3.
Нефрэктомию (удаление 5/6 всей почечной ткани) проводили по следующей схеме (Смирнов и др., 2005). На первом этапе у наркотизированных золетилом крыс удаляли 2/3 ткани одной почки. Второй этап проводили через 1 нед: у наркотизированных животных удаляли вторую почку целиком.
Внутривенную трансплантацию МСКч (5 млн клеток в 100 мкл культуральной среды α-МЕМ) проводили на 5-е сут после первого этапа нефрэктомии.
Визуализацию и мониторинг микрососудистой сети проводили через 4 мес после нефрэктомии и трансплантации МСКч. У наркотизированных животных удаляли теменную кость и твердую мозговую оболочку, тем самым открывая доступ к пиальной оболочке сенсомоторной коры. Поверхность мозга непрерывно орошали раствором Кребса (NaCl 120.4 мМ, KCl 5.9 мМ, NaHCО3 15.5 мМ, MgCl 1.2 мМ, CaCl2 2.5 мМ, NaH2PO4 1.2 мМ, глюкоза 11.5 мМ, pH 7.4) (с температурой 38оC). На протяжении всего эксперимента контролировали среднее АД инвазивным методом через катетер в бедренной артерии, соединенный с датчиком DTXPlusTM (Argon Critical Care Systems, Сингапур), с помощью компьютерной программы, разработанной в нашей лаборатории. АД животных в течение всего эксперимента оставалось примерно на одном уровне. Температуру тела животных в течение всего опыта поддерживали на уровне 38°C. Визуализацию пиальных артерий (при общем увеличении оптической системы 160×) проводили с помощью оригинальной установки, включающей в себя стереоскопический микроскоп MC-2ZOOM (Микромед, Россия), цветную камеру-видеоокуляр для микроскопа DCM-510 (Scopetek, Китай) и персональный компьютер. На статических изображениях с помощью компьютерной программы для цитофотометрии “Photo M” (авторская разработка А. Черниговского, http://www.t_lambda. chat.ru) измеряли диаметры пиальных артериальных сосудов. В ходе эксперимента у каждого животного было исследовано более 20 пиальных микрососудов. Диаметры артерий и артериол фиксировали в стандартных условиях при непрерывном орошении поверхности мозга раствором Кребса и при орошении мозга раствором гидросульфида натрия (NaHS) (30 мкМ) (Sigma-Aldrich, USA). При растворении в воде NaHS быстро гидролизуется с образованием сероводорода (H2S).
Все исследованные пиальные артериальные микрососуды были разбиты на группы по их диаметрам: 60–80 мкм, 40–60 мкм, 20–40 мкм, менее 20 мкм. О результатах воздействия H2S судили по количеству артериальных сосудов, изменивших свой диаметр, и по степени их расширения.
С целью исключить возможный вклад оксида азота (NO) в расширение сосудов в ответ на воздействие H2S мы ингибировали продукцию NO посредством аппликации неселективного ингибитора NO-синтазы L-NAME (N(ω)-nitro-l-arginine methyl ester, Sigma-Aldrich, 100 мкМ), а затем на фоне действия L-NAME проводили аппликацию H2S на поверхность головного мозга.
У тех же экспериментальных животных с помощью многофункционального лазерного диагностического комплекса ЛАКК-М (ЛАЗМА, Россия) определяли миогенный тонус церебральных сосудов. Датчик прибора ЛАКК-М устанавливали на поверхности каждого полушария в точке с приблизительными координатами АР = 2–3 мм от брегмы; SD = 1.0 мм латерально от сагиттального шва. Регистрацию ЛДФ-грамм проводили в течение 10 мин. По ЛДФ-граммам прилагаемое к комплексу ЛАКК-М программное обеспечение автоматически с помощью вейвлет-преобразования рассчитывало амплитудно-частотный спектр колебаний перфузии. По величинам амплитуд колебаний микрокровотока в конкретных частотных диапазонах возможно оценить состояние функционирования определенных механизмов регуляции перфузии (Крупаткин, Сидоров, 2013). В представленной работе мы рассматривали миогенную составляющую тонуса церебральных сосудов.
Статистическая обработка данных. Математическая обработка полученных данных проведена с использованием пакета статистических программ Microsoft Excel 2003 и программы InStat 3.02 (GraphPad Software Inc., США). Данные представлены в виде среднего арифметического значения и его ошибки. Сравнение средних данных независимых выборок при нормальном характере распределения вариант в совокупности данных (выборке) проводили при помощи дисперсионного анализа с последующим попарным сравнением групп согласно критерию Тьюки. При распределении вариант в выборке, отличном от нормального, при сравнении групп применяли критерий Краскела−Уоллиса с последующим попарным сравнением групп согласно критерию Данна. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ
Согласно результатам, полученным методом проточной цитофлуориметрии, использованная в экспериментах культура МСКч содержала 99.7% CD90+, CD73+, CD105+, CD44+-клеток (собственно МСК), 0.3% CD45+, CD34+-клеток (клетки гемопоэтического ряда) и 0.5% CD14+, CD11b+, HLA-DR+. Содержание 7AAD+-клеток (нежизнеспособных) было не более 0.9–1%.
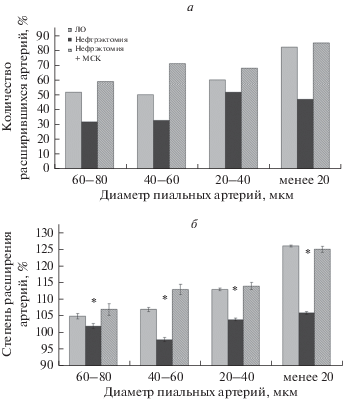
В группе нефрэктомированных животных мы выявили значительное ухудшение реактивности стенок пиальных артерий и артериол при аппликации на поверхность мозга вазодилататора H2S. У нефрэктомированных крыс число сосудов, диаметр которых увеличился при воздействии H2S, было в 1.5–1.7 раза меньше, чем в группе ложнооперированных (ЛО) животных (рис. 1а). По степени изменения диаметра сосудов (рис. 1б) видно, что у ЛО животных все группы артерий и артериол увеличили диаметр на 5–26%, тогда как у нефрэктомированных животных не произошло статистически значимого изменения диаметра (кроме самых мелких артерий диаметром менее 20 мкм, где увеличение диаметра составило 6%). Применение МСКч позволило сохранить реактивность пиальных артерий и артериол у нефрэктомированных крыс на уровне ЛО животных. Как видно из рис. 1, в группе животных, получавших клеточную терапию, число артериальных микрососудов, ответивших расширением на воздействие H2S, было даже больше, чем в ЛО группе. Степень расширения пиальных артерий была примерно одинаковой в обеих группах.
Рис. 1.
Реакция пиальных артерий и артериол на воздействие сероводорода. а – Количество пиальных артерий и артериол, ответивших дилатацией (%), б – степень изменения диаметра пиальных артерий и артериол в (%) от исходного диаметра, принятого за 100%. По горизонтали – группы артериальных сосудов разного диаметра. Результаты представлены в виде М ± SE, *достоверные отличия от контроля (ЛО) (p < 0.05).
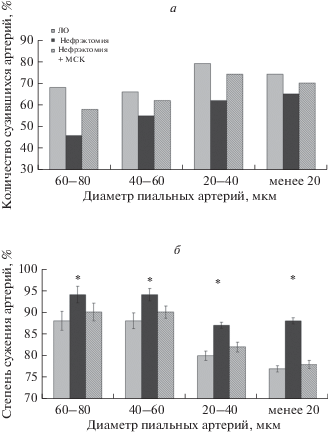
Действие L-NAME приводило у ЛО животных к выраженной констрикции пиальных артерий. При этом уменьшение диаметра наблюдали у 70–80% всех исследованных артерий (рис. 2а). Уменьшение диаметра составило 12–23% от его исходной величины (рис. 2б). В группе нефрэктомированных животных констрикция в ответ на воздействие L-NAME была значительно меньше: уменьшением диаметра ответило 46–65% пиальных артерий, а степень уменьшения диаметра составляла 6–13%. В группе нефрэктомированных животных, которым вводили МСКч, число сузившихся артерий составило 68–74%, степень уменьшения диаметра – 8–22%.
Рис. 2.
Реакция пиальных артерий и артериол на воздействие L-NAMЕ. а – Количество пиальных артерий и артериол, ответивших дилатацией (%), б – степень изменения диаметра пиальных артерий и артериол в (%) от исходного диаметра, принятого за 100%. По горизонтали – группы артериальных сосудов разного диаметра. Результаты представлены в виде М ± SE, *достоверные отличия от контроля (ЛО) (p < 0.05).
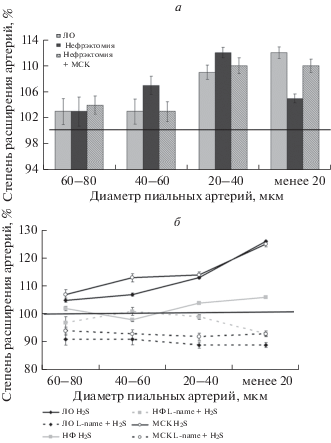
Применение H2S на фоне действия L-NAME у ЛО крыс привело к статистически значимой дилатации на 9–12% только мелких артерий диаметром менее 40 мкм (рис. 3а). У нефрэктомированных крыс максимальным расширением на воздействии H2S на фоне L-NAME ответили пиальные артерии диаметром 20–40 мкм (12 ± 0.7%); у сосудов диаметром 40–60 мкм и менее 20 мкм степень расширения составила 7 ± 1.4 и 5 ± 0.7% соответственно. В группе, получавшей клеточную терапию, как и в группе ЛО, дилатацию более 5% наблюдали у артерий диаметром менее 40 мкм (10 ± 1.2%). По сравнению с расширением артерий в ответ на действие “чистого” H2S степень дилатации при действии H2S на фоне L-NAME во всех экспериментальных группах была существенно меньше и не достигала даже первоначального исходного диаметра сосудов (рис. 3б).
Рис. 3.
Изменение диаметра пиальных артерий под воздействием сероводорода на фоне действия блокатора L-NAMA. а – Изменение диаметра пиальных артерий и артериол, б – сравнение степени расширения пиальных артерий при действии “чистого” сероводорода и сероводорода на фоне L-NAME. По горизонтали: группы артериальных сосудов разного диаметра, по вертикали: изменение диаметра пиальных артерий и артериол (%) по отношению к исходному диаметру, принятому за 100%. Результаты представлены в виде М ± SE, *достоверные отличия от контроля (ЛО) (p < 0.05).
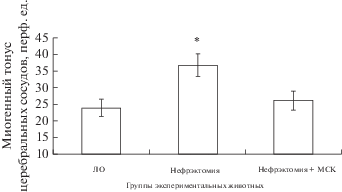
Миогенная составляющая тонуса церебральных сосудов (рис. 4) у крыс после нефрэктомии была повышена по сравнению с ЛО в среднем в 1,5 раза. В группе животных, которым вводили МСКч, этот показатель соответствовал таковому в группе ЛО.
ОБСУЖДЕНИЕ
Исследование влияния трансплантации МСК на микроциркуляцию в головном мозге пациентов с ХБП является необходимой составляющей разработки методик клеточной терапии при данном заболевании. Ранее мы показали, что внутривенное введение МСКч привело к предотвращению развития эндотелиальной дисфункции церебральных артерий и сохранению тканевой перфузии и сатурации кислородом в коре головного мозга нефрэктомированных крыс на уровне ложнооперированных животных (Соколова, Павличенко, 2020). ГМК, наряду с эндотелием, играют основную роль в регуляции тонуса церебральных сосудов. Сохранение функции этих клеток при развитии заболеваний, приводящих к ремоделингу микрососудистого русла головного мозга (например, ХБП), – необходимое условие поддержания церебрального кровотока и АД на нормальном физиологическом уровне.
Проведя более 500 прижизненных исследований реактивности пиальных артерий и артериол диаметром до 80 мкм у интактных крыс в возрасте 3–8 мес, мы убедились, что аппликация раствора NaHS на поверхность мозга вызывала дилатацию 60–85% микрососудов. Имеющиеся в литературе данные о том, что H2S приводит к констрикции артериальных сосудов (Kubo et al., 2007; Баскаков и др., 2010) были получены в работах in vitro и не нашли подтверждения в наших исследованиях. Полученные нами экспериментальные данные о значительном снижении количества дилатированных сосудов и степени расширения пиальных артерий при воздействии на поверхность головного мозга раствора NaHS, который является донором H2S, у нефрэктомированных крыс (рис. 1) свидетельствуют об ухудшении функционирования ГМК церебральных сосудов и повышении ригидности сосудистой стенки. Ухудшение дилататорной функции ГМК сосудов коры головного мозга у нефрэктомированных животных подтверждалось и повышенным уровнем миогенного сосудистого тонуса: 36.8 ± 3.4 перф. ед. против 24 ± 2.5 перф. ед. у ЛО крыс. В группе нефрэктомированных животных, которым была проведена внутривенная трансплантация МСКч, дилатация пиальных артерий в ответ на воздействие H2S (рис. 1) и миогенный тонус церебральных сосудов (рис. 4) статистически значимо не отличались от таковых у ЛО крыс.
Дилататорный эффект H2S объясняют либо его прямым воздействием на кальциевые каналы ГМК, либо на АТФ-зависимые калиевые каналы этих клеток (Tang et al., 2005; Черток, Коцюба, 2012; Hedegaard et al., 2016). Вопрос о эндотелий-зависимом или не зависимом механизме действия H2S на ГМК в настоящее время широко обсуждается (Bełtowski et al., 2014). Отмечено, что удаление эндотелия сосудов не оказало существенного влияния на дилататорный эффект H2S (Łowicka et al., 2007). С другой стороны, в последние годы появляется все больше свидетельств того, что H2S и оксид азота (NO) имеют перекрывающиеся сигнальные пути трансдукции. H2S и NO не только влияют на биосинтез друг друга, но также производят новые виды сигнальных молекул посредством химического взаимодействия (Testai et al., 2015). В эндотелиальных клетках H2S может увеличивать образование NO в два раза посредством активации эндотелиальной NO-синтазы (Predmore et al., 2011). Воздействие L-NAME – неселективного ингибитора NO-синтазы – приводило к констрикции церебральных артерий как в группе ЛО, так и после нефрэктомии. Однако уменьшением диаметра у ЛО крыс ответило 66–79% артерий, а в группе нефрэктомированных животных – 46–65%; степень уменьшения диаметра составила 12–23 и 6–13% соответственно (рис. 2). Следовательно, эндотелий-зависимая регуляция сосудистого тонуса, которая в физиологических условиях реализуется с участием NO, после нефрэктомии ухудшается примерно в 2 раза. К настоящему времени доказано, что ХБП сопровождается развитием эндотелиальной дисфункции мозговых сосудов (Martens et al., 2016), снижением синтеза NO, что приводит к повышению сосудистого тонуса и ухудшению дилататорных реакций. Добавление H2S на фоне действия L-NAME вызывало дилатацию сосудов, амплитуда которой была меньше по сравнению с эффектом H2S в растворе Кребса (рис. 3) во всех экспериментальных группах животных. Меньший дилататорный эффект H2S на церебральные артерии при снижении производства NO свидетельствует о том, что часть воздействия H2S реализуется с участием NO и имеет эндотелий-зависимый характер. Данный механизм присущ и ЛО и нефрэктомированным животным. Сохранение степени констрикторной реакции на L‑NAME в группе нефрэктомированных животных, которым была проведена внутривенная трансплантация МСКч, на уровне ЛО крыс (рис. 2) свидетельствует об отсутствии выраженной эндотелиальной дисфункции у данных животных. К такому же выводу мы пришли в наших предыдущих исследованиях (Соколова, Павличенко, 2020).
Применение МСК для улучшения функционирования ГМК сосудов при различных патологических состояниях, в том числе и при ХБП, имеет огромный терапевтический потенциал. В настоящее время разрабатываются методики тканевой инженерии с применением МСК для получения полноценно функционирующего сосудистого фрагмента (Gu et al., 2018, 2019). Применение МСК позволяет улучшить функцию почек при ХБП различной этиологии, при этом положительный терапевтический эффект наблюдали в течение 3–18 мес. (Peired et al., 2016). С помощью МСК можно купировать тканевое воспаление (Newman et al., 2009), развитие окислительного стресса (Calió et al., 2014). Однако, в работе на мышах с ХБП (Kramann et al., 2016) было показано, что МСК-подобные Gli1+ клетки хоть и дифференцируются в ГМК, но экспрессируют маркеры ГМК на очень низком уровне. Была выявлена дифференцировка трансплантированных клеток в остеобласты, что крайне нежелательно при ХБП. Выявление как положительного, так и отрицательного влияния трансплантации МСК при ХБП требует продолжения исследований в этой области.
Итак, результаты наших исследований показали, что после нефрэктомии у крыс в среднем в 1.5–2 раза понижены показатели реактивности церебральных артерий по сравнению с ложнооперированными животными. Применение МСКч у нефрэктомированных крыс позволило сохранить сократительную функцию ГМК артерий и артериол на уровне контрольных животных и нормализовать миогенный тонус церебральных сосудов.
Список литературы
Александрин В.В. 2007. Сохранение постоянства напряжения сосудистых стенок пиальных артериол при ауторегуляции мозгового кровотока. Региональное кровообращение и микроциркуляция. Т. 4. С. 56. (Aleksandrin V.V. 2007. Preservation of the tension in vessel walls of pial arterioles in cerebral blood flow autoregulation. Regional’noye Krovoobraschenie i Microcirculyatsia. V. 4. P. 56.)
Баскаков М.Б., Гусакова С.В., Желудева А.С., Смаглий Л.В., Ковалев И.В., Вторушина Т.А., Носов Д.С., Еременко К.В., Медведев М.А., Орлов Н.С. 2010. Влияние сероводорода на сократительную активность гладкомышечных клеток аорты крысы. Бюллетень сибирской медицины. Т. 6. С. 12. (Baskakov M.B., Gusakova S.V., Zheludeva A.S., Smagly L.V., Kovalyov I.V., Vtorushina T.A., Nosov D.S., Yeryomenko K.V., Medvedev M.A., Orlov S.N. 2010. Effect of hydrogen sulfide on the contractile activity of smooth muscle cells from the rat aorta. Bulletin of Siberian Medicine. V. 6. P. 12.)
Колесников С.И., Власов Б.Я., Колесникова Л.И. 2015. Сероводород как третья эссенциальная газовая молекула живых тканей. Вестник РАМН. Т. 70. № 2. С. 237. (Kolesnikov S.I., Vlasov B.Ya., Kolesnikova L.I. 2015. Hydrogen as a third essential gas molecule in living tissues. Vestnik RAMN. V. 70. P. 273.)
Крупаткин А.И., Сидоров В.В. 2013. Функциональная диагностика состояния микроциркуляторно-тканевых систем (Руководство для врачей). М.: Либроком. (Krupatkin A.I., Sidorov V.V. 2013. Functional diagnostic of microcirculatory-tissue systems state (Manual for doctors). M.: Librocom.)
Смирнов А.В., Добронравов В.А., Неворотин А.И., Хохлов С.Е., Сиповский В.Г., Барабанова В.В., Чефу С.Г., Жлоба А.А., Блашко Э.Л. 2005. Гипергомоцистеимия усугубляет повреждения нефрона при экспериментальной хронической почечной недостаточности. Нефрология. Т. 9. № 4, С. 67. (Smirnov A.V., Dobronravov V.A., Nevorotin A.I., Khokhlov S.E., Sipovsky V.G., Barabanova V.V., Chefu S.G., Zhloba A.A., Blashko E.L. Hyperhomocysteinemia exacerbates the nephron injuries induced by experimental kidney failure. Nephrology. V. 9. № 4. P. 67.)
Соколова И.Б., Павличенко Н.Н. 2020. Эффективность применения мезенхимных стволовых клеток для улучшения микроциркуляции в коре головного мозга нефрэктомированных крыс. Цитология. Т. 62. № 6. С. 410. (Sokolova I. B., Pavlichenko N. N. The efficacy of mesenchymal stem cells transplantation for improvement of microcirculation in the cerebral cortex of nephrectomized rats. Tsitologiya. V. 62. № 6. P. 410.)
Черток В.М., Коцюба А.Е. 2012. Эндотелиальный (интимный) механизм регуляции мозговой гемодинамики: трансформация взглядов. Тихоокеанский медицинский журнал. Т. 2. С. 17. (Chertok V.M., Kotsyba A.E. Endothelial (intimal) mechanism of cerebral hemodynamics regulation: changing views. Tikhookeanskiy Meditsinkiy Zhurnal. V. 2. P. 17.)
Asanuma H., Meldrum D.R., Meldrum K.K. 2010. Therapeutic applications of mesenchymal stem cells to repair kidney injury. J. Urol. V. 184. P. 26.
Assem M., Lando M., Grissi M., Kamel S., Massy Z., Chillon J., Henaut L. 2018. The impact of uremic toxins on cerebrovascular and cognitive disorders. Toxins. V. 10. P. 1.
Bełtowski J., Jamroz-Wi$s..$niewska A. 2014. Hydrogen sulfide and endothelium-dependent vasorelaxation. Molecules. V. 19. P. 21183.
Calió M.L., Marinho D.S., Ko G.M., Ribeiro R.R., Carbonel A.F., Oyama L.M., Ormanji M., Guirao T.P., Calió P.L., Reis L.A., Simões M.D.J., Lisbôa-Nascimento T., Ferreira A.T., Bertoncini C.R.A. 2014. Transplantation of bone marrow mesenchymal stem cells decreases oxidative stress, apoptosis, and hippocampal damage in brain of a spontaneous stroke model. Free Radical Biol. Med. V. 70. P. 141.
Choi S., Park M., Kim J., Hwang S., Park S., Lee Y. 2009. The role of mesenchymal stem cells in the functional improvement of chronic renal failure. Stem Cells Dev. V. 18. P. 521.
Dunn W.R., Alexander S.P.H., Ralevic V., Roberts R.E. 2016. Effects of hydrogen sulphide in smooth muscle. Pharmacol. Therap. V. 158. P. 101.
Gouroju S., Rao P., Bitla A., Vinapamula K., Manohar S., Vishnubhotla S. 2017. Role of gut-derived uremic toxins on oxidative stress and inflammation in patients with chronic kidney disease. Indian J. Nephrol. V. 27. P. 359.
Gu W., Hong X., Le Bras A., Nowak W.N., Bhaloo S. I., Deng J., Xie Y., Hu Y., Ruan X. Z., Xu Q. 2018. Smooth muscle cells differentiated from mesenchymal stem cells are regulated by microRNAs and suitable for vascular tissue grafts. J. B-iol. Chem. V. 293. P. 8089.
Gu W., Nowak W.N., Xie Y., Le Bras A., Hu Y., Deng J., Issa Bhaloo S., Lu Y., Yuan H., Fidanis E., Saxena A., Kanno T., Mason A.J., Dulak J., Cai J., Xu Q. 2019. Single-cell RNA-sequencing and metabolomics analyses reveal the contribution of perivascular adipose tissue stem cells to vascular remodeling. Arteriosclerosis, Thrombosis, and Vascular Biology. V. 39. P. 2049
Hart J.L. 2020. Vasorelaxation elicited by endogenous and exogenous hydrogen sulfide in mouse mesenteric arteries. Naunyn-Schmiedeberg’s Archives of Pharmacology. V. 393. P. 551.
Hedegaard E.R., Gouliaev A., Winther A.K., Arcanjo D.D.R., Aalling M., Renaltan N. S., Wood M.E., Whiteman M., Skovgaard N., Simonsen U. 2016. Involvement of potassium channels and calcium-independent mechanisms in hydrogen sulfide-induced relaxation of rat mesenteric small arteries. J. Pharm. Exp. Therap. V. 356. P. 53.
Hénaut L., Mary A., Chillon J. M., Kamel S., Massy Z. A. 2018. The impact of uremic toxins on vascular smooth muscle cell function. Toxins. V. 10. P. 218.
Hu H., Zou C. 2017. Mesenchymal stem cells in renal ischemia-reperfusion injury: Biological and therapeutic perspectives. Curr. Stem Cell Res. Ther. V. 12. P. 183.
Ikram M.A., Vernooij M.W., Hofman A., Niessen W.J., Van Der Lugt A., Breteler M.M.B. 2008. Kidney function is related to cerebral small vessel disease. Stroke. V. 39. P. 55.
Jono S., Shioi A., Ikari Y., Nishizawa Y. 2006. Vascular calcification in chronic kidney disease. J. Bone Mineral. Metab. V. 20. P. 5829.
Kramann R., Goettsch C., Wongboonsin J., Iwata H., Schneider R.K., Kuppe C., Kaesler N., Chang-Panesso M., Machado F.G., Gratwohl S., Madhurima K., Hutcheson J. D., Jain S., Aikawa E., Humphreys B. D. 2016. Adventitial MSC-like cells are progenitors of vascular smooth muscle cells and drive vascular calcification in chronic kidney disease. Cell Stem Cell. V. 19. P. 628.
Kubo S., Doe I., Kurokawa Y., Nishikawa H., Kawabata A. 2007. Direct inhibition of endothelial nitric oxide synthase by hydrogen sulfide: Contribution to dual modulation of vascular tension. Toxicology. V. 232. P. 138.
Lin F. 2008. Renal repair: Role of bone marrow stem cells. Pediatric Nephrology. V. 23. P. 851.
Łowicka E., Bełtowski J. 2007. Hydrogen sulfide (H2S) – The third gas of interest for pharmacologists. Pharm. Rep. V. 59. P. 4.
Martens C.R., Kirkman D.L., Edwards D.G. 2016. The vascular endothelium in chronic kidney disease: A novel target for aerobic exercise. Exercise Sport Sci. Rev. V. 44. P. 12.
Monroy M.A., Fang J., Li S., Ferrer L., Birkenbach M.P., Lee I., Wang H., Yang X.F., Choi E.T. 2015. Chronic kidney disease alters vascular smooth muscle cell phenotype. Front. Biosci. Landmark. V. 20. P. 784.
Newman R.E., Yoo D., LeRoix M.A., Danikovitch-Miagkova A. 2009. Treatment of inflammatory diseases with mesenchymal stem cells. Inflamm. Allergy Drug Targets. V. 8. P. 110.
Patel S., Fedinec A.L., Liu J., Weiss M.A., Pourcyrous M., Harsono M., Parfenova H., Leffler C.W. 2018. H2S mediates the vasodilator effect of endothelin-1 in the cerebral circulation. Am. J. Physiol. Heart and Circulatory Physiology. V. 315. P. 1759.
Pavlichenko N., Sokolova I., Vijde S., Shvedova E., Alexandrov G., Krouglyakov P., Fedotova O., Gilerovich E.G., Polyntsev D.G., Otellin V. A. 2008. Mesenchymal stem cells transplantation could be beneficial for treatment of experimental ischemic stroke in rats. Brain Res. V. 1233. P. 203.
Peired A.J., Sisti A., Romagnani P. 2016. Mesenchymal stem cell-based therapy for kidney disease: A review of clinical evidence. Stem Cells Int. V. 2016. P. 4798639.
Predmore B.L., Julian D., Cardounel A.J. 2011. Hydrogen sulfide increases nitric oxide production from endothelial cells by an Akt-dependent mechanism. Front. Physiol. V. 2. P. 104.
Streeter E., Hart J., Badoer E. 2012. An investigation of the mechanisms of hydrogen sulfide-induced vasorelaxation in rat middle cerebral arteries. Naunyn-Schmiedeberg’s Archives of Pharmacology. V. 385. P. 991.
Tang G., Wu L., Liang W., Wang R. 2005. Direct stimulation of KATP channels by exogenous and endogenous hydrogen sulfide in vascular smooth muscle cells. Mol. Pharm. V. 68. P. 1757.
Testai L., D’Antongiovanni V., Piano I., Martelli A., Citi V., Duranti E., Virdis A., Blandizzi C., Gargini C., Breschi M. C., Calderone V. 2015. Different patterns of H2S/NO activity and cross-talk in the control of the coronary vascular bed under normotensive or hypertensive conditions. Nitric Oxide. Biology and Chemistry. V. 47. P. 25.
Дополнительные материалы отсутствуют.