Цитология, 2020, T. 62, № 11, стр. 822-828
Экспрессия парвальбумина и β-III-тубулина в клетках субвентрикулярной зоны в неонатальный период у крыс
Л. И. Хожай *
Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
* E-mail: astarta0505@mail.ru
Поступила в редакцию 07.07.2020
После доработки 14.08.2020
Принята к публикации 15.08.2020
Аннотация
Цель работы заключалась в иммуногистохимическом выявлении кальций-связывающего белка парвальбумина и маркера нейральной дифференцировки стволовых клеток β-III-тубулина в клетках субвентрикулярной зоны в период новорожденности у крыс (5 и 10 постнатальные сутки). Показано, что в субвентрикулярной зоне присутствуют клетки, экспрессирующие β-III-тубулин, они представлены одним морфологическим клеточным типом и являются незрелыми дифференцирующимися нейробластами (тип А). Число таких клеток остается постоянным во время неонатального периода и составляет более 30% от общего числа клеток субвентрикулярной зоны. Выявлено, что значительная часть дифференцирующихся нейробластов экспрессирует парвальбумин. Число таких клеток составляет более 20% от общего числа клеток всех типов и является постоянным во время периода новорожденности.
Формирование ЦНС в эмбриональный и особенно в постнатальный период в настоящее время привлекает пристальное внимание исследователей. Это связано с необходимостью понимания механизмов образования новых популяций нейронов и глии и процессов возможного пополнения ими уже сформированных формаций мозга, как в нормальных условиях, так и при различных хронических нейродегенеративных заболеваниях ЦНС (болезнь Паркисона, Альцгеймера и т.д.), а также при травмах головного мозга с частичной утратой нейронов. У человека и позвоночных животных после рождения в мозге остаются зоны, названные нейрогенными нишами, где нейрогенез сохраняется в течение длительного периода времени. В этих зонах происходит пролиферация малодифференцированных клеток и начальные этапы дифференцировки новых популяций нервных и глиальных клеток (Anderson, 2001; Merkle et al, 2007; Conover, Notti, 2008; Platel et al., 2010; Обухов и др., 2019). Одной из нейрогенных ниш у многих позвоночных является субвентрикулярная зона, расположенная вдоль стенки латерального мозгового желудочка. В настоящее время структурная организация субвентрикулярной зоны хорошо известна (Platel et al., 2010; Обухов и др., 2019).
Клеточный состав субвентрикулярной зоны представлен несколькими линиями малодифференцированных клеток-предшественников (Conover, Notti, 2008; Platel et al., 2010; Обухов и др., 2019). Клетки каждой линии имеют определенный морфологический фенотип и экспрессируют разнообразные, свойственные этому фенотипу, ростовые, нейротрофические или транскрипционные факторы, которые наряду с воздействием факторов окружающей среды могут направлять дифференцировку клеток-предшественников по тому или иному пути развития (Anderson, 2001; Обухов и др., 2019). В настоящее время выделяют следующие типы клеток: (1) юные нейробласты, имеющие овальное или веретеновидное тело (тип А) и, как правило, два коротких отростка, направленных к просвету желудочка и поверхности мозга, они обладают способностью к тангенциальной миграции, формируют небольшие скопления вблизи эпендимы, или цепочки клеток, экспрессируют специфические мембранные маркеры Dcx (doublecortin), β-III-тубулин и молекулы клеточной адгезии PSA-NCA (Platel et al., 2010; Обухов и др., 2019); (2) прогениторные клетки, так называемые, нейральные стволовые клетки, астроцитоподобные, являющиеся потомками клеток радиальной глии (тип В), находятся в тесном контакте с эпендимой, имеют довольно крупный размер и часто образуют небольшие скопления рядом с группами клеток типа А, экспрессируют GFAР, виментин, десмин, GLAST, коннексин 43, Aldh1L1, Lex (Cd15), транспортеры GLT-1 и GAT3/4, глутаматсинтазу, самообновляющаяся популяция клеток, как полагают, сохраняется в постнатальном периоде длительное время и является источником клеток-предшественников нейронов и глии как в эмбриональный, так и в постнатальный периоды; (3) клетки, имеющие малый размер, округлую или овальную форму тела (тип С), рассматривающиеся как промежуточная (транзиторная) стадия дифференцировки клеток типов В, экспрессируют маркеры Mash1, EGFR, транскрипционный фактор Dlx2; (4) эпендимные клетки (тип Е) выстилают полость латерального мозгового желудочка, имеют кубическую форму, несут на апикальной поверхности реснички и микроворсинки, экспрессируют виментин, белок S-100, CD-24, сохраняют способность к делению, ряд авторов рассматривает их как клетки-предшественники нейронов (Scheffler, 2005; Merkle et al., 2007; Platel et al., 2010; Ming., Song, 2011; Обухов и др., 2019).
Дифференцирующиеся нейробласты (тип А) экспрессируют основной структурный белок микротрубочек β-III-тубулин (Platel et al., 2010). В нейронах зрелого мозга микротрубочки определяют форму клеток и присутствуют в отростках – аксонах и дендритах. Показано, что β-III-тубулин играет важную роль в регенерации аксонов и дендритов, при этом повышается уровень его экспрессии (Liu, Brady, 2004). Исследования нейрогенеза в развивающемся мозге показали высокую селективность β-III-тубулина как раннего нейронального маркера. Экспрессия β-III-тубулина была выявлена в цитоплазме юных нейронов различной локализации в развивающемся мозге у лабораторных млекопитающих, поэтому β-III-тубулин часто используют для верификации нейрональной дифференциации нейральных стволовых клеток (Коржевский и др., 2010). В настоящее время данные об экспрессии β-III-тубулина в субвентрикулярной зоне в неонатальный период отсутствуют.
Наряду с экспрессией факторов различной природы, действующих на разные стадии нейро- и глиогенеза, клетки субвентрикулярной зоны могут экспрессировать нейромедиаторы (ГАМК, глутамат, серотонин, дофамин). Показано, что часть мигрирующих нейробластов иммуноположительны на ГАМК (Bolteus, Bordey, 2004; Platel et al., 2010; Mu, 2010; Sequerra et al., 2010; Обухов и др., 2019).
Известно, что в зрелом мозге популяция ГА-МКергических интернейронов неодноpодна и включает разные подтипы, отдельные из которых экспрессируют кальций-cвязывающие белки: паpвальбумин, кальбиндин и кальpетинин, являющиеся главными “буфеpами”, регулирующими уровень кальция в нейpонаx (Zaitsev, 2005; Kay, Brunjes, 2014; Зинченко и др., 2016).
Считают, что нейроны, экспрессирующие парвальбумин, представляют главный подтип корковых ГАМКергических интернейронов, специализированных на обеспечение быстрого и надежного перисоматического торможения основных пирамидных нейронов и контроля их выходов (Zaitsev, 2005; Kay, Brunjes, 2014; Зинченко, 2016). Учитывая физиологическую и функциональную важность этой популяции тормозных интернейронов, экспрессирующих парвальбумин, возникает необходимость в исследовании их появления в субвентрикулярной зоне и возможности пополнения численности их популяции в других формациях мозга. В настоящее время практически нет сведений об экспрессии парвальбумина в клетках субвентрикулярной зоны в неонатальный период (т.е. период новорожденности), когда в мозге идут активные процессы становления локальных тормозных ГАМКергических сетей.
В связи с этим целью настоящей работы было выявление парвальбумина и β-III-тубулина (маркерного нейрального белка) в клетках субвентрикулярной зоны в период новорожденности у крыс.
МАТЕРИАЛ И МЕТОДИКА
Работа проведена на лабораторных крысах линии Wistar из питомника Института физиологии им. И.П. Павлова РАН (Санкт-Петербург).
Гистологические и иммуногистохимические методы исследования. Головной мозг родившихся крысят извлекали, фиксировали в цинк-этанол-формальдегиде на фосфатно-солевом буфере (рН 7.4), обезвоживали, заливали в парафин по общепринятой методике и готовили серийные фронтальные срезы большого мозга толщиной 6–7 мкм на уровне брегмы от –1.80 до –2.04 мм (Paxinos, Watson, 1998). Затем срезы помещали на предметные стекла SuperFrost Plus Gold (Menzel-Glaser, Германия). У интактных животных исследовали субвентрикулярную зону, расположенную вдоль стенки латерального желудочка мозга (рис. 1а, область исследования – выделенный фрагмент), на 5-е (n = 5) и 10-е (n = 6) сут постнатального развития (П5 и П10).
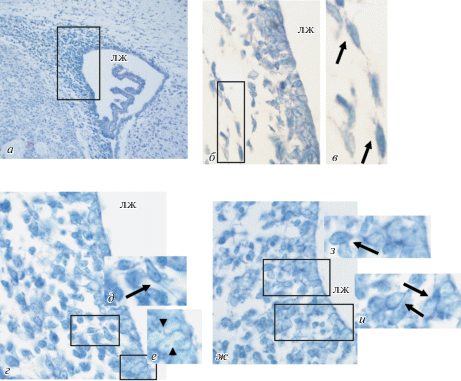
Рис. 1.
Субвентрикулярная зона мозга крысы на П10; окраска по Нисслю. а – Общий вид субвентрикулярной зоны (выделена область исследования); б, в – цепочка нейробластов с отростками (тип А) (стрелки); г, е – скопление крупных малодифференцированных клеток (тип В) (головки стрелок); г, д, ж, з, и – юные нейробласты с отростками (тип А) рядом с эпендимой (стрелки). лж – латеральный желудочек мозга. Увел. об. а – 10×, б–и – 100× (в, д, е, з, и – увеличенные детали выделенных фрагментов).
Иммуногистохимическую реакцию на β-III-тубулин проводили с использованием первичных кроличьих моноклональных антител (anti-beta-III-tubulin, клон [EP1569Y], Abcam, Великобритания) в разведении 1 : 50. После процедуры теплового демаскирования белков в цитратном буфере (рН 6.1) (Dako, Дания) в течение 25 мин срезы инкубировали в первичных антителах при 4°С в течение 18 ч. В качестве вторичных реагентов для антител к β-III-тубулину использовали реактивы из набора LSAB + System-HRP (Dako, Дания) (срезы помещались в биотинилированные антитела “Link” на 35 мин при комнатной температуре и после промывки в фосфатном буфере помещались в стрептовидин/HRP на 30 мин при комнатной температуре). Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). Специфичность иммунной реакции проверяли с помощью негативного контроля (без первичных антител).
Иммуногистохимическую реакцию на парвальбумин проводили с использованием первичных кроличьих поликлональных антител к парвальбумину (anti-parvalbumin antibody rabbit polyclonal, Abcam, Великобритания) в разведении 1 : 100. После процедуры теплового демаскирования белков в цитратном буфере (рН 6.1) (Dako, Дания) в течение 25 мин, срезы инкубировали в первичных антителах при 4°С в течение 16 ч. В качестве вторичных реагентов для антител к парвальбумину использовали реактивы из набора EnVision + System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США). Инкубацию срезов во вторичных антителах осуществляли в течение 40 мин при комнатной температуре. Для визуализации продукта реакции использовали хромоген DAB+ (Dako, Дания). Специфичность иммунной реакции проверяли с помощью негативного контроля (без первичных антител).
Для проведения общего морфологического исследования часть гистологических срезов окрашивали по методу Ниссля по общепринятой методике. Срезы заключали в синтетическую среду Permaunt (Termo, США).
Статистическая оценка результатов исследования. При проведении иммуногистохимической реакции все процедуры были стандартизированы и осуществлялись одновременно для гистологических срезов мозга, полученных от животных обоих сроков исследования. Материал анализировали на цифровых изображениях фронтальных серийных срезов, полученных при помощи светового микроскопа Leica DME (Leica, Германия) и цифровой камеры Leica EC3 (Leica, Германия).
Количество иммунопозитивных клеток оценивали на стандартной площади 0.1 мм2 (условной единице площади) при увеличении объектива 100×. Подсчитывали число иммуноположительных клеток и общее количество всех типов клеток. Соотношение между ними выражали в процентах. Подсчеты осуществляли на 10–12 срезах мозга, взятых от 4–5 животных каждой исследуемой возрастной группы при помощи компъютерной программы ImageJ 50. Статистически обработанные данные представлены как средние значения ± стандартная ошибка среднего (m ± SEM). Для анализа и сравнения полученных результатов между разными группами животных использовали t-критерий Стъюдента и onewayANOVA (Statistica 8.0, Statsoft Inc., USA) c достоверностью различий при Р < 0.05.
Использованные реактивы: первичные кроличьи поликлональные антитела anti-parvalbumin antibody rabbit polyclonal, первичные кроличьи моноклональные антитела anti-beta-III-tubulin, клон [EP1569Y] (Abcam, Великобритания); вторичные антитела из набора LSAB + System-HRP, хромоген DAB+ (Dako, Дания); вторичные антитела из набора реактивов EnVision + System-HRP Labelled Polymer Anti-Rabbit (DakoCytomation, США); метиленовый синий (Bio-Орtica, Италия); синтетическая среда для заключения гистологических срезов Permaunt (Termo, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологическое исследование. На П5 и П10 (в период новорожденности) в субвентрикулярной зоне мозга крысят морфологическая картина распределения разных типов клеток (описанных ранее (Platel et al., 2010; Обухов и др. 2019)) идентична. Рядом с эпендимными клетками (тип Е), выстилающими полость латерального желудочка, присутствуют небольшие скопления малодифференцированных крупных клеток со светлыми ядрами и малым объемом цитоплазмы (тип В) (рис. 1г, е, головки стрелок) и группы (от 2 до 4) веретеновидных или овальных клеток – юных нейробластов, имеющих отростки (тип А) (рис. 1б, г–и, стрелки). Иногда нейробласты образуют цепочки (рис. 1б, в, стрелки) или располагаются одиночно.
Иммуногистохимическая реакция на парвальбумин. На П5 клетки эпендимы (тип Е) иммунонегативны на парвальбумин. Крупные клетки (тип В), образующие скопления, цепочки, или располагающиеся одиночно, также иммунонегативны. Иммунопозитивными оказались клетки, имеющие веретеновидную или овальную форму, светлое ядро, небольшой объем цитоплазмы и отростки (тип А). Они образуют небольшие скопления, цепочки, окружают группы клеток типа В или располагаются одиночно. Таким образом, в субвентрикулярной зоне на П5 иммуноположительными на парвальбумин оказываются нейробласты (установленный морфологический тип А). Число иммунопозитивных нейробластов равно 21.3 ± 2.1 (на условную единицу площади) и составляет 24.1% от общего числа (88.5 ± 6.2) клеток разных типов, расположенных на этой площади.
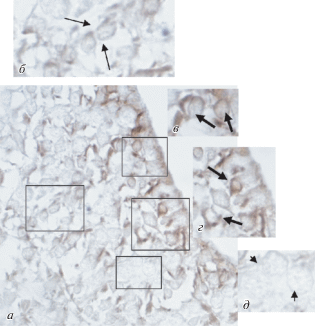
На П10 клетки эпендимы (тип Е) и крупные клетки (тип В) также иммуноотрицательны (рис. 2а, д, головки стрелок). Как и на предыдущем сроке исследования, иммунопозитивными на парвальбумин оказались клетки, имеющие веретеновидную или овальную форму тела, светлое ядро и тонкие отростки (тип А). Они располагаются небольшими группами (рис. 2а, в, г, стрелки), образуют цепочки (рис. 2а, б, стрелки). Часть иммунопозитивных клеток локализуется вблизи эпендимы, а часть диффузно распределяется по территории субвентрикулярной зоны. Таким образом, в субвентрикулярной зоне на П10, т.е. к концу периода новорожденности, иммунопозитивными на парвальбумин оказываются юные нейробласты (тип А). Их число равно 24.1 ± 2.4 (на условную единицу площади) и составляет 20.8% от общего числа (115.7 ± 3.2) клеток всех типов, расположенных на этой площади.
Рис. 2.
Субвентрикулярная зона мозга крысы на П10; иммуногистохимическая реакция на парвальбумин. а – Общая картина распределения продукта иммуногистохимической реакции; б – цепочка иммунопозитивных нейробластов (стрелки); в, г – иммунопозитивные нейробласты с отростками (тип А), локализованные вблизи эпендимы (стрелки); д – иммунонегативные крупные клетки (тип В) (головки стрелок). Увел. об. 100× (б–д – увеличенные детали выделенных фрагментов).
Иммуногистохимическая реакция на β-III-тубулин. На П5 клетки эпендимы (тип Е) и крупные малодифференцированные клетки (тип В), образующие скопления (рис. 3а, в, головки стрелок) или располагающиеся одиночно, иммунонегативны. Иммунопозитивными на β-III-тубулин оказались клетки, имеющие веретеновидную или овальную форму, светлое ядро, небольшой объем цитоплазмы и отростки (тип А). Они локализуются вблизи эпендимы (рис. 3а, б, г, стрелки), одиночные клетки встречаются по всей территории субвентрикулярной зоны. Таким образом, в субвентрикулярной зоне на П5 юные нейробласты (тип А) иммунопозитивны на β‑III-тубулин. Их число равно 48.5 ± 4.2 (на условную единицу площади) и составляет 34.6% от общего числа (140.3 ± 5.3) клеток всех типов, расположенных на этой площади.
Рис. 3.
Субвентрикулярная зона мозга крысы на П5 (а–г) и П10 (д–ж), иммуногистохимическая реакция на β-III-тубулин. а, д – Общая картина распределения продукта иммуногистохимической реакции; б, г, е, ж – иммунопозитивные нейробласты (тип А) (стрелки), локализующиеся рядом с эпендимой; в – иммунонегативные крупные клетки (тип В) (головки стрелок). Увел. об. 100× (б–г, е, ж – увеличенные детали выделенных фрагментов).
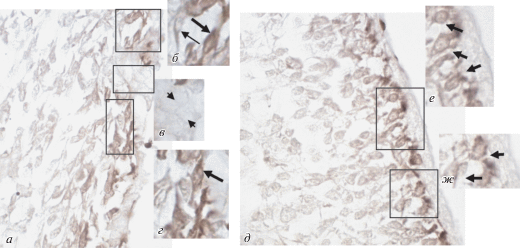
На П10 клетки эпендимы (тип Е) и крупные малодифференцированные клетки (тип В) иммунонегативны. Иммунопозитивными на β-III-тубулин, как и на предыдущем сроке исследования, являются юные нейробласты (тип А) с тонкими отростками (рис. 3д, е, ж, стрелки). Они локализуются рядом с эпендимой, могут образовывать цепочки или располагаться одиночно. Количество таких иммунопозитивных клеток равно 50.1 ± 5.2 (на условную единицу площади) и составляет 31.4% от общего числа (159.4 ± 6.3) клеток всех типов, присутствующих на этой площади.
Результаты данного исследования показали, что у крысят в субвентрикулярной зоне в период новорожденности (на П5 и П10) клетки одного морфологического типа являются иммунопозитивными на парвальбумин. Их фенотип соответствует ранее установленному для мигрирующих нейробластов (тип А) (Platel et al., 2010; Обухов и др. 2019). Численность популяций клеток, иммунопозитивных на парвальбумин на П5 и П10 является сопоставимой (21.3 ± 2.1 и 24.1 ± 2.4 клеток, соответственно; различия не достоверны при Р < 0.05) и составляет более 20% от общего числа клеток разных типов. Можно предположить, что в период новорожденности происходит равномерное и постоянное производство нейральных клеток, содержащих парвальбумин.
Полученные данные свидетельствуют о том, что как на П5, так и на П10, в субвентрикулярной зоне присутствуют клетки иммунопозитивные на β-III-тубулин, морфология которых также соответствует нейробластам (тип А). Их число на исследованных сроках тоже является сопоставимым (48.5 ± 4.2 и 50.1 ± 5.2 клеток соответственно; различия не достоверны при Р < 0.05), и составляет более 30% от общего числа разных типов клеток. Учитывая, что β-III-тубулин является маркером нейральной дифференцировки стволовых клеток, можно предположить, что в субвентрикулярной зоне в период новорожденности более 30% клеток находится в состоянии дифференцировки по нейральному типу, и представленны юными нейробластами (тип А). Сравнительный анализ цифровых значений показал, что как на П5, так и П10 число клеток, экспрессирующих парвальбумин, примерно в 2 раза ниже, чем число клеток, экспрессирующих β-III-тубулин, т.е. только часть клеток, находящихся в процессе дифференцировки, экспрессирует парвальбумин. Сообщалось, что в субвентрикулярной зоне зрелого мозга часть клеток, вступивших в дифференцировку, способна экспрессировать глутамат, дофамин, ГАМК и другие нейромедиаторы (Platel et al., 2010). Это может, во-первых, объяснить разницу в численности популяций исследуемых клеток, во-вторых, свидетельствовать о том, что в период новорожденности почти половина дифференцирующихся нейральных клеток экспрессирует парвальбумин.
Недавние исследования показали, что у млекопитающих в зрелом неокортексе значительная часть (20–25%) популяции ГАМКергических интернейронов экспрессирует парвальбумин (Gabbott, Bacon, 1996; Zaitsev et al., 2005). Считают, что этот подтип тормозных интернейронов, характеризующийся колокализацией парвальбумина и ГАМК, является физиологически важным, участвующим в модуляции динамики внутpиклеточного кальция в нейpонаx, влияющим на процессы возбуждения и cинxpонной импульcной активноcти нейpонов и т.д. (Gabbott, Bacon, 1996; Zaitsev et al., 2005; Зинченко и др., 2016).
Также известно, что в зрелом мозге часть нейробластов, мигрирующих из субвентрикулярной зоны в обонятельную луковицу, экспрессирует ГАМК (Bolteus, Bordey, 2004; Scheffler et al., 2005), и это дает основание предполагать, что дифференцирующиеся нейробласты в субвентрикулярной зоне уже приобретают определенный нейромедиаторный фенотип. Однако существует мнение, что в субвентрикулярной зоне нейробласты, иммуноположительные на ГАМК, не обеспечены механизмом синтеза ГАМК, типичным для дифференцированных интернейронов неокортекса (Sequerra et al., 2007; Inta, 2008). Авторы идентифицировали альтернативный механизм синтеза ГАМК, который заключается в преобразовании частей разрушенных глутаматных ферментных систем в ГАМК (Sequerra et al. 2007; Inta, 2008), поэтому принадлежность нейробластов к ГАМКергическому фенотипу, по их мнению, может быть обратимой (Sequerra et al., 2007). Тем не менее, установлено, что в постнатальный период вновь образованные в субвентрикулярной зоне нейробласты являются источником тормозных ГАМКергических интернейронов, которые мигрируют в обонятельную луковицу, неокортекс и стриатум (Anderson et al., 1997; Schuurmans et al., 2004; Merkle et al., 2007).
Результаты данного исследования показали, что значительная часть дифференцирующихся нейробластов способна экспрессировать парвальбумин. Учитывая имеющиеся в литературе данные о том, что мигрирующие нейробласты могут экспрессировать ГАМК (Anderson et al. 1997; Schuurmans et al., 2004; Merkle et al. 2007) и что часть ГАМКергических нейронов содержит парвальбумин, мигрирующие нейробласты, экспрессирующие парвальбумин, вероятно, можно рассматривать как потенциальные тормозные интернейроны, способные мигрировать в слои неокортекса и интегрироваться в формирующиеся локальные тормозные сети.
Список литературы
Зинченко В.П., Туpовcкая М.В., Теплов И.Ю., Бережнов А.В., Туpовcкий Е.А. 2016. Роль парвальбумин-содержащих интернейронов в регуляции спонтанной синхронной активности нейронов мозга в культуре. Биофизика. Т. 61. № 1. С. 102. (Zinchenko V.P., Turovskaya M.V., Teplov I.Yu., Berezhnov A.V., Turovsky E.A. 2016. A role of parvalbumin-containing interneurons in regulation of spontaneous synchronous activity of the brain neurons in culture. Вiophysics. V. 61. № 1. P. 102.)
Коржевский Д.Э., Петрова Е.С., Кирик О.В. 2010. Нейральные маркеры, используемые при изучении дифференцировки стволовых клеток. Клеточная трансплантология и тканевая инженерия. Т. 5. № 3. С. 1. (Korzhevsky D.E., Petrova E.S., Kirik O.V. 2010. Neuronal the markers used at studying of a differentiation of stem cells. Cellular Transplantology and Tissue Engineering. V. 5. № 3. P. 1.)
Обухов Д.К., Цехмистренко Т.А., Пущина Е.В., Вараксин А.А. 2019. Формирование популяций нейронов и нейроглии в пре- и постнатальном развитии ЦНС позвоночных животных. Морфология. Т. 156. № 6. С. 57. (Obukhov D.K., Tsehmistrenko T.A., Puschhina E.V., Varaksin A.A. 2019. The forvation of population of neurons and glia in the pre- and postnatal development of the CNS of vertebrates. Morphology. V. 156. № 6. P. 57.)
Anderson D.J. 2001. Stem cells and pattern formation in the nervous system: The possible versus the actual. Neuron. V. 30. P. 19.
Bolteus A.J., Bordey A. 2004. GABA release and uptake regulate neuronal precursor migration in the postnatal subventricular zone. J. Neurosci. V. 24. P. 7623.
Conover J.R., Notti Q. 2008. The neural stem cell niche. Cell Tiss. Res. V. 331. P. 211.
Gabbott P.L.A., Bacon S.J. 1996. Local circuit neurons in the medial prefrontal cortex (areas 24 a, b, c, 25, 32) in the monkey. 1. Cell morphology and morphometrics. J. Comp. Neurol. V. 364. P. 567.
Inta I.D., Alfonso. J, von Engelhardt J., Kreuzberg M.M., Meyer A.H., van Hooft J.A, Monyer H. 2008. Neurogenesis and widespread forebrain migration of distinct GABAergic neurons from the postnatal subventricular zone. Proc. Natl. Acad. Sci. USA. V. 105. P. 209949. https:doi.org/https://doi.org/10.1073/pnas.0807059105
Liu H.H., Brady S.T. 2004. cAMP, tubulin, axonal transport and regeneration. Exp. Neurol. V. 189. P. 199. https://doi.org/10.1016/j.expneurol.2004.06,006
Kay R.B., Brunjes P.C. 2014. Diversity among principal and GABAergic neurons of the anterior olfactory nucleus. Front. Cell Neurosci. V. 8. P. 111.
Merkle F.T., Mirzadeh Z., Alvarez-Buylla A. 2007. Mosaic organization of neural stem cells in the adult brain. Science. V. 317. P. 381.
Ming G., Song H. 2011. Adult neurogenesis in the mammalian brain. Significant answers and significant questions. Neuron. V. 70. P. 687.
Mu Y., Lee S.W., Gate F. 2010. Signaling in adult neurogenesis. Curr. Opin. Neurobiol. V. 20. P. 416.
Paxinos G., Watson C. 1998. The rat brain in stereotaxic coordinates. London: Press.
Platel J.-C., Stamboulian S., Nguyen I., Bordey A. 2010. Neurotransmitter signaling in postnatal neurogenesis: The first leg. Brain Res. Rev. V. 63. P. 60. https://doi.org/10.1016/j.brainresrev.2010.02.004
Scheffler B., Walton N.M., Lin D.D., Goetz A.K., Enikolopov G., Roper S.N., Steindler D.A. 2005. Phenotypic and functional characterization of adult brain neuropoiesis. Proc. Natl. Acad. Sci. USA. V. 102. P. 9353.
Schuurmans C., Armant O., Nieto M., Stenman J.M., Britz O., Klenin N., Brown C., Langevin L.-M., Steibt J., Tang H., Cunningham J.M., Dyck R., Walsh C., Campbell K., Polleux F., Guillemot F. 2004. Sequential phases of cortical specification involve neurogenin-dependent and -independent pathways. EMBO J. V. 23. P2892.
Sequerra E.B., Gardino P., Hedin-Pereira C., de Mello F.G. 2007. Putrescine as an important source of GABA in the postnatal rat subventricular zone. Neuroscience. V. 146. P. 489. https://doi.org/10.1016/j.neuroscience.2007.01.062
Sequerra E.B., Miyakoshi L.M., Froґes M.M., Menezes J.R.L., Hedin-Pereira C. 2010. Generation of glutamatergic neurons from postnatal and adult subventricular zone with pyramidal-like morphology. Cerebral Cortex. V. 20. P. 2583.
Zaitsev A.V., Gonzales-Burgos G., Povysheva N.V., Kroner S., Lewis D.A., Krimer L.S. 2005. Localization of calcium-binding proteins in physiologically and morphologically characterized interneurons in monkey prefrontal cortex. Cerebral Cortex. V. 15. P. 1178.
Дополнительные материалы отсутствуют.


