Цитология, 2020, T. 62, № 11, стр. 793-802
Вемурафениб индуцирует повышение уровня дормантных (Ki-67-негативных) клеток при BRAF-негативном статусе меланомы
Е. Д. Николаева 1, И. Ю. Дубовцева 1, Р. Н. Белоногов 1, А. Н. Наркевич 1, А. В. Мошев 2, А. А. Савченко 1, 2, Т. Г. Рукша 1, *
1 Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого
660022 Красноярск, Россия
2 Научно-исследовательский институт медицинских проблем Севера
660022 Красноярск, Россия
* E-mail: tatyana_ruksha@mail.ru
Поступила в редакцию 14.07.2020
После доработки 14.08.2020
Принята к публикации 17.08.2020
Аннотация
Устойчивость к традиционной химиотерапии и рецидивы опухолей связывают с присутствием в неоднородной популяции опухолевых клеток покоящихся (или дормантных, с арестом клеточного цикла в фазах G1/G0, Ki-67-негативных) опухолевых клеток. С целью получения и изучения этой клеточной популяции применяли воздействие противоопухолевым агентом вемурафенибом на две клеточные линии меланомы – BRO и SK-MEL-2. Были получены клеточные популяции с блоком клеточного цикла в фазах G1/G0, который подтверждался негативным окрашиванием клеток на белок Ki-67 и изменением экспрессии генов белков-регуляторов клеточного цикла CDK4, CCND1, CDKN1B.
Устойчивость злокачественных новообразований к химиотерапии связывают с наличием дормантных (покоящихся) клеток (quiescent dormant cells) в структуре опухолей. Кроме того, часть дормантных клеток может быть рассеяна в организме (disseminated dormant cells). Эти клетки могут находиться в неактивном состоянии до нескольких лет и являются причиной рецидивов заболевания (Ossowski, Aguirre-Ghiso, 2010). При меланоме наличие дормантного состояния опухоли хорошо документировано и связывается с развитием поздних рецидивов (Senft, Ronai, 2016). Дормантность клеток характеризуется арестом клеточного цикла в фазе G0/G1, остановкой пролиферации, замедлением метаболизма, изменением содержания регуляторных белков и активацией антиапоптотических процессов (Pradhan et al., 2018), что делает клетки устойчивыми к противоопухолевой химио- и лучевой терапии, действие которых направлено на пролиферирующие клетки. Механизмы, посредством которых инициируются и поддерживаются дормантные клетки при меланоме или опухолях других типов недостаточно изучены, а количество исследований, посвященных этому явлению, ограничено, хотя они имеют потенциальную клиническую значимость.
Идентификация дормантных клеток осуществляется посредством анализа уровня белка-маркера клеточной пролиферации Ki-67 (выявляемому специфическими антителами), по уровню изменений экспрессии генов белков (циклинов D1 и E, циклин-зависимых киназ CDK1/2/4/6, белков RB), участвующих в регуляции клеточного цикла и переходу клеток из одной фазы в другую (G0/G1, G1/S), ингибитора циклин-зависимой киназы 1В (CDKN1B) (Gao et al., 2017). Установлено, что дормантные клетки не экспрессируют Ki-67, характеризуются измененным содержанием циклинов и повышением CDKN1B.
Вместе с тем, значимой проблемой изучения дормантных клеток является создание модели клеток этого типа in vitro и in vivo. В настоящее время существует ряд способов получения дормантных клеток различных опухолей и среди них: индукция дормантного состояния в опухолевых клетках in vivo путем ингибирования ангиогенеза, модуляции иммунного ответа, в частности, с помощью ингибиторов BRAF-киназы – компонента сигнального каскада MAPK/ERK, присутствующего конститутивно во всех клетках эукариот в норме (Senft, Ronai, 2016). Для получения дормантных клеток in vitro могут быть использованы методы селекции этих клеток из солидных опухолей и метастазов, полученных из организма больного (Touil et al., 2016). Помимо этого, существуют способы индукции дормантных клеток в культуре различными способами: посредством помещения единичных опухолевых клеток в синтетические аналоги экстраклеточного матрикса (желатин, агарозу, матригель); использование сокультивирования с клетками микроокружения, например, стромой костного мозга; создание дефицита кислорода или питательных веществ; лекарственная индукция дормантности и другие (Pradhan et al., 2018).
В представленной работе для получения популяций дормантных клеток в качестве химиотерапевтического агента был использован вемурафениб, который является низкомолекулярным конкурентным ингибитором BRAF-киназы при наличии у нее мутации в положении V600 (BRAFV600+). Эта мутация обнаружена в 8% всех злокачественных образований, а в случае меланомы – примерно в 50% опухолей. При этом мутация BRAFV600+ может присутствовать далеко не во всех клетках опухоли вследствие ее неоднородности (Cheng et al., 2018). Вемурафениб избирательно блокирует АТФ-связывающий сайт BRAF, что приводит к уменьшению передачи сигналов по MAP-киназному каскадному пути и далее к апоптозу. В качестве защитного механизма (избегания апоптоза) клетки способны выходить из клеточного цикла, переходя в фазу покоя G0, оставаясь в таком состоянии некоторое время (Manjili, 2017). Поскольку вемурафениб является одним из основных таргетных препаратов для терапии меланомы, модель получения дормантных клеток меланомы с использованием этого вещества может иметь большое значение для изучения процессов лекарственной устойчивости, метастазирования и рецидивирования меланомы.
Эффекты вемурафениба в клетках меланомы с диким типом BRAF-киназы (BRAFV600–) изучены мало (Haferkamp et al., 2013). По некоторым данным, вемурафениб обладает воздействием на дикий тип BRAF-киназы (Inamdar et al., 2010), оказывая, в том числе, токсическое действие на клетки меланомы с BRAFV600– (Tahiri et al., 2013). Установлено, что в таком случае вемурафениб изменяет уровень активации сигнального каскада ERK (Lorentzen, 2019). Тем не менее, есть данные об отсутствии действия вемурафениба на клетки меланомы с диким типом BRAF-киназы. Они получены в основном при использовании препарата в обычных терапевтических концентрациях.
Мы предположили, что действие вемурафениба в высоких концентрациях на клетки меланомы с BRAFV600– может обратимо подавлять сигнальный путь МАРК, снижать уровень пролиферации клеток, приводя к G1/G0-аресту клеточного цикла. В этой связи, в настоящей работе были использованы клетки меланомы с BRAFV600– линий BRO и SK-MEL-2. Цель работы заключалась в определении влияния вемурафениба на возможность клеток меланомы переходить в фазу покоя G0 (дормантное состояние).
МАТЕРИАЛ И МЕТОДИКА
Культуры клеток. Использовали две клеточные линии меланомы: 1) BRO (полученную из амеланотической меланомы от пациента мужского пола в возрасте 34 лет), предоставленную Научно-исследовательским институтом фундаментальной и клинической иммунологии (Новосибирск, Россия); 2) клеточную линию SK-MEL-2 (ATCC® HTB-68™), которая была получена из метастаза меланомы, локализованного на поверхности бедра пациента мужского пола европейской этнической принадлежности в возрасте 60 лет; мутационный статус: гомозиготная мутация по гену NRAS p.Gln61Arg (c.182A>G), TERT c.250C>T (–146C>T), гетерозиготная мутация гена TP53 p.Gly245Ser (c.733G>A); линия предоставлена ООО Биолот (Санкт-Петербург, Россия).
Обе клеточные линии культивировали в среде RPMI-1640 (ООО НПП ПанЭко, Россия), содержащей 10% фетальной бычьей сыворотки (ООО Диаэм, Россия), 1% антибиотиков (смесь пенициллина и стрептомицина; Gibco Life Technologies, Нидерланды) при 37°С и 5% CO2 в инкубаторе (Sanyo Electric Co. Ltd., Япония). Замену среды проводили каждые 72 ч.
Воздействие вемурафенибом и МТТ-анализ. Концентрации полумаксимального ингибирования (IC50) активности клеточного метаболизма на 50% противоопухолевым препаратом вемурафениб (PLX4032) (S1267; SelleckChem, США) для обеих клеточных линий были определены методом MTT-теста. Для этого клетки рассеивали в 96-луночные планшеты в концентрации 3 × 104 кл. в 100 мкл среды в каждую лунку. Через 24 ч питательную среду заменяли на свежую и добавляли вемурафениб из стокового раствора 50 мМ в ДМСО (Helicon, Россия) с конечной концентрацией в среде 0.75, 1.25, 2.5, 5 и 10 мкМ. Контролем служили клетки без добавления препарата. Через 72 ч питательную среду заменяли на среду, в которую добавляли 5%-ный раствор МТТ-бромида (5 мг/мл) (Invitrogen, Thermo Fisher Scientific, Inc., Нидерланды) и культивировали 4 ч. Затем среду из лунок удаляли и добавляли 100 мкл ДМСО для растворения образовавшихся кристаллов МТТ-формазана. Оптическую плотность раствора измеряли при 490/620 нм на спектрофотометре Эфос-9305 (ОАО Швабе-Фотосистемы, Россия). Эксперимент повторяли трижды. IC50 для обеих клеточных линий рассчитаны с использованием программного обеспечения Graphpad PRISM 8.0 (GraphPad, США). Значения IC50 определяли по калибровочной (логарифмической) прямой зависимости метаболической активности от концентрации препарата.
Клетки меланомы BRO и SK-MEL-2 рассеивали в 6-луночные планшеты в концентрации 4 × 105 кл./мл, через 24 ч заменяли питательную среду на свежую и добавляли вемурафениб, исходя из ранее рассчитанных IC50 для каждой линии исследуемых клеток (табл. 1). Через 72 ч заменяли питательную среду и культивировали клетки еще 48 ч. Полученные клетки использовали для дальнейшего анализа.
Таблица 1.
Используемые концентрации вемурафениба для клеток линий BRO и SK-MEL-2 меланомы
| Концентрация, кратная дозе IC50 |
Конечная концентрация, мкМ | |
|---|---|---|
| клетки BRO | клетки SL-MEL-2 | |
| 1(IC50) | 1.6 | 1.3 |
| 10(IC50) | 16.4 | 12.5 |
| 50(IC50) | 81.8 | 62.4 |
| 75(IC50) | 122.7 | 93.5 |
| 100(IC50) | 163.6 | 124.7 |
Иммуноцитохимическое окрашивание. Пролиферацию клеток оценивали по присутствию внутриядерного белка Ki-67 – маркера активно делящихся клеток и отсутствующего в клетках, находящихся в фазе G0. Для иммунофлуоресцентного окрашивания использовали поликлональные кроличьи анти-Ki-67-антитела в разведении 1 : 200 (ab15580; Abcam, США), в качестве вторичных антител использовали козьи анти-кроличьи антитела Alexa Fluor® 488 IgG (H + L) в разведении 1 : 100 (Invitrogen, Thermo Fisher Scientific, США). Клетки фиксировали 4%-ным формалином в течение 1 ч, пермеабилизацию клеток проводили 0.1%-ным раствором Тритона X-100 (Biotechnik GmbH, Германия) в течение 15 мин и затем блокировали бычьей сывороткой в течение 1 ч при комнатной температуре. Затем клетки инкубировали с Ki-67-антителами в течение ночи при 4°C с последующей инкубацией при комнатной температуре в течение 1 ч с вторичными антителами. Ядерную ДНК окрашивали DAPI (1 мкг/мл) (Invitrogen, Thermo Fisher Scientific, Нидерланды). Подсчет клеток проводили не менее, чем в 10 полях зрения с помощью системы визуализации EVOS FLoid Cell Imaging Station (Thermo Fisher Scientific, США).
Анализ распределения клеток по фазам клеточного цикла. Использовали метод проточной цитометрии. Клетки снимали с поверхности планшетов 0.25%-ным раствором трипсин-ЭДТА (ООО НПП ПанЭко, Россия), промывали фосфатным буфером и фиксировали ледяным 70%-ным этанолом в течение 1 ч, затем промывали фосфатным буфером и инкубировали с Ki-67-антителами, конъюгированными с FITC (11-5698-82; Invitrogen, США), разведенными в фетальной бычьей сыворотке 1 : 200. Затем клетки промывали фосфатно-буферным раствором и окрашивали йодистым пропидием (PI, 100 мкг/мл) (Invitrogen, Thermo Fisher Scientific, Нидерланды) в течение 20 мин. Анализ проводили в Центре коллективного пользования КНЦ СО РАН на проточном цитофлуориметре Navios (Beckman Coulter, США), используя лазер с длиной волны 488 нм и необходимые фильтры. Полоса пропускания для FITC составляла 530/30 нм и для PI – 610/20 нм. Обработку полученных цитофлуориметрических результатов осуществляли с помощью программ Navios Software v. 1.2 и Kaluza v. 2.1.1 (Beckman Coulter, США). В каждой пробе анализировали не менее 50000 клеток. Гейтирование клеток, находящихся на разных стадиях клеточного цикла, осуществляли в логарифмическом режиме. Клетки, находящиеся в фазе G0, являются отрицательными по Ki-67 и имеют низкие уровни PI, их гейтирование осуществляли в диапазоне значений до 100 по шкале флуоресценции Ki-67-FITC (отрицательный результат) и в диапазоне значений флуоресценции PI 0.7–1.3 отн. ед.
Анализ жизнеспособности клеток. Для определения доли живых, апоптотических и некротических клеток использовали набор реагентов FITC-Annexin-V (Biolegend Biolegend, США) в соответствии с инструкцией производителя. Снятые с планшета клетки дважды промывали фосфатным буфером, ресуспендировали в 100 мкл связывающего буфера и добавляли 5 мкл Annexin-V, инкубировали 15 мин при комнатной температуре, затем промывали в связывающем буфере и добавляли 5 мкл PI (Biolegend Biolegend, США). По результатам анализа окрашенные клетки разделяли на четыре группы: жизнеспособные (Annexin-V–PI–), ранние апоптотические (Annexin-V+PI–), поздние апоптотические (Annexin-V+PI+) и некротические (Annexin-V–PI+) клетки. Пропорцию клеток в каждой фазе определяли с помощью проточного цитометра Cytomics FC-500 (Beckman Coulter, США) с использованием программного обеспечения CXP (версия 2.2) (Beckman Coulter, США).
Выделение РНК. Выделение тотальной РНК проводили с помощью наборов РИБО-золь-С и РИБО-сорб в соответствии с инструкцией производителя (АмплиСенс®, Россия). Концентрацию мРНК измеряли с помощью флуориметра Qubit® 2.0 (Invitrogen Life Technologies, Сингапур) и набора Qubit® RNA HS Assay kit (Invitrogen, США).
Обратная транскрипция (ОТ) и ПЦР в реальном времени (ПЦР-РВ). Экспрессию генов белков C-DKN1B, CDK4 и CCND1, участвующих в регуляции клеточного цикла, определяли методом ПЦР-РВ. Выделенную мРНК подвергали обратной транскрипции в кДНК с помощью обратной транскриптазы MMLV (набор MMLV RT kit; Евроген, Россия). Реакционная мастер-смесь состояла из 6 мкл РНК, 3 мкл случайного праймера, 4 мкл 5-кратного буфера для синтеза первой цепи, 2 мкл DTT, 2 мкл смеси dNTPs, 1 мкл MMLV ревертазы и 2 мкл dH2O. Смесь инкубировали в течение 30 мин при 37°C.
Для ПЦР-РВ использовали наборы реактивов TaqMan® (Applied Biosystems; Thermo Fisher Scientific, Inc., США) для анализа экспрессии следующих генов: CDKN1B (ингибитора циклин-зависимой киназы 1B; Hs05046945_s1), CDK4 (циклин-зависимой киназы 4; Hs00364847_m1), CCND1 (циклина D1; Hs00765553_m1). В качестве эндогенных контролей использовали наборы того же производителя для гена HPRT (гипоксантингуанинфосфорибозилтрансферазы 1; Hs02800695_m1) и гена GAPDH (глицеральдегид-3-фосфатдегидрогеназы; Hs02786624_g1). Реакционная смесь для ПЦР состояла из 8 мкл 2.5-кратной реакционной смеси для ОТ-ПЦР с эталонным красителем ROX (Syntol, Россия), 2 мкл кДНК, 1 мкл праймеров и 9 мкл деионизированной воды. Полученные результаты обработаны методом прямого сравнения ΔΔCt.
Статистический анализ. Использовали программу Statistica 6.0 (StatSoft, Россия). Статистическую значимость полученных данных оценивали с помощью непараметрического критерия Манна−Уитни и t-критерия Стьюдента. Статистически значимыми считали различия при уровне значимости p < 0.05.
РЕЗУЛЬТАТЫ
После воздействия противоопухолевым препаратом вемурафениб метаболическая активность клеток снижалась соответственно увеличению его концентрации. IC50 исследуемого вещества составила для клеточной линии BRO 1.636 мкМ, для SK-MEL-2 – 1.247 мкМ (рис. 1). Далее клетки подвергали воздействию вемурафенибом в концентрациях, кратных дозе IC50 (табл. 1) с последующим выполнением иммуноцитохимической визуализации доли Ki-67-негативных клеток.
Рис. 1.
Изменение активности метаболизма (АМ) клеток линий BRO (а) и SK-MEL-2 (б) в зависимости от концентрации вемурафениба. По результатам МТТ-теста.
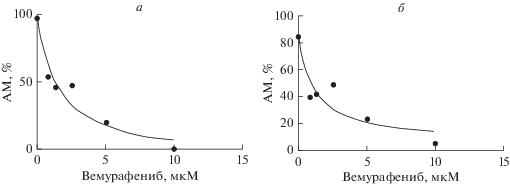
После воздействия вемурафенибом общее количество клеток BRO уменьшалось пропорционально возрастанию концентрации препарата. При концентрации 1(IC50) в клетках BRO количество Ki-67-негативных клеток увеличилось на 2%, при 50(IC50) – на 75%, при 75(IC50) и 100(IC50) доля непролиферирующих клеток составила 100% по сравнению с контролем. В клетках SK-MEL-2 доля Ki-67-негативных клеток (в фазе G0 клеточного цикла) достигла уровня 77.5%, 94.2% и 100% при воздействии вемурафенибом в концентрации 10(IC50), 75(IC50) и 100(IC50) соответственно (рис. 2, табл. 2). По результатам иммуноцитохимического окрашивания доли клеток линии BRO в фазе G0 увеличивалась в 7 раз при концентрации вемурафениба 50(IC50), клеток SK-MEL-2 – в 5 раз при 10(IC50). Эти концентрации были выбраны и использованы в дальнейшем для подтверждения биологического эффекта вемурафениба методом проточной цитометрии. При более высоких концентрациях препарата оставались единичные клетки, и хотя было отмечено увеличение доли Ki-67-негативных клеток, использовать эти данные не представлялось возможным.
Рис. 2.
Клетки меланомы линий BRO (а–в) и SK-MEL-2 (г–е), окрашенные антителами к белку Ki-67 после 72-часового действия вемурафениба. а, г – Контроль (до воздействия вемурафенибом). б, д – При дозе вемурафениба 1(IC50), в – при дозе 50(IC50), е – при дозе 10(IC50). Ядра Ki-67-положительных клеток окрашены в голубой цвет, ядра всех других клеток – в синий цвет (DAPI). Регистрируется увеличение относительное количество Ki67-негативных клеток после экспозиции.
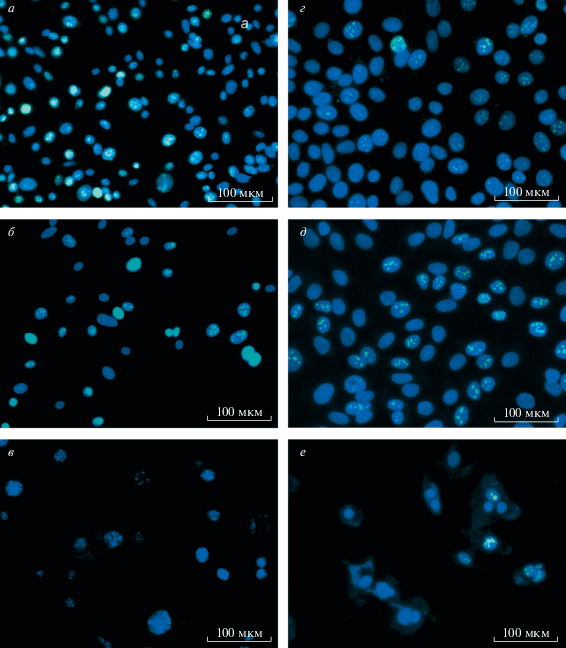
Таблица 2.
Доля Ki-67-негативных клеток после воздействия вемурафенибом по результатам иммунофлуоресцентного окрашивания
| Концентрация вемурафениба |
Ki-67-негативные клетки, % | |
|---|---|---|
| BRO | SK-MEL-2 | |
| – (Контроль) | 10.5 ± 0.0 | 14.6 ± 6.4 |
| 1(IC50) | 12.9 ± 0.0а | 13.4 ± 2.0 |
| 10(IC50) | 21.2 ± 0.0а | 77.5 ± 3.6а |
| 50(IC50) | 75.0 ± 0.03а | 78.7 ± 17.8а |
| 75(IC50) | 100.0 ± 0.0а | 94.2275 ± 4.4а |
| 100(IC50) | 100.0 ± 0.0а | 100.0 ± 0.0 |
а Здесь и в табл. 3, 4: различия с показателями контрольной группы соответствующего типа клеток достоверны при p < 0.05.
Результаты проточной цитометрии показали аналогичную тенденцию (рис. 3). Доля клеток BRO в фазе G0 при воздействии вемурафенибом увеличилась с 2% в контроле до 7.8 и 49% при 1(IC50) и 50(IC50) соответственно. Доля клеток, находящихся в стадии раннего апоптоза (окрашенных Annexin-V-позитивно и PI-негативно), уменьшилась с 34.5% в контроле до 3.45% при дозе 50(IC50). Доля клеток в стадии позднего апоптоза (Annexin-V-позитивных и PI-позитивных) увеличилась с 31.9% в контроле до 63.8% при 50(IC50), при этом доля живых клеток (Annexin-V-негативных, PI-негативных) в экспериментальных группах была выше, чем в контроле: при 1(IC50) – 84.8, а при 50(IC50) – 30.0% против 25.3% в контрольной группе (табл. 3, рис. 4).
Рис. 3.
Распределение клеток линий BRO (а–в) и SK-MEL-2 (г–е) по фазам клеточного цикла после воздействия вемурафенибом по результатам проточной цитометрии. По горизонтали и вертикали – интенсивность флуоресценции йодида пропидия (PI) и анти-Ki-67-антител соответственно. G0-позитивные клетки находятся в нижнем квадрате. а, г – Контроль (до воздействия); дозы препарата: б, д – 1(IC50), в – 50(IC50); е – 10(IC50).
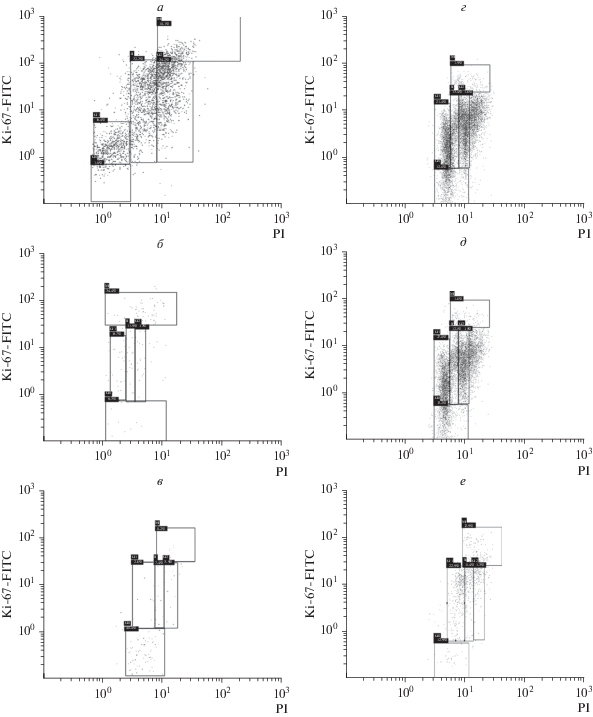
Таблица 3.
Изменение доли клеток в фазе G0, живых и апоптотических клеток после воздействия вемурафенибом. По результатам проточной цитометрии
| Концентрация вемурафениба |
Фаза G0, % | Ранний апоптоз, % | Поздний апоптоз, % | Живые, % |
|---|---|---|---|---|
| Линия BRO | ||||
| – (Контроль) | 2.1 ± 0.3 | 34.5 ± 7.2 | 31.9 ± 3.2 | 25.4 ± 2.6 |
| 1(IC50) | 7.8 ± 2.9а | 4.2 ± 2.17а | 2.2 ± 1.0 * | 84.8 ± 3.7а |
| 50(IC50) | 49.0 ± 15.1а | 3.5 ± 0.9а | 63.8 ± 30.4 | 30.1 ± 29.0 |
| Линия SK-MEL-2 | ||||
| – (Контроль) | 12.5 ± 1.5 | 6.0 ± 0.3 | 1.6 ± 0.1 | 91.5 ± 0.40 |
| 1(IC50) | 15.5 ± 0.8а | 3.6 ± 2.0 | 0.8 ± 0.4а | 95.1 ± 2.46 |
| 10(IC50) | 18.4 ± 10.7 * | 18.3 ± 7.2а | 2.0 ± 0.4 | 78.83 ± 7.43а |
Рис. 4.
Распределение клеток меланомы BRO (а–в) и SK-MEL-2 (г–е) по стадиям жизнеспособности после воздействия вемурафенибом в разной концентрации. По результатам проточной цитометрии. По горизонтали и вертикали – интенсивность флуоресценции Annexin-V (AnV) и PI соответственно. а, г – Контроль (до воздействия); дозы препарата: б, д – 1(IC50), в – 50(IC50); е – 10(IC50).
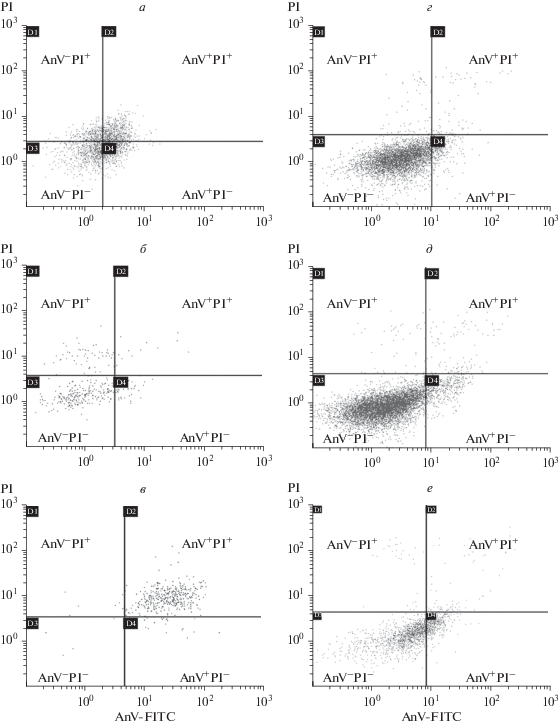
Доля клеток SK-MEL-2 в фазе G0 после воздействия вемурафенибом увеличивалась незначительно: от 12.5% в контроле до 15.5% при 1(IC50) и до 18% при дозе 10(IC50). При этом доля клеток в стадии раннего апоптоза увеличилась с 6 в контроле до 18% при 10-кратной IC50. Доля клеток в стадии позднего апоптоза была близка к контрольной при 10(IC50): 1.6 и 2.0% соответственно (табл. 3, рис. 4).
Было установлено изменение экспрессии белков, участвующих в регуляции клеточного цикла. В клетках меланомы BRO в экспериментальных группах экспрессия гена циклин-зависимой киназы CDK4 и ингибитора CDKN1B не детектировалась, экспрессия CCND1 (циклина, регулирующего активность CDK4) увеличивалась при 1(IC50) и 10(IC50) в 46.7 и 143 раза соответственно, а и при дальнейшем увеличении концентрации не детектировалась (табл. 4).
Таблица 4.
Уровни относительной экспрессии генов CDK4, CCND1, CDKN1B после воздействия вемурафенибом. По результатам ПЦР в реальном времени
| Концентрация вемурафениба | CDK4 | CCND1 | CDKN1B |
|---|---|---|---|
| Линия BRO | |||
| – (Контроль) | 0 | 0.2 | 15.1 |
| 1(IC50) | 0 | 16.7 | 0 |
| 10(IC50) | 0 | 26.4а | 0 |
| 50(IC50) | 0 | 0 | 0 |
| 75(IC50) | 0 | 0 | 0 |
| 100(IC50) | 0 | 0 | 0 |
| Линия SK-MEL-2 | |||
| – (Контроль) | 0.0 | 1 | 0.0 |
| 1(IC50) | 0.1 | 1.6 | 0.0 |
| 10(IC50) | 0.2 | 1.4 | 0.0 |
| 50(IC50) | 0 | 9.0а | 0.2 |
| 75(IC50) | 0 | 6.0 | 0.7 |
| 100(IC50) | 0 | 7.7 | – |
Для клеток меланомы SK-MEL-2 отмечали тенденцию к увеличению относительной экспрессии CDK4 при концентрациях препарата 1(IC50) и 10(IC50). При больших концентрациях экспрессия CDK4 не детектировалась. Экспрессия CCND1 при концентрациях препарата 1(IC50) и 10(IC50) была близкой к контролю, но увеличивалась при 50(IC50), 75(IC50) и 100(IC50). Экспрессия CDKN1B была максимальной и выше, чем в контрольной группе в 14.6 раз при 10(IC50), а при дальнейшем увеличении концентрации вемурафениба снижалась (табл. 4).
ОБСУЖДЕНИЕ
Целью настоящей работы было оценить способность противоопухолевого вещества вемурафениб влиять на уровень дормантных опухолевых клеток. Подобный подход описан в ряде работ. Например, показана способность доксорубицина и доцетакселя повышать долю дормантных клеток в общем пуле клеток рака молочной железы и рака предстательной железы (Li et al., 2014). Принцип такой модели заключается в том, что препарат воздействует на пролиферирующие клетки, приводя их к апоптозу, а покоящиеся клетки с арестом клеточного цикла G0/G1 остаются интактными. В представленной работе в качестве противоопухолевого агента использован вемурафениб, применяемый при терапии меланомы на поздних стадиях заболевания.
Действительно, при воздействии вемурафенибом отмечали повышение уровня клеток, находящихся в фазе G0, согласно результатам иммунофлюоресцентного анализа и проточной цитометрии. Вемурафениб избирательно блокирует АТФ-связывающий сайт BRAF, что приводит к уменьшению передачи сигналов в MAP-киназном каскадном пути и далее – к апоптозу. Снижение активности сигнального пути MAPK–ERK1/2 также является одним из индикаторов дормантного поведения клеток (Ossowski, Aguirre-Ghiso, 2010). Соотношение сигнальных путей киназ ERK1/2 и p38 регулирует ход клеточного цикла, а повышение активности киназы p38 посредством индукции ответа белков с внутренней неупорядоченностью обеспечивает арест клеточного цикла и сохранение жизнеспособности клеток (Fares, 2020). Это соотносится с результатами нашего анализа уровня апоптоза: сохранение сравнительно высокого содержания живых клеток после воздействия вемурафенибом на фоне снижения их метаболической активности, определяемой по МТТ-тесту, может также говорить о повышении доли живых, но не пролиферирующих клеток со сниженным метаболизмом.
В нашей работе были использованы две линии клеток BRAFV600– меланомы (BRO и SK-MEL-2). В этих клетках изменение доли покоящихся непролиферирующих клеток было подтверждено окрашиванием на белок Ki-67 после действия вемурафениба в разных концентрациях. При этом в клетках BRO и SK-MEL-2 предсказуемо возрастала экспрессия гена ингибитора циклин-зависимой киназы B1 (CD-KN1B) и наблюдалась низкая экспрессия гена циклин-зависимой киназы 4 (CDK4) и гена циклина D1 (CCND1), но в клетках линии SK-MEL-2 наблюдали парадоксально высокую экспрессию гена циклина CCND1. Белок CDKN1B выполняет в клетках несколько функций. При ядерной локализации он связывается с комплексом CDK4/CCND1, регулирующим переход клетки в фазу клеточного цикла S (G0/S), подавляя функционирование этого комплекса и блокируя переход клетки из фазы G1 в фазу S, нарушая нормальное протекание клеточного цикла и деление клеток. Показано, что CDKN1B подавляет развитие опухолей, но также участвует в избегании ими развития апоптоза путем перехода клеток в фазу G0 при воздействии противоопухолевыми препаратами (Alcazar et al., 2012), являясь, таким образом, маркером дормантных клеток.
Соотношение белков CDKN1B/CDK4/CCND1 может быть важным показателем для понимания поведения клетки и остановки в G1 клеточного цикла. Во-первых, высокий уровень экспрессии CDK4 и CCND1 в клетке свидетельствуют о нормальном протекании клеточного цикла или усиленной пролиферации, наблюдаемой в клетках меланомы; во-вторых, увеличение экспрессии CDKN1B – свидетельство остановки в фазе G1 и перехода клетки в дормантное состояние (G0). Изменения экспрессии гена циклина CCND1 наблюдаются при развитии меланомы (Sauter et al., 2002). Описан механизм приобретения резистентности к BRAF-ингибиторам путем сверхэкспрессии CCND1 и мутаций CDK4 и выдвинуто предположение, что клетки с повышенной амплификацией CCND1 менее зависимы от передачи внутриклеточного каскада BRAF/MEK (Smalley et al., 2002).
Таким образом, вемурафениб индуцирует повышение доли клеток меланомы, находящихся в фазе G0. С учетом доказанного возможного присутствия в пределах одной опухоли клеток, как BRAFV600–, так и BRAFV600+ (Chang, 2020), эта способность вемурафениба требует дальнейшего изучения, так как она может вносить вклад в формирование резистентности опухоли к терапии. Описанная нами технология получения популяции клеток со сравнительно высокой представленностью покоящихся клеток может использоваться в фундаментальных исследованиях канцерогенеза и для создания новых подходов к терапии злокачественных новообразований.
Список литературы
Alcazar O., Achberger S., Aldrich W., Hu Z., Negrotto S., Saunthararajah Y., Triozzi P. 2012. Epigenetic regulation by decitabine of melanoma differentiation in vitro and in vivo. Int. J. Cancer. V. 131. P. 18.
Chang G.A, Wiggins J.M., Corless B.C., Syeda M.M., Tadepalli J.S., Blake S., Fleming N., Darvishian F., Pavlick A., Berman R., Shapiro R., Shao Y., Karlin-Neumann G., Spittle C., Osman I., Polsky D. 2020. TERT, BRAF, and NRAS mutational heterogeneity between paired primary and metastatic melanoma tumors. J. Invest. Dermatol. V. 140. P. 1609.
Cheng L., Lopez-Beltran A., Massari F., MacLennan G.T., Montironi R. 2018. Molecular testing for BRAF mutations to inform melanoma treatment decisions: a move toward precision medicine. Mod. Pathol. V. 31. P. 24.
Fares J., Fares M.Y., Khachfe H.H., Salhab H.A., Fares Y. 2020. Molecular principles of metastasis: A hallmark of cancer revisited. Sign. Transduct. Tar. V. 5. P. 28.
Gao X.-L., Zhang M., Tang Y.-L., Liang X.-H. 2017. Cancer cell dormancy: Mechanisms and implications of cancer recurrence and metastasis. OncoTargets Ther. V. 10. P. 5219.
Haferkamp S., Borst A., Adam C., Hufnagel A.L., Houben R., Meierjohann S. 2013. Vemurafenib induces senescence features in melanoma cells. J. Invest. Dermatol. V. 133. P. 1601.
Inamdar G.S., Madhunapantula S.V., Robertson G.P. 2010. Targeting the MAPK pathway in melanoma: Why some approaches succeed and other fail. Biochem. Pharmacol. V. 80. P. 624.
Li S., Kennedy M., Payne S., Kennedy K., Seewaldt V.L., Pizzo S.V., Bachelder R. E. 2014. Model of tumor dormancy/recurrence after short-term chemotherapy. PLoS One 9(5), e98021. https://doi.org/10.1371/journal.pone.0098021
Lorentzen H.F. Targeted therapy for malignant melanoma. 2019. Curr. Opin. Pharmacol. V. 46. P. 116.
Manjili M.H. 2017. Tumor dormancy and relapse: from a natural byproduct of evolution to a disease state. Cancer Res. V. 77. P. 2564.
Ossowski L., Aguirre-Ghiso J.A. 2010. Dormancy of metastatic melanoma. Pigment Cell Melanoma Res. V. 23. P. 41.
Pradhan S., Sperduto J.L., Farino C.J., Slater J.H. 2018. Engineered in vitro models of tumor dormancy and reactivation. J. Biol. Eng. V. 12. P. 37.
Sauter E.R., Yeo U.-C., von Stemm A., Zhu W., Litwin S., Tichansky D.S., Pistritto G., Nesbit M., Pinkel D., Herlyn M., Bastian B.C. 2002. Cyclin D1 is a candidate oncogene in cutaneous melanoma. Cancer Res. V. 62. P. 3200.
Senft D., Ronai Z.A. 2016. Immunogenic, cellular, and angiogenic drivers of tumor dormancy – a melanoma view. Pigment Cell Melanoma Res. V. 29. P. 27.
Smalley K.S.M., Lioni M., Palma M.D., Xiao M., Desai B., Egyhazi S., Hansson J., Wu H., King A.J., Van Belle P., Elder D.E., Flaherty K.T., Herlyn M., Nathanson K.L. 2008. Increased cyclin D1 expression can mediate BRAF inhibitor resistance in BRAF V600E-mutated melanomas. Mol. Cancer Ther. V. 7. P. 2876.
Tahiri A., Røe K., Ree A.H., de Wijn R., Risberg K., Busch C., Lønning P.E., Kristensen V., Geisler J. 2013. Differential inhibition of ex vivo tumor kinase activity by vemurafenib in BRAF(V600E) and BRAF wild-type metastatic malignant melanoma. PLoS One. 8. e72692. https://doi.org/10.1371/journal.pone.0072692
Touil Y., Segard P., Ostyn P., Begard S., Aspord C., Machhour R.E., Masselot B., Vandomme J., Flamenco P., Idziorek T., Figeac M., Formstecher P., Quesnel B., Polakowska R. 2016. Melanoma dormancy in a mouse model is linked to GILZ/FOXO3A-dependent quiescence of disseminated stem-like cells. Sci. Rep. 6, 30405. https://doi.org/10.1038/srep30405
Дополнительные материалы отсутствуют.


