Цитология, 2020, T. 62, № 11, стр. 815-821
ГАМК-ергические аксосоматические синапсы нейронов коры головного мозга крысы
В. А. Разенкова 1, *, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: valeriya.raz@yandex.ru
Поступила в редакцию 17.07.2020
После доработки 29.07.2020
Принята к публикации 01.08.2020
Аннотация
Целью работы являлось изучение организации ГАМК-ергических аксосоматических синаптических терминалей в области париетальной, цингулярной и пириформной коры головного мозга крысы с помощью иммуногистохимической реакции на фермент синтеза ГАМК – глутаматдекарбоксилазу и последующей конфокальной лазерной микроскопии. В качестве материала для исследования использовали головной мозг крыс-самцов породы Вистар (n = 11). В результате проведенной работы получены сведения о морфологической организации пресинаптических терминалей исследуемых областей коры. Были установлены различия в размерах ГАМК-ергических синапсов и плотности их распределения на телах пирамидных нейронов различных областей коры (P < 0.05). Продемонстрирована высокая информативность методов конфокальной лазерной микроскопии при изучении синаптических структур головного мозга. Полученные результаты позволяют получить более полную оценку тормозных структур головного мозга и их взаимодействия с глутаматергическими структурами (которыми являются пирамидные нейроны). Используемый методологический подход способствует выявлению морфологических признаков дисфункции ГАМК-ергической системы.
Синаптические терминали, использующие ГАМК (гамма-аминомасляную кислоту) в качестве нейротрансмиттера, называют ГАМК-ергическими. Роль ГАМК-ергических тормозных синапсов в коре больших полушарий заключается в регулировании физиологической активности пирамидных нейронов – основных возбуждающих эфферентов коры головного мозга. Нарушение регуляции гомеостаза ГАМК приводит к изменениям соотношения возбуждающих и тормозных сигналов, что наблюдается при различных патологических состояниях. Часто подобные нарушения связаны с различными психоневрологическими расстройствами, такими как расстройства аутического спектра, синдром Туретта, болезнь Альцгеймера (Südhof, 2017; Prévot, Sibille, 2020). Так, нарушения в ГАМК-ергической нейропередаче были обнаружены в корковых отделах лимбической системы пациентов с шизофренией и биполярным расстройством (Benes et al., 2000). Известно, что одним из ключевых элементов лимбической системы является поясная кора (Коржевский и др., 2013). Благодаря своим связям с таламусом, гиппокампом и парагиппокампальной извилиной, а также другими отделами коры, поясная кора принимает участие в регуляции когнитивных функций, таких как формирование рабочей памяти, переработка эмоционально окрашенной информации и формирование эмоциональных реакций (Etkin et al., 2011; Козловский и др., 2012; Григорьев и др., 2018). Не менее важной структурой лимбической системы является пириформная кора. Эта область коры больших полушарий является частью обонятельной системы головного мозга. Предполагается, что пириформная кора может играть критическую роль в развитии эпилепсии (Young et al., 2018, 2019). Таким образом, большое значение приобретает исследование структурных особенностей синаптических терминалей в этих областях коры, что важно для оценки их влияния на когнитивные функции в случае патологического изменения ГАМК-ергических структур головного мозга на начальных этапах развития заболевания.
Ранее синаптические структуры исследовали с применением методов электронной микроскопии (von Krosigk et al., 1992; Fabri, Manzoni, 1996). Для выявления ультраструктурных особенностей тормозных нейронов и их терминалей исследователи продолжают использовать этот метод и в настоящее время (Кириченко и др., 2017; Glausier et al., 2017; Zhang et al., 2019). Однако возможности метода электронной микроскопии ограничиваются техническими проблемами, связанными с трудоемкой пробоподготовкой и малым размером образца ткани, что не позволяет использовать электронную микроскопию в качестве рутинного метода. Альтернативой выступают методы флуоресцентной микроскопии, которые могут использоваться не только в научных исследованиях, но и при клинической диагностике. Разновидностью флуоресцентной микроскопии является конфокальная лазерная микроскопия. Преимущество этого метода заключается в возможности исследовать большую площадь среза при высоком пространственном разрешении. Кроме того, особенности обработки сигнала позволяют послойно сканировать образец на заданной глубине, исключая сигналы из других плоскостей среза, что дает возможность с большей точностью анализировать мелкие структуры синаптических терминалей (Феофанов, 2007; Штейн, 2007; Свищев, 2011).
Цель настоящей работы – изучить организацию ГАМК-ергических аксосоматических синаптических терминалей в области париетальной, цингулярной и пириформной коры головного мозга крысы с использованием методов конфокальной лазерной микроскопии.
МАТЕРИАЛ И МЕТОДИКА
Исследование проводили на парафиновых срезах головного мозга половозрелых интактных крыс-самцов породы Вистар (n = 11) из архива лаборатории функциональной морфологии центральной и периферической нервной системы Института экспериментальной медицины. При содержании и умерщвлении животных соблюдали международные основные принципы Европейской Конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях (Страсбург, 1986 г.) и “Правила проведения работ с использованием экспериментальных животных” (приказ № 755 от 12.08.1977 г. МЗ СССР, заключение локального этического комитета № 1/20 от 27.02.2020). Материал фиксировали в цинк-этанол-формальдегиде и заливали в парафин по общепринятой методике. Из залитого в парафин материала формировали блоки, изготавливали срезы толщиной 5 мкм и наклеивали их на предметные стекла с адгезивным покрытием Superfrost Ultra Plus (Menzel Gläser, Германия).
После депарафинирования препаратов проводили тепловое демаскирование в модифицированном цитратном буфере (S1700, Agilent, США) в течение 24 мин. Для ингибирования эндогенной пероксидазы срезы обрабатывали 3%-ным водным раствором перекиси водорода в течение 10 мин. Для выявления ГАМК-ергических синапсов использовали антитела к ферменту синтеза ГАМК – глутаматдекарбоксилазе (GAD). На основании предварительного тестирования антител к различным изоформам этого белка (GAD65 и GAD67), предпочтение было отдано антителам к GAD67, поскольку этот реагент выявляет как синаптические терминали, так и тела ГАМК-ергических нейронов (что может быть использовано в качестве внутреннего положительного контроля). Кроличьи поликлональные антитела к GAD67 (E10260, Spring Bioscience, США) в разведении 1 : 300 наносили на срезы и инкубировали во влажной камере 3 сут при температуре 27.5°С. В качестве вторичных антител использовали реагент Reveal HRP Conjugate из набора Reveal Polyvalent HRP DAB Detection System (SPD-060, Spring Bioscience, США). Инкубацию во вторичных антителах проводили в течение 30 мин при температуре 27.5°С. После окончания инкубации и промывки срезов в фосфатно-солевом буфере на них наносили козьи антитела против пероксидазы хрена, конъюгированные с флуорохромом Cy3 (рабочее разведение 1 : 100) (Jackson ImmunoResearch, США). Для визуализации клеточных ядер использовали флуоресцентный ядерный краситель SYTOX Green в концентрации 0.5 мкМ (Invitrogen, США), который добавляли непосредственно в раствор антител.
Срезы инкубировали 30 мин при температуре 27.5°С. После обезвоживания и просветления в орто-ксилоле (Вектон, Россия) препараты заключали в среду Cytoseal 60 (Richard-Allan Scientific, США). В качестве положительного контроля при постановке иммуногистохимических реакций на GAD67 были использованы препараты мозжечка крысы, для нейронов которых хорошо известна локализация этого белка (Greif et al., 1991). Для постановки отрицательного контроля антител на один из срезов обрабатываемой серии препаратов вместо раствора первичных антител наносили раствор для разведения антител Antibody Diluent (Spring Bioscience, США).
Анализ и фотографирование гистологических препаратов проводили с помощью сканирующего конфокального микроскопа Zeiss LSM 800, оснащенного системой Airyscan (Carl Zeiss AG, Германия). Использовали объективы Plan-Apochromat 20×/0.8 M27 и Plan-Apochromat 63×/1.40 Oil DICM27 (масляная иммерсия). Для возбуждения флуоресценции Cy3 и SYTOX Green использовали лазеры с длиной волны 561 и 488 нм соответственно. Обработку полученных изображений проводили с помощью программ ZEN-2012 (Carl Zeiss AG, Германия) и ImageJ (Wayne Rasband (NIH), США).
Размер пирамидных нейронов и ГАМК-ергических синаптических терминалей оценивали путем вычисления площади (area). Проводили измерение параметров округлости (circularity) синаптических терминалей и соотношения длинной и короткой сторон прямоугольника, в который вписывается пресинапс (aspect ratio). Дополнительно считали плотность распределения синаптических терминалей на единицу периметра пирамидного нейрона (10 мкм). Статистическую обработку проводили в программах Statistica 10 (StatSoft, Россия) и GraphPad Prism 8 (GraphPad Software, США). Данные представляли в виде среднего значения и ошибки средней. Проверку нормальности распределения данных осуществляли с применением критерия Шапиро−Уилка. Для сравнения данных, соответствующих нормальному распределению, применяли однофакторный дисперсионный анализ ANOVA. Данные, несоответствующие нормальному распре-делению, сравнивали с помощью одностороннего дисперсионного анализа Краскела−Уоллиса. Различия считали достоверными при P < 0.05.
РЕЗУЛЬТАТЫ
Проведение иммуногистохимической реакции на GAD67 позволило иммуноселективно выявить тела и синаптические терминали ГАМК-ергических нейронов (рис. 1а, в, д). Наиболее отчетливо аксосоматические ГАМК-ергические синапсы выявляются на глутаматергических пирамидных нейронах, составляющих около 80% клеток коры головного мозга. Размеры пирамидных нейронов варьируют в зависимости от области коры. Так, в области париетальной коры средняя площадь этих клеток составляет 213.74 ± ± 9.84 мкм2, тогда как в областях цингулярной и пириформной коры находятся нейроны со средней площадью 123.97 ± 4.94 и 114.29 ± 5.11 мкм2 соответственно. Статистический анализ выявил различия в размерах пирамидных нейронов цингулярной и пириформной коры по сравнению с размерами клеток в области париетальной коры.
Рис. 1.
ГАМК-ергические синаптические терминали на пирамидных нейронах головного мозга крысы. а, в, д – ГАМК-ергические окончания на пирамидных нейронах разных областей коры. Иммуногистохимическая реакция на GAD67, визуализация с помощью флуорохрома Cy3 (красный цвет) с окраской ядер SYTOX Green (зеленый цвет). Рамка ограничивает пирамидный нейрон, стрелки указывают на ГАМК-ергические синаптические терминали. Конфокальная лазерная микроскопия. Объектив Plan-Apochromat 63×/1.40 Oil DICM27 (масляная иммерсия). Масштабные отрезки – 20 мкм. а – Париетальная кора, в – цингулярная кора, д – пириформная кора. б, г, е – Обобщенные схемы, характеризующие наиболее часто встречающиеся варианты пирамидных нейронов и особенности распределения и морфологии синапсов. б – Пирамидный нейрон париетальной коры с крупными синапсами, г – меньшего размера пирамидный нейрон цингулярной коры с крупными синапсами, е – малый пирамидный нейрон пириформной коры с мелкими синапсами. Стрелки указывают на ГАМК-ергические синаптические терминали. Масштабные отрезки – 10 мкм.
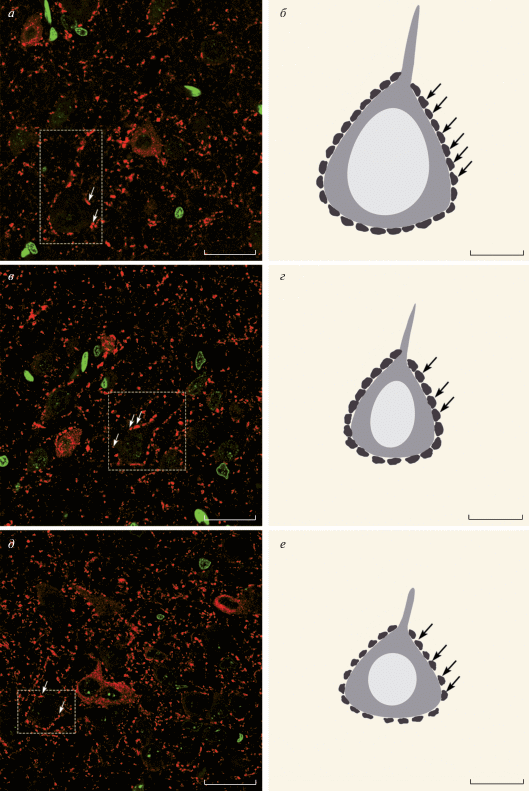
В ходе проведения морфометрического анализа синаптических терминалей было выявлено, что пресинаптические ГАМК-ергические терминали в исследуемых областях коры представляют собой относительно крупные структуры и располагаются равномерно по периметру клетки (рис. 1). Плотность распределения синапсов на единицу длины в пириформной и цингулярной областях коры примерно одинакова и составляет в среднем 5 синапсов на 10 мкм (5.12 ± 0.32 и 5.27 ± 0.3 соответственно) по сравнению с 6.54 ± 0.29 синаптическими терминалями на 10 мкм в области париетальной коры.
Как наиболее крупные, так и наиболее мелкие пресинапсы наблюдали в цингулярной коре (2.97 и 0.02 мкм2 соответственно), однако наименьшие средние значения площади пресинаптических терминалей отмечали в области пириформной коры. Статистически достоверными были различия размеров синаптических терминалей между пириформной (0.35 ± 0.02 мкм2) и париетальной (0.67 ± 0.03 мкм2), но не цингулярной (0.64 ± 0.03 мкм2) корой. Размеры пресинаптических терминалей цингулярной и пириформной областей коры также различаются статистически.
Наше исследование показало, что несмотря на наличие в изучаемых областях структур, имеющих округлую (или близкую к округлой) форму, в среднем форма синаптических терминалей во всех исследуемых областях коры значительно отличается от таковой. Средние значения округлости составляют: 0.51 ± 0.01 в области париетальной коры, 0.52 ± 0.01 в области цингулярной, и 0.53 ± 0.01 в области пириформной коры. Также было показано, что значение длинной стороны синаптической терминали в среднем превышает значение ее короткой стороны более чем в полтора раза (1.61 ± 0.03, 1.68 ± 0.04 и 1.7 ± 0.03 в областях париетальной, цингулярной и пириформной коры соответственно).
Результаты проведенных измерений представлены в таблице (табл. 1).
Таблица 1.
Морфометрическая характеристика ГАМК-ергических синаптических терминалей и пирамидных нейронов трех областей коры головного мозга крысы
| Параметр | Париетальная кора | Цингулярная кора | Пириформная кора |
|---|---|---|---|
| Размер пирамидных нейронов, мкм2 | 213.74 ± 9.84 | 123.97 ± 4.94а | 114.29 ± 5.11а |
| Плотность распределения синапсов на единицу длины периметра (10 мкм) | 6.54 ± 0.29 | 5.27 ± 0.3а | 5.12 ± 0.32а |
| Размер пресинаптических терминалей, мкм2 | 0.67 ± 0.03 | 0.64 ± 0.03 | 0.35 ± 0.02б |
| Округлость | 0.51 ± 0.01 | 0.52 ± 0.01 | 0.53 ± 0.01 |
| Соотношение сторон пресинапса | 1.61 ± 0.03 | 1.68 ± 0.04 | 1.7 ± 0.03 |
ОБСУЖДЕНИЕ
Синаптические контакты являются ключевыми функциональными и структурными элементами центральной нервной системы. Аксосоматические ГАМК-ергические терминали на пирамидных нейронах принадлежат интернейронам различных классов. В первую очередь, это парвальбумин-содержащие корзинчатые нейроны – один из крупнейших классов ГАМК-ергических нейронов неокортекса. Парвальбумин-содержащие клетки составляют около 40% всех интернейронов и располагаются во всех кортикальных слоях за исключением первого. Другая группа клеток, образующих синаптические окончания на телах пирамидных нейронов – холецистокинин-содержащие корзинчатые нейроны. Их тела находятся преимущественно в II, III и IV слоях коры (Markram et al., 2004; Kepecs, Fishell, 2014; Lim et al., 2018; Kuljis et al., 2019).
Известно, что помимо глутаматергических нейронов коры сигналы от различных ядер таламуса получают быстроразряжающиеся корковые интернейроны, к которым относятся парвальбумин-содержащие клетки (Hull et al., 2009). Такие нейроны достигают критического уровня деполяризации быстрее глутаматергических, чем обеспечивают упреждающее торможение соседних с ними возбуждающих клеток, благодаря которому обеспечивается временна́я точность передачи сигналов от таламуса к коре (Hull et al., 2009; Зайцев, 2013). Холецистокинин-содержащие клетки относятся к классу интернейронов, экспрессирующих на мембране серотониновый рецептор типа 3. Помимо серотонина активацию этих клеток может вызывать ацетилхолин путем воздействия на Н-холинорецепторы, находящиеся на их мембране. Несмотря на то, что нейроны этого класса не относятся к быстроразряжающимся и не участвуют в формировании упреждающего торможения, возбуждение холецистокинин-содержащих клеток также обеспечивается сигналами, получаемыми от таламических ядер. Таким образом, обе группы нейронов, формирующих ГАМК-ергические синпатические терминали на телах пирамидных нейронов, обеспечивают связь коры с таламическими ядрами, что, по-видимому, позволяет поддерживать функции контроля эмоций в изучаемых корковых отделах лимбической системы (Lee et al., 2010; Rudy et al., 2011).
Морфологические характеристики синаптических терминалей, а также плотность их распределения могут служить важными нейроанатомическими параметрами, которые, предположительно, изменяются при патологии и моделировании заболеваний. В частности, размер синапсов коррелирует с таким функциональным аспектом, как вероятность высвобождения нейромедиатора (Holderith et al., 2012). Согласно нашим данным, для ГАМК-ергических синаптических терминалей характерно разнообразие размеров – от наиболее мелких структур в пределах 1 мкм2 до крупных синапсов, достигающих 3 мкм2, что соотносится с выделенными Петерсом и соавторами (Peters et al., 1990) типами аксонных терминалей. Более того, при использовании методики, описанной в настоящем исследовании, наблюдали структуры меньшего размера, чем плотные терминали по классификации Петерса.
Данные, полученные в ходе измерения размеров ГАМК-ергических синаптических терминалей, интересны в контексте вариации площадей самих пирамидных нейронов в различных областях коры. Пириформная кора млекопитающих относится к палеокортексу и состоит из трех слоев, а пирамидные нейроны этой области коры гомологичны скорее пирамидным нейронам III, но не V слоя неокортекса (Luzzati, 2015; Klingler, 2017). Принимая это во внимание, можно было бы ожидать, что размеры пирамидных клеток здесь будут отличаться. И действительно, клетки париетальной коры практически в два раза крупнее нейронов II слоя пириформной коры. Значительная разница в размерах ГАМК-ергических синаптических терминалей, образованных на телах этих нейронов пириформной коры по сравнению с таковыми в неокортексе, также была ожидаема. Поскольку характерное для палеокортекса распределение интернейронов не совпадает с их распределением в неокортексе, можно сделать предположение, что размеры ГАМК-ергических синаптических терминалей пириформной коры связаны с особенностями цитоархитектоники и послойной организацией этой области (Suzuki, Bekkers, 2010). При этом наши наблюдения показывают, что несмотря на соответствие размеров синаптических терминалей в областях новой коры, пирамидные нейроны V слоя цингулярной коры оказались меньше клеток, расположенных в париетальной коре. По-видимому, это может быть связано с уникальной организацией поясной коры (Коржевский и др., 2013; Григорьев и др., 2018).
Количество синаптических окончаний на телах пирамидных нейронов может отражать функциональное состояние коры больших полушарий. Снижение количества синаптических терминалей в области цингулярной коры отмечается при различных заболеваниях, оказывающих влияние на когнитивные функции, такие как болезнь Альцгеймера и шизофрения (Scheff, Price, 2001; Roberts et al., 2015). Существует предположение, что именно гибель синаптических окончаний может быть причиной когнитивных нарушений (Robinson et al., 2014). Увеличение количества тормозных контактов при нарушении функций интернейронов в целом наблюдается в пириформной коре при экспериментальном моделировании эпилептических припадков (Gavrilovici et al., 2012; Pollock et al., 2014). В норме плотность распределения синаптических терминалей на пирамидных нейронах в изучаемых областях коры различна, что, по-видимому, связано с различиями кортикальных цепей исследуемых областей.
Измерения округлости и соотношения сторон позволяют оценить форму синапсов. Округлость зависит от соотношения площади объекта к его периметру и показывает, насколько форма объекта приближается к форме математически совершенного круга. Соотношение сторон дает представление во сколько раз более длинная сторона объекта превосходит более короткую его сторону и, поэтому, может служить мерой вытянутости объекта. Таким образом, согласно проведенному анализу, аксосоматические синапсы, расположенные на пирамидных нейронах исследуемых областей коры, чаще имеют веретеновидную или овальную, а не округлую форму.
Проведенное исследование показало информативность методов конфокальной лазерной микроскопии при изучении синаптических структур головного мозга. Иммуногистохимическое окрашивание позволило выявить пресинаптические аксосоматические терминали интернейронов коры больших полушарий мозга. Анализ формы и размеров ГАМК-ергических терминалей в совокупности с изучением характера их распределения предоставляет ценную информацию о функционировании коры головного мозга. Полученные результаты будут способствовать выявлению ранних стадий развития заболеваний мозга, связанных с дисфункцией ГАМК-ергической системы.
Список литературы
Григорьев И.П., Алексеева О.С., Кирик О.В., Суфиева Д.А., Коржевский Д.Э. 2018. Распределение низкомолекулярных белков нейрофиламентов в поясной коре головного мозга крысы. Морфология. Т. 154. № 5. С. 7. (Grigoriyev I.P., Alekseyeva O.S., Kirik O.V., Sufiyeva D.A., Korzhevskiy D.E. 2018. Distribution of neurofilament light chain proteins in rat brain cingulate cortex. Morphology (Morphologiia). V. 154. № 5. P. 7.)
Зайцев А.В. 2013. Классификация и функции ГАМКергических интернейронов новой коры млекопитающих. Биологические мембраны. Т. 30. № 4. С. 253. (Zaitsev A.V. 2013. Classification and functions of GABAergic interneurons of the mammalian new cortex. Biochemistry (Moscow) Supplement. Series A: Membrane and Cell Biology. V. 7. № 4. P. 253.)
Кириченко Е.Ю., Логвинов А.К., Филиппова С.Ю. 2017. Щелевые контакты нейронов в корковых колонках и в вентральных ядрах таламуса крыс. Цитология Т. 59. № 10. С. 705. (Kirichenko E.Yu., Logvinov A.K., Filippova S.Yu. 2018. Neuronal gap junctions in functional cortical columns and ventral thalamic nuclei. Cell Tiss. Biol. (Tsitologiya). V. 12. P. 74.)
Козловский С.А., Величковский Б.Б., Вартанов А.В., Никонова Е.Ю., Величковский Б.М. 2012. Роль областей цингулярной коры в функционировании памяти человека. Экспериментальная психология. Т. 5. № 1. С. 12. (Kozlovsky S.A., Velichkovsky B.B., Vartanov A.V., Nikonova E.Yu., Velichkovsky B.M. 2012. The role of the domains of the anterior cingulate cortex in the functioning of human memory. Experimental Psychology. V. 5. № 1. P. 12.)
Коржевский Д.Э., Григорьев И.П., Новикова А.Д., Ковальчук В.А., Кирик О.В. 2013. Холинергические структуры поясной коры головного мозга крысы. Медицинский академический журнал. Т. 13. № 4. С. 49. (Korzhevskii D.E., Grigorev I.P., Novikova A.D., Kovalchuk V.A., Kirik O.V. 2013. Cholinergic structures of the cingulate cortex of the rat brain. Med. Acad. J. (Meditsinskiy Akademicheskiy Zhurnal). V. 13. № 4. P. 49.)
Свищев Г.М. 2011. Конфокальная микроскопия и ультрамикроскопия живой клетки. Москва: Физматлит. (Svishchev G.M. 2011. Confocal microscopy and ultramicroscopy of a living cell. Moscow: Fizmatlit.)
Феофанов А.В. 2007. Спектральная лазерная сканирующая конфокальная микроскопия в биологических исследованиях. Успехи биологической химии. Т. 47. С. 371. (Feofanov A.V. 2007. Spectral confocal laser scanning microscopy in biological research. Uspekhi Biologicheskoi Khimii. V. 47. P. 371.)
Штейн Г.И. 2007. Руководство по конфокальной микроскопии. СПб.: ИНЦ РАН. (Shtein G.I. 2007. Manual on confocal microscopy. St. Petersburg: Institute of Cytology RAS.)
Benes F.M., Todtenkopf M.S., Logiotatos P., Williams M. 2000. Glutamate decarboxylase65-immunoreactive terminals in cingulate and prefrontal cortices of schizophrenic and bipolar brain. J. Chem. Neuroanat. V. 20 P. 259. https://doi.org/10.1016/S0891-0618(00)00105-8
Etkin A., Egne T., Kalisch R. 2011. Emotional processing in anterior cingulate and medial prefrontal cortex. In Trends in Cognitive Sciences. V. 15. № 2. P. 85. https://doi.org/10.1016/j.tics.2010.11.004
Fabri M., Manzoni T. 1996. Glutamate decarboxylase immunoreactivity in corticocortical projecting neurons of rat somatic sensory cortex. Neuroscience. V. 72. P. 435. https://doi.org/10.1016/0306-4522(95)00568-4
Gavrilovici C., Pollock E., Everest M., Poulter M.O. 2012. The loss of interneuron functional diversity in the piriform cortex after induction of experimental epilepsy. Neurobiol. Dis. V. 48. P. 317. https://doi.org/10.1016/j.nbd.2012.07.002
Glausier J.R., Roberts R.C., Lewis D.A. 2017. Ultrastructural analysis of parvalbumin synapses in human dorsolateral prefrontal cortex. J. Comp. Neurol. V. 525. P. 1. https://doi.org/10.1002/cne.24171
Greif K.F., Erlander M.G., Tillakaratne N.J., Tobin A.J. 1991. Postnatal expression of glutamate decarboxylases in developing rat cerebellum. Neurochemical research. V. 16. P. 235. https://doi.org/10.1007/BF00966086
Holderith N., Lorincz A., Katona G., Rózsa B., Kuli, A., Watanabe M., Nusser Z. 2012. Release probability of hippocampal glutamatergic terminals scales with the size of the active zone. Nat. Neurosci. V. 15. P. 988. https://doi.org/10.1038/nn.3137
Hull C., Isaacson J.S., Scanziani M. 2009. Postsynaptic mechanisms govern the differential excitation of cortical neurons by thalamic inputs. J. Neurosci. V. 29. P. 9127. https://doi.org/10.1523/JNEUROSCI.5971-08.2009
Kepecs A., Fishell G. 2014. Interneuron cell types are fit to function. Nature. V. 505. P. 318. https://doi.org/10.1038/nature12983
Klingler E. 2017. Development and organization of the evolutionarily conserved three-layered olfactory cortex. eNeuro. V. 4. https://doi.org/10.1523/ENEURO.0193-16.2016
Kuljis D.A., Park E., Telmer C.A., Lee J., Ackerman D.S., Bruchez M.P., Barth A.L. 2019. Fluorescence-based quantitative synapse analysis for cell type-specific connectomics. ENeuro. V. 6. https://doi.org/10.1523/ENEURO.0193-19.2019
Lee S.H., Hjerling-Leffler J., Zagha E., Fishell G., Rudy B. 2010. The largest group of superficial neocortical GABAergic interneurons expresses ionotropic serotonin receptors. J. Neurosci. V. 30 P. 16796. https://doi.org/10.1523/JNEUROSCI.1869-10.2010
Lim L., Mi D., Llorca A., Marín O. 2018. Development and functional diversification of cortical interneurons. Neuron. V. 100. P. 294. https://doi.org/10.1016/j.neuron.2018.10.009
Luzzati F. 2015. A hypothesis for the evolution of the upper layers of the neocortex through co-option of the olfactory cortex developmental program. Front. Neurosci. V. 9. https://doi.org/10.3389/fnins.2015.00162
Markram H., Toledo-Rodriguez M., Wang Y., Gupta A., Silberberg G., Wu C. 2004. Interneurons of the neocortical inhibitory system. Nat. Rev. Neurosci. V. 5. P. 793. https://doi.org/10.1038/nrn1519
Peters A., Sethares C., Harriman K.M. 1990. Different kinds of axon terminals forming symmetric synapses with the cell bodies and initial axon segments of layer II/III pyramidal cells. II. Synaptic junctions. J. Neurocytol. V. 19. P. 584. https://doi.org/10.1007/BF01257246
Pollock E., Everest M., Brown A., Poulter M.O. 2014. Metalloproteinase inhibition prevents inhibitory synapse reorganization and seizure genesis. Neurobiol. Dis. V. 70. P. 21. https://doi.org/10.1016/j.nbd.2014.06.003
Prévot T., Sibille E. 2020. Altered GABA-mediated information processing and cognitive dysfunctions in depression and other brain disorders. Mol. Psychiatry. https://doi.org/10.1038/s41380-020-0727-3
Roberts R.C., Barksdale K.A., Roche J.K., Lahti A.C. 2015. Decreased synaptic and mitochondrial density in the postmortem anterior cingulate cortex in schizophrenia. Schizophrenia Research. V. 168. P. 543. https://doi.org/10.1016/j.schres.2015.07.016
Robinson J.L., Molina-Porcel L., Corrada M.M., Raible K., Lee E.B., Lee V.M.Y., Kawas C.H., Trojanowski J.Q. 2014. Perforant path synaptic loss correlates with cognitive impairment and Alzheimer’s disease in the oldest-old. Brain. V.137. P. 2578. https://doi.org/10.1093/brain/awu190
Rudy B., Fishell G., Lee S.H., Hjerling-Leffler J. 2011. Three groups of interneurons account for nearly 100% of neocortical GABAergic neurons. Dev. Neurobiol. V. 71. P. 45. https://doi.org/10.1002/dneu.20853
Scheff S.W., Price D.A. 2001. Alzheimer’s disease-related synapse loss in the cingulate cortex. J. Alzheimer’s Dis. V. 3. P. 495. https://doi.org/10.3233/JAD-2001-3509
Südhof T.C. 2017. Synaptic neurexin complexes: A molecular code for the logic of neural circuits. Cell. V. 171. P. 745. https://doi.org/10.1016/j.cell.2017.10.024
Suzuki N., Bekkers J.M. 2010. Inhibitory neurons in the anterior piriform cortex of the mouse: Classification using molecular markers. J. Comp. Neurol. V. 518. P. 1670. https://doi.org/10.1002/cne.22295
von Krosigk M., Smith Y., Bolam, J.P., Smith A.D. 1992. Synaptic organization of gabaergic inputs from the striatum and the globus pallidus onto neurons in the substantia nigra and retrorubral field which project to the medullary reticular formation. Neuroscience. V. 50. P. 531. https://doi.org/10.1016/0306-4522(92)90445-8
Young J.C., Vaughan D.N., Nasser H.M., Jackson G.D. 2019. Anatomical imaging of the piriform cortex in epilepsy. Exp. Neurol. V. 320. https://doi.org/10.1016/j.expneurol.2019.113013
Young J.C., Vaughan D.N., Paolini A.G., Jackson G.D. 2018. Electrical stimulation of the piriform cortex for the treatment of epilepsy: A review of the supporting evidence. Epilepsy and Behavior. V. 88. P. 152. https://doi.org/10.1016/j.yebeh.2018.09.004
Zhang Q., Lee W.C.A., Paul D.L., Ginty D.D. 2019. Multiplexed peroxidase-based electron microscopy labeling enables simultaneous visualization of multiple cell types. Nat. Neurosci. V. 22. P. 828. https://doi.org/10.1038/s41593-019-0358-7
Дополнительные материалы отсутствуют.


