Цитология, 2020, T. 62, № 12, стр. 903-912
Оценка биосовместимости поликапролактоновых скаффолдов, обеспечивающих адресную доставку щелочной фосфатазы
А. Н. Иванов 1, *, Ю. А. Чибрикова 1, М. С. Савельева 1, А. С. Рогожина 1, И. А. Норкин 1
1 Научно-исследовательский институт травматологии, ортопедии и нейрохирургии Саратовского государственного медицинского университета им. В.И. Разумовского
410002 Саратов, Россия
* E-mail: lex558452@gmail.com
Поступила в редакцию 29.07.2020
После доработки 09.09.2020
Принята к публикации 11.09.2020
Аннотация
Ген щелочной фосфатазы начинает экспрессироваться на самых ранних этапах остеогенеза, что обусловливает перспективы адресной доставки данного фермента для стимуляции репаративных процессов костной ткани с помощью скаффолдов. Целью исследования являлась оценка биосовместимости поликапролактоновых скаффолдов, минерализованных ватеритом, обеспечивающих адресную доставку щелочной фосфатазы в условиях субкутанных имплантационных тестов на белых крысах. Установлено, что скаффолды из поликапролактона и ватерита, содержащие щелочную фосфатазу, не вызывают выраженного воспалительного ответа, активно васкуляризуются и заселяются элементами соединительной ткани, что обуславливает перспективы их апробации для стимуляции регенерации костной ткани.
Создание скаффолдов, или матриц, выступающих в роли биомиметических каркасов, открывает новые перспективы в тканевой инженерии. Однако матрицы, применяемые для восполнения дефектов костей, отличаются от таковых для мягких тканей. Высокая степень биосовместимости, регенераторный потенциал и оптимальные биомеханические свойства – ключевые таргетные параметры разрабатываемых трехмерных скаффолдов. Для соответствия данным параметрам, матрицы должны обладать механической прочностью и длительным периодом биодеградации, стимулировать пролиферацию остеогенных клеток, не вызывая цитотоксических эффектов (Садовой и др., 2014). Прочность скаффолда входит в число обязательных требований в связи с необходимостью поддержания высоких механических нагрузок, свойственных костной ткани. Длительный период биодеградации необходим для остеокондукции на всем протяжении остеогенеза, включая миграцию, пролиферацию, дифференцировку остеобластов, синтез ими межклеточного вещества и его минерализацию, а также в период ремоделирования костной ткани.
Основная концепция современных скаффолдов заключается в использовании комбинированных материалов природного и синтетического происхождения. Простота изготовления синтетических скаффолдов, их высокая универсальность, а также возможность регуляции механических параметров определяют перспективы и целесообразность их применения (James et al., 2011). Среди синтетических полимеров наиболее изученным и часто используемым является поликапролактон (ПКЛ), представляющий собой полиэфир, мономером которого является ε-капролактон. Данный материал обладает высоким значением предела прочности на разрыв и модуля упругости, отличается стабильностью в окружающей среде, биосовместимостью, доказанной в условиях как in vitro, так и in vivo, контролируемой протеолитической биоразлагаемостью, скорость которой может достигать 24 мес (Cheung et al., 2007; Sabir et al., 2009). Все вышеуказанные свойства ПКЛ обеспечивают оптимальные остеокондуктивные свойства изготовленных из него скаффолдов.
Остеоиндуктивные свойства скаффолдов играют ключевую роль в процессе регенерации костной ткани, поскольку непосредственно связаны со стимуляцией активности остеогенного дифферона клеток. Для оптимизации остеоиндуктивных и остеокондуктивных свойств скаффолда в их состав включают неорганические соединения, например, фосфатные и карбонатные соли кальция, в частности гидроксиапатит, кальцит и ватерит (Schröder et al., 2018). Наиболее часто с этой целью используется гидроксиапатит. Однако карбонатные соли кальция обладают меньшей стабильностью и большей биологической активностью. Среди них наибольший интерес представляет ватерит (ВТ), который является одной из трех полиморфных модификаций CaCO3. В качестве компонента матриц он обладает рядом преимуществ: имеет легкие и доступные условия синтеза и разложения, является прямым источником кальция, который непосредственно необходим при остеогенезе, и обладает пористой поверхностью, способной адсорбировать различные вещества и при имплантации адресно доставлять их в зону дефекта (Saveleva et al., 2018).
С целью создания скаффолдов с новыми свойствами для улучшенного процесса регенeрации кoстной ткани, ПКЛ-матрицы модифицируют различными функциональными соединениями. Для этого применяются разные группы биологически активных веществ, например, факторы роста. Однако в настоящее время недостаточно изучен вопрос безопасности применения ростовых факторов в связи с их потенциальной способностью стимулировать процессы онкогенеза. Поэтому перспективным направлением является поиск альтернативных стимуляторов остеогенеза. В связи с этим в рамках данного исследования в качестве биологически активного вещества адресно доставляемого минерализованным ВТ ПКЛ-скаффолдом была использована щелочная фосфатаза (ЩФ). ЩФ способна модулировать функции различных клеток, взаимодействуя с их рецепторами, протеазами, гормонами и другими биомолекулами, включая протеогликаны и коллагены. В условиях in vitro продемонстрировано, что введение ЩФ в состав скаффолдов из натуральных полимеров (коллаген, фибрин) индуцирует остеогенную дифференцировку мезенхимальных стволовых клеток, стимулирует пролиферацию остеобластов и минерализацию (Osathanon et al., 2009; Jafary et al., 2017). Следовательно, добавление данного белка в исследуемые матрицы способствует локальному изменению ферментативного гомеостаза, и, соответственно, открывает новые перспективы стимуляции остеогенеза и оптимизации интенсивности репаративных процессов (Sroga, Vashishth, 2005).
Обязательным требованием для имплантации матриц в организм является биосовместимость. Адсорбция белка на волокнах матрицы может вызывать воспалительную реакцию организма, как было показано ранее (Норкин и др., 2018). Учитывая, что ЩФ – фермент, необходима тщательная проверка бисовместимости скаффолдов, в том числе при подкожных имплантационных тестах. Это связано с тем, что подкожная жировая клетчатка богато васкуляризована, что способствует быстрому развитию воспалительных изменений. В этой связи целью данного исследования являлась оценка биосовместимости ПКЛ-скаффолдов, минерализованных ВТ, обеспечивающих адресную доставку ЩФ, в условиях субкутанных имплантационных тестах на белых крысах.
МАТЕРИАЛ И МЕТОДИКА
Эксперимент проведен на 90 белых крысах-самцах. Животные были поделены на следующие экспериментальные группы: 1) группа контроля (интактные животные); 2) группа отрицательного контроля (животные, которым имплантировали скаффолды с овальбумином, не обладающие биосовместимостью); 3) группа сравнения (животные, которым имплантировали скаффолды из ПКЛ, минерализованные ватеритом); 4) экспериментальная группа (крысы, которым имплантировали скаффолды из ПКЛ и ВТ с добавлением ЩФ).
Изготовление скаффолдов проводилось методом электроформования, методология минерализации и адсорбции веществ описана в ранее опубликованной работе (Saveleva et al., 2018).
В качестве отрицательного контроля были использованы скаффолды с овальбумином, которые не обладают биосовместимостью и вызывают выраженную воспалительную реакцию при подкожной имплантации белым крысам (Иванов и др., 2016a).
До проведения вмешательства животных наркотизировали путем внутримышечного введения комбинации Телазола и Ксиланита в дозировках 0.1 мл/кг и 1 мг/кг соответственно.
На 7-е или 21-е сут эксперимента под общей анестезией у животных забирали кровь в объеме 5 мл пункцией правых отделов сердца. Сыворотку крови получали с помощью центрифугирования 3000 об./мин. Аликвoты сыворотки крови замораживали и хранили при температуре –20°С.
Для изучения проявлений системной воспалительной реакции проводили определение концентрации фактора некроза опухоли альфа (ФНО), интерлейкина-1-бета (ИЛ-1) в сыворотке крови животных с использованием наборов реактивов “IL-1β rat”, “TNF-α rat” и спектрофотометра Anthos 2020 (Biochrom, Великобритания).
Для выявления воспалительного фенотипа эндотелиальных клеток исследовали концентрации фактора роста эндотелия сосудов (VEGF) и фрагментов гликокаликса эндотелиальных клеток – растворимых форм Синдекана-1 в сыворотке крови методом ИФА на ридере Anthos 2020 (Biochrom, Великобритания) с использованием реактивов Rat VEGF Immunoassay и “ELISA Kit For Syndecan 1 Rat”.
На 21-е сут животные были выведены из эксперимента путем передозировки препаратов для наркоза, и был забран материал для морфологического исследования. С этой целью скаффолд и окружающие его ткани удаляли единым блоком, после чего фиксировали формалином, обезвоживали в спиртах и заливали в парафин. Срезы толщиной 4–6 мкм окрашивали гематоксилином Майера и эозином. Препараты исследовали при помощи микроскопа AxioImager Z2 (CarlZeiss, Германия) и микровизора проходящего света серии μVizo-103 (ЛОМО ФОТОНИКА, Россия). На гистологических препаратах выявляли локальные признаки воспалительной реакции: отек, гиперемия, инфильтрация скаффолда и окружающих его тканей иммунокомпетентными клетками. Проводили морфометрический подсчет количества клеток каждой клеточной популяции: фибробластов, фиброцитов, полиморфноядерных лейкоцитов, лимфоцитов и макрофагов в пяти полях зрения скаффолда и его перифокальной зоны при увеличении объектива 63×.
Использованные реактивы: Телазол (Zoetis Inc, США); Ксиланит (Interchemie, Нидерланды); гематоксилин Майера, 1%-ный водный раствор эозина, среды Bio-Monht и Bio-Clear, этиловый спирт, хлороформ, 10%-ный раствор нейтрального формалина (Биовитрум, Россия), наборы реагентов “IL-1β rat”, “TNF-α rat” (eBioscience, Invitrogen by Thermo Fisher Scientific, США), Rat VEGF Immunoassay (R&D Systems, США), ELISA Kit For Syndecan 1 Rat (Cloud-Clone Corp., КНР).
РЕЗУЛЬТАТЫ
Оценка системного воспалительного ответа. В результате проведенных исследований у животных, которым имплантировали матрицы с адсорбированным овальбумином, к 7-м и 21-м сут эксперимента обнаружено статистически значимое повышение концентрации ФНО и ИЛ-1 по сравнению с аналогичными показателями в контрольной группе крыс (рис. 1а, б). У животных группы сравнения после имплантации скаффолдов из ПКЛ и ВТ концентрация ФНО и ИЛ-1 не отличалась от контрольных значений как на 7-е, так и на 21-е сут. (рис. 1а, б). У животных экспериментальной группы концентрация цитокинов на 7-е и 21-е сут. также не отличалась от контрольных значений и была значимо ниже, чем в группе крыс, которым имплантировали скаффолды с овальбумином (рис. 1а, б).
Рис. 1.
Изменение концентрации фактора некроза опухоли (ФНО) (а) и интерлейкина-1 (ИЛ-1) (б) в сыворотке крови крыс после имплантации скаффолдов. Контроль – интактные животные, отрицательный контроль – имплантация скаффолдов с овальбумином, группа сравнения – имплантация ПКЛ-скаффолдов с ВТ, экспериментальная группа – имплантация ПКЛ-скаффолдов с ВТ и ЩФ. Числа над столбиками – медиана, нижний и верхний квартиль.
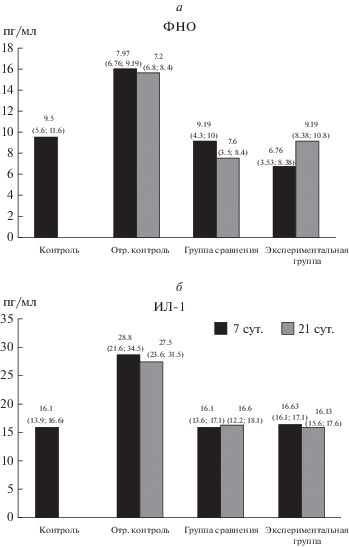
Таким образом, у животных из группы отрицательного контроля при имплантации скаффолдов, содержащих овальбумин, наблюдается системный воспалительный ответ, проявляющийся увеличением уровня провоспалительных цитокинов в сыворотке крови. Адсорбция на скаффолдах ЩФ, в отличие от овальбумина не приводит к увеличению концентрации провоспалительных цитокинов в системном кровотоке при субкутанных имплантационных тестах у белых крыс, что свидетельствует в пользу биосовместимости матриц данного типа.
Оценка воспалительной активации эндотелиальных клеток. У крыс в группе отрицательного контроля на 7-е и 21-е сут после имплантации бионесовместимых матриц отмечалось увеличение концентрации VEGF в сыворотке крови в 3.7 и 4.7 раза соответственно (рис. 2а). Кроме того, у крыс данной группы выявлено статистически значимое повышение концентрации синдекана-1 на 7-е и 21-е сут. эксперимента по сравнению с интактными животными (рис. 2б). В группе сравнения к 7-м сут. после имплантации матриц из ПКЛ и ВТ концентрация VEGF в крови возрастала более выражено, превышая в 5.8 раза значения у интактных животных и в 1.6 раза – у крыс из группы отрицательного контроля. К 21-м сут эксперимента у животных экспериментальной группы концентрация VEGF в сыворотке крови уменьшалась до значений, не имеющих статистических отличий от контрольной группы (рис. 2а). При этом у крыс этой группы концентрация синдекана-1 в сыворотке крови значимо не менялась, в отличие от крыс группы отрицательного контроля, что свидетельствует об отсутствии признаков повреждения эндотелиального гликокаликса (рис. 2б). У животных экспериментальной группы уровень VEGF на 7-е сут эксперимента превышал контрольные значения, но был в 1.6 раз ниже, чем в группе сравнения (рис. 2а). При этом концентрация синдекана-1 повышалась в 1.6 раз к 7-м сут и нормализовалась к 21-м сут после имплантации (рис. 2б).
Рис. 2.
Изменение концентрации фактора роста эндотелия сосудов (а) и синдекана-1 (б) в сыворотке крови крыс после имплантации скаффолдов. Контроль – интактные животные, отрицательный контроль – имплантация скаффолдов с овальбумином, группа сравнения – имплантация ПКЛ-скаффолдов с ВТ, экспериментальная группа – имплантация ПКЛ-скаффолдов с ВТ и ЩФ. Числа над столбиками – медиана, нижний и верхний квартиль.
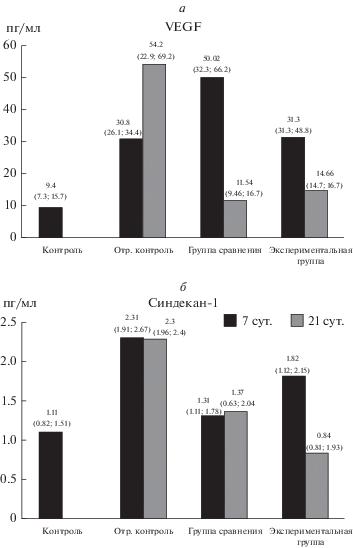
Таким образом, при имплантации скаффолдов с овальбумином отмечается продолжительная индукция ангиогенеза с сопутствующим формированием воспалительного фенотипа эндотелиальных клеток. У крыс группы сравнения признаков воспалительной активации эндотелиоцитов не отмечается, а концентрация VEGF в крови нормализуется к 21-м сут эксперимента, свидетельствуя о завершении активной фазы ангиогенеза. При имплантации скаффолдов с ЩФ паттерн изменения концентрации VEGF аналогичен таковому у крыс группы сравнения. При этом отмечается слабо выраженная транзиторная воспалительная активация эндотелиоцитов на ранних сроках после имплантации скаффолдов с ЩФ, полностью нивелирующаяся к 21-м сут эксперимента.
Морфологическая верификация биосовместимости скаффолдов. При исследовании тканей зоны имплантации скаффолдов у животных группы отрицательного контроля к 21-сут после имплантации вокруг скаффолда обнаруживался соединительнотканный барьер инфильтрированный лейкоцитами, а также отек тканей перифокальной области (рис. 3а). В составе лейкоцитарной инфильтрации перифокальной области скаффолдов преобладающими клеточными типами являлись лимфоциты и макрофаги, количество которых в среднем составляло 13 и 11%. Также в перифокальной области отмечалось наличие единичных нейтрофильных лейкоцитов (табл. 1). Наблюдалось слабое заселение матрицы элементами фибробластического ряда, отсутствовали признаки ее васкуляризации (рис. 3б). Преобладающей клеточной популяцией в структуре скаффолда являлись полиморфноядерные лейкоциты, преимущественно нейтрофилы, которые составляли 48% от общего числа клеток. Обнаруживались лимфоциты и макрофаги, число которых в среднем достигало 11 и 15% (табл. 2).
Рис. 3.
Гистологические препараты тканей зоны имплантации скаффолдов (обозначены белой стрелкой) на 21-е сут. эксперимента в группе отрицательного контроля (а, б), в группе сравнения (в, г) и в экспериментальной группе (д, е). Увел. об.: а, в, д – 5×, б, г, е – 63×.
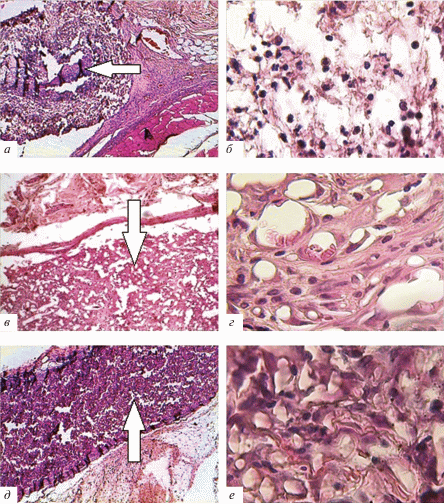
Таблица 1.
Клеточные популяции перифокальной зоны скаффолдов
| Клетки | Скаффолды с овальбумином (отрицательный контроль) (n = 10) | ПКЛ-скаффолды с ВТ (n = 10) |
ПКЛ-скаффолды с ВТ и ЩФ (n = 10) |
|---|---|---|---|
| Фибробласты | 30 (15;34) | 13 (10;15) p1 = 0.001985 |
15 (11;20) р1 = 0.005727 р2 = 0.138778 |
| Фиброциты | 9 (6;13) | 11 (7;16) р1 = 0.270130 |
13 (8;21) р1 = 0.065472 р2 = 0.398603 |
| Полиморфноядерные лейкоциты | 3 (2;5) | 0 (0;0) р1 = 0.000018 |
0 (0;0) р1 = 0.000025 р2 = 0.310486 |
| Лимфоциты | 7 (3;11) | 0 (0;1) р1 = 0.000025 |
0 (0;1) р1 = 0.000001 р2 = 0.939743 |
| Макрофаги | 6 (4;7) | 1 (1;2) р1 = 0.000790 |
1 (0;2) р1 = 0.000001 р2 = 0.668390 |
Таблица 2.
Клеточные популяции скаффолдов
| Скаффолды с овальбумином (отрицательный контроль) (n = 10) | ПКЛ-скаффолды с ВТ (n = 10) |
ПКЛ-скаффолды с ВТ и ЩФ (n = 10) |
|
|---|---|---|---|
| Фибробласты | 5 (1;12) | 38 (21;47) р1 = 0.000002 |
26 (20;35) р1 = 0.000001 р2 = 0.029082 |
| Фиброциты | 2 (0;6) | 22 (13;32) р1 = 0.000002 |
17 (13;19) р1 = 0.000001 р2 = 0.002185 |
| Полиморфноядерные лейкоциты | 13 (5;16) | 0 (0;1) р1 = 0.000005 |
0 (0;2) р1 = 0.000035 р2 = 0.573535 |
| Лимфоциты | 3 (2;3) | 2 (0;4) р1 = 0.625375 |
0 (0;2) р1 = 0.003900 р2 = 0.003100 |
| Макрофаги | 4 (2;6) | 2 (0;4) р1 = 0.037999 |
1 (0;1) р1 = 0.000032 р2 = 0.011144 |
Таким образом, абсорбция овальбумина на ПКЛ-скаффолдах существенно снижает их биосовместимость, что морфологически проявляется формированием ограничивающего их соединительнотканного барьера и нейтрофильной инфильтрацией. Отсутствие васкуляризации и минимальное заселение скаффолда клетками фибробластического ряда свидетельствуют о его низком ангиогенном и регенераторном потенциале.
У животных группы сравнения на 21-е сут эксперимента в перифокальной области не отмечалось признаков отграничения ПКЛ-скаффолда с ВТ соединительной тканью, а также отеков и лейкоцитарной инфильтрации (рис. 3в). Преобладающими клетками перифокальной области являлись фибробластические элементы. К 21-м суткам эксперимента ПКЛ-скаффолд, минерализованный ВТ, был хорошо васкуляризован, в отличие от бионесовместимых матриц (рис. 3в, г) Число фибробластов и фиброцитов в скаффолде, минерализованным ВТ, в 2.5 раза превышало таковое в матрицах с адсорбированным чужеродным белком, доля этих клеточных элементов составила 34 и 60% от общего числа клеток соответственно (табл. 2). Количество лейкоцитов в структуре ПКЛ-матриц с ВТ было в 2 раза ниже, чем в матрицах, содержащих овальбумин.
Таким образом, признаков отсутствия биосовместимости при имплантации скаффолдов с ВТ не отмечается – матрица заселяется клетками соединительной ткани, хорошо васкуляризуется на фоне отсутствия воспалительных изменений.
В перифокальной зоне скаффолдов с ЩФ преобладали клетки фибробластического ряда, встречались единичные макрофаги и гигантские многоядерные клетки (рис. 3д). Число лейкоцитов, макрофагов и полиморфноядерных лейкоцитов в перифокальной области скаффолда с ЩФ не имело статистически значимых различий с клеточным составом тканей зоны имплантации у крыс группы сравнения, при этом было значимо ниже, чем в группе отрицательного контроля (табл. 1).
Скаффолды с ЩФ заселялись фибробластическими элементами и васкуляризовались (рис. 3е). При морфометрическом анализе установлено, что фибробласты и фиброциты в матрице составляют 54% от общего количества клеток. При этом фиброцитов обнаружено 34% (табл. 2). Количество фибробластов и фиброцитов в скаффолдах с ЩФ было меньше, чем в матрицах у крыс группы сравнения, но значительно превышало таковое в скаффолдах с овальбумином (табл. 2). Признаков лейкоцитарной инфильтрации скаффолдов с ЩФ в отличие от матриц с овальбумином не обнаружено.
Таким образом, морфологическая картина, наблюдаемая при субкутанных имплантационных тестах скаффолдов, содержащих ЩФ, не имеет значимых отличий от таковой при имплантации скаффолдов, не содержащих фермента. Следовательно, адресная доставка ЩФ не оказывает негативного влияния на биосовместимость скаффолдов из ПКЛ и ВТ.
ОБСУЖДЕНИЕ
Результаты изучения комплекса биохимических и морфологических изменений, возникающих при имплантации скаффолдов с адсорбированным овальбумином, позволяют выделить ряд локальных и системных проявлений воспаления. Локальные проявления включают комплекс сосудистых и тканевых реакций. Тканевые реакции при имплантации скаффолдов с овальбумином характеризуются лейкоцитарной инфильтрацией как самого скаффолда, так и его перифокальной зоны. При этом вокруг скаффолда формируется отграничивающий соединительнотканный барьер, а заселение скаффолда фибробластами не отмечается. Выраженная лейкоцитарная инфильтрация сопровождается гиперпродукцией цитокинов, повышенная концентрация которых в кровотоке отражает системный характер воспалительного ответа на имплантацию данного типа матриц. Сосудистые реакции при имплантации скаффолдов с овальбумином проявляются функциональной и структурной перестройкой сосудистого русла. Функциональные изменения проявляются гиперемией сосудов зоны имплантации, а структурное ремоделирование характеризуется длительной активацией ангиогенеза. Согласно данным литературы, воспалительные цитокины и, в частности, ФНО и ИЛ-1, оказывают стимулирующее действие на ангиогенез, что объясняет пролонгированное повышение VEGF в крови у животных группы отрицательного контроля (Щаницын и др., 2019). Полученные результаты свидетельствуют, что выраженная длительная гиперпродукция VEGF не приводит к васкуляризации скаффолда с овальбумином, а в совокупности с действием цитокинов и других факторов, выделяемых лейкоцитами, включая матриксные металлопротеиназы, вызывает формирование воспалительного фенотипа эндотелиальных клеток. Формирование воспалительного фенотипа, сопровождающееся деградацией гликокаликса, снижает барьерные свойства сосудистой стенки и повышает ее проницаемость (Иванов и др., 2016б), способствуя лейкоцитарной инфильтрации и формированию отеков. Выраженная лейкоцитарная инфильтрация, отсутствие эффективной васкуляризации и, следовательно, трофической поддержки значительно ограничивают регенераторный потенциал скаффолдов с овальбумином, что морфологически проявляется ограничением его колонизации фибробластическими элементами.
В ходе исследования установлено, что отсутствие признаков воспалительной реакции, активная колонизация фибробластами, хорошая васкуляризация имплантированных ПКЛ-матриц с ВТ свидетельствует о наличии биосовместимости и высоком регенераторном потенциале, что согласуется с ранее полученными результатами (Иванов и др., 2018). При этом ангиогенные реакции имеют паттерн, значительно отличающийся от такового для небиосовместимых матриц и характеризующийся выраженной, но кратковременной активацией продукции VEGF в ранние сроки после имплантации, на фоне отсутствия признаков повреждения эндотелиального гликокаликса. Снижение уровня VEGF, вероятно, обусловлено васкуляризацией матрицы и ингибированием продукции данного фактора по принципу отрицательной обратной связи. Анализируя совокупность вышеизложенных биохимических и морфологических данных, следует отметить, что высокая интенсивность заселения скаффолдов клетками ассоциирована с васкуляризацией матриц, а также быстрой редукцией локальных и системных проявлений после имплантации. Следовательно, регенераторный потенциал скаффолдов напрямую зависит от ангиогенного потенциала и биосовместимости.
Несмотря на то, что ЩФ является белком, ее присутствие в скаффолдах, в отличие от овальбумина, не оказывает влияния на биосовместимость – локальных и системных признаков воспаления при имплантации скаффолдов не выявлено. Кроме того, ранее было продемонстрировано, что при имплантации белым крысам ПКЛ/ВТ-скаффолдов, содержащих и не содержащих ЩФ, изменения активности фермента в сыворотке крови статистической значимости не достигают, отражая преимущественно локальный характер его высвобождения (Иванов и др., 2019). Ангиогенные реакции, наблюдаемые при имплантации скаффолдов с ЩФ, имеют тот же характер, что и в группе сравнения, отличаясь лишь незначительным транзиторным повышением концентрации синдекана-1 и меньшей пиковой концентрацией VEGF на ранних сроках имплантации, которые не препятствуют васкуляризации матриц. У крыс экспериментальной группы, также как и в группе сравнения, к 21-м сут эксперимента отмечается завершение ангиогенных реакций и стабилизация сосудистого русла матрицы. Различия биосовместимости и регенераторного потенциала скаффолдов с овальбумином и ЩФ, вероятно, обусловлены слабой видовой и тканевой специфичностью фермента (Mota et al., 2008). В частности, согласно данным литературы, ЩФ продуцируют фибробласты (Abe et al., 2001). Меньшее количество фибробластов в скаффолдах с ЩФ по сравнению со скаффолдами из ПКЛ и ВТ без фермента, вероятнее всего, обусловлено ингибированием пролиферации по принципу отрицательной обратной связи – ввиду достаточной концентрации фермента, поступившего извне, происходит снижение пролиферативной активности фибробластов. Так, согласно некоторым данным, продукция ЩФ фибробластами снижает их миграционную и пролиферативную активность (Santos et al., 2010). Ингибирующее влияние ЩФ на активность фибробластических клеток создает предпосылки для использования этого фермента в качестве фактора, регулирующего колонизацию скаффолдов клеточными элементами.
Таким образом, результаты проведенных субкутанных имплантационных тестов позволяют заключить, что наличие в скаффолдах ЩФ, в отличие от овальбумина, не нарушает их биосовместимости. ПКЛ-скаффолды с ВТ и ЩФ способны к васкуляризации и заселению клетками, что обусловливает возможность их применения для стимуляции регенерации костной ткани.
Список литературы
Иванов А.Н., Козадаев М.Н., Белова С.В., Блинникова В.В., Мамонова И.А., Пучиньян Д.М., Федонников А.С., Норкин И.А. 2016a. Сравнительный анализ перфузии и динамики маркеров острой фазы воспалительной реакции при имплантации матриц на основе поликапролактона и гидроксиапатита. Современные проблемы науки и образования. Т. 4. С. 15. (Ivanov A.N., Kozadaev M.N., Belova S.V., Blinnikova V.V., Mamonova I.А., Puchinyan D.M., Fedonnikov А.С., Norkin I.A. 2016a. Comparative analysis of perfusion and dynamics of acute-phase markers of inflammatory response after polycaprolactone hydroxyapatite matrix implantation. Modern Problems of Science and Education. V. 4. Р. 15.)
Иванов А.Н., Куртукова М.О., Козадаев М.Н., Суровцева К.А., Савельева М.С., Бугаева И.О., Парахонский Б.В., Блинникова В.В., Гладкова Е.В., Бабушкина И.В., Чибрикова Ю.А., Норкин И.А. 2019. Влияние на регенерацию костной ткани локальных изменений ионного и ферментативного гомеостаза скаффолдами из поликапролакона минерализованными ватеритом. Патологическая физиология и экспериментальная терапия. Т. 63. № 3. С. 81. (Ivanov A.N., Kurtukova M.O., Kozadaev M.N., Surovtseva K.A., Saveleva M.S., Bugaeva I.O., Parakhonskiy B.V., Blinnikova V.V., Gladkova E.V., Babushkina I.V., Chibrikova U.A., Norkin I.A. 2019. The effect of local changes in ionic and enzymatic homeostasis induced by polycaprolactone scaffolds mineralized with vaterite on bone tissue regeneration. Pathological Physiology and Experimental Therapy. V. 63. No 3. С. 81.)
Иванов А.Н., Куртукова М.О., Козадаев М.Н., Тяпкина Д.А., Кустодов С.В., Савельева М.С., Бугаева И.О., Парахонский Б.В., Галашина Е.А., Гладкова Е.В., Норкин И.А. 2018. Оценка биосовместимости поликапролактоновых матриц, минерализованных ватеритом, при субкутанных имплантационных тестах у белых крыс. Саратовский научно-медицинский журнал. Т. 14. № 3. С. 451. (Ivanov A.N., Kurtukova M.O., Kozadaev M.N., Tyapkina D.A., Kustodov S.V., Savelyeva M.S., Bugaeva I.O., Parakhonsky B.V., Galashina E.A., Gladkova E.V., Norkin I.A. 2018. Assessment of biocompatibility of polycaprolactone matrices mineralized by vaterite in subcutaneous implantation tests in white rats. Saratov Journal of Medical Scientific Research. V. 14. № 3. Р. 451.)
Иванов А.Н., Пучиньян Д.М., Норкин И.А. 2016b. Роль эндотелиальных клеток в ангиогенезе. Успехи современной биологии. Т. 136. № 5. С. 491. (Ivanov A.N., Puchinyan D.M., Norkin I.A. 2016b. The role of endothelial cells in angiogenesis. Successes of Modern Biology. V. 136. № 5. Р. 491.)
Норкин И.А., Иванов А.Н., Куртукова М.О., Савельева М.С., Мартюкова А.В., Горин Д.А., Парахонский Б.В. 2018. Особенности микроциркуляторных реакций при субкутанной имплантации поликапролактоновых матриц, минерализованных ватеритом. Саратовский научно-медицинский журн. Т. 14. № 1. С. 35. (Norkin I.A., Ivanov A.N., Kurtukova M.O., Savelyeva M.S., Martyukova A.V., Gorin D.A., Parakhonsky B.V. 2018. Features of microcirculatory reactions during subcutaneous implantation of polycaprolactone matrices mineralized with vaterite. Saratov Journal of Medical Scientific Research. V. 14. № 1. P. 35.)
Садовой М.А., Ларионов П.М., Самохин А.Г., Рожнова О.М. 2014. Клеточные матрицы (скаффолды) для целей регенерации кости: современное состояние проблемы. Хирургия позвоночника. Т. 2. С. 79. (Sadovoy M.A., Larionov P.M., Samokhin A.G., Rozhnova O.M. 2014. Cellular matrices (scaffolds) for bone regeneration: the current state of the problem. Spinal Surgery. V. 2. P. 79.)
Щаницын И.Н., Иванов А.Н., Ульянов В.Ю., Норкин И.А. 2019. Современные концепции стимуляции регенерации костной ткани с использованием биологически активных скаффолдов. Цитология. Т. 61. № 1. С. 16. (Shchanitsyn I.N., Ivanov A.N., Ulyanov V.Yu., Norkin I.A. 2019. Modern concepts of stimulating bone tissue regeneration using biologically active scaffolds. Tsitologiya. V. 61. No 1. P. 16)
Abe T., Abe Y., Aida Y., Hara Y., Maeda K. 2001. Extracellular matrix regulates induction of alkaline phosphatase expression by ascorbic acid in human fibroblasts. J. Cell. Physiol. V. 189. P. 144.
Cheung H.Y., Lau K.T., Lu T.-P., Hui D. 2007. A critical review on polymer-based bio-engineered materials for scaffold development. Composites. Part B: Engineering. V. 38. P. 291.
Jafary F., Hanachi P., Gorjipour K. 2017. Osteoblast differentiation on collagen sScaffold with immobilized alkaline phosphatase. Int. J. Organ Transplant. Med. V. 8. P. 195.
James R., Meng D., Laurencin C.T., Kumbar S.G. 2011. Nanocomposites and bone regeneration. Front. Mater. Sci. V. 5. P. 342.
Mota A., Silva P., Neves D., Lemos C., Calhau C., Torres D., Martel F., Fraga H., Ribeiro L., Alçada M.N.M.P., Pinho M.J., Negrão M.R., Pedrosa R., Guerreiro S., Guimarães J.T. et al. 2008. Characterization of rat heart alkaline phosphatase isoenzymes and modulation of activity. The Brazilian Journal of Medical and Biological Research. V. 41. P. 600.
Osathanon T., Giachelli C.M., Somerman M.J. 2009. Immobilization of alkaline phosphatase on microporous nanofibrous fibrin scaffolds for bone tissue engineering. Biomaterials. V. 30. P. 4513.
Sabir M.I., Xu X., Li L. 2009. A review on biodegradable polymeric materials for bone tissue engineering applications. J. Mater. Sci. V. 44. P. 5713.
Santos V.R., Gomes R.T., Resendec M., Almeidad O.P., Colletad R.D. 2010. Isolation and characterization of gingival fibroblasts positive for alkaline phosphatase in patients with chronic periodontitis and drug-induced gingival hyperplasia. Rev. odonto ciênc. V. 25. P. 54.
Saveleva M.S., Atkin V.S., Lyubun G.P., Gorin D.A., Skirtach A.G., Parakhonskiy B.V., Ivanov A.N., Fedonnikov A.S., Norkin I.A., Kurtukova M.O., Martyukova A.V., Cherevko E.I., Sargsyan A.K., Ivanova A.G. 2018. Hybrid PCL/CACO3 scaffolds with capabilities of carrying biologically active molecules: synthesis, loading and in vivo applications. Materials Science and Engineering. V. 85. P. 57.
Schroeder R., Besch L., Pohlit H., Panthoefer M., Roth W., Frey H., Tremel W., Unger R. 2018. Particles of vaterite, a metastable CaCO3 polymorph, exhibit high biocompatibility for human osteoblasts and endothelial cells and may serve as a biomaterial for rapid bone regeneration. J. Tiss. Eng. Regen. Med. V. 12. P. 1754.
Sroga G.E., Vashishth D. 2005. Effects of bone matrix proteins on fracture and fragility in osteoporosis. Biophys. Chem. V. 257. P. 2432.
Дополнительные материалы отсутствуют.


