Цитология, 2020, T. 62, № 2, стр. 129-140
Жизнеспособность, ультраструктура и миграционная активность нейтрофилов после фагоцитоза синтетических микрокапсул
М. Ю. Никитина 1, *, А. А. Пономарева 1, 2, А. Г. Даминова 2, 3, Т. А. Невзорова 1, Я. В. Тараканчикова 4, 5, Е. Н. Аточина-Вассерман 1, 6, Р. И. Литвинов 1, 6
1 Научно-исследовательская лаборатория “Белково-клеточные взаимодействия” Института фундаментальной медицины и биологии Казанского (Приволжского) федерального университета
420008 Казань, Россия
2 Казанский институт биохимии и биофизики ФИЦ КазНЦ РАН
420111 Казань, Россия
3 Междисциплинарный центр “Аналитическая микроскопия” Казанского (Приволжского)
федерального университета
420021 Казань, Россия
4 Университет Оулу
90014 Оулу, Финляндия
5 Санкт-Петербургский академический университет
194021 Санкт-Петербург, Россия
6 Медицинский факультет Пенсильванского унвиверситета
19104 Пенсильвания, Филадельфия, США
* E-mail: mn1994@yandex.ru
Поступила в редакцию 10.11.2019
После доработки 19.11.2019
Принята к публикации 19.11.2019
Аннотация
Нейтрофилы – самая многочисленная популяция лейкоцитов, которая является частью системы врожденного иммунитета и осуществляет антибактериальную защиту организма. Способность нейтрофилов к фагоцитозу и хемотаксису позволяет рассматривать их как потенциальное средство адресной доставки лекарственных веществ в очаги воспаления. Нагружая мигрирующие нейтрофилы инкапсулированным лекарственным веществом, можно уменьшить его токсический эффект на клетку-переносчика, а также избежать изменения концентрации и биоактивности транспортируемого вещества. В настоящей работе изучали взаимодействие синтетических микрокапсул (потенциальных “грузовых контейнеров”) с нейтрофилами человека, а именно: фагоцитарную активность нейтрофилов, ультраструктурные изменения и их миграционную способность после фагоцитоза. Результаты показали, что при кратковременном культивировании нейтрофилов в присутствии микрокапсул клетки фагоцитируют микрокапсулы пропорционально числу микрокапсул во внеклеточной среде; при этом нейтрофилы частично сохраняют жизнеспособность и миграционную активность. Однако, длительное культивирование in vitro нейтрофилов с микрокапсулами приводит к уменьшению популяции нейтрофилов и снижению миграционной способности сохранившихся клеток, что указывает на цитотоксический эффект микрокапсул. Кроме того, интернализация микрокапсул сопровождается изменениями ультраструктуры нейтрофилов, которые выражаются в изменении формы ядер, нарушении целостности плазматической мембраны и вакуолизации цитоплазмы вплоть до полного разрушения отдельных клеток. Таким образом, нейтрофилы потенциально пригодны для переноса инкапсулированных веществ, однако разработка систем адресной доставки веществ с использованием нейтрофилов и синтетических микрокапсул требует оптимизации и дополнительного изучения.
Направленный транспорт, или адресная доставка лекарственных веществ, является актуальной проблемой современной медицины, поскольку лекарственные препараты, введенные в кровоток, затрагивают не только пораженные зоны, но и здоровые органы и ткани, часто вызывая побочные эффекты. При этом только небольшая часть лекарственного препарата (около нескольких процентов), достигает мишени при системном введении, что существенно снижает терапевтический эффект (Ивонин и др., 2012). В настоящее время существуют и разрабатываются разнообразные системы адресной доставки лекарств, преследующие единую цель: доставить лекарственный препарат в терапевтической концентрации к очагу поражения в организме, минуя здоровые органы и ткани. Эта цель достигается разными способами; существуют системы направленного транспорта лекарств с использованием векторов, искусственных контейнеров, наночастиц и других носителей (Thomas et al., 2003; Batrakova et al., 2007; Weissman, 2015; Timin et al., 2018).
Одним из способов адресной доставки биоактивных веществ может быть использование живых клеток, в частности, эритроцитов или лейкоцитов, которые выступают в качестве естественных переносчиков, имеющих ряд преимуществ перед искусственными, прежде всего, биосовместимость (Choi et al., 2007; Chu et al., 2018). Однако в использовании живых клеток как переносчиков есть большой недостаток – это прямое взаимодействие клетки-носителя с лекарственным веществом, что может изменить как свойства самой клетки, так и активность препарата (Choi et al., 2007). Для того чтобы минимизировать эти нежелательные эффекты, лекарственное вещество можно инкапсулировать и доставлять в очаг поражения внутри клетки-переносчика. Именно такая конструкция стала объектом настоящего исследования, а именно: возможность нагрузки нейтрофилов синтетическими микрокапсулами, которые являются потенциальными контейнерами для лекарственных веществ.
Нейтрофилы как нельзя лучше подходят для роли клеток-переносчиков инкапсулированных препаратов, потому что они способны фагоцитировать частицы, в том числе капсулы с биоактивным веществом, и активно мигрировать в зону воспаления – мишень лекарственного препарата (Chu et al., 2018). Зрелые нейтрофилы, или полиморфонуклеарные лейкоциты, – это округлые клетки размером 9–15 мкм с характерным ядром, состоящим из 2–5 сегментов, которые соединены между собой тонкими мостиками (Тотолян, Фрейдлин, 2000; Быков, 2002). Цитоплазма зрелых нейтрофилов содержит гранулы (50–200 на клетку) (Быков, 2002; Faurschou, 2003) и секреторные везикулы, в которых хранятся белки и ферменты, необходимые для осуществления функций этих клеток (Cieutat, 1998). Главная из них – антимикробная защита организма путем фагоцитоза микроорганизмов и тканевого детрита (Cross et al., 2005). При взаимодействии с мишенью нейтрофилы образуют псевдоподии, которые обволакивают фагоцитируемый объект и соединяются между собой в замкнутое пространство, так что фагоцитируемая частица оказывается внутри клетки (Mayadas et al., 2014).
Нейтрофильный фагоцитоз сочетается со способностью этих клеток к хемотаксису, т.е. направленному движению клетки по градиенту концентрации хемоаттрактанта в очаг воспаления, в инфицированные и (или) поврежденные ткани. Процесс трансэндотелиальной миграции нейтрофилов из кровяного русла в очаги воспаления протекает в несколько стадий: 1) слабые кратковременные контакты с эндотелиоцитами; 2) “качение” (rolling) нейтрофилов по поверхности эндотелия; 3) активация нейтрофилов, их “остановка” (arrest) и прочное связывание с поверхностью эндотелия; 4) миграция нейтрофилов через межэндотелиальные щели – экстравазация; 5) миграция к месту воспаления – хемотаксис (Быков, 2002). Наиболее сильными положительными хемоаттрактантами являются пептид формил-метионил-лейцил-фенилаланин (FMLF), анафилатоксин C5a и интрелейкин-8 (IL-8) (Petri, Sanz, 2018).
В литературе имеются сведения об успешном использовании нейтрофилов для адресной доставки веществ. Наночастицы, покарытые лекарственным препаратом, переносились нейтрофилами через эндотелиальный барьер кровеносных сосудов и уменьшали выраженность воспаления легочной ткани, вызванное липополисахаридом (Chu et al., 2018). Наночастицы альбумина, введенные в кровоток, поглощались активированными нейтрофилами и также транспортировались в зону воспаления (Chu et al., 2018). В отличие от дендритных и раковых клеток, способных поглощать искусственные микрокапсулы (Popov et al., 2018), данные о взаимодействии нейтрофилов с синтетическими микрокапсулами отсутствуют.
Цель данного исследования состояла в изучении функциональных и морфологических последствий фагоцитоза нейтрофилами синтетических микрокапсул. Микрокапсулы, использованные в данной работе, представляют собой округлые полые многослойные структуры размером 1–3 мкм. Они синтезированы на основе растворимой частицы-шаблона, вокруг которой послойно накладываются слои полиэлектролита (De Cock et al., 2010). В качестве шаблона используются частицы карбоната кальция, которые вымываются после изготовления капсул с помощью химических агентов (Navolokin et al., 2018; Pavlov et al., 2015; Xue et al., 2017). Преимуществом этих капсул является их биоразлагаемость и сравнительно низкая токсичность (Pavlov et al., 2015). После выделения активных нейтрофилов из периферической крови человека определяли оптимальные условия для эффективного фагоцитоза микрокапсул при сохранении максимальной жизнеспособности нейтрофилов, включая миграционную способность клеток. Результаты подтверждают принципиальную возможность нагрузки нейтрофилов синтетическими микрокапсулами, пригодными для переноса инкапсулированных веществ. После взаимодействия с микрокапсулами часть популяции нейтрофилов сохраняет способность к активному хемотаксису, однако жизнеспособность и миграционная активность нейтрофилов зависит от условий культивирования с микрокапсулами. Таким образом, разработка систем адресной доставки веществ с использованием нейтрофилов и синтетических микрокапсул требует оптимизации и дополнительного изучения.
МАТЕРИАЛ И МЕТОДИКА
Использованные реактивы: флюоресцентный краситель 7AAD (Beckman Coulter, США), флюоресцентный краситель йодид пропидия (eBioscience, США), хемоаттрактант IL-8 (Sigma, Германия), меченные фикоэритрином (PE) моноклональные антитела против CD11b (Invitrogen, США) и меченные аллофикоцианином (APC) антитета к CD16 (BioLegend, США), среда для выделения нейтрофилов Lympholyte-Poly Cell Separation Media (Cedarlane, Канада), лизирующий буфер ACK Lysing Buffer (Gibco, США), среда для культивирования клеток RPMI 1640, эмбриональная телячья сыворотка, урографин 76% и фиколл-400 с плотностью 1.077 г/см3 (ПанЭко, Россия), трипановый синий (eBioscience, США), Epon 812 (Fluka, Швейцария), хлорид калия, дигидрофосфат калия, хлорид натрия, гидрофосфат натрия аналитической степени чистоты (Helicon, Россия), карбонат натрия, дигидрат хлорида кальция, полистиролсульфонат натрия (ПСС, мол. масса >70 000), полиаллиламин гидрохлорид с (ПАА, мол. массой >50 000), бычий сывороточный альбумин (БСА), флуоресцеин-изотиоцианат (FITC), динатриевая соль этилендиаминтетрауксусной кислоты (ЭДТА; Sigma-Aldrich, Германия).
Выделение нейтрофилов центрифугированием в градиенте плотности. Венозную кровь здоровых доноров собирали в вакутейнеры с 3.8%-ным цитратом натрия в соотношении 9 : 1 по объему. Все процедуры выполняли в соответствии с рекомендациями, утвержденными Этическим комитетом Межрегионального клинико-диагностического центра (Казань, Россия). Нейтрофилы выделяли из свежей цитратной крови центрифугированием при 500 g в течение 60 мин при комнатной температуре в градиенте плотности фиколл-урографина 1.119 г/см3 и 1.077 г/см3. В качестве альтернативного метода использовали центрифугирование на коммерческой среде Lympholyte-Poly Cell Separation Media. Соотношение общего объема разделительной среды к объему крови было равно 1 : 1. После центрифугирования фракцию нейтрофилов собирали и отмывали 3 раза фосфатно-солевым буфером с помощью центрифугирования в течение 5 мин при 300 g. Если в осадке нейтрофилов была примесь эритроцитов, добавляли лизирующий буфер ACK Lysing Buffer и инкубировали в течение 10–12 мин при комнатной температуре. После инкубации с лизирующим буфером клетки трижды отмывали фосфатно-солевым буфером.
Синтез и характеристика микрокапсул. Использовали синтетические полимерные микрокапсулы, меченные FITC, синтезированные как описано ранее (De Cock et al., 2010; Pavlov et al., 2015). Микрокапсулы состоят из ядра, основанного на пористом карбонате кальция, и полимерной оболочки. Частицы Са-СО3 готовили путем соосаждения водных растворов солей карбоната натрия и хлорида кальция. После отмывки суспензии частиц водой ядро микрокапсул покрывали разнозаряженными слоями полимеров с последующим растворением ядра карбоната кальция в присутствии ЭДТА. Процесс послойной сборки полимерных плёнок начинается с адсорбции поликатиона ПАА на пористую поверхность ватерита. После отмывки не связавшихся с поверхностью молекул полимера на положительно заряженную поверхность ватерита адсорбируется полианион ПСС, формируя, тем самым, отрицательно заряженную поверхность полимерной структуры. Повторение описанной процедуры приводит к образованию на поверхности ядра водонерастворимого полимерного комплекса, образующего оболочку микрокапсул. Конечный размер полимерных капсул зависит от начального размера ядра карбоната кальция, который можно контролировать, варьируя параметры синтеза. В процессе синтеза в ядро капсулы, а также между ее полиэлектролитными слоями возможна упаковка биологически активных веществ и наночастиц. Для визуализации микрокапсул в процессе их синтеза был инкапсулирован БСА, конъюгированный с флуоресцентным красителем FITC. По данным электронной микроскопии микрокапсулы имеют полую структуру и размер около 1–3 мкм. Перед использованием суспензию микрокапсул выдерживали в течение 10 минут в ультразвуковой ванне для устранения агрегатов. Точную концентрацию микрокапсул в суспензии определяли, подсчитывая их количество микроскопически перед каждым экспериментом.
Анализ фагоцитирующей способности нейтрофилов. Для этого анализа и подбора оптимального соотношения микрокапсул и клеток, необходимого для эффективного фагоцитоза с сохранением жизнеспособности нейтрофилов, выделенные нейтрофилы культивировали с микрокапсулами в питательной среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки, 100 ед./мл пенициллина, 100 ед./мл стрептомицина, в следующих соотношениях (микрокапсулы : клетки): 0.5 : 1; 1 : 1; 1.5 : 1 и 3 : 1. Культивировали в течение 20 мин при 37°С, 5% CO2 и периодическом помешивании. После культивирования клетки отмывали от микрокапсул холодным фосфатно-солевым буфером 3 раза, центрифугируя при 300 g в течение 5 мин при 4°С. Отмытые от микрокапсул клетки суспендировали в зависимости от дальнейших целей в среде для культивирования или в буфере для изучения миграции. В качестве контроля использовали нейтрофилы, культивированные без микрокапсул.
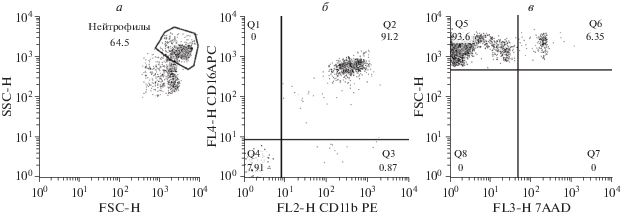
Проточная цитометрия нейтрофилов. Для определения степени чистоты клеточных препаратов, общего числа нейтрофилов и фракции нейтрофилов с микрокапсулами, а также жизнеспособности клеток на всех этапах исследования использовали метод проточной цитометрии. Измерения были выполнены на проточном цитометре FacsCalibur (BD Biosciences, США). Данные анализировали с использованием программного обеспечения FlowJo. Гейт нейтрофилов определяли по характерным сигналам прямого и бокового светорассеяния (рис. 1а) как описано ранее (Cole et al., 1995; Hirz, Dumontet, 2016). Кроме того, нейтрофилы идентифицировали с использованием моноклональных антител против CD11b и CD16 (рис. 1б). Для определения жизнеспособности клеток использовали флюоресцентные красители 7AAD и йодид пропидия, окрашивающие ядра нежизнеспособных клеток (рис. 1в); при этом cигналы от неокрашенных частиц внутри гейта нейтрофилов расценивали как жизнеспособные клетки. Измеряли 3000 событий в гейте нейтрофилов.
Рис. 1.
Характерные точечные диаграммы, полученные методом проточной цитометрии. Выделение гейта нейтрофилов (а) на основании характерного прямого (FSC, размер) и бокового (SSC, гранулярность) светорассеяния. Распределение нейтрофилов по квадрантам в зависимости от флюоресценции антител к CD11b (FL2-H CD11b PE) и CD16 (FL4-H CD16 APC) (б) и распределение нейтрофилов по квадрантам в зависимости от их размера (FSC-H) и флюоресценции красителя 7AAD (FL3-H 7ADD), окрашивающего нежизнеспособные клетки (в). Q2 – положительные по CD11b и CD16 события; Q5 – отрицательные по флюоресценции крупные события – жизнеспособные нейтрофилы; Q6 – положительные по флюоресценции крупные события – нежизнеспособные нейтрофилы.
Трансмиссионная электронная микроскопия (ТЭМ) нейтрофилов. Суспензию клеток в разных экспериментальных условиях фиксировали 2.5%-ным глутаровым альдегидом в течение 1 ч при комнатной температуре, затем центрифугировали при 1000 g в течение 5 мин и отмывали от глутарового альдегида фосфатно-солевым буфером 3-кратным центрифугированием. К осадку клеток добавляли 1% OsO4, оставляли на 2 ч при комнатной температуре, после чего проводили дегидратацию образцов в растворах этанола возрастающей концентрации (от 30 до 100 об. %) и в ацетоне. Использовали смолу для заливки Epon 812. Ультратонкие срезы получали на ультрамикротоме LKB-8800 (LKB, Швеция). Cрезы монтировали на медные сеточки и окрашивали 2%-ным водным раствором уранилацетата в течение 20 мин и цитратом свинца в течение 10 мин. Образцы анализировали на электронном микроскопе JEM-1200 EX (Jeol, Япония) при рабочем напряжении 80 кВ.
Миграция нейтрофилов по градиенту хемоаттрактанта. Для оценки миграционной активности нейтрофилов использовали систему, состоящую из двух камер (верхней и нижней), разделенных вставкой из мембраны с размером пор 5 мкм. После 20-минутного культивирования и отмывки от микрокапсул клетки суспендировали в буферной среде (RPMI-1640, 0.5% БСА, 2 мМ CaCl2, 2 мМ MgCl2, 10 мМ HEPES, pH 7.2) и помещали в верхнюю камеру в количестве 2.5 × 105 клеток на 1 лунку; в нижнюю камеру для создания градиента хеммоаттрактанта добавляли ту же среду, содержащую 50 нМ интерлейкина-8 (IL-8). Для осуществления миграции клетки культивировали в течение 1 ч при 37°С и 5% CO2. Число нейтрофилов, мигрировавших через поры мембраны в нижнюю камеру, определяли микроскопически в гемоцитометре; кроме того, считали число нейтрофилов на нижней стороне мембраны, окрашенной по Романовскому–Гимзе. Полученные значения суммировали и определяли долю мигрировавших клеток (%), обнаруженных по другую сторону мембраны, от общего числа клеток, помещенных в верхнюю камеру.
Статистический анализ. Использовали исходные данные без преобразований и выбросов. Для обоснованного выбора статистических методов результаты проверяли на нормальность распределения по критериям Д’Агостино и Шапиро–Уилка. При условии нормального распределения различия между выборками оценивали с помощью непарного двустороннего метода Стьюдента. Результаты представляли как среднее арифметическое и стандартное отклонение. Уровень статистической значимости составлял 95% (P < 0.05). Для расчетов применяли статистический программный пакет GraphPad Prism 7.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика чистоты и жизнеспособности изолированных нейтрофилов. Нейтрофилы, выделенные в градиенте плотности фиколл-урографина или с использованием коммерческой среды Lympholyte-Poly Cell Separation Media, сравнивали по чистоте и жизнеспособности. Результаты проточной цитометрии показали, что при выделении нейтрофилов на фиколл-урографине доля нейтрофилов от числа всех лейкоцитов составляет 61–75%, тогда как при выделении клеток с использованием Lympholyte-Poly Cell Separation Media содержание нейтрофилов увеличивалось до 76–84%, а содержание положительных по CD11b и CD16 событий внутри гейта нейтрофилов достигало 90% (рис. 1б). Доля жизнеспособных нейтрофилов, определенная по отсутствию окрашивания йодистым пропидием, составила в среднем 94 ± 2% при выделении на фиколл-урографине и 92 ± 2% при выделении на коммерческой среде. Таким образом, выделение нейтрофилов двумя способами позволяет получить препараты нейтрофилов одинаковой жизнеспособности, но более высокой чистоты при использовании коммерческой среды Lympholyte-Poly Cell Separation Media. В дальнейших экспериментах использовали нейтрофилы, выделенные на коммерческой среде.
Влияние синтетических микрокапсул на жизнеспособность нейтрофилов. Для оценки влияния микрокапсул на жизнеспособность нейтрофилов клетки культивировали с микрокапсулами в течение 20 мин при трех разных соотношениях микрокапсул и клеток (0.5 : 1; 1 : 1 и 1.5 : 1) с последующей отмывкой от микрокапсул и культивированием в течение 1, 2 и 4-х ч.
По данным проточной цитометрии средняя доля нейтрофилов в контроле после 20-минутного культивирования без микрокапсул составляла 88% от всех лейкоцитов и находилась на уровне 83–88% на протяжении всего времени культивирования (рис. 2а). В присутствии микрокапсул среднее число нейтрофилов сразу после 20-минутного культивирования не изменялось при соотношении капсул и клеток 0.5 : 1 (89%), однако при соотношениях 1 : 1 и 1.5 : 1 число нейтрофилов снижалось (в среднем до 63 и 59% от числа лейкоцитов соответственно; P < 0.05). Содержание нейтрофилов прогрессивно уменьшалось с увеличением времени культивирования при всех изученных соотношениях микрокапсул и клеток (рис 2а). При соотношении 0.5 : 1 через 1, 2 и 4 ч культивирования (после 20-минутного пре-культивирования в присутствии микрокапсул) средняя доля нейтрофилов составляла 72, 60 и 67% соответственно. При соотношении 1 : 1 через 1, 2 и 4 ч средняя доля нейтрофилов составляла 65, 59 и 74% соответственно. Наибольшее падение количества нейтрофилов наблюдали при соотношении микрокапсул и клеток 1.5 : 1, когда оно составляло 61, 50 и 52% через 1, 2 и 4 ч соответственно. Несмотря на статистическую вариабельность, полученные результаты в целом указывают на прогрессивное уменьшение содержания нейтрофилов в препаратах при культивировании в присутствии микрокапсул.
Рис. 2.
Доля нейтрофилов в гейте лейкоцитов (а) и доля жизнеспособных нейтрофилов от всех нейтрофилов (б) после 20-минутного пре-культивирования клеток с микрокапсулами при разных соотношениях микрокапсула/клетка с последующим культивированием в течение 1, 2 и 4 ч. Гистограммы по результатам проточной цитометрии. К (белые столбцы) – контроль (в отсутствие микрокапсул). Звездочка показывает достоверность различия относительно нейтрофилов, культивированных без микрокапсул, в каждой временной точке (P < 0.05, n = 5).
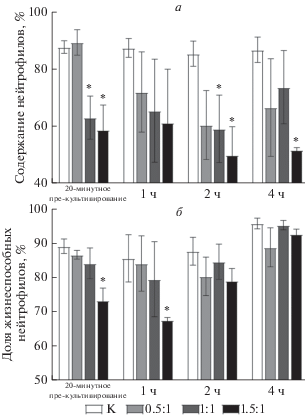
На фоне прогрессирующего уменьшения числа нейтрофилов после 20-минутного культивирования с микрокапсулами (рис. 2а) доля жизнеспособных клеток либо уменьшалась (в контроле и через 1 ч культивирования), либо не менялась и даже возрастала через 2 и 4 ч культивирования (рис. 2б). Средняя доля жизнеспособных нейтрофилов без микрокапсул после 20-минутного культивирования составляла 89% и оставалась сравнительно постоянной в пределах 86–96% на протяжении всего времени культивирования (рис. 2б). При соотношениях микрокапсул и клеток 0.5 : 1, 1 : 1, 1.5 : 1 через 1 и 2 часа фракция жизнеспособных клеток уменьшалась. При дальнейшем культивировании до 4-х ч относительное содержание жизнеспособных клеток увеличивалось параллельно с уменьшением абсолютного числа нейтрофилов в образце (рис. 2а). Это указывает на разрушение значительного числа нейтрофилов, в результате чего фракция выживших клеток становится преобладающей. Полученные результаты показывают, что микрокапсулы обладают цитотоксическим эффектом, который выражается в уменьшении числа нейтрофилов уже на ранних сроках культивирования пропорционально соотношению микрокапсул и клеток. В то же время часть нейтрофилов устойчива к токсическому эффекту микрокапсул и сохраняет жизнеспособность на длительных сроках длительного культивирования в присутствии микрокапсул.
Взаимодействие нейтрофилов с микрокапсулами, меченными FITC. Взаимодействие флюоресцентно-меченных (FITC) микрокапсул с нейтрофилами изучали методом проточной цитометрии, определяя долю сигналов FITC в гейте нейтрофилов одновременно с флюоресценцией красителя 7AAD как показателя нежизнеспособности клеток (рис. 3). При этом FITC-положительные нейтрофилы оценивали как клетки, которые являются носителями микрокапсул либо на поверхности, либо внутри в результате фагоцитоза. Микрокапсулы и клетки культивировали при соотношениях 0.5 : 1, 1 : 1 и 1.5 : 1 в течение 20 мин. с последующей отмывкой от микрокапсул и культивированием в течение 1, 2, и 4 ч. Результаты показывают, что доля нейтрофилов, которые колокализованы с микрокапсулами, в целом прямо зависит от соотношения микрокапсулы/клетки; разница особенно видна в сравнении доли FITC-положительных нейтрофилов при соотношениях 0.5 : 1 против 1 : 1 и 1.5 : 1 (рис. 4а). Фракции нейтрофилов, связанных с микрокапсулами, при всех изученных соотношениях прогрессивно уменьшались в процессе культивирования, что, вероятно, объясняется прогрессирующим разрушением нейтрофилов, фагоцитировавших микрокапсулы, и (или) высвобождением микрокапсул с поверхности клеток.
Рис. 3.
Распределение нейтрофилов по квадрантам диаграмм в зависимости от флюоресценции красителей FITC (FL1-H) и 7AAD (FL3-Р). Характерные точечные диаграммы проточной цитометрии. Диаграммы отражают распределение клеток живых, связанных с микрокапсулами (7AAD−, FITC+), и живых, не связанных с микрокапсулами (7AAD−, FITC−), после культивирования с микрокапсулами в разных соотношениях. Соотношение микрокапсулы/клетки: а – 0.5 : 1, б – 1 : 1, в – 1.5 : 1. Квадранты: Q1 – флюоресцирующие по 7AAD и не флюоресцирующие по FITC (мертвые нейтрофилы без микрокапсул), Q2 – флюоресцирующие и по 7AAD, и по FITC (мертвые нейтрофилы с микрокапсулами), Q3 – не флюоресцирующие по 7AAD, но флюоресцирующие по FITC (живые нейтрофилы с микрокапсулами), Q4 – не флюоресцирующие ни по 7AAD, ни ни по FITC (живые нейтрофилы без микрокапсул).
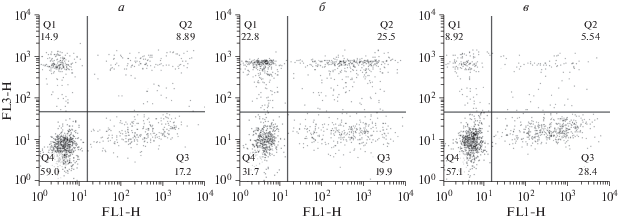
Рис. 4.
Доля всех FITC-положительных (FITC+) нейтрофилов, т.е. связанных с микрокапсулами (а), и FITC+7AAD−-нейтрофилов, т.е. связанных с микрокапсулами и сохранивших жизнеспособность (ЖС) (б), после 20-минутного культивирования клеток с микрокапсулами, меченными FITC и последующим культивированием в течение 1, 2 и 4 ч при разных соотношениях с клетками. Проточная цитометрия. Результаты нормализованы по значениям, полученным после 20-минутного пре-культивирования при соотношении микрокапсулы/клетки 0.5 : 1. *Разница достоверна относительно образца с соотношением капсулы/клетки 0.5 : 1 после 20-минутного пре-культивирования (P < 0.05, n = 5).
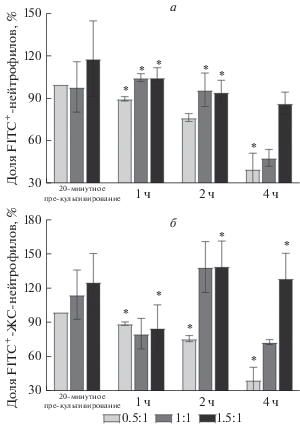
Среди нейтрофилов, связавшихся с микрокапсулами (FITC-положительных), доля жизнеспособных (7AAD-отрицательных) клеток в целом увеличивалась, как с увеличением времени культивирования, так и с ростом соотношения микрокапсулы/клетки (рис. 4б). Так, доля FITC-положительных жизнеспособных нейтрофилов на разных сроках культивирования при соотношении 1.5 : 1 была в среднем в 1.5–2.5 раза выше, чем при соотношении 0.5 : 1. Этот результат согласуется с данными на рис. 2б и подтверждает, что на длительных сроках культивирования начинают преобладать нейтрофилы, которые изначально присутствовали в препарате, но были не подвержены токсичному влиянию микрокапсул и сохранили жизнеспособность.
Фагоцитоз синтетических микрокапсул нейтрофилами, их внутриклеточная локализация и влияние на ультраструктуру клеток. Результаты проточной цитометрии показали, что часть нейтрофилов после культивирования с микрокапсулами физически взаимодействует с ними, сохраняя при этом жизнеспособность. Для того чтобы убедиться, что микрокапсулы действительно интернализуются, а не только прикрепляются к поверхности клеток, а также для визуализации изменений в ультраструктуре фагоцитировавших клеток, использовали метод трансмиссионной электронной микроскопии. При подготовке образцов нейтрофилы культивировали с микрокапсулами в соотношениях микрокапсулы/клетки 1 : 1, 1.5 : 1 и 3 : 1, а также нейтрофилы без капсул в качестве контроля.
Интактные нейтрофилы имели средние линейные размеры 9–11 мкм, небольшие единичные псевдоподии, характерные сегментированные (лопастные) ядра с конденсированным по периферии гетерохроматином. В цитоплазме наблюдали большое количество нейтрофильных гранул, отличающихся друг от друга размерами и электронной плотностью, литические вакуоли, гранулы гликогена и единичные митохондрии (рис. 5).
Рис. 5.
Ультраструктура интактных нейтрофилов. а – Общий вид клеток; б – крупный план цитоплазмы клетки. Обозначения: Г – гранулы; ГГ – гранулы гликогена; ЛВ – литическая вакуоль; ЛК – липидная капля; Мт – митохондрия; П – псевдоподия; Я – ядро. Трансмиссионная электронная микроскопия (ТЭМ). Масштабный отрезок – 2 мкм. Увел.: 4000× (а) и 6000× (б).
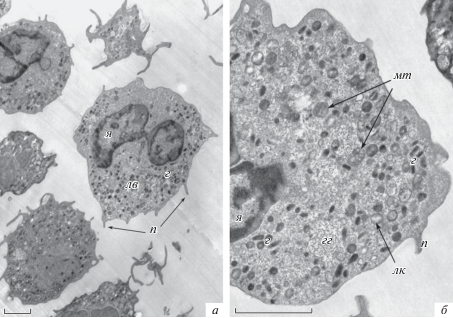
На рис. 6 представлены микрофотографии клеток, культивированных с микрокапсулами в соотношении 1 : 1. На электронограммах видны микрокапсулы, которые находятся как в межклеточном пространстве, так и внутри клеток; в некоторых клетках находится только одна микрокапсула, когда как в других число микрокапсул достигает 4–5. Сами микрокапсулы выглядят как округлые частицы с неровным контуром (электронноплотной оболочкой микрокапсул с электроннопрозрачным центром, иногда внутри микрокапсул визуализируется рыхлое содержимое) (рис. 6а, 7в, г). Важно отметить, что интернализация микрокапсул при данном соотношении с клетками почти не меняет ультраструктуру клеток по сравнению с контролем. Признаков деструкции и других патологических струкурных изменений в нейтрофилах не наблюдали.
Рис. 6.
Ультраструктура нейтрофилов после культивирования в присутствии микрокапсул при соотношении микрокапсулы/клетки 1 : 1. а – Общий вид, б – крупный план клеток с капсулами. ТЭМ. К – микрокапсула, остальные обозначения те же, что на рис. 5. Масштабный отрезок – 1 мкм. Увел.: 2500× (а) и 10 000× (б).
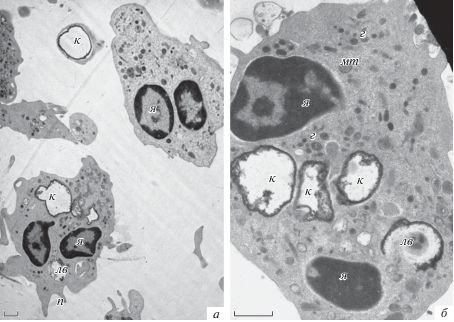
При увеличении соотношения микрокапсулы/клетки до 1.5 : 1 ультраструктура нейтрофилов уже отличается, а именно: отсутствуют псевдоподии, микрокапсулы находятся внутри клеток, свободных микрокапсул при этом не наблюдали (рис. 7а, б). Визуально гранул в цитоплазме становится меньше, и это может свидетельствовать о том, что начался процесс дегрануляции и часть гранул слилась с фаголизосомой. Поглощенные микрокапсулы находятся внутри больших аутолитических вакуолей. Следует отметить, что такие изменения выявляются уже после 20-минутного культивирования с микрокапсулами.
Рис. 7.
Ультраструктура нейтрофилов после культивирования с микрокапсулами в соотношении микрокапсулы/клетки 1.5 : 1 (а, б) и 3 : 1 (в, г). Обозначения те же, что на рис. 5. Масштабный отрезок – 1 мкм. Увел.: 8000× (а, б), 5000× (в) и 2500× (г).
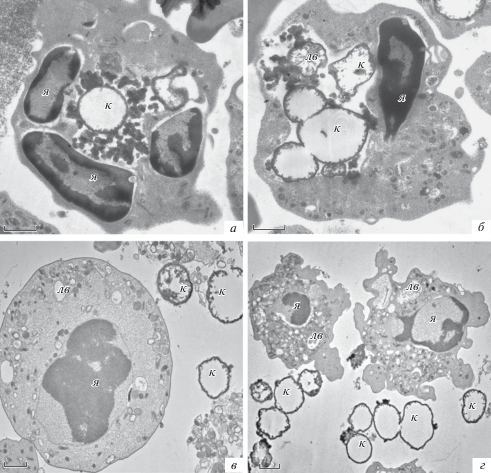
Для подтверждения вывода о том, что соотношение микрокапсулы/клетки 1.5 : 1 и выше является неблагоприятным для клеток, исследовали образец нейтрофилов, культивированных с микрокапсулами при соотношении микрокапсулы/клетки 3 : 1 (рис. 7в, г). Большинство клеток в этих образцах было разрушено или имело выраженные признаки деструкции. Если при соотношении 1 : 1 клетки имели амебоидную форму с псевдоподиями, то при соотношении 3 : 1 они становились округлыми без псевдоподий, цитоплазма уплотнялась, содержала множество мелких литических вакуолей (рис. 7в, г). У значительной части нейтрофилов нарушалась целостность плазматической мембраны, клетки фрагментировались (рис. 7г). В сохранившихся клетках можно было выявить признаки пикноза ядра, отсутствие лопастных ядер, уменьшение общего объeма за счет сжатия и суперкоденсации гетерохроматина (рис. 7г). Интересно, что при соотношении микрокапсулы/клетки 3 : 1 не было ни одной клетки с микрокапсулами внутри, как это было при других соотношениях, но при этом были свободные микрокапсулы вне клеток. Возможно, это связано с тем, что нейтрофилы, максимально насыщенные микрокапсулами, разрушаются и микрокапсулы вновь оказываются во внеклеточном пространстве.
Результаты трансмиссионной электронной микроскопии согласуются с данными проточной цитометрии и подтверждают, что соотношение микрокапсулы/клетки 1 : 1 является оптимальным и для сохранения жизнеспособности, и для структурной целостности при сохранении способности к эффективному фагоцитозу микрочастиц.
Влияние синтетических микрокапсул на миграционную активность нейтрофилов. Для оценки влияния микрокапсул на способность нейтрофилов к миграции использовали клетки после 20-минутного культивирования в присутствии микрокапсул в соотношении 1 : 1 (эксперимент) в сравнении с клетками, культивированных без микрокапсул (контроль). Для клеток создавали условия для миграции по градиенту хеммоаттрактанта IL-8 из верхней камеры в нижнюю через пористую мембрану культивировали в течение 1 ч. Без капсул доля мигрироваших нейтрофилов в среднем составляла 25 ± 7% через 1 ч культивирования, что примерно в 2 раза выше, чем миграция клеток без хеммоаттрактанта (12 ± 2% за то же время). В присутствии микрокапсул доля мигрировавших клеток по градиенту IL-8 снижалась в среднем до 11 ± 2% (P < 0.01), т.е. до уровня миграции клеток в отсутствие хеммоаттрактанта. Среди мигрировавших нейтрофилов по данным проточной цитометрии доля FITC-положительных и жизнеспособных клеток составляла в среднем 16 ± 3%. Снижение миграционной активности после культивирования нейтрофилов с микрокапсулами подтверждает цитотоксический эффект микрокапсул, хотя часть нейтрофилов, связанных с микрокапсулами, сохраняет способность к миграции.
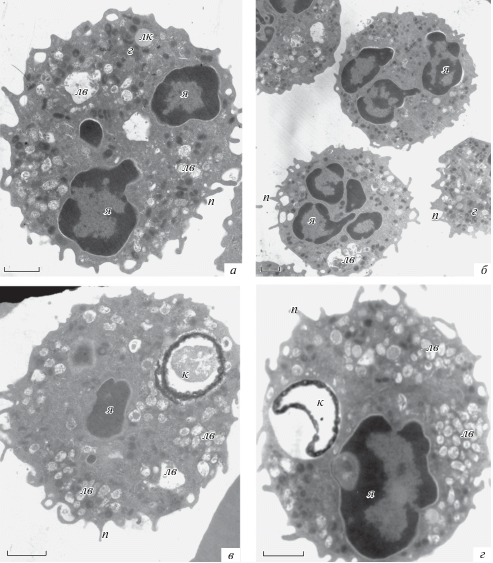
Чтобы прямо подтвердить способность нейтрофилов, нагруженных микрокапсулами, к миграции, исследовали ультраструктуру клеток, мигрировавших из верхней камеры по градиенту хеммоаттрактанта в нижнюю. Как показала электронная микроскопия, среди мигрировавших нейтрофилов значительную часть составляли клетки, содержащие микрокапсулы внутри (рис. 8). В сравнении с интактными свежевыделенными нейтрофилами (рис. 5) у всех нейтрофилов после миграции наблюдали большое количество псевдоподий по всей окружности клетки, что указывает на активацию мигрировавших клеток. Образование псевдоподий и активацию наблюдали как в клетках без капсул, так и в нейтрофилах с капсулами (рис. 8). По сравнению с нейтрофилами до миграции (рис. 5–7) в мигрировавших клетках значительно увеличивалось содержание литических вакуолей, при этом число электронноплотных гранул уменьшалось. Важно отметить, что мигрировавшие нейтофилы содержали по одной микрокапсуле на клетку, тогда как число микрокапсул, поглощенных одним нейтрофилом до миграции, могло достигать четырех (рис. 6б и 7б). По-видимому, фагоцитоз более чем одной микрокапсулы подавляет миграционную активность нейтрофилов. Полученные результаты подтверждают принципиальную возможность использования нейтрофилов в качестве переносчиков инкапсулированных веществ.
Рис. 8.
Ультраструктура нейтрофилов после 1-часовой миграции из верхней камеры в нижнюю по градиенту хеммоаттрактанта IL-8. а, б – Нейтрофилы, не содержащие микрокапсулы; в, г – нейтрофилы, содержащие микрокапсулы. Обозначения те же, что на рис. 5. Масштабный отрезок – 1 мкм. Увел. 10 000× (а, в), 5000× (б), и 12 000× (г).
ВЫВОДЫ
Таким образом, результаты исследования показывают возможность нагрузки нейтрофилов синтетическими микрокапсулами при сохранении жизнеспособности клеток, структурной целостности и, главное, миграционной активности, что указывает на потенциальную возможность использования нейтрофилов в качестве естественных переносчиков для транспортировки инкапсулированных биоактивных веществ в очаги воспаления. Однако в процессе взаимодействия с микрокапсулами жизнеспособность и миграционная активность нейтрофилов существенно снижается, что указывает на цитотоксической эффект микрокапсул, хотя часть нейтрофилов устойчива к неблагоприятному действию микрокапсул. Таким образом, возможность использования нейтрофилов для транспортировки инкапсулированных веществ требует дополнительного изучения, прежде всего с точки зрения повышения биосовместимости синтетических микрокапсул и оптимизации условий их взаимодействия с клетками in vitro.
Список литературы
Быков В.Л. 2002. Цитология и общая гистология. СПб.: СОТИС. (Bykov V.L. (2002). Cytology and general histology. SPb.: SOTIS.)
Ивонин А.Г., Пименов Е.В., Оборин В.А., Девришов Д.А., Копылов С.Н. 2012. Направленный транспорт лекарственных препаратов: современное состояние вопроса и перспективы. Известия Коми научного центра УрО РАН. Т. 1. № 9. С. 46. (Ivonin A.G., Pimenov E.V., Oborin V.A., Devrishov D.A., Kopylov S.N. 2012. Directional transport of drugs: current state of the art and prospects. Bulletin of the Komi Science Center, Ural Branch of the Russian Academy of Sciences. V. 1. № 9. P. 46.)
Тотолян А.А., Фрейдлин И.С. 2000. Клетки иммунной системы. СПб.: Наука. 9. (Totolyan A.A., Freidlin I.S. 2000. Cells of the immune system. SPb.: Science.)
Batrakova E.V., Li S., Reynolds A.D., Mosley R.L., Bronich T.K., Kabanov A.V., Gendelman H.E. 2007. A macrophage-nanozyme delivery system for Parkinson’s disease. Bioconjug. Chem. V. 18. P. 1498.
Choi M.R., Stanton-Maxey K.J., Stanley J.K., Levin C.S., Bardhan R., Akin D., Badve S., Sturgis J., Robinson J.P., Bashir R.D., Halas N.J., Clare S.E. 2007. A cellular Trojan Horse for delivery of therapeutic nanoparticles into tumors. Nano Lett. V. 7. P. 3759.
Chu D., Dong X., Shi X., Zhang C., Wang Z. 2018. Neutrophil-based drug delivery systems. Adv. Mater. V. 30. e1706245. https://doi.org/10.1002/adma.201706245
Cieutat A. 1998. Azurophilic granules of human neutrophilic leukocytes are deficient in lysosome-associated membrane proteins but retain the mannose 6-phosphate recognition marker. Blood. V. 91. P. 1044.
Cole A.T., Garlick N.M., Galvin A.M., Hawkey C.J., Robins R.A. 1995. A flow cytometric method to measure shape change of human neutrophils. Clin. Sci. V. 89. P. 549.
De Cock L.J., De Koker S., De Geest B.G., Grooten J., Vervaet C., Remon J.P., Sukhorukov G.B., Antipina M.N. 2010. Polymeric multilayer capsules in drug delivery. Angew Chem. Int. Ed. Engl. V. 49. P. 6954.
Faurschou M. 2003. Neutrophil granules and secretory vesicles in inflammation Microbes Infect. V. 5. P. 1317.
Hirz T., Dumontet C. 2016. Neutrophil isolation and analysis to determine their role in lymphoma cell sensitivity to therapeutic agents. J. Vis. Exp. V. 25. e53846. https://doi.org/10.3791/53846
Mayadas T.N., Cullere X., Lowell C.A. 2014. The multifaceted functions of neutrophils. Annu. Rev. Pathol. V. 9. P. 181.
Navolokin N.A., German S.V., Bucharskaya A.B., Godage O.S., Zuev V.V., Maslyakova G.N., Pyataev N.A., Zamyshliaev P.S., Zharkov M.N., Terentyuk G.S., Gorin D.A., Sukhorukov G.B. 2018. Systemic administration of polyelectrolyte microcapsules: Where do they accumulate and when? In vivo and ex vivo study. Nanomaterials. V. 8. e812. https://doi.org/10. 3390/nano8100812
Pavlov A.M., Gabriel S.A., Sukhorukov G.B., Gould D.J. 2015. Improved and targeted delivery of bioactive molecules to cells with magnetic layer-by-layer assembled microcapsules. Nanoscale. V. 7. P. 9686.
Petri B., Sanz M.J. 2018. Neutrophil chemotaxis. Cell Tissue Res. V. 371. P. 425.
Popov A.L., Popova N., Gould David J., Shcherbakov A.B., Sukhorukov G.B., Ivanov V.K. 2018. Ceria nanoparticles-decorated microcapsules as a smart drug delivery/protective system: Protection of encapsulated P. pyralis luciferase. ACS Appl. Mater. Interfaces. V. 10. P. 14367.
Thomas C.E., Ehrhardt A., Kay M.A. 2003. Progress and problems with the use of viral vectors for gene therapy. Nat. Rev. Genet. V. 4. P. 346.
Timin A.S., Litvak M.M., Gorin D.A., Atochina-Vasserman E.N., Atochin D.N., Sukhorukov G.B. 2018. Cell-based drug delivery and use of nano- and microcarriers for cell functionalization. Adv. Healthc. Mater. V. 7: 1700818. https://doi.org/10.1002/adhm.201700818
Weissman D. 2015. mRNA transcript therapy. Expert Rev. Vaccines. V. 14. P. 265.
Xue J., Zhao Z., Zhang L., Xue L., Shen S., Wen Y., Wei Z., Wang L., Kong L., Sun H., Ping Q., Mo R., Zhang C. 2017. Neutrophil-mediated anticancer drug delivery for suppression of postoperative malignant glioma recurrence. Nat. Nanotechnol. V. 12. P. 692.
Дополнительные материалы отсутствуют.


