Цитология, 2020, T. 62, № 2, стр. 141-148
Иммунофлуоресцентная идентификация изоформ субъединицы α1 потенциал-зависимых Ca2+-каналов семейств CaV1, CaV2 и CaV3 в зонах холинергических синапсов соматической мускулатуры дождевого червя Lumbricus terrestris
Л. Ф. Нуруллин 1, 2, 3, *, Е. М. Волков 1, **
1 Казанский государственный медицинский университет
420012 Казань, Россия
2 Казанский институт биохимии и биофизики - обособленное структурное подразделение Федерального исследовательского центра “Казанский научный центр Российской академии наук”
420111 Казань, Россия
3 Казанский (Приволжский) федеральный университет
420008 Казань, Россия
* E-mail: lenizn@yandex.ru
** E-mail: euroworm@mail.ru
Поступила в редакцию 17.10.2019
После доработки 18.11.2019
Принята к публикации 19.11.2019
Аннотация
Методами флуоресцентной и конфокальной микроскопии в соматической мышце дождевого червя Lumbricus terrestris идентифицированы следующие субъединицы α1 потенциал-зависимых Са2+-каналов: α1S, α1C, α1D, α1F каналов типов CaV1.1–1.4; α1А канала типа CaV2.1; α1Е канала типа CaV2.3 и α1G, α1I, α1H канала типов CaV3.1–3.3, а также определен белок экзо-эндоцитозного цикла синаптических везикул синаптофизин. Пресинаптическая мембрана холинергических синапсов содержит потенциал-зависимые Са2+-каналы типов CaV1.1, CaV1.2 (в состав которых входят субъединицы α1S и α1C), CaV2.1 (с субъединицей α1A), CaV2.3 (с субъединицей α1E), CaV3.2 и CaV3.3 (с субъединицами α1H, α1I), тогда как Са2+-каналы CaV1.3 и CaV1.4 (имеющие субъединицы α1D, α1F) и каналы CaV3.1 (с субъединицей α1G) преимущественно входят в состав мышечных мембран.
Ключевым моментом в процессе запуска везикулярного цикла синаптических пузырьков, лежащего в основе секреции медиатора, является вход Са2+ в двигательные нервные окончания через потенциал-зависимые Са2+-каналы. Потенциал-зависимые Ca2+-каналы состоят из каналообразующей субъединицы α1, связанной с тремя вспомогательными субъединицами α2/δ, β, и γ (Catterall, 2000). Субъединица α1 в составе ионного канала может быть представлена различными изоформами. Каждая подобная изоформа контролируется отдельным геном. В настоящее время известно, что геном как позвоночных, так и беспозвоночных животных может включать до 10 подобных генов (Catteral et al., 2005). Так, изоформы α1S, α1C, α1D и α1F субъединицы α1 характерны для каналов CaV1.1–1.4, субъединица α1А – для CaV2.1, α1B – для CaV2.2, α1Е – для CaV2.3, α1G, α1H и α1I – для CaV3.1–3.3 (Catterall et al., 2005).
Са2+-каналы, в состав которых входят разные изоформы субъединицы α1, имеют разную чувствительность к деполяризации и по этому критерию и ряду фармакологических отличий объединяются в ряд семейств, а именно: высокопороговые каналы CaV1.1–1.4 (L-типа), CaV2.1 (P/Q-типа), CaV2.2 (N-типа) и низкопороговые CaV3.1–3.3 (T-типа) (Catterall, 2000; Nurullin et al., 2011; Нуруллин и др., 2013). Между высокопороговыми и низкопороговыми каналами находятся каналы типа CaV2.3 (R-типа) (Pardo el., 2006; Wormuth et al., 2016). Характеристики экзо(эндо)везикулярного цикла, а именно синхронности вызванного и спонтанного выброса медиатора в нервно-мышечных синапсах в значительной степени определяются особенностями функционирования Са2+-каналов пресинаптической мембраны (Smith et al., 2012; Kaeser, Regehr, 2014). Установлено, что соматическая мышца дождевого червя иннервируется холинергическими синапсами (Walker et al., 1993; Волков и др., 2012), везикулярный цикл в которых имеет ярко выраженную Са2+-зависимость (Волков, 2012). В пресинаптических образованиях выявляется ряд ключевых Са2+-сенсорных белков везикулярного цикла, а также Са2+-каналы типа CaV2.2 (Волков и др., 2012). Наличие же иных описанных выше типов Са2+-каналов в холинергических нервно-мышечных синапсах в эволюционно-первичной поперечно-исчерченной двигательной мускулатуре аннелид остается не известным.
Таким образом, в соответствии с целью настоящего исследования были сформулированы следующие задачи: 1) определение типов Са2+-каналов на основании иммунофлуоресценции и входящих в их состав изоформ α1-субъединицы; 2) изучение особенностей локализации Са2+-каналов, входящих в состав разных семейств на пре- и постсинаптической мембранах холинергических двигательных нервно-мышечных синапсов соматической мышцы дождевого червя Lumbricus terrestris.
МАТЕРИАЛ И МЕТОДИКА
Выделенные препараты фрагментов кожно-мускульного мешка дождевого червя Lumbricus terrestris закрепляли с помощью иголок на дне чашек Петри, залитых смолой Sylgard, и перфузируровали раствором Древеса−Пакса (состав в мМ: 77 NaCl, 4 KCl, 43 Na2SO4, 6 CaCl2, 2 трис, 167 сахароза, pH 7.4) около 30 мин при комнатной температуре (22 ± 1°С). Далее в течение 30 мин препараты фиксировали в 2% растворе p-формальдегида, отмывали 3 раза по 30 мин в фосфатном буфере. Мышцы последовательно инкубировали в 0.5% растворе тритона X-100 30 мин, в растворе, содержащем 5% нормальной козьей сыворотки, 1% бычьего сывороточного альбумина и 0.5% тритона X-100 15 мин и еще 15 мин в растворе 1% бычьего сывороточного альбумина и 0.5% тритона X-100 (раствор А). Все эти растворы были приготовлены на фосфатном буфере.
Затем препараты инкубировали в течение 12 ч при температуре 4°С в растворе А с поликлональными антителами к субъединицам потенциал-зависимых Ca2+-каналов α1A, α1C, α1D, α1E, α1F, α1G, α1H, α1I, α1S и синаптофизину (все в разведении 1 : 200). Препараты отмывали в растворе А 3 раза по 30 мин и инкубировали 1 ч при комнатной температуре с соответствующими вторичными антителами, конъюгированными с Alexa 488 или 647 (разведение 1 : 800) в растворе А. Окрашивание постсинаптических никотиновых ацетилхолиновых (АХ) рецепторов производили с помощью тетраметилродамин-α-бунгаротоксин (ТМР-Б, 20 мкг/мл) в течении 30 мин. Для подтверждения специфичности связывания поликлональных антител с соответствующими белками проводили контрольные эксперименты. Для негативного контроля препарат инкубировали с вторичными антителами без предшествующей инкубации с первичными антителами. Для позитивного контроля производили инкубацию препарата с первичными антителами в присутствии иммуногенного пептида, на который вырабатывались первичные антитела. Отсутствие окрашивания в контрольных экспериментах указывает на специфичность связывания антител с соответствующими пептидами.
После отмывки в фосфатном буфере препараты помещали в раствор фосфатного буфера с глицерином (1 : 1) и размещали на предметном стекле для проведения микроскопического исследования на лазерном сканирующем конфокальном микроскопе Zeiss LSM 510 Meta (Carl Zeiss, Германия) с применением масляного иммерсионного объектива 63×/1.4. Для возбуждения эмиссии флуорофоров применялся аргоновый и гелий-неоновый лазеры. Длины волн возбуждения: для флуорофоров Alexa 488 – 488 нм, тетраметилродамин – 543 нм, Alexa 647 – 633 нм. Анализ полученных конфокальных изображений проводили в программе ImageJ (NIH, США).
Использовали следующие реактивы: p-формальдегид, трис, фосфатный буфер (137 NaCl, 2.7 KCl, 4.3 Na2SO4, 1.4 KH2PO4, pH 7.2), Тритон X-100, нормальную козью сыворотку, бычий сывороточный альбумин, ТМР-Б, глицерин (Sigma-Aldrich, США); первичные поликлональные антитела и соответствующие им иммуногенные пептиды (Santa Cruz Biotechnologies, США); антитела вторичные Alexa 488 и Alexa 647 (Invitrogen, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
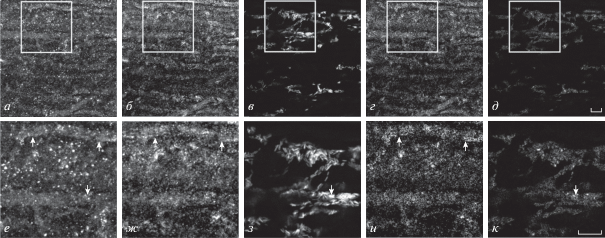
В качестве маркера двигательных нервных окончаний использовали белок синаптофизин, обязательный компонент молекулярной машины экзо-эндоцитозного цикла синаптических везикул (Valtorta et al., 2004; Kwon, Chapman, 2011). Для определения зоны постсинаптической мембраны холинергических синапсов применяли специфический блокатор никотинового АХ-рецептора – ТМР-Б (Krause, Wernig, 1985; Nurullin et al., 2011). Иммуногистохимическое окрашивание препарата кожно-мускульного мешка дождевого червя антителами на α1S субъединицу потенциал-зависимого Са2+-канала типа CaV1.1 выявило иммунопозитивную реакцию на данную субъединицу (рис. 1а, е). При этом окрашивание на α1S выявилось во всех зонах наблюдения (рис. 1а, е). Окрашивание субъединицы α1S совпадало с окрашиванием антителами на белок синаптофизин (рис. 1а, б, г, е, ж, и, стрелки) и в некоторых местах с окрашиванием ТМР-Б АХ-рецепторов (рис. 1а, в, д, е, з, к, стрелки). Можно предположить, что число Са2+-каналов типа CaV1.1, имеющих в своем составе субъединицу α1S, возрастает в зоне двигательных нервных окончаний.
Рис. 1.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1S (а, е) потенциал-зависимого Са2+-канала типа CaV1.1; антителами к пресинаптическому белку синаптофизину (б, ж); окрашивание тетраметилродамин-α-бунгаротоксином (ТМР-Б) никотиновых ацетилхолиновых (АХ) рецепторов (в, з). На всех рисунках (рис. 1–9): на нижней панели представлены увеличенные области, соответствующие выделенным квадратам на верхней панели; г – программно-обработанное изображение, полученное при совмещении изображений а и б (субъединица α1 и синаптофизин), демонстрирующее только совпадающие при наложении изображений светлые пиксели (и – увеличенная область изображения г); д – программно-обработанное изображение, полученное при совмещении изображений а и в (α1 субъединица и ТМР-Б), демонстрирующее только совпадающие при наложении изображений светлые пиксели (к – увеличенная область изображения д). При наложении двух изображений светлые пиксели, присутствующие только на одном из изображений, на итоговых изображениях не учитывались. Таким образом, можно увидеть места совпадения окрашивания на указанные маркеры. На нижних панелях стрелки указывают на места совпадения окрашивания на указанную субъединицу, синаптофизин и АХ-рецепторы. Масштабная линейка – 10 мкм.
В структуру Са2+-каналов типа CaV1 входят также субъединицы α1C (CaV1.2), α1D (CaV1.3) и α1F (CaV1.4). Дальнейшие исследования показали, что окрашивание на субъединицы α1C и α1D было неравномерным (рис. 2а, е, 3а, е). Участки окрашивания на α1C совпадали с окрашиванием на АХ-рецепторы (рис. 2а, в, д, е, з, к, стрелки), но не совпадало с окрашиванием на синаптофизин (рис. 2а, б, г, е, ж, и). Окрашивание на α1D не совпадало с окрашиванием на синаптофизин и АХ-рецепторы (рис. 3а–к). Весьма вероятно, что Са2+-каналы CaV1.2, имеющие в своем составе субъединицу α1С, в большей степени сосредоточены в зоне постсинаптической мембраны холинергических синапсов, тогда как каналы типа CaV1.3, имеющие субъединицу α1D, не имеют такой специфической концентрации в зоне пресинаптической и постсинаптической мембран нервно-мышечного синапса. Окрашивание на наличие α1F субъединицы Са2+-канала (CaV1.4 типа) обнаруживалось во всех зонах наблюдения (рис. 4а, е) и не совпадало с одновременным окрашиванием на синаптофизин и АХ-рецепторы (рис. 4а–к). По всей видимости Са2+-каналы CaV1.4, имеющие в своем составе субъединицу α1F, сосредоточены преимущественно в мембранах клеток мышечной ткани.
Рис. 2.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1C (а, е) потенциал-зависимого Са2+-канала типа CaV1.2, антителами к пресинаптическому белку синаптофизину (б, ж) и красителем ТМР-Б рецепторов АХ (в, з). Здесь и на рис. 3–9: г, д, и, к – объяснения в подписи к рис. 1.
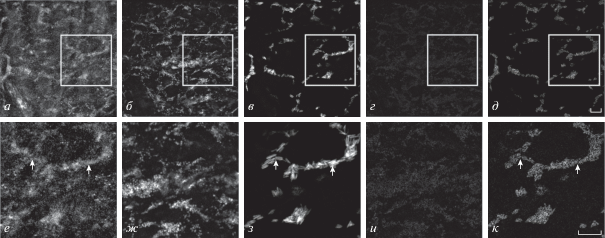
Рис. 3.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1D (а, е) потенциал-зависимого Са2+-канала типа CaV1.3, антителами к пресинаптическому белку синаптофизину (б, ж) и красителем ТМР-Б рецепторов АХ (в, з).

Рис. 4.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1F (а, е) потенциал-зависимого Са2+-канала типа CaV1.4, антителами к пресинаптическому белку синаптофизину (б, ж) и красителем ТМР-Б рецепторов АХ (в, з).

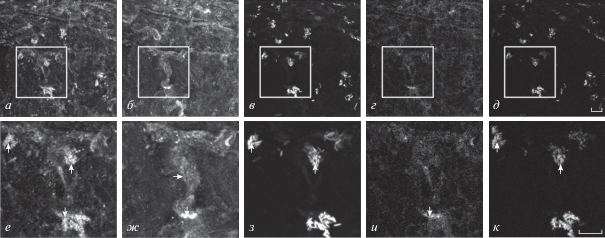
Окрашивание препарата антителами на α1А субъединицу Са2+-канала типа CaV2.1 имело неравномерный характер (рис. 5а, е). Наиболее интенсивные участки окрашивания на эту субъединицу совпадали с окрашиванием антителами на синаптофизин и с окрашиванием ТМР-Б АХ-рецепторов (рис. 5а–к, стрелки). Можно предположить, что пресинаптическая мембрана холинергических нервно-мышечных синапсов соматической мышцы дождевого червя содержит Са2+-каналы типа CaV2.1.
Рис. 5.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1A (а, е) потенциал-зависимого Са2+-канала типа CaV2.1, антителами к пресинаптическому белку синаптофизину (б, ж) и ТМР-Б рецепторов АХ (в, з).

Окрашивание препарата на α1Е-субъединицу Са2+-канала CaV2.3 также было неравномерным (рис. 6а, е). Однако при этом некоторые участки интенсивной окраски на α1Е субъединицу совпадали с окрашиванием на АХ-рецепторы (рис. 6а, в, д, е, з, к, стрелки), но не с окрашиванием на синаптофизин (рис. 6а, б, г, е, ж, и). Данное обстоятельство можно трактовать как наличие в зоне постсинаптической мембраны холинергических синапсов в соматической мышце дождевого червя Са2+-каналов типа CaV2.3.
Рис. 6.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1E (а, е) потенциал-зависимого Са2+-канала типа CaV2.3 антителами к пресинаптическому белку синаптофизину (б, ж) и красителем ТМР-Б рецепторов АХ (в, з).

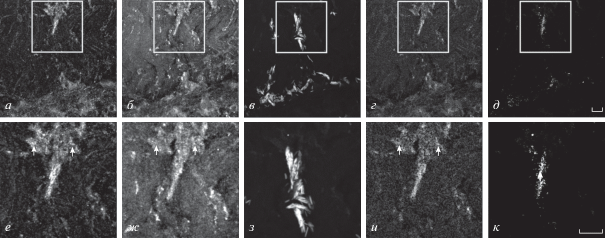
Окрашивание препарата на α1G субъединицу Са2+-канала (CaV3.1 типа) обнаруживалось во всех участках наблюдения (рис. 7а, е) и не совпадало с одновременным окрашиванием на синаптофизин и АХ-рецепторы (рис. 7а–к). Можно думать, что Са2+-каналы CaV3.1 распределяются по мембране клеток соматической мышцы дождевого червя. Известно, что этот тип Са2+-каналов участвует в спонтанной сократительной активности (Catterall, 2000). Также известно, что соматическая мышца дождевого червя обладает способностью к спонтанной сократительной активности по типу сердечной мышцы позвоночных (Давид, 1990). Весьма вероятно, что этот тип мышечной активности в мышце аннелид связан с работой соответствующего типа Са2+-каналов. Окрашивание на α1H субъединицу Ca2+-канала CaV3.2 было неравномерным (рис. 8а, е), имело разную интенсивность и во многом совпадало с окрашиванием на АХ-рецепторы (рис. 8а, в, д, е, з, к, стрелки), а в некоторых местах совпадало с окрашиванием на синаптофизин (рис. 8а, б, г, е, ж, и). При этом окрашивание на синаптофизин было в виде тяжей (рис. 8б, ж, стрелки), которые визуально соединялись со свечением субъединицы α1H (рис. 8а, е) и АХ-рецепторов (рис. 8в, з).
Рис. 7.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1G (а, е) потенциал-зависимого Са2+-канала типа CaV3.1 антителами к пресинаптическому белку синаптофизину (б, ж) и ТМР-Б рецепторов АХ (в, з).

Рис. 8.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1H (а, е) потенциал-зависимого Са2+-канала типа CaV3.2 антителами к пресинаптическому белку синаптофизину (б, ж) и ТМР-Б рецепторов АХ (в, з).
Окрашивание на α1I-субъединицу Ca2+-канала CaV3.3 было также неравномерным (рис. 9а, е), и в зонах, где интенсивность свечения была больше, окрашивание на α1I-субъединицу практически полностью совпадало с окрашиванием на синаптофизин (рис. 9а, б, г, е, ж, и, стрелки), а в некоторых участках совпадало с окрашиванием и на АХ-рецепторы (рис. 9а, в, е, д, е, з, к, стрелки). Таким образом, есть основание полагать, что Са2+-каналы типа CaV3, имеющие в своем составе субъединицы α1Н (CaV3.2) и α1I (CaV3.3), могут присутствовать на мембране пресинаптических окончаний холинергических двигательных синапсов в мышце дождевого червя.
Рис. 9.
Флуоресцентное тройное окрашивание препарата соматических мышечных волокон дождевого червя антителами к субъединице α1I (а, е) потенциал-зависимого Са2+-канала типа CaV3.3, антителами к пресинаптическому белку синаптофизину (б, ж) и окрашивание ТМР-Б рецепторов АХ (в, з).
Таким образом, в геноме дождевого червя Lumbricus terrestris имеются гены, кодирующие пептидные молекулы α1S, α1C, α1D α1F (субъединицы) Са2+-каналов типов CaV1.1–1.4, субъединицу α1A Са2+-канала типа CaV2.1, α1Е-субъединицу Са2+-канала CaV2.3 и субъединицы α1G, α1H и α1I Са2+-каналов типов CaV3.1–3.3.
Ранее в соматических мышечных волокнах дождевого червя нами была показана возможность экспрессии α1В-субъединицы Са2+-канала типа CaV2.2 (Волков и др., 2012). Таким образом, в нервно-мышечных синапсах и клетках соматической мышцы аннелид имеются практически все известные типы потенциал-зависимых Са2+-каналов, характерных кaк для позвоночных, так и беспозвоночных животных (Catterall, 2000; Jeziorski et al., 2000). Концентрация Са2+-каналов CaV1, имеющих в своем составе субъединицы α1S (CaV1.1) и α1C (CaV1.2) выше в зоне холинергических нервно-мышечных двигательных синапсов, тогда как Са2+-каналы данного типа, имеющие в своей структуре субъединицы α1D (CaV1.3) и α1F (CaV1.4) такой локальной концентрации не имеют и распределены по всем мембранам мышечных клеток. Са2+-каналы CaV2.1, имеющие в своем составе субъединицу α1А, сосредоточены в области нервно-мышечных синапсов. Са2+-каналы типа CaV2.3, имеющие в своем составе субъединицу α1Е, так же, хотя и в меньшей степени, сосредоточены в зоне холинергических синапсов. И, наконец, Са2+-каналы CaV3, имеющие своем составе субъединицы α1H (CaV3.2) и α1I (CaV3.3), также сосредоточены почти исключительно в зоне двигательных нервных окончаний, тогда как Са2+-каналы CaV3.1 с субъединицей α1G – на мембранах мышечных клеток.
Кроме того, в ходе проведенных экспериментов впервые определен белок молекулярной машины везикулярного цикла нервных окончаний синаптофизин, который дополняет семейство ранее выявленных подобных белков, таких как синаптотагмин 1 и синтаксин 1 в нервно-мышечных синапсах дождевого червя (Волков и др., 2012).
Проведенные эксперименты и их обсуждение позволяют предположить, что пресинаптическая мембрана холинергических синапсов соматической мышцы дождевого червя содержит следующие типы потенциал-зависимых Са2+-каналов (в соответствии с идентифицированными изоформами субъединицы α1): CavV1.1, CaV1.2 (с субъединицами α1S, α1C), CaV2.1 (α1A), CaV2.3 (α1E), CaV3.2, CaV3.3 (α1H, α1I), а также Са2+-канала CaV2.2 (α1В) (Волков и др., 2012). Тогда как Са2+-каналы CaV1.3, CaV1.4 (с субъединицами α1D, α1F) и каналы CaV3.1 (α1G) преимущественно входят в состав мышечных мембран.
Таким образом в нервно-мышечных синапсах и клетках соматической мышцы аннелид имеются практически все известные типы потенциал-зависимых Са2+-каналов, характерных как для позвоночных (Catterall, 2000), так и беспозвоночных животных (Jeziorski et al., 2000), но имеющих свою специфику распределения по возбудимым мембранам нервных и мышечных клеток.
Список литературы
Волков М.Е. 2012. Прижизненная окраска нервных образований флуоресцентными красителями и оптическое определение ацетилхолина в соматической мышце дождевого червя Lumbricus terrestris. Бюл. эксперим. биол. мед. Т. 54. № 7. С. 112. (Volkov M.E. 2012. Vital staining of nerve structures with fluorescent dyes and optical determination of acetylcholine in the somatic muscle of the earthworm Lumbricus terrestris. Bull. Exper. Biol. Med. V. 154. № 1. P. 100.)
Волков М.Е., Волков Е.М., Нуруллин Л.Ф. 2012. Иммуноцитохимическая идентификация синаптотагмина 1, синтаксина 1, Сa2+-канала N-типа и H-холинорецептора в двигательных нервно-мышечных синапсах соматической мышцы дождевого червя Lumbricus terrestris. Цитология. Т. 54. № 11. С. 847. (Volkov M.E., Volkov E.M., Nurullin L.F. 2012. Immunocytochemical identification of synaptotagmin 1, syntaxin 1, N-type Ca(2+)-channel and nicotinic cholinoreceptor in motor neuromuscular junctions of earthworm somatic muscle Lumbricus terrestris. Tsitologiia. V. 54. № 11. P. 847.)
Давид О.Ф. 1990. Морфофизиологические основы локомоции аннелид. Л.: Наука. (David O.F. 1990. Morphophysiological basis of annelid locomotion. L.: Science.)
Нуруллин Л.Ф., Ценцевицкий А.Н., Маломуж А.И., Никольский Е.Е. 2013. Обнаружение низкопороговых кальциевых каналов T-типа (CaV3) в нервно-мышечном синапсе лягушки Доклады Академии наук. Т. 449 № 3. С. 360. (Nurullin L.F., Tsentsevitsky A.N., Malomouzh A.I., Nikolsky E.E. 2013. Revealing of T-type low-voltage activated calcium channels (CaV3) in frog neuromuscular junctions. Dokl. Biol. Sci. V. 449. № 3. P. 73.)
Catterall W.A. 2000. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell. Dev. Biol. V. 16. P. 521.
Catterall W.A., Perez-Reyes E., Snutch T.P., Striessnig J. 2005. International union of pharmacology. XLVIII. Nomenclature and structure-function relationships of voltage-gated calcium channels. Pharmacol. Rev. V. 57. P. 411.
Jeziorski M.C., Greenberg R.M., Anderson P.A. 2000. The molecular biology of invertebrate voltage-gated Ca(2+) channels. J. Exp. Biol. V. 203. P. 841.
Kaeser P.S., Regehr W.G. 2014. Molecular mechanisms for synchronous, asynchronous, and spontaneous neurotransmitter release. Annu. Rev. Physiol. V. 76. P. 333.
Krause M., Wernig A. 1985. The distribution of acetylcholine receptors in the normal and denervated neuromuscular junction of the frog. J. Neurocytol. V. 14. P. 765.
Kwon S.E., Chapman E.R. 2011. Synaptophysin regulates the kinetics of synaptic vesicle endocytosis in central neurons. Neuron. V. 70. P. 847.
Nurullin L.F., Mukhitov A.R., Tsentsevytsky A.N., Petrova N.V., Samigullin D.V., Malomouzh A.I., Bukharaeva E.A., Nikolsky E.E., Vyskočil F. 2011. Voltage-dependent P/Q-type calcium channels at the frog: Neuromuscular junction. Physiol. Res. V. 60. P. 815.
Pardo N.E., Hajela R.K., Atchison W.D. 2006. Acetylcholine release at neuromuscular junctions of adult tottering mice is controlled by N-(cav2.2) and R-type (cav2.3) but not L-type (cav1.2) Ca2+ channels. J. Pharmacol. Exp. Ther. V. 319. P. 1009.
Smith S.M., Chen W., Vyleta N.P., Williams C., Lee C.H., Phillips C., Andresen M.C. 2012. Calcium regulation of spontaneous and asynchronous neurotransmitter release. Cell Calcium. V. 52. P. 226.
Valtorta F., Pennuto M., Bonanomi D., Benfenati F. 2004. Synaptophysin: Leading actor or walk-on role in synaptic vesicle exocytosis? Bioessays. V. 26. P. 445.
Walker R.J., Holden-Dye L., Franks C.J. 1993. Physiological and pharmacological studies on annelid and nematode body wall muscle. Comp. Biochem. Physiol C. V. 106. P. 49.
Wormuth C., Lundt A., Henseler C., Müller R., Broich K., Papazoglou A., Weiergräber M. 2016. Review: Cav2.3 R-type voltage-gated Ca2+ channels – functional implications in convulsive and non-convulsive seizure activity. Open Neurol. J. V. 10. P. 99.
Дополнительные материалы отсутствуют.


