Цитология, 2020, T. 62, № 2, стр. 121-128
Цитотоксическое действие природного штамма вируса болезни Ньюкасла на опухолевые клетки в условиях in vitro
Е. В. Шекунов 1, *, К. С. Юрченко 1, А. М. Шестопалов 1
1 Научно-исследовательский институт экспериментальной и клинической медицины ФИЦ фундаментальной
и трансляционной медицины
630117 Новосибирск, Россия
* E-mail: egor_shekunov@mail.ru
Поступила в редакцию 16.08.2019
После доработки 05.11.2019
Принята к публикации 11.11.2019
Аннотация
Онколитические вирусы болезни Ньюкасла (ВБН) представляют одну из непатогенных для человека групп противоопухолевых агентов для экспериментального лечения онкологических заболеваний. Известно, что реализация цитотоксического эффекта штаммов ВБН на опухолевые клетки зависит от особенностей строения вирусного генома, вирулентности штамма и культуры опухолевых клеток (NIH, 2018). При этом механизм ВБН-индуцированной гибели недостаточно изучен. Цель данной работы заключалась в исследовании характера морфологических изменений в опухолевых клетках человека HeLa и Hep-2 (дериват HeLa) после инфицирования природным мезогенным штаммом ВБН NDV/Altai/pigeon/770/2011. Подсчет живых опухолевых клеток с помощью МТТ-теста показал, что через 144 ч после инфицирования цитотоксическая активность штамма NDV/Altai/pigeon/770/2011 снижает жизнеспособность клеток до 13.08 ± 8.29% (HeLa) и 4.74 ± 3.29% (Hep-2 – дериват HeLa). Рутинное окрашивание выявило морфологические признаки деградации зараженных клеток, а морфометрические исследования – увеличение значения ядерно-цитоплазматического отношения (ЯЦО). Наличие вируса в опухолевых клетках визуализировано методом иммуноцитохимического окрашивания (ИЦХ) с помощью антител к HN гликопротеину оболочки ВБН. Результаты иммунодетекции фактора некроза опухоли-альфа (TNFα) позволяют предположить активацию клеточной гибели по пути апоптоза на фоне вирусной инфекции. Полученные результаты свидетельствуют о выраженной цитотоксической активности природного штамма NDV/Altai/pigeon/770/2011 в отношении клеток аденокарциномы HeLa и Hep-2 (дериват HeLa) и чувствительности исследуемых клеточных линий к онколитическому действию ВБН.
Применение онколитических вирусов является перспективным методом лечения онкологических заболеваний, вследствие способности вирусных частиц оказывать таргетное цитолитическое воздействие на клетки опухоли, не поражая при этом здоровые клетки. Одним из виротерапевтических агентов является вирус болезни Ньюкасла (ВБН). ВБН относится к парамиксовирусам птиц (род Avulavirus, семейство Paramyxoviridae), содержит одноцепочечную негативную РНК размером около 15 т. п. о. (Miller et al., 2010). Преимущества данного вируса для виротерапии заключаются в высокой стабильности генома, отсутствии взаимодействия с ДНК клетки-хозяина, слабых побочных эффектах у онкологических больных (Zhao, Liu, 2012). Описаны процессы проникновения вируса в клетку, его репликации (Puhlmann et al., 2010), однако, механизмы клеточной гибели на фоне онколитической активности ВБН остаются малоизученными. До сих пор поступают противоречивые сообщения о том, какой именно из механизмов является лидирующим. В одном из исследований лентогенного штамма ВБН Hitchner B1 было отмечено, что опухолевые клетки погибают путем вирусопосредованной активации некроптоза (Koks et al., 2015). Анализ клеток A549, инфицированных тремя различными штаммами ВБН: LaSota (лентогенный), Beaudette C (мезогенный) и FMW (велогенный), продемонстрировал активацию как внешних, так и внутренних апоптических путей (Bian et al., 2011), в то же время эти данные противоречат результатам, согласно которым лентогенный штамм LaSota в клетках немелкоклеточного рака легкого человека A549 вызывал процесс митофагии с последующим ингибированием апоптоза (Cuadrado-Castano et al., 2015). Такая неоднозначная клиническая картина при использовании различных штаммов ВБН обуславливает проведение новых исследований в данной области.
Целью настоящей работы является изучение цитотоксической активности природного штамма NDV/Altai/pigeon/770/2011 в отношении опухолевых клеточных линий человека HeLa и Hep-2 (производные HeLa).
Штамм NDV/Altai/pigeon/770/2011, выделенный из организма сизого голубя и относящийся к группе ВБН – голубиный парамиксовирус серотип-1, был выбран для последующих исследований как штамм с наиболее выраженным онколитическим потенциалом в отношении опухолевых клеточных линий in vitro из коллекции изолятов ВБН (Yurchenko et. al., 2018). Объектами исследования механизма цитотоксического действия природного штамма ВБН служили часто используемые в экспериментальной онкологии опухолевые клеточные линии человека HeLa и Hep-2 (дериват HeLa), которые относятся к наиболее часто диагностируемому гистогенетическому типу опухоли – карциноме, на долю которой приходится 90% всех онкологических заболеваний (Cooper, Hausman, 2013). В ряде работ описана противоопухолевая эффективность вакцинных и аттениуриванных штаммов ВБН по отношению к карциноме человека (Ginting et al., 2017; Yan et al., 2017; Abdullahi et al., 2018), а также отмечен высокий онколитический потенциал ВБН при инфицировании линии HeLa (Cheng et al., 2016; Rajmani et al., 2016; Chu et al., 2018).
В настоящей работе для анализа активации механизма клеточной гибели было проведено иммуноцитохимическое выявление фактора некроза опухоли TNF-альфа, который является основным участником программируемой клеточной гибели, протекающей по пути активации внешнего рецепторопосредованного пути апоптоза, или RIP1, а также RIP3-зависимого некроптоза. Кроме того, на основе результатов исследований Молоуки с соавторами (Molouki et al., 2010, 2011), в которых клетки HeLa инфицировали велогенным штаммом ВБН, оценивали долю клеток, экспрессирующих анти-апоптотический белок Bcl-2, после ВБН-инфицирования с целью анализа возможного сдвига в сторону антиапоптотической регуляции и соотношения Bax/Bcl-2 при возможной ВБН-опосредованной активации внутреннего пути апоптоза.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали опухолевые клетки человека HeLa (аденокарцинома шейки матки) и Hep-2 – дериват HeLa (аденокарцинома гортани), которые культивировали в ростовой среде ДМЕМ (Gibco Inc.) с 10%-ной сывороткой плодов коровы (Gibco Inc.) и 60 мкг/мл гентамицина сульфата в стандартных условиях при температуре 37°С и в атмосфере с 5%-ным содержанием CO2.
Цитотоксическую активность природного мезогенного штамма NDV/Altai/pigeon/770/2011 (Yurchenko et al., 2015) проверяли на суточных монослоях опухолевых клеток на 96-луночных планшетах. Разведения вируса в концентрации 10 MOI готовили в поддерживающей среде MEM (Gibco Inc.), содержащей 1% сыворотки плодов коровы (Gibco Inc.). Клетки инкубировали с вирусом в течение 1 ч 30 мин в стандартных условиях. Контрольные опухолевые клетки без вируса инкубировали в ростовой среде. Затем меняли среду на поддерживающую.
Жизнеспособность клеток после инфицирования штаммом NDV/Altai/pigeon/770/2011 оценивали колориметрическим методом при помощи MTT-теста через 24, 72 и 144 ч. MTT разводили в концентрации 0.5 мг/мл в ФСБ. 10%-ный рабочий раствор MTT готовили на поддерживающей среде. Оптическую плотность измеряли через 40 мин после добавления ДМСО при длине волны 540 нм и 630 нм (фон) на микропланшетном фотометре Lonza Biotek ELX808 Absorbance Microplate Reader (США). Процент живых клеток рассчитывали по формуле: (Э540 − Э630)/(К540 − К630) × × 100%, где Э – показатели, полученные для образцов из зараженных вирусом лунок, а К – показатели, полученные для образцов из контрольных лунок.
Для светооптического исследования готовили препараты клеточных линий, инфицированные штаммом ВБН в концентрации 10 MOI. Через 24, 72 и 144 ч после инфицирования штаммом NDV/Altai/pigeon/770/2011 клетки фиксировали в 2.5%-ном глутаровом альдегиде на фосфатно-солевом буфере (pH 7.4) при комнатной температуре в течение 1 ч. Препараты окрашивали по стандартной методике гематоксилином и эозином. Для количественной оценки степени морфологических изменений в опухолевых клетках рассчитывали отношение площади ядра к площади цитоплазмы (ЯЦО) по формуле ЯЦО = Sя/Sц, где Sя – площадь ядра, а Sц – площадь цитоплазмы.
Для иммуноцитохимического окрашивания (ИЦХ) использовали промывочный раствор 0.25%-ного Triton X100 на ФСБ. Неспецифическую сорбцию клеток блокировали в растворе 0.25%-ного Triton X100 на ФБС с 5% сыворотки козла (30 мин). Время экспозиции клеток с антителами к HN-гликопротеину оболочки ВБН (IgG фракция кроличьих антисывороток, полученные из крови иммунизированных штаммом NDV/Altai/pigeon/770/2011 животных после очистки аффинной хроматографией), TNFα (1 : 50, ab6671, Abcam) и Bcl-2 (1 : 50, ab59348, Abcam, Англия) составило 90 мин. Для визуализации ИЦХ была использована система детекции HRP/DAB (ABC) Detection IHC Kit (Abcam, Англия). Визуализацию проводили на микроскопе AxioImagerA1 с фотокамерой AxioCam MRc (Carl Zeiss, Германия) в ЦКП микроскопического анализа биологических объектов СО РАН и ЦКП “Современные оптические системы” НИИЭКМ ФИЦ ФТМ.
Измерения площади исследуемых клеток проводили в программе ImageJ. Статистическую обработку данных МТТ-теста и определения ЯЦО при рутинном окрашивании проводили с помощью пакета статистических программ “Statistica 6.0”, для оценки достоверности различий между выборками применяли t-критерий Стьюдента (достоверными считали различия при Р менее 0.05).
РЕЗУЛЬТАТЫ
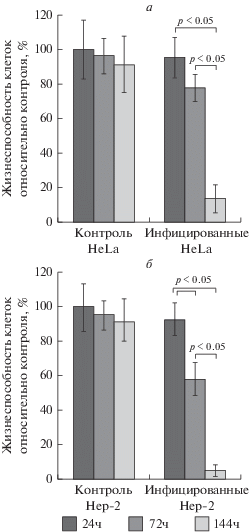
Для определения цитотоксической активности штамма NDV/Altai/pigeon/770/2011, вызывающей гибель клеточной популяции, мы оценили жизнеспособность опухолевых клеток в динамике после инфицирования вирусом. При концентрации вируса 10 MOI через 24 ч выживаемость клеток HeLa и Hep-2 оставалась высокой и составляла 95.26 ± 11.85 и 92.83 ± 9.65% соответственно. Через 72 ч доля живых клеток HeLa снижалась до 77.78 ± 7.85%, а клеток Hep-2 – до 57.84 ± 9.27%. Максимальный цитотоксический эффект был достигнут через 144 ч, когда доля живых клеток составила 13.08 ± 8.29% (для HeLa) и 4.74 ± 3.29% (для Hep-2) (рис. 1).
Рис. 1.
Снижение жизнеспособности клеток HeLa (а) и Hep-2 (б) после инфицирования штаммом ВБН NDV/Altai/pigeon/770/2011 (концентрация 10 MOI) по результатам МТТ-теста. Расчет процента живых клеток производили по формуле: (Э540 − Э630)/(К540 − К630) × 100%, где Э – колориметрические показатели, полученные для зараженных вирусом клеток, а К – колориметрические показатели для контрольных клеток. Данные представлены в виде средних значений и стандартных ошибок.
Светооптическое исследование контрольных клеток HeLa и Hep-2 после рутинного окрашивания гематоксилином и эозином показало низкий уровень дифференцировки изучаемых клеточных культур. Цитоплазма обладает равномерным окрашиванием, без включений, характерно наличие крупного, центрально расположенного ядра (рис. 2а).
Рис. 2.
Изменение морфологии опухолевых клеток HeLa после инфицирования штаммом NDV/Altai/pigeon/770/2011. а – Контрольные клетки HeLa, б – клетки HeLa через 24 ч после инфицирования, в – клетки HeLa через 72 ч после инфицирования. Об. 40×.
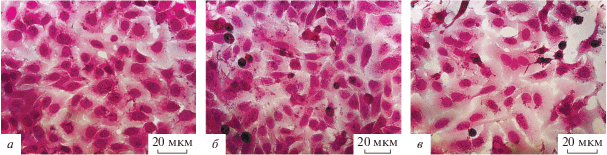
Через 24 ч после инфицирования штаммом ВБН ядра клеток линии HeLa становятся менее выраженными в результате уменьшения интенсивности окрашивания и визуальной четкости их границ ядер. Четко определяются 1–2 ядрышка. Цитоплазма приобретает гетероморфный вид, регистрируются небольшие включения (рис. 2б). Через 72 ч изменения становятся более выраженными. Клетки начинают приобретать нехарактерную форму, отмечаются нарушения целостности монослоя. Ядра клеток смещаются к периферии (рис. 2в).
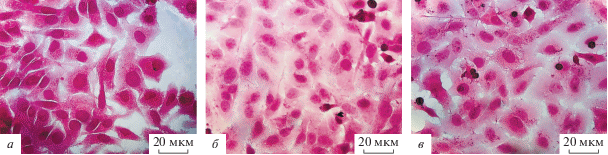
Аналогичные морфологические изменения выявляются в инфицированной штаммом ВБН клеточной линии Hep-2, визуально регистрируется снижение площади цитоплазмы (рис. 3).
Рис. 3.
Изменение морфологии опухолевых клеток Hep-2 после инфицирования штаммом NDV/Altai/pigeon/770/2011. а – Контрольные клетки Hep-2, б – клетки Hep-2 через 24 ч после инфицирования, в – клетки Hep-2 через 72 ч после инфицирования. Об. 40×.
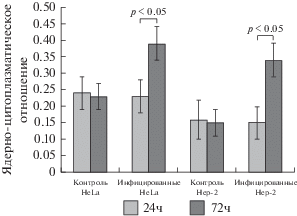
Средние значения ЯЦО с течением времени после инфицирования штаммом NDV/Altai/pigeon/770/2011 возрастают. Через 72 ч данный показатель увеличивается на 69% для клеточной линии HeLa и на 126% для клеточной линии Hep-2 (рис. 4).
Рис. 4.
Динамика ядерно-цитоплазматического отношения после трансдукции клеток штаммом ВБН NDV/Altai/pigeon/770/2011 (концентрация 10 MOI). Данные представлены в виде средних значений и стандартных ошибок.
Наличие вируса в клетках опухолевых линий человека HeLa и Hep-2 было подтверждено с помощью ИЦХ с использованием антител к HN гликопротеину оболочки NDV/Altai/pigeon/770/2011. Никаких меченных антителами аккумуляций и агрегаций в цитоплазме и ядрах контрольных (не инфицированных вирусом) опухолевых клеток не обнаружено (рис. 5а, б).
Рис. 5.
Иммуноцитохимическое окрашивание клеток HeLa (а, в) и Hep-2 (б, г) с помощью антител к HN-гликопротеину ВБН. а, б – Контрольные клетки, в, г – клетки через 24 ч после инфицирования штаммом NDV/Altai/pigeon/770/2011. Стрелками отмечены иммунопозитивные зоны в цитоплазме. Об. 40×.
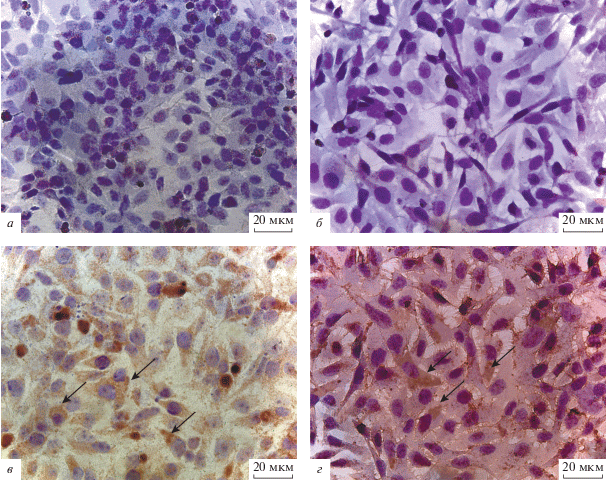
Препараты зараженных вирусом клеток обеих опухолевых линий человека демонстрируют положительный результат иммуноокрашивания (рис. 5в, г), что подтверждает способность вируса инфицировать опухолевые клетки и персистировать в них. Отмечено, что внутри клеток вирусные частицы дисперсно распределены в цитоплазме, в ядрах их скопления не обнаруживаются.
Белок TNFα, являющийся одним из маркеров апоптоза, в контрольных клетках аденокарцином не выявлялся с помощью ИЦХ (рис. 6а, б), однако, спустя 24 ч после трансдукции ВБН, в клетках обеих исследованных линий были зарегистрированы иммунопозитивные аккумуляции (рис. 6в, г).
Рис. 6.
Иммуноцитохимическое окрашивание контрольных HeLa (а, в) и Hep-2 (б, г) с помощью антител к TNFα. а, б – Контрольные клетки, в, г – клетки через 24 ч после инфицирования штаммом NDV/Altai/pigeon/770/2011. Стрелками отмечены иммунопозитивные зоны в цитоплазме. Об. 40×.
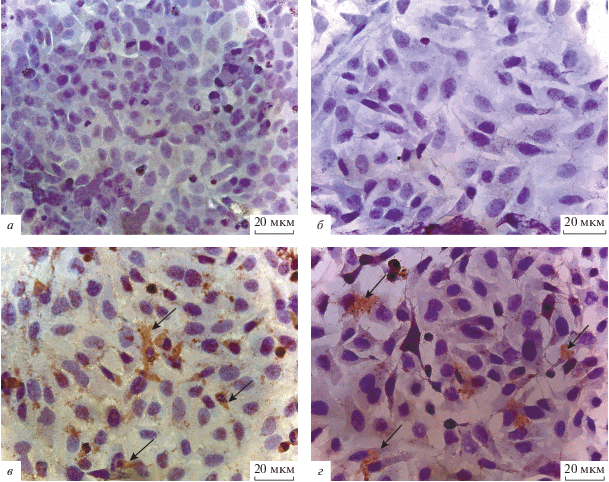
Количество экспрессирующих белок Bcl-2 клеток в обеих клеточных линиях (HeLa и Hep-2) после инфицирования штаммом ВБН было незначительным (обнаруживались единичные Bcl-2-позитивные клетки) и не отличалось от соответствующих контрольных показателей (не показано).
ОБСУЖДЕНИЕ
Наряду с масштабными исследованиями различных онколитических штаммов вирусов, в том числе вируса болезни Ньюкасла, и проведения серий доклинических и начальных фаз клинических испытаний препаратов на их основе, все еще стоит проблема нехватки знаний о механизмах цитотоксического онколизиса, что делает проблему исследования вирусов наиболее актуальной. Не существует сформированного представления о тропности штаммов ВБН к конкретному типу опухоли, так же остаются неизученными и возможные отдаленные эффекты подобного лечения.
Исходя из полученных нами результатов, можно сделать вывод, что цитотоксическое воздействие ВБН на опухолевые клетки HeLa и Hep-2 (дериват HeLa) является ярко выраженным и приводит к эффективному снижению жизнеспособности клеток обеих линий. Полученные свидетельства онколитического действия ВБН в отношении опухолевых клеток человека подтверждаются уже описанными в литературе фактами (Mansour et al., 2011; Шестопалова et al., 2012; Yurchenko et al., 2018). В опухолевых клетках зачастую нарушен механизм противовирусной защиты, связанный с активацией протеинкиназы R. В связи с этим, РНК-содержащие вирусы имеют благоприятные условия для размножения в опухолевых клетках. ВБН способен реплицироваться в опухолевой клетке в 10 000 раз эффективнее, чем в нормальных клетках (Schirrmacher, Fournier, 2009).
Подтверждение присутствия вирусных частиц в инфицированных клетках изученных линий позволяет сделать вывод, что все наблюдаемые морфологические изменения, а также особенности ИЦХ с использованием антител к факторам апоптоза (TNFα), отличающие инфицированные клетки от контрольных, связаны с онколитическим действием ВБН.
На основании результатов, полученных методом рутинного окрашивания гематоксилином и эозином, а также результатов по измерению ЯЦО, можно сделать вывод, что синтетический аппарат зараженных клеток находится в состоянии повышенной активности. Очевидно, что ВБН использует синтетические процессы клетки-хозяина для своей репликации, в результате чего последняя со временем утрачивает способность поддерживать свои основные жизненно необходимые функции и погибает (Auer, Bell, 2012).
Результаты иммуногистохимических реакций с антителами к TNFα свидетельствуют, что однократное инфицирование штаммом ВБН NDV/Altai/pigeon/770/2011 может активировать или усиливать процесс гибели клеток карцином HeLa и Hep-2 путем апоптоза. Так, вирусный белок NH индуцирует апоптоз, опосредованный рецептором смерти, через активацию каспазы-8 (Rajmani et al., 2015). Усиление гибели, очевидно, также связано с влиянием вирусной инфекции и репродукции ВБН на процессы внешнего пути активации апоптоза в клетках карцином. Присутствие ВБН или же его белков (HN) усиливает чувствительность клеток HeLa к действию TNFα за счет торможения транскрипции ядерного фактора NF-kB, ответственного за контроль апоптоза (Rajmani et al., 2016). Однако, стоит отметить, что некроптотический путь гибели также может запускаться опосредованно через рецепторы смерти, к которым относятся рецепторы фактора некроза опухоли TNFR1(CD120) и TNFR2, рецепторы TRAILR1 и TRAILR2 (Vandenabeele et al., 2010). Вследствие этого, трудно утверждать наверняка, какой именно путь гибели превалирует при трансдукции опухолевых клеток штаммом NDV/Altai/pigeon/770/2011, данный аспект требует дальнейшего изучения.
Относительно данных иммуногистохимического окрашивания с использованием антител к Bcl-2 можно отметить, что согласно результатам аналогичных работ при инфицировании клеточной линии HeLa не было выявлено существенных изменений суммарных уровней анти- и проапоптотических белков Bcl-2 и Bax до и после заражения велогенным штаммом ВБН AF2240, что свидетельствует о том, что соотношение Bax/Bcl-2 на уровне белка оставалось постоянным. Кроме того, введение эндогенного Bcl-2 не влияло на процесс реализации гибели клеток HeLa. Таким образом, изменение соотношения Bax/Bcl-2 не участвует в ВБН-опосредованной гибели клеток HeLa (Molouki et al., 2010, 2011). В настоящей работе также не было обнаружено изменения количества Bcl-2 экспрессирующих клеток при инфицировании вирусом, вследствие чего можно предположить, что штамм NDV/Altai/pigeon/770/2011 реализует свой цитолитический потенциал без активации внутреннего пути апоптоза, как минимум на ранних сроках заражения.
Таким образом, клеточные линии аденокарциномы шейки матки HeLa и аденокарциномы гортани Hep-2 (дериват HeLa), имеющие единое гистогенетическое происхождение, проявляют высокую чувствительность к онколитическому воздействию штамма ВБН NDV/Altai/pigeon/770/2011.
Список литературы
Шестопалова Л.В., Максимова А.Д., Красильникова А.А., Корчагина К.В., Силко Н.Ю., Шестопалов А.М. 2012. Вирусы болезни Ньюкасла как перспективный агент для создания онколитических препаратов. Вестник Новосибирского государственного университета. Т. 10. № 2. С. 232. (Shestopalova L.V., Maksimova A.D., Krasilnikova A.A., Korchagina K.V., Silko N.Yu., Shestopalov A.M. 2012. Newcastle disease viruses as a promising agent for the creation of oncolytic drugs. Bulletin of the Novosibirsk State University. V. 10. № 2. P. 232.)
Abdullahi S., Jäkel M., Behrend S. J., Steiger K., Topping G., Krabbe T., Colombo A., Sandig V., Schiergens T.S., Thasler W.E., Werner J., Lichtenthaler S.F., Schmid R.M., Ebert O., Altomonte J. 2018. A novel chimeric oncolytic virus vector for improved safety and efficacy as a platform for the treatment of hepatocellular carcinoma. J. Virol. V. 92 : e01386-18.
Auer R., Bell J.C. 2012. Oncolytic viruses: Smart therapeutics for smart cancers. Future Oncology. V. 8. P. 1.
Bian J., Wang K., Kong X., Liu H., Chen F., Hu M., Zhang X., Jiao X., Ge B., Wu Y., Meng S. 2011. Caspase- and p38-MAPK-dependent induction of apoptosis in A549 lung cancer 675 cells by Newcastle disease virus. Arch. Virol. V. 156. P. 1335.
Cheng X., Wang W., Xu Q., Harper J., Carroll D., Galinski M. S., Suzich J., Jin H. 2016. Genetic modification of oncolytic Newcastle disease virus for cancer therapy. J. Virol. V. 90. P. 5343.
Chu Z., Ma J., Wang C., Lu K., Li X., Liu H., Wang X., Xiao S., Yang Z. 2018. Newcastle disease virus V protein promotes viral replication in HeLa cells through the activation of MEK/ERK signaling. Viruses. V. 10. P. 489.
Cooper G.M., Hausman R.E. 2013. The cell: A molecular approach. Sixth Edition. Oxford: Sinauer Associates. 832 p.
Cuadrado-Castano S., Sanchez-Aparicio M.T., García-Sastre A., Villar E. 2015. The therapeutic effect of death: Newcastle disease virus and its antitumor potential. Virus Res. V. 209. P. 56.
Ginting T.E., Suryatenggara J., Christian S., Mathew G. 2017. Proinflammatory response induced by Newcastle disease virus in tumor and normal cells. Oncolytic Virother. V. 6. P. 21.
Koks C.A., Garg A.D., Ehrhardt M., Riva M., Vandenberk L., Boon L., De Vleeschouwer S., Agostinis P., Graf N., Van Gool S.W. 2015. Newcastle disease virotherapy induces long term survival and tumor-specific immune memory in orthotopic glioma through the induction of immunogenic cell death. Int. J. Cancer. V. 136. P. 313.
Mansour M., Palese P., Zamarin D. 2011. Oncolytic specificity of Newcastle disease virus is mediated by selectivity for apoptosis-resistant cells. J. Virol. V. 85. P. 6015.
Miller P.J., Afonso C.L., Spackman E., Scott M.A., Pedersen J.C., Senne D.A., Brown J.D., Fuller C.M., Uhart M.M., Karesh W.B., Brown I.H., Alexander D.J., Swayne D.E. 2010. Evidence for a new avian paramyxovirus serotype 10 detected in rockhopper penguins from the Falkland Islands. J. Virol. V. 84. P. 11496.
Molouki A., Hsu Y. T., Jahanshiri F., Abdullah S., Rosli R., Yusoff K. 2011. The matrix (M) protein of Newcastle disease virus binds to human bax through its BH3 domain. Virol. J. V. 8. P. 385.
Molouki A., Hsu Y.T., Jahanshiri F., Rosli R., Yusoff K. 2010. Newcastle disease virus infection promotes Bax redistribution to mitochondria and cell death in HeLa cells. Intervirology. V. 53. P. 87.
Puhlmann J., Puehler F., Mumberg D., Boukamp P., Beier R. 2010. Rac1 is required for oncolytic NDV replication in human cancer cells and establishes a link between tumorigenesis and sensitivity to oncolytic virus. Oncogene. V. 29. P. 2205.
Rajmani R.S., Gandham R.K., Gupta S.K., Sahoo A.P., Singh P.K., Kumar R., Saxena S., Chaturvedi U., Tiwari A.K. 2015. HN protein of Newcastle disease virus induces apoptosis through SAPK/JNK pathway. Appl. Biochem. Biotechnol. V. 177. P. 940.
Rajmani R.S., Gupta S.K., Singh P.K., Gandham R.K., Sahoo A.P., Chaturvedi U., Tiwari A.K. 2016. HN protein of Newcastle disease virus sensitizes HeLa cells to TNF-α-induced apoptosis by downregulating NF-κB expression. Arch. Virol. V. 161. P. 2395.
Schirrmacher V., Fournier P. 2009. Newcastle disease virus: A promising vector for viral therapy, immune therapy, and gene therapy of cancer. Humana Press. V. 542. P. 565.
Vandenabeele P., Galluzzi L., Berghe T. V., & Kroemer G. 2010. Molecular mechanisms of necroptosis: An ordered cellular explosion. Nat. Rev. Mol. Cell Biol. V. 11. P. 700.
Yan Y., Su C., Hang M., Huang H., Zhao Y., Shao X., Bu X. 2017. Recombinant Newcastle disease virus rL-RVG enhances the apoptosis and inhibits the migration of A549 lung adenocarcinoma cells via regulating alpha 7 nicotinic acetylcholine receptors in vitro. Virol. J. V. 14. P. 190.
Yurchenko K.S., Sivay M.V., Glushchenko A.V., Alkhovsky S.V., Shchetinin A.M., Shchelkanov M.Y., Shestopalov A.M. 2015. Complete genome sequence of a Newcastle disease virus isolated from a rock dove (Columba livia) in the Russian Federation. Genome Announc. V. 3 : e01514-14.
Yurchenko K.S., Zhou P., Kovner A.V., Zavjalov E.L., Shestopalova L.V., Shestopalov A.M. 2018. Oncolytic effect of wild-type Newcastle disease virus isolates in cancer cell lines in vitro and in vivo on xenograft model. PloS One. V. 13 : e0195425.
Zhao L., Liu H. 2012. Newcastle disease virus: A promising agent for tumour immunotherapy. Clin. Exp. Pharm. Physiol. V. 39. P. 725.
Дополнительные материалы отсутствуют.


