Цитология, 2020, T. 62, № 2, стр. 112-120
Регуляция асимметричного распределения липидов в мембране эритроцитов человека в присутствии глицерина и полиэтиленгликоля
Н. Г. Землянских *
Институт проблем криобиологии и криомедицины НАН Украины
61016 Харьков, Украина
* E-mail: nzemliansky@gmail.com
Поступила в редакцию 09.10.2019
После доработки 28.10.2019
Принята к публикации 01.11.2019
Аннотация
Криопротекторные агенты (КПА), используемые для защиты эритроцитов при замораживании, могут влиять на структурные и функциональные параметры мембраны, от которых зависит жизнеспособность клеток. Цель работы заключалась в исследовании влияния глицерина и ПЭГ на экстернализацию фосфатидилсерина (ФС) на поверхность эритроцитов, а также в определении роли ионов Са2+ и АТФ-зависимых процессов в регуляции трансмембранной асимметрии липидов в присутствии данных КПА. Установлено, что действие глицерина на эритроциты не ведет к экстернализации ФС. Поддержание активностей скрамблаз и флипаз в эритроцитах в присутствии глицерина на уровне контрольных параметров позволяет им реагировать на повышение [Са2+]in, вызванное кальциевым ионофором А23187, и блокирование АТ-Фазных реакций, обусловленное ванадатом, подобно нативным клеткам. Действие ПЭГ способствует нарушению распределения ФС в мембране благодаря изменениям активностей липидных транслоказ. При этом активация скрамблаз и (или) ингибирование флипаз под влиянием ПЭГ не достигают максимальных значений, о чем свидетельствует увеличение количества эритроцитов с экстернализованным ФС при нагрузке клеток Са2+ с помощью ионофора и ингибировании АТФ-зависимых реакций ванадатом. Действие ПЭГ на липидную асимметрию мембран эритроцитов, по-видимому, опосредовано его влиянием на уровень Са2+ в клетке. Нарушения структурных параметров мембраны, обусловленные перераспределением ФС в присутствии ПЭГ, отличающие его от действия глицерина, могут быть причиной нестабильности криоконсервированных эритроцитов в физиологических условия in vitro.
Плазматические мембраны эукариотических клеток характеризуются асимметричным трансмембранным распределением фосфолипидов (Op den Kamp, 1979). В наружном слое мембраны преобладают сфингомиелин и фосфатидилхолин, а фосфатидилэтаноламин и фосфатидилсерин преимущественно локализованы во внутреннем слое. Различия в составе фосфолипидов внешнего и внутреннего слоев мембраны определяют особенности их физических свойств и играют важную роль в формировании специфического микроокружения периферических и интегральных белковых компонентов (Marsh, 1995), а также создают оптимальные условия для их регулярного контроля трансдуктивными сигналами вторичных мессенджеров (Hinderliter et al., 2004).
Поддержание композиционных различий между липидными слоями мембраны во многом определяется медленной скоростью флип-флопа (Nakano et al., 2009; Contreras et al., 2010), обусловленной высокой энергией активации прохождения гидрофильной головной группы фосфолипида через гидрофобную часть мембраны. Вместе с тем трансмембранная асимметрия липидов контролируется активными транспортными процессами (Arashiki, Takakuwa, 2017). Скрамблазы, флипазы и флопазы представляют 3 типа транслоказ, различающихся направлением переноса липидов и источником энергии для их функционирования. Скрамблазы разрушают асимметричное распределение липидов, перенося их из одного слоя в другой по концентрационному градиенту без затрат энергии (Hankins et al., 2015). Флипазы, транспортирующие аминофосфолипиды (главным образом ФС) из внешнего слоя мембраны во внутренний, обеспечивают восстановление липидной асимметрии при ее нарушении так же, как и флопазы, которые переносят фосфолипиды (в основном, фосфатидилхолин) в противоположном направлении. Флипазы и флопазы при функционировании используют энергию АТФ. Основным маркером нарушения асимметричного распределения липидов в мембране эритроцитов является экстернализация ФС на поверхности клетки, поскольку в норме он локализован исключительно во внутреннем слое. Данный процесс зависит от двух типов ферментов – скрамблаз и флипаз, – активность которых регулируется несколькими сигнальными системами (Segawa et al., 2016).
В стрессовых условиях нарушение асимметрии липидов может привести к модификациям свойств мембраны и повлиять на структуру и функциональную активность различных компонентов, от которых зависит выживание клеток. При криоконсервировании эритроцитов человека применяют криопротекторные агенты (КПА), которые изменяют свойства среды и способны воздействовать на структурные параметры мембраны. В зависимости от их способности проникать через плазматическую мембрану различают эндо- и экзоцеллюлярные КПА.
Разрешенные для использования в медицине методы криоконсервирования эритроцитов основаны на применении глицерина, легко проникающего через мембрану (Scott et al., 2005). Такие методы предполагают удаление КПА перед трансфузией, что требует значительных материальных затрат. Экзоцеллюлярные вещества позволяют исключить данный этап и могут послужить основой для создания безотмывочных методов криоконсервирования крови. Однако эритроциты, замороженные с экзоцеллюлярными КПА, имеют скрытые дефекты мембраны, обнаруживаемые при переносе клеток в физиологические условия in vitro (Singbartl et al., 1998; Землянских, Бабийчук, 2019). В частности такое поведение характерно для эритроцитов человека, криоконсервированных с ПЭГ (Землянских, Бабийчук, 2019).
Сравнительные исследования реорганизации мембран под влияниям глицерина и ПЭГ позволяют идентифицировать негативные проявления действия ПЭГ на жизнеспособность эритроцитов. Ранее было показано, что данные КПА по-разному влияют на активность Са2+-АТФазы (Землянских, Кофанова, 2006; Землянских, Бабийчук, 2016). Изменение асимметричного распределения ФС в мембране эритроцитов может быть опосредовано влиянием КПА на мембранные системы, контролирующие уровень Са2+, поскольку функционирование липидных транслоказ зависит от внутриклеточной концентрации ионов Са2+ ([Са2+]in). Можно допустить, что неблагоприятные процессы, изменяющие устойчивость эритроцитов, инициируются на этапе контакта клеток с КПА.
Цель настоящей работы состояла в оценке влияния глицерина и ПЭГ на нарушение асимметричного распределения ФС в мембранах эритроцитов человека, а также изучении роли ионов Са2+ и АТФ-зависимых процессов в регуляции экстернализации ФС на поверхности мембран в присутствии данных КПА.
МАТЕРИАЛ И МЕТОДИКА
Реактивы В работе использовали аннексин V, конъюгированный с флуоресцентным красителем FITC (аннексин V-FITC) (BD Biosciences, США), бычий сывороточный альбумин (БСА; PAA Laboratories GmbH, Австрия), ионофор А23187, Tris, HEPES (Sigma, США), полиэтиленгликоль 1500, глюкозу, CaCl2 (Fluka, США), глицерин, NaCl, КCl, MgCl2 и другие реактивы производства России и Украины квалификации х. ч. или ос. ч.
Объект исследования. Эритроциты крови доноров, полученной из Центра службы крови г. Харькова, осаждали центрифугированием при 1200 g в течение 10 мин при комнатной температуре, удаляли плазму и лейкоцитарные компоненты крови. Осажденные эритроциты трижды промывали с помощью центрифугирования в аналогичном режиме в среде, содержащей 150 мМ NaCl, 10 мМ Трис-HCl, pH 7.4 (соотношение клеток и среды ~ 1 : 7). Отмытые эритроциты, инкубированные в модифицированной среде Рингера (состав (мМ): 125 NaCl, 5 КCl, 1 MgCl2, 1 CaCl2, 32 HEPES (pH 7.4), 5 мМ глюкозы, 0.5% БСА), служили контролем.
Инкубирование эритроцитов с КПА. К аликвотам отмытых эритроцитов (100 мкл) добавляли равные объемы растворов 30%-ного глицерина и 30%-ного ПЭГ, содержащих дополнительно (мМ) 125 NaCl, 5 КCl, 32 HEPES (pH 7.4) и 5 глюкозы. Клетки инкубировали в течение 30 мин при 37°С. Равновесные концентрации КПА в среде на завершающем этапе инкубирования клеток составляли ~ 20%. Аликвоты эритроцитов разводили в 20%-ных растворах КПА, содержащих дополнительно 125 мМ NaCl, 5 мМ КCl, 32 мМ HEPES (pH 7.4) и 5 мМ глюкозы до конечной концентрации 107 кл./мл. Разведенные эритроциты инкубировали на протяжении 1 и 24 ч при 37°С при постоянном перемешивании. По завершению инкубации эритроциты дополнительно разводили до концентрации 106 кл./мл в соответствующих растворах КПА, содержащих все вышеуказанные компоненты и 2.5 мМ CaCl2, и добавляли аннексин V-FITC (5 мкл). Клетки инкубировали в темноте в течение 20 мин и определяли связывание c клетками аннексина V-FITC методом проточной цитометрии на приборе FACS Calibur (Becton Dickenson Biosciences, США). В каждом измерении просчитывали 100 000 событий. Данные анализировали с помощью программы BD CellQuest Pro software (Becton Dickenson Biosciences).
Обработка клеток ванадатом. Для оценки роли АТФ-зависимых реакций в нарушениях липидной асимметрии мембран эритроциты обрабатывали орто-ванадатом. Отмытые эритроциты инкубировали в растворе Рингера, дополненном 1 мМ Na3VO4 в течение 45 мин при 37°С. Для удаления избытка ортованадата натрия клетки отмывали в равном объеме раствора Рингера. Затем к эритроцитам, обработанным ортованадатом, добавляли растворы КПА и инкубировали в соответствии с вышеописанными условиями на протяжении 1 ч.
Обработка клеток ионофором А23187. Для оценки роли ионов Са2+ в нарушениях липидной асимметрии мембран эритроциты обрабатывали ионофором А23187. Отмытые эритроциты инкубировали в растворе Рингера в присутствии 2 мкМ А23187 в течение 45 мин при 37°С. Для удаления ионофора, не связавшегося с мембранами, клетки отмывали в равном объеме раствора, содержащего (мМ) 125 NaCl, 5 КCl, 32 HEPES, 5 глюкозы, 2 ЭДТА (без MgCl2 и Ca-Cl2). При второй отмывке использовали аналогичный раствор, не содержащий ЭДТА. Третью отмывку выполняли с использованием раствора того же состава без ЭДТА, но дополненного 1% БСА. К эритроцитам, обработанным ионофором А23187, добавляли растворы КПА и инкубировали в соответствии с вышеописанными условиями.
Статистическую обработку результатов выполняли с использованием программного пакета Statgraphics plus 2.1 for Windows (Statistical Graphics Corp.). Все выборки имели нормальное распределение. Эксперименты проведены на крови четырех разных доноров (n = 4). Данные представлены в виде средних значений и стандартных отклонений. Различия между экспериментальными группами оценивали с помощью критерия знаков Вилкоксона и множественного рангового теста в зависимости от конкретных задач. При Р < 0.05 данные считали статистически значимыми.
РЕЗУЛЬТАТЫ
Анализ нарушений липидной асимметрии основан на высокоафинном связывании ФС на наружной поверхности клетки со специфическим белком аннексином V, конъюгированным с флуоресцентным красителем FITC. Изменения в мембране эритроцитов оценивали при кратковременном (1 ч) и длительном (24 ч) воздействии глицерина и ПЭГ на клетки, что позволяет идентифицировать возможность даже незначительных нарушений исследуемого параметра, поскольку с течением времени слабовыраженные тенденции трансформируются в определяемые структурные перестройки.
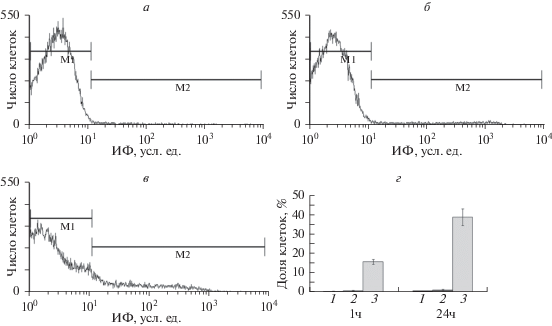
В присутствии глицерина изменений асимметричного распределения ФС не наблюдали на протяжении 24 ч инкубации, а количество клеток, связывающих аннексин, не отличалось от контрольных значений в соответствующие периоды времени (рис. 1 б, г). Экзоцеллюлярный ПЭГ даже при кратковременном контакте с эритроцитами оказывал существенное влияние на распределение ФС в бислое (рис. 1 в, г). При этом количество клеток, связывающих аннексин V-FITC, увеличивалось с течением времени (до 24 ч), но не так быстро, как на протяжении 1 ч инкубации. Таким образом, результаты влияния глицерина и ПЭГ на регуляцию трансбислойного распределения ФС в мембране эритроцитов существенно различаются.
Рис. 1.
Экстернализация фосфатидилсерина (ФС) в эритроцитах человека при инкубации их в течение 1 и 24 ч в присутствии криопротекторных агентов (КПА). Гистограммы распределения интенсивности флуоресценции (ИФ) эритроцитов, меченных аннексин V-FITC, после инкубации в течение 1 ч: а – в растворе Рингера, б, в – в среде, содержащей соответственно глицерин и полиэтиленгликоль 1500 (ПЭГ); г – доля эритроцитов, связывающих аннексин V-FITC, после инкубации в растворе Рингера (столбец 1) и среде, содержащей глицерин (столбец 2) или ПЭГ (столбец 3). Здесь и на рис. 2, 3 : а–в – типичные (повторяющиеся) результаты эксперимента, проточная цитометрия; аннексин V-FITC – аннексин V, конъюгированный с FITC; данные представлены в виде средних значений (М) и стандартных отклонений (вертикальные отрезки), n = 4.
Нарушения асимметричного распределения ФС в мембране обусловлены изменениями активностей скрамблаз и флипаз. Для оценки роли флипаз, использующих АТФ в качестве источника энергии для переноса молекул, в дезорганизации липидной асимметрии в мембране эритроцитов под действием КПА можно использовать ванадат, который в неспецифичной манере блокирует АТФазные реакции, лежащие в основе функционирования данного типа транслоказ (Segawa et al., 2016). Инкубация эритроцитов, обработанных ванадатом, в среде Рингера в течение 1 ч не вызывала увеличения доли клеток, связывающих аннексин (повышение от 0.5 ± 0.2% до 0.8 ± 0.3%, Р > 0.05) (рис. 2а, г). Аналогичные результаты были получены при инкубации эритроцитов, обработанных ванадатом, в присутствии глицерина на протяжении 1 ч (рис. 2б, г), что подтверждает их способность к поддержанию трансмембранной асимметрии ФС.
Рис. 2.
Влияние ингибирования ATP-зависимых реакций на асимметричное распределение ФС в эритроцитах человека при инкубации их в присутствии КПА в течение 1 ч. Гистограммы распределения ИФ аннексин V-FITC-меченных эритроцитов, предварительно обработанных ванадатом (1 мМ), при инкубации в растворе Рингера (а) и среде, содержащей глицерин (б) или ПЭГ (в); г – доля аннексин V-FITC-меченных эритроцитов, предварительно обработанных 1 мМ ванадатом, при инкубации в растворе Рингера (столбец 1) и среде, содержащей глицерин (столбец 2) или ПЭГ (столбец 3).
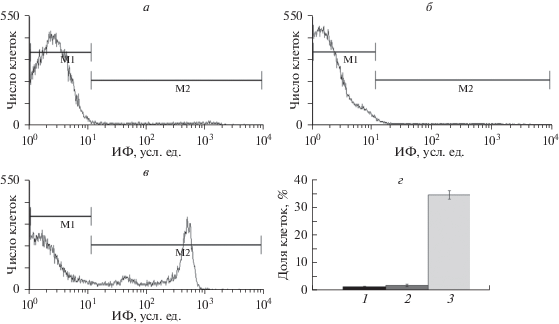
Инкубация эритроцитов, обработанных ванадатом, в присутствии ПЭГ сопровождалась значительным увеличением экстернализации ФС (рис. 2в, г) по отношению к клеткам, не подвергавшимся такой обработке (см. рис. 1в, г). Следовательно, несмотря на нарушение распределения ФС в бислое эритроцитов под влиянием ПЭГ, активность флипаз оказывает этому существенное противодействие, поскольку ингибирование АТФ-зависимых реакций в эритроцитах увеличивает количество клеток с экстернализованным ФС в 2 раза. Следовательно, в присутствии ПЭГ наблюдается неполное ингибирование флипаз, активность которых в значительной степени зависит от уровня Са2+.
Нагрузка клеток ионами Са2+ с помощью ионофора А23187 позволяет оценить особенности функционирования липид-транспортирующих систем в мембранах эритроцитов в присутствии КПА, поскольку рост [Са2+]in является одним из наиболее изученных триггеров экстернализация ФС. Как видно из представленных данных (рис. 3а–в), в результате повышения уровня Са2+ количество эритроцитов, связывающих аннексин V, увеличивалось как при инкубировании в растворе Рингера, так и средах, содержащих КПА, но диапазон изменений зависел от типа среды.
Рис. 3.
Влияние нагрузки эритроцитов ионами Ca2+ на асимметричное распределение ФС в эритроцитах человека при инкубации в присутствии КПА в течение 1 ч. Гистограммы распределения ИФ аннексин V-FITC-меченных эритроцитов, предварительно обработанных ионофором A23187 (2 мкМ), при инкубации в растворе Рингера (а) и среде, содержащей глицерин (б) или ПЭГ (в); г – доля аннексин V-FITC-меченных эритроцитов, предварительно обработанных A23187, при инкубации в растворе Рингера (столбец 1) и в среде, содержащей глицерин (столбец 2) или ПЭГ (столбец 3).
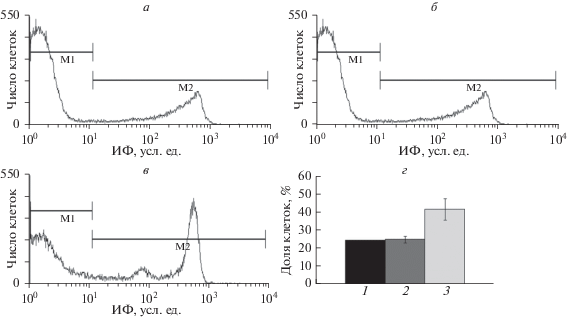
В присутствии глицерина экстернализация ФС в эритроцитах, предварительно нагруженных Ca2+, была идентична той, которую наблюдали в клетках, инкубированных в растворе Рингера (рис. 3а, б, г). Данный факт характеризует отсутствие изменений базовых активностей транслоказ, контролирующих асимметрию распределения ФС в эритроцитах в присутствии глицерина. В Ca2+-нагруженых эритроцитах, инкубированных в присутствии ПЭГ, экстернализация ФС была выше (рис. 3в, г) чем в клетках, обработанных ванадатом. Однако прирост в абсолютных значениях не был таким значительным, как в случае клеток, инкубированных в растворе Рингера и среде, содержащей глицерин (см. рис. 2 и 3а–в). Более высокие показатели экстернализации ФС при инкубации эритроцитов, нагруженных Са2+, в присутствии ПЭГ свидетельствуют об усилении активности скрамблаз и (или) ингибирования флипаз, очевидно, благодаря суммирующему эффекту действия ионофора и высокой концентрации иона в клетке, обусловленной влиянием ПЭГ, на активность Са2+-АТФазы (Землянских, Бабийчук, 2016) и скорость входа Са2+ в клетки (Kucherenko, Bernhardt, 2006). Следовательно, в присутствии ПЭГ активация скрамблаз и (или) ингибирование флипаз не достигают максимальных значений, поскольку увеличение [Ca2+]in вызывает дополнительную экстернализацию ФС в эритроцитах.
Таким образом, действие глицерина на эритроциты не влияет на их способность контролировать асимметричное трансмембранное распределение ФС. Очевидно, сохранение регуляторного баланса активностей скрамблаз и флипаз на уровне контрольных параметров позволяет эритроцитам в присутствии данного КПА реагировать на повышение [Са2+]in в клетках (вызванное ионофором А23187) и блокирование АТФазных реакций (обусловленное ванадатом) подобно нативным клеткам. Инкубация клеток с ПЭГ способствует нарушению распределения ФС в мембране благодаря изменениям активностей транслоказ, контролирующих асимметрию липидного бислоя. Однако увеличение количества эритроцитов с экспонированным на поверхности ФС под влиянием ПЭГ при нагрузке клеток Са2+ свидетельствует о том, что активация скрамблаз и (или) ингибирование флипаз не достигает максимальных значений. Кроме того, на это указывает существенное повышение экстернализации ФС в эритроцитах в присутствии ПЭГ при ингибировании АТФ-зависимых реакций ванадатом. Действие ПЭГ на липидную асимметрию мембран эритроцитов может быть опосредовано его влиянием на уровень Са2+ в клетке.
ОБСУЖДЕНИЕ
Представленные результаты продемонстрировали принципиальные отличия действия ПЭГ и глицерина на асимметричное распределение ФС в мембране эритроцитов. Структурные перестройки, обусловленные перераспределением ФС, могут быть одной из причин нестабильности клеток, криоконсервированных под защитой ПЭГ, в физиологических условиях in vitro, несмотря на низкий уровень гемолиза после размораживания.
Экстернализация ФС обусловлена регуляторными изменениями активностей липидных транслоказ и реализуется благодаря одновременной активации скрамблаз и ингибированию флипаз. Использование ванадата для блокирования флипаз показало, что инкубирование эритроцитов в присутствии глицерина так же, так и в среде Рингера, не вызывает значимого увеличения количества клеток, связывающих аннексин V, что, очевидно, обусловлено отсутствием стимулов для скрамблинга липидов в стационарном состоянии, для которого характерна медленная скорость входа Ca2+ в клетку и низкая активность Ca2+-АТФазы, а, следовательно, и флипаз при низкой [Са2+]in. Поэтому ингибирование ванадатом АТ-Фазных реакций не отражается на регуляции липидной асимметрии мембран в рамках исследованного периода времени.
Полученные результаты косвенно подтверждают, что клеточные системы, контролирующие [Са2+]in в эритроцитах в присутствие глицерина, способны поддерживать низкий уровень Са2+, несмотря на небольшое, но статистически значимое снижение активности Са2+-АТФазы (Землянских, Кофанова, 2006) под влиянием глицерина в концентрации 20–30%. Отсутствие скрамблинга ФС указывает на то, что в данных условиях [Са2+]in не достигает уровня, необходимого для активации скрамблазы (25–100 мкМ) (Weiss et al., 2012). В результате ингибирование флипаз ванадатом не имеет последствий для перераспределения ФС в мембране эритроцитов в присутствии глицерина так же, как и в контроле.
Ингибирование флипаз ванадатом в эритроцитах при инкубации в присутствии ПЭГ способствует увеличению количества клеток с экстернализованным ФС, что указывает на неполное ингибирование их активности под влиянием КПА. Изменение [Са2+]in в эритроцитах в присутствии ПЭГ возможно благодаря ингибированию Ca2+-АТФазы (Землянских, Бабийчук, 2016) и осмотическому сжатию, сопровождающемуся открытием неспецифических катионных каналов (Foller et al., 2008). Несмотря на то, что криопротекторные среды не контролируются по уровню Са2+, т.е. не содержат определенных комбинаций хелаторов и ионов Са2+, источником роста [Са2+]in могут быть следовые количества ионов, присутствующие в солевых растворах на уровне 10–6–10–5 М (Patton et al., 2004), вследствие их случайного входа через канало-подобные пути в мембранах эритроцитов (Baunbaek, Bennekou, 2008). При этом повышение [Са2+]in может носить локальный характер, т.е. происходить в отдельных участках околомембранной зоны (Rizzuto et al., 1993; Marsault et al., 1997). Поэтому активность флипаз и скрамблаз в эритроцитах в присутствии ПЭГ может изменяться неравномерно. Неполному ингибированию флипаз в присутствии ПЭГ может также способствовать наличие в клетках различных изоформ данного фермента.
Известно, что флипазы являются членами семейства Р4-АТФаз (~120 кДа) (Andersen et al., 2016), активация которых происходит при их ассоциации с некаталитической субъединицей из семейства мембранных белков CDC50 (Hankins et al., 2015). В эритроцитах человека в разных пропорциях представлены изоформы АТР11А, АТР11В и АТР11С (Liou et al., 2019), которые различаются по ряду параметров: кинетическим характеристикам (Km и Vmax), чувствительности к Са2+ и ванадату, а также способности к расщеплению каспазами (Segawa et al., 2016). Возможно, благодаря разнообразию их свойств и локальной неоднородности повышения [Са2+]in некоторые флипазы могут сохранять активность в эритроцитах в присутствии ПЭГ. Кроме того, необходимо отметить, что ванадат способствует также дополнительному снижению активности Ca2+-АТФазы в эритроцитах, которая сохраняется на уровне 20–30% от контрольных показателей в присутствии ПЭГ (Землянских, Бабийчук, 2016), что также может несколько увеличить уровень Ca2+ в клетке.
Нагрузка клеток ионами Са2+ с помощью ионофора продемонстрировала отсутствие изменений в исходном балансе активностей скрамблаз и флипаз в эритроцитах в присутствии глицерина. Это также указывает на способность Са2+-транспротрирующих мембранных систем эритроцитов поддерживать уровень Са2+ в клетке в присутствии данного КПА близким к диапазону физиологической нормы, поскольку в противном случае дополнительная нагрузка клеток Са2+ на фоне более высоких значений [Са2+]in привела бы к пропорциональному увеличению экстернализации ФС относительно контрольных параметров. Об этом свидетельствует корреляционная зависимость между ингибированием активности флипаз и увеличением уровня Са2+ в клетках при варьировании концентраций ионофора А23187 (Korenaga et al., 1993). В то же время более высокие показатели экстернализации ФС при инкубации эритроцитов, нагруженных Са2+, в присутствии ПЭГ в сравнении раствором Рингера и глицерин-содержащей средой, по-видимому, обусловлены кумулятивным эффектом ионофора и высокой концентрации иона в клетке, обусловленной влиянием ПЭГ на активность Са2+-транспортирующих систем (Kucherenko, Bernhardt, 2006; Землянских, Бабийчук, 2016).
Изменения в функционировании различных мембранных компонентов, связанные с перераспределением ФС в бислое, могут привести к нарушению целостности клеток и нарастанию гемолиза с течением времени после возвращения криоконсервированных эритроцитов в условия активного метаболизма. Здесь важно отметить, что механическая стабильность мембран в известной мере зависит от взаимодействия цитоскелета с ФС при его асимметричном распределении (Manno et al., 2002). В частности, сайты высокоаффинного взаимодействия выявлены в 8 из 38 тройных спиральных структурных повторов спектрина, составляющих основную часть α- и β-цепей этого цитоскелетного белка, а также в негомологичном N-концевом домене β-цепи (An et al., 2004).
Непосредственная близость сайтов связывания ФС в β-спектрине от участков присоединения анкирина и белка полосы 4.1, опосредующих его ассоциацию с интегральными белками, позволяет предположить, что взаимодействие спектрина с ФС модулирует его контакты с другими белковыми компонентами и (или) способствует образованию липидных доменов, обогащенных ФС. Кроме того, в мембране эритроцитов выявлен сложный характер взаимодействия ФС с белком полосы 4.1 (An et al., 2001), который может образовывать контакты не только с головной группой ФС через положительно заряженные аминокислоты, но и формировать плотное гидрофобное взаимодействие с остатками жирных кислот ФС. При этом ассоциация белка полосы 4.1 с ацильными цепями влияет на его способность взаимодействовать с кальмодулином, белком полосы 3 и гликофорином C. Следовательно, при нарушении липидной асимметрии изменения характера взаимодействий спектрина и белка полосы 4.1 с ФС могут способствовать перераспределению белок-белковых взаимодействий в мембрано-цитоскелетном комплексе и изменению его стабильности, как в условиях стресса, так и при переносе криоконсервированных клеток в физиологические условия.
Кроме того, нарушение липидной асимметрии сопровождается дисбалансом физических характеристик внешнего и внутреннего слоев мембраны и ведет к изменению параметров натяжения, способствуя деформации мембраны или инвагинации с отделением везикул (Devaux et al., 2008). Потеря мембранного материала и деформационные процессы также могут быть существенными факторами, влияющими на стабильность клеток при криоконсервировании и последующем их возвращении в физиологические условия.
Поиск путей к блокированию нарушений липидной асимметрии мембран эритроцитов может быть своеобразным инструментом для улучшения консервирующих сред, основанных на экзоцеллюлярных КПА. В настоящее время известны многочисленные стимулы нарушения асимметричного распределения ФС в мембране эритроцитов (Lang, Lang, 2015), но механизм их реализации может вовлекать различные промежуточные схемы, включающие активацию каналов, протеинкиназ, фосфолипаз, эндопептидаз и других клеточных компонентов, которые во многом сопутствуют или запускают повышение [Са2+]in (Lang, Lang, 2015). Кроме того, установлены также и ингибиторы, тормозящие или блокирующие развитие экстернализации ФС, в число которых входят антиоксиданты, катехоламины, ингибиторы эндопептидаз, нитропруссид натрия (донор NO) и целый ряд других фармацевтических веществ (Lang , Lang, 2015), которые могут быть использованы для коррекции структурных перестроек мембранных липидов. Однако выбор того или иного соединения для биохимической стабилизации мембран эритроцитов путем блокирования экстернализации ФС в присутствии экзоцеллюлярного КПА должен быть основан на детальном понимании механизма нарушения липидной асимметрии, который может включать дополнительные регуляторные звенья. Тем не менее, учитывая определяющую роль [Са2+]in в развитии нарушений распределения ФС, использование фармацевтически приемлемых ингибиторов Са2+ и антиоксидантов может быть первым шагом для изучения возможностей блокирования негативных процессов, связанных с экстернализацией ФС в эритроцитах в присутствии экзоцеллюлярного КПА.
Список литературы
Землянских Н.Г., Бабийчук Л.А. 2016. Изменения активности Са2+-ATPазы эритроцитов под влиянием ПЭГ-1500 и низких температур. Цитология. Т. 58. № 12. С. 964. (Zemlianskykh N.G., Babiychuk L.A. 2017. The changes in erythrocyte Ca2+-ATPase activity induced by PEG-1500 and low temperatures. Cell and Tissue Biology. V. 11. С. 104.)
Землянских Н.Г., Бабийчук Л.А. 2019. Пространственно-конформационные модификации белков мембранно-цитоскелетного комплекса криоконсервированных эритроцитов. Биол. мембраны. Т. 36. № 2. С. 125. (Zemlianskykh N.G., Babijchuk L.A. 2019. Spatial-conformational modifications of proteins in membrane-cytoskeleton complex of cryopreserved erythrocytes. Biologicheskie Membrany (Russ). V. 36. № 2. P. 125.)
Землянских Н.Г., Кофанова О.А. 2006. Модификация активности Са2+-АТРазы эритроцитов человека под влиянием глицерола: роль кальмодулина. Биохимия. Т. 71. № 8. С. 1112. (Zemlyanskikh N.G., Kofanova O.A. 2006. Modulation of human erythrocyte Ca2+-ATPase activity by glycerol: the role of calmodulin. Biochemistry (Moscow). V. 71. P. 900.)
An X., Guo X., Wu Y., Mohandas N. 2004. Phosphatidylserine binding sites in red cell spectrin. Blood Cells Mol. Dis. V. 32. P. 430.
An X.L., Takakuwa Y., Manno S., Han B.G., Gascard P., Mohandas N. 2001. Structural and functional characterization of protein 4.1R-phosphatidylserine interaction: Potential role in 4.1R sorting within cells. J. Biol. Chem. V. 276. P. 35 778.
Andersen J.P., Vestergaard A.L., Mikkelsen S.A., Mogensen L.S., Chalat M., Molday R.S. 2016. P4-ATPases as phospholipid flippases-structure, function, and enigmas. Front. Physiol. V. 7. P. 275. https://doi.org/. eCollection 2016.https://doi.org/10.3389/fphys.2016.00275
Arashiki N., Takakuwa Y. 2017. Maintenance and regulation of asymmetric phospholipid distribution in human erythrocyte membranes: Implications for erythrocyte functions. Curr. Opin. Hematol. V. 24. P. 167.
Baunbaek M., Bennekou P. 2008. Evidence for a random entry of Ca2+ into human red cells. Bioelectrochem. V. 73. P. 145.
Contreras F.X., Sánchez-Magraner L., Alonso A., Goñi F.M. 2010. Transbilayer (flip-flop) lipid motion and lipid scrambling in membranes. FEBS Lett. V. 584. P. 1779.
Devaux P.F., Herrmann A., Ohlwein N., Kozlov M.M. 2008. How lipid flippases can modulate membrane structure. Biochim. Biophys. Acta. V. 1778. P. 1591.
Foller M., Kasinathan R.S., Koka S., Lang C., Shumilina E., Birnbaumer L., Lang F., Huber S.M. 2008. TRPC6 contributes to the Ca2+ leak of human erythrocytes. Cell Physiol. Biochemistry. V. 21. P. 183.
Hankins H.M., Baldridge R.D., Xu P., Graham T.R. 2015. Role of flippases, scramblases and transfer proteins in phosphatidylserine subcellular distribution. Traffic. V. 16. P. 35.
Hinderliter A., Biltonen R.L., Almeida P.F. 2004. Lipid modulation of protein-induced membrane domains as a mechanism for controlling signal transduction. Biochemistry. V. 43. P. 7102.
Korenaga R., Ando J., Ohtsuka A., Sakuma I., Yang W., Toyo-oka T., Kamiya A. 1993. Close correlation between cytoplasmic Ca2+ levels and release of an endothelium-derived relaxing factor from cultured endothelial cells. Cell Struct. Funct. V. 18. P. 95.
Kucherenko Y.V., Bernhardt I. 2006. The study of Ca2+ influx in human erythrocytes in isotonic polyethylene (glycol) 1500 (PEG-1500) and sucrose media. Ukr. Biokhim. Zh. 78. № 6. P. 46.
Lang E., Lang F. 2015. Triggers, inhibitors, mechanisms, and significance of eryptosis: The suicidal erythrocyte death. Biomed. Res. Int. V. 2015. ID 513518. https://doi.org/10.1155/2015/513518
Liou A.Y., Molday L.L., Wang J., Andersen J.P., Molday R.S. 2019. Identification and functional analyses of disease-associated P4-ATPase phospholipid flippase variants in red blood cells. J. Biol. Chem. V. 294. P. 6809.
Manno S., Takakuwa Y., Mohandas N. 2002. Identification of a functional role for lipid asymmetry in biological membranes: Phosphatidylserine-skeletal protein interactions modulate membrane stability. Proc. Natl. Acad. Sci. USA. V. 99. P. 1943.
Marsault R., Murgia M., Pozzan T., Rizzuto R. 1997. Domains of high Ca2+ beneath the plasma membrane of living A7r5 cells. EMBO J. V. 16. P. 1575.
Marsh D. 1995. Lipid-protein interactions and heterogeneous lipid distribution in membranes. Mol. Membr. Biol. V. 12. P. 59.
Nakano M., Fukuda M., Kudo T., Matsuzaki N., Azuma T., Sekine K., Endo H., Handa T. 2009. Flip-flop of phospholipids in vesicles: Kinetic analysis with time-resolved small-angle neutron scattering. J. Phys. Chem. B. V. 113. P. 6745.
Op den Kamp J.A. 1979. Lipid asymmetry in membranes. Annu. Rev. Biochem. 48 : 47–71.
Patton C., Thompson S., Epel D. 2004. Some precautions in using chelators to buffer metals in biological solutions. Cell Calcium. V. 35. P. 427.
Rizzuto R., Brini M., Murgia M., Pozzan T. 1993. Microdomains with high Ca2+ close to IP3-sensitive channels that are sensed by neighboring mitochondria. Science. V. 262. P. 744.
Scott K.L., Lecak J., Acker J.P. 2005. Biopreservation of red blood cells: Past, present, and future. Transfus. Med. Rev. V. 19. P. 127.
Segawa K., Kurata S., Nagata S. 2016. Human Type IV P-type ATPases that work as plasma membrane phospholipid flippases and their regulation by caspase and calcium. J. Biol. Chem. V. 291. P. 762.
Singbartl K., Langer R., Henrich A. 1998. Altered membrane skeleton of hydroxyethylstarch-cryopreserved human erythrocytes. Cryobiology. V. 36. P. 115.
Weiss E., Cytlak U.M., Rees D.C., Osei A., Gibson J.S. 2012. Deoxygenation-induced and Ca2+ dependent phosphatidylserine externalisation in red blood cells from normal individuals and sickle cell patients. Cell Calcium. V. 51. P. 51.
Дополнительные материалы отсутствуют.


