Цитология, 2020, T. 62, № 3, стр. 173-180
Роль холестерина в мембранной локализации кальциевых каналов TRPV5 в Т-клетках человека линии Jurkat
Л. В. Кевер 1, С. Б. Семенова 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: svsem@incras.ru
Поступила в редакцию 10.10.2019
После доработки 08.11.2019
Принята к публикации 11.11.2019
Аннотация
Многие ионные каналы локализуются в областях плазматической мембраны, обогащенных холестерином и сфинголипидами, известных как липидные рафты. Проблема взаимодействия ионных каналов с рафтами является одной из самых малоизученных в современной биологии и физиологии. В настоящей работе мы исследовали роль липидных рафтов в мембранной локализации кальциевых каналов TRPV5 (transient receptor potential vanilloid, type 5), обнаруженных нами ранее в Т-клетках человека линии Jurkat. Иммунофлуоресцентный анализ клеток показал примембранную локализацию белков TRPV5 и их колокализацию с липидными рафтами. Уменьшение мембранного холестерина с использованием метил-β-циклодекстрина (MбЦД) приводило к уменьшению поверхностной экспозиции каналов и их диффузному распределению в цитоплазме клеток. Анализ изображений клеток, полученный с помощью иммуноэлектронной микроскопии выявил локальные скопления белков TRPV5 в виде кластеров в плазматической мембране клеток. Экстракция мембранного холестерина и разрушение липидных рафтов приводили к исчезновению кластеров каналов и уходу каналов TRPV5 с плазматической мембраны клеток в цитоплазму. В целом полученные результаты показали, что локализация кальциевых каналов TRPV5 в виде кластеров в плазматической мембране критически зависит от уровня холестерина и целостности липидных рафтов в Т-клетках линии Jurkat.
Кальций-проводящие каналы TRP представляют собой полимодальные ионные датчики, которые, реагируя на различные физические и химические раздражители, интегрируют множество сигналов, поступающих в клетку. Каналы TRP участвуют в подавляющем большинстве реакций организма, включая зрительную, обонятельную, болевую и температурную рецепции (Montell et al., 2002; Clapham, 2003; Flockerzi, 2007). Они задействованы в нейрогенезе, развитии мозга и синаптической трансмиссии (Vennekens et al., 2012). Ряд каналов TRP участвует в иммунитете и обменных процессах организма (Fernandes, 2012). Поэтому неудивительно, что дисфункции многих каналов суперсемейства TRP приводят к развитию различных заболеваний (Nilius, 2007).
Являясь интегральными белками, каналы TRP чувствительны к липидному составу мембраны, в которую они встроены. До недавних пор считалось, что липиды играют в клетке только пассивную роль, являясь простыми строительными блоками для мембран, разграничивая внутриклеточные компартменты и отделяя внутреннюю среду от внеклеточной среды клетки. Однако за последние десятилетия возникло новое понимание роли липидов в жизнедеятельности клеток. Стало известно, что основные липиды плазматической мембраны, такие, как холестерин и сфинголипиды могут плотно упаковываться вместе, образуя микродомены (липидные рафты), участвующие во многих функциональных реакциях клеток (Simons, Toomre, 2000; Pizzo, Viola, 2003). Известно участие рафтов в таких процессах, как транспорт мембранных белков, сборка сигнальных комплексов, передача нервных импульсов, эндо- и экзоцитоз, а также регуляция активности ионных каналов (Levitan et al., 2000; Lundbaek et al., 2003; Schengrund, 2010; Sheng et al., 2012).
Состав липидов в значительной степени определяет структурные и физические свойства плазматической мембраны, ее текучесть, кривизну и жесткость (Yeagle, 1985), что критически влияет на гейтинг ионных каналов (Pucadyil, Chattopadhyay, 2004). На свойства каналов также могут влиять ассоциированные с липидными рафтами различные сигнальные белки. Кроме того, некоторые липиды сами могут выступать в качестве специфических агонистов ионных каналов. Важные данные относительно регулирования функций канала холестерином были получены при использовании метил-β-циклодекстрина (MбЦД) (Heino et al., 2000; Slimane et al., 2001; Barbuti et al., 2004). Так, экстракция мембранного холестерина показала, что активность каналов TRPM8 критически зависит от целостности липидных рафтов, поскольку приводила к значительному сдвигу порога активации термо-чувствительных каналов TRPM8 в сторону более высоких температур (Morenilla-Palao et al., 2009). Таким же образом разрушение липидных рафтов путем истощения любого из главных его компонент фармакологическими инструментами блокировало агонист-зависимую активацию каналов TRPV1 (Szoke et al., 2010). Вход Ca2+ в клетки прекращался, либо когда холестерин был истощен с помощью MбЦД (Liu et al., 2006; Kilsdonk et al., 1995), либо когда молекулы сфингомиелина были разрушены сфингомиелиназой (Kobayashi et al., 2006).
Два члена суперсемейства TRP – каналы TRPV5 и TRPV6 (первоначально известные, как СаТ2 и CaT1, или ЕСаС1 и ECaC2) были впервые клонированы из эпителиальных клеток почки кролика и тонкого кишечника крысы (Hoenderop et al., 2001; Peng, Hediger, 2002). Позднее они были отнесены к подсемейству ванилоидных рецепторов (TRPV) и идентифицированы в клетках других млекопитающих, включая человека (Nijenhuis et al., 2003). Показано, что эти каналы могут обеспечивать строго дозированное поступление Са2+ и участвовать в активной (ре)абсорбции Са2+ в эпителиальных клетках почек, тонком кишечнике и плаценте (Hoenderop, 2002; Nijenhuis et al., 2003). Ранее с помощью полимеразной цепной реакции в реальном времени и Вестерн-блот-анализа мы показали экспрессию каналов TRPV5 и TRPV6 в Т‑клетках лейкемии человека линии Jurkat (Vassilieva et al., 2013).
Кальциевые каналы TRPV5 и TRPV6 являются конститутивно активными, поэтому избирательная ассоциация ионных каналов с конкретным липидным микроокружением в мембране может быть критически необходима для их активации. Несмотря на это, вопрос о взаимодействии кальциевых каналов TRPV5 с липидным микроокружением и липидными рафтами практически не изучен. Ранее с помощью электрофизиологических и иммунофлуоресцентных методов, а также метода иммуноэлектронной микроскопии мы показали, что мембранный холестерин регулирует активность каналов TRPV6 в T-клетках человека линии Jurkat (Kever et al., 2019).
В настоящей работе мы изучали роль липидных рафтов в локализации кальциевых каналов TRPV5 в плазматической мембране Т-клеток лейкемии человека линии Jurkat.
МАТЕРИАЛ И МЕТОДИКА
Клетки линии Jurkat получены из Российской коллекции клеточных культур позвоночных Института цитологии РАН (Санкт-Петербург). Клетки культивировали при 37°С в среде RPMI 1640, содержащей 10% эмбриональной телячьей сыворотки и 0.008% гентамицина при температуре 37°С в атмосфере 5% СО2.
Иммунофлуоресцентный анализ проводили на клетках, которые предварительно были посеяны на стекла, покрытые поли-L-лизином. Клетки инкубировали 40 мин (при 37°С и 5% СО2) в среде без сыворотки в присутствии и отсутствие (контрольные клетки) 1% метил-β-циклодекстрина (MбЦД, Sigma-Aldrich). Далее клетки фиксировали в растворе 3.7%-ного параформальдегида и пермеабилизовали в присутствии 0.25%-ного Tween 20. Затем контрольные и обработанные клетки инкубировали сперва с первичными антителами (в разведении 1 : 100), выработанными против TRPV5 (H-99, Santa Cruz Biotechnology, США) в течение ночи (при 4°С), а потом с вторичными антикроличьими антителами (1 : 200), конъюгированными с Су3 (Jackson ImmunoResearch Europe Ltd, Великобритания) в течение 40 мин (при 37°С). Для визуализации липидных рафтов, богатых холестерином, использовали специфический маркер липидных рафтов, β-субъединицу холерного токсина (5 мг/мл), конъюгированную с FITC (FITC-CTB, Sigma-Aldrich). После окрашивания клеток FITC-CTB покровные стекла заключали в смолу Vectashield Mounting Medium (Vector Laboratories, США) и исследовали с помощью конфокального микроскопа Olympus FV3000 (Olympus Corporation, Япония), используя масляный объектив 60×. Интенсивность флуоресценции (по меньшей мере 7–15 клеток) в каждом эксперименте) оценивали с помощью программы ImageJ (NIH, США) и усредняли. Интенсивность флуоресценции в контрольных и обработанных клетках сравнивали с использованием стандартного t-критерия Стьюдента. Данные представлены в виде среднего значения и его ошибки. Различия считали достоверными при P < 0.05.
Иммуноэлектронная микроскопия. Контрольные и обработанные МбЦД клетки фиксировали в растворе PBS, содержащем 2% параформальдегида и 0.5% глутаральдегида в течение 1 ч, затем обезвоживали в спиртах и заливали в акриловую смолу LR-White. Ультратонкие срезы помещали на никелевые сетки, покрытые формваровой пленкой. Для иммуноокрашивания срезы экспонировали 20 мин в 1%-ном BSA на PBS, а затем инкубировали в течение 1 ч сначала с первичными (в разведении 1 : 100) анти-TRPV5 антителами (H-99, Santa Cruz Biotechnology, США), потом с вторичными (1 : 50) антикроличьими антителами, коньюгированными с коллоидным золотом (Electron Microscopy Sciences, Hatfield, PA, США). В работе использовали коллоидное золото с размером частиц 10 нм. Срезы клеток, обработанные антителами, контрастировали уранил-ацетатом и цитратом свинца и анализировали с помощью электронного микроскопа Librа-120 (Германия).
Подготовка препаратов мембранных фрагментов для иммуноэлектронной микроскопии. Использовали описанную процедуру (Sanan, Anderson, 1991). Покровные стекла с предварительно посеянными на них клетками быстро охлаждали путем погружения в ледяной буфер (25 мM Hepes, 25 мM KCl, 2.5 мM Mg(СН3СОО)2) и переворачивали на никелевые сетки с формваровой пленкой, предварительно покрытые поли-L-лизином. С помощью резиновой пробки покровные стекла с клетками в течение 20 с прижимали к никелевым сеткам. Затем стекла резко отрывали от никелевых сеток, при этом на сетках оставались участки плазматической мембраны клеток. Никелевые сетки с остатками клеток аккуратно промывали в ледяном буфере и фиксировали в 2%-ном параформальдегиде (10 мин). Затем прикрепленные к сеткам мембраны клеток переворачивали на капли, содержащие первичные анти-TRPV5 и вторичные (конъюгированные с коллоидным золотом) антитела (указанные выше) и инкубировали в течение 30 мин. После промывки в PBS образцы фиксировали в растворе 2%-ного глутаральдегида (1 ч) и оставляли на ночь отмываться в PBS при 4°С. После этого образцы постфиксировали в 1%-ном OsO4 (10 мин), промывали буфером и дистиллированной водой. Далее образцы обрабатывали 1%-ным водным раствором таниновой кислоты (10 мин) и окрашивали 1%-ным уранил-ацетатом (10 мин). После сушки мембранные фрагменты, прикрепленные к сеткам, анализировали на электронном микроскопе Libra-120 (Германия).
РЕЗУЛЬТАТЫ
Липидные микродомены в клетках Jurkat оценивали по уровню флуоресцентного свечения конъюгата FITC-CTB, который селективно связывается с ганглиозидом GM1 (одним из маркерных компонентов рафтов). Oкраска ганглиозида GM1 выявила участки интенсивного свечения на плазматической мембране Т-клетках линии Jurkat (рис. 1а, в).
Рис. 1.
Распределение кальциевых каналов TRPV5 в контрольных и обработанных МбЦД Т-клетках Jurkat, полученное с помощью иммунофлуоресценции. Представлены изображения клеток (слева направо): в проходящем свете, зелёная флуоресценция FITC-CTB (маркер липидных рафтов), красная флуоресценция TRPV5, окрашенных антителами, меченными Cy3, и совмещение изображений. Шкала – 10 мкм. Внизу гистограмма распределения интенсивности флуоресценции (ИФ) на мембране и в цитоплазме клеток до и после экстракции холестерина с помощью МбЦД соответственно. Сканирование вдоль диаметра клетки. Видно, что ИФ, соответствующая ганглиозиду GM1 и каналам TRPV5, после обработки клеток МбЦД существенно уменьшается на мембране клеток, а ИФ, соответствующая TRPV5, увеличивается в цитозоле.
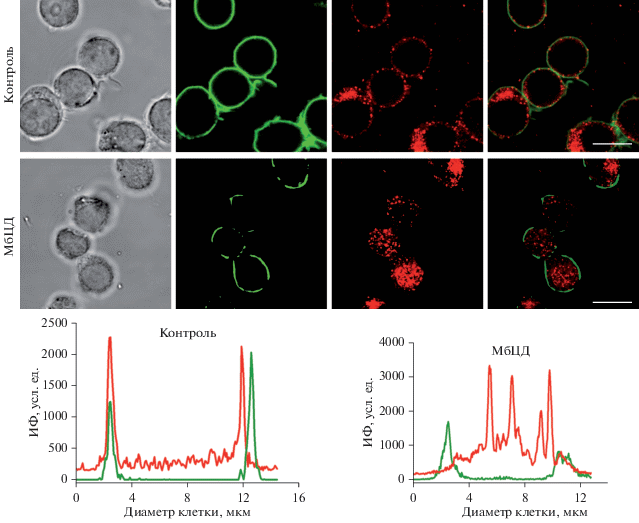
Локализацию каналов TRPV5 в клетках исследовали с помощью иммунофлуоресцентного окрашивания специфическими антителами против TRPV5 (как указано в разделе “Материал и методика”). Как представлено на рис. 1 иммунореактивность TRPV5 была в основном сосредоточена на плазматической мембране, а также частично присутствовала во внутриклеточном пространстве клеток. Для экстракции мембранного холестерина и деструкции липидных рафтов использовали акцептор холестерина МбЦД. Инкубация клеток с 1% МбЦД не изменила морфологию Т-клеток (рис. 1), но значительно снизила окрашивание плазматической мембраны по сравнению с контрольными клетками. В клетках, обработанных деструктором липидных рафтов, наблюдали более диффузное распределение каналов TRPV5 чем в контрольных клетках (рис. 1). Как показали результаты, истощение мембранного холестерина привело к значительному снижению интенсивности флуоресцентного сигнала на мембране клеток, окрашенных с использованием анти-TRPV6 антител, но в то же время увеличило сигнал от антител, находящихся внутри клеток (рис. 1).
Визуализация дискретных белков методом иммунофлуоресценции является трудно разрешимым вопросом, учитывая их небольшой размер. Поэтому, чтобы преодолеть дифракционный предел световой микроскопии и анализировать пространственное распределение белков TRPV5 в T-клетках лейкемии человека использовали электронный микроскоп. Для электронно-микроскопического анализа предварительно обработанные МбЦД и контрольные клетки были инкубированы с антителами против TRPV5, и вторичными антителами, конъюгированными с золотом (как указано в разделе “Материал и методика”). Анализ изображений показал, что часть частиц коллоидного золота (10 нм) индивидуально распределена по клеточной мембране, тогда как другие находятся в кластерах размером около 50–100 нм в непосредственной близости от плазматической мембраны (рис. 2, I). Наличие скоплений частиц золота предполагает высокую локальную концентрацию молекул TRPV5, что согласуется с нашими электрофизиологическими (Vassilieva et al., 2013) и иммунофлуоресцентными данными, которые выявили кластеризацию каналов TRPV5 в плазматической мембране клеток (рис. 1). Очень важно, что распределение золотых частиц различалось в контрольных клетках и обработанных MбЦД. Фактически маркировка золотом наблюдалась и в плазматической мембране, и в цитозоле контрольных клеток (рис. 2, I). Однако после истощения мембранного холестерина с помощью MбЦД, частицы золота редко обнаруживались на плазматической мембране клеток. Более того, локальных скоплений частиц золота, метящих TRPV5, в виде кластеров практически не наблюдали в плазматической мембране клеток, обработанных MбЦД (рис. 2, I).
Рис. 2.
Микрофотографии локализации каналов TRPV5 в клетках Jurkat (I) и их мембранных фрагментах (II) в контроле и после действия МбЦД. По данным иммуноэлектронной микроскопии. Каналы маркированы специфическими антителами, коньюгированными с частицами коллоидного золота (10 нм). Участки с частицами золота (стрелки) выделены рамкой (I) или овалом (II). В контрольных клетках частицы золота локализованы в кластерах на плазматической мембране, после экстракции холестерина частицы диффузно распределены в клетках (стрелка). На гистограмме (справа) – число частиц золота в контроле и после действия МбЦД; вертикальные отрезки – ошибка среднего, различия достоверны при P < 0.05.
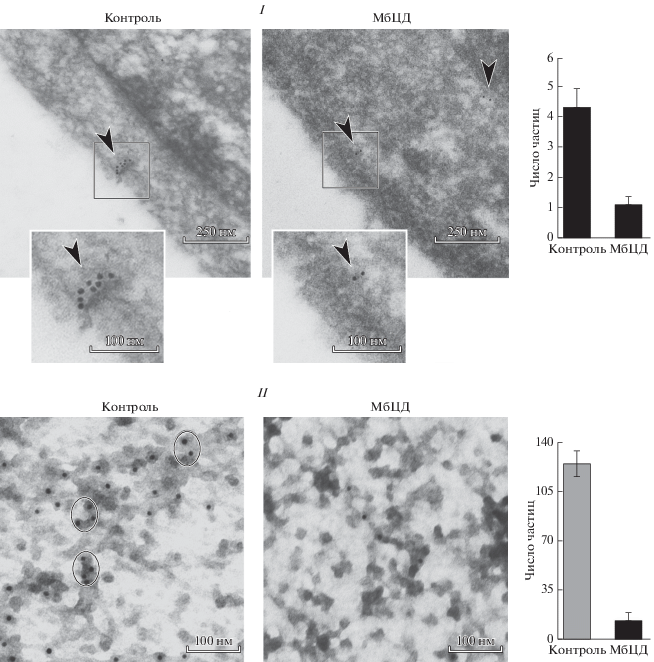
Чтобы получить дополнительные данные относительно мембранного распределения каналов TRPV5 в контрольных клетках и клетках с пониженным содержанием холестерина, мы модифицировали метод изоляции фрагментов плазматической мембраны клеток на никелевых сетках (Sanan, Anderson, 1991). Для этой цели клетки, закрепленные, с одной стороны, на никелевой сетке, а с другой – на покровным стекле, быстро разрывали резким отведением покровного стекла (см. раздел “Материал и методика”). Цитоплазму с внутриклеточным содержимым отмывали, а мембранные фрагменты обрабатывали антителами и далее анализировали с помощью электронного микроскопа.
Распределение частиц золота, маркирующих TRPV5, в контрольных клетках проиллюстрировано в виде микрофотографий и количественно представлено на рис. 2, II. Микрофотография показывает, что частицы золота, маркирующие TRPV5, распределены по одиночке или в виде небольших рассеянных кластеров, которые редко превышают диаметр 100 нм (размер шкалы на рис. 2, II). Среднее число частиц золота, метящих TRPV5 (посчитанных вручную), в контрольных клетках, составило 124.9 ± 9.0 (n = 12) (рис. 2, II). Примерно половина частиц золота распределялась диффузно, а остальные находились в кластерах, которые чаще всего содержали 2–4 частицы, реже – до 10 частиц (рис. 2, II). После экстракции мембранного холестерина с помощью МбЦД в плазматической мембране клеток наблюдали почти 10-кратное снижение числа золотых частиц (13.0 ± 0.88, n = 11), которые диффузно распределялись по мембране (рис. 2, II). Важно отметить, что в клетках, обработанных МбЦД, скоплений золотых частиц в виде кластеров практически не обнаруживали.
ОБСУЖДЕНИЕ
Избирательная ассоциация ряда ионных каналов с определенными липидами плазматической мембраны и липидными рафтами критически необходима для регуляции их активности. В настоящей работе установлена взаимосвязь между локализацией кальциевых каналов TRPV5 в плазматической мембране Т-клеток лейкемии человека и целостностью липидных рафтов. С помощью иммунофлуоресценции и иммуноэлектронной микроскопии показана колокализация каналов с липидными рафтами. Экстракция мембранного холестерина приводила к деструкции липидных рафтов и диффузному распределению каналов в цитоплазме клеток. Полученные результаты указывают на то, что холестерин критически необходим для локализации каналов TRPV5 в плазматической мембране Т-клеток линии Jurkat. Более того, обнаруженное объединение каналов в кластеры указывает на важную роль липидных рафтов в регуляции активности каналов. Липиды мембранных рафтов могут оказывать влияние на активность канала либо посредством прямых белково-липидных взаимодействий, либо путем воздействия на физические свойства двухслойной мембраны (Martens et al., 2000; Hering et al., 2003). Кроме того, рафты, по-видимому, могут избирательно рекрутировать нужные сигнальные молекулы для эффективной и избирательной передачи сигнала. Прямое взаимодействие с рафт-ассоциированными белками, такими, как кавеолин, также может влиять на функции канала, изменяя ионную проводимость, или влияя на транспорт каналов и их экспозицию в плазматической мембране.
Ряд исследований показал, что модуляторами каналов TRP могут быть также липиды различных метаболических путей, включая метаболиты циклооксигеназы, липоксигеназы, фосфолипидов и лизофосфолипидов (Szallasi, Blumberg, 2007; Bang et al., 2010). Кроме того, на функции ионных каналов могут влиять сигнальные белки, которые накапливаются в липидных рафтах. Так, в липидных рафтах был обнаружен ряд рецепторов, связанных с G-белками, различные классы G-белков, аденилатциклаза, протеинкиназа C, синтаза оксида азота, тирозинкиназы, белки Ras, и митоген-активированные протеинкиназы и др. (Patel et al., 2008).
Согласно полученным результатам, липидные рафты регулируют активность каналов TRPV5 в Т-клетках человека, по-видимому, влияя на их локализацию и плотность в плазматической мембране. Полученные данные являются исключительно актуальными, поскольку известна ключевая роль липидных рафтов в рецепторной сигнализации и активации лимфоцитов (Montixi et al., 1998; Xavier et al., 1998; Zhang et al., 1998; Ilangumaran et al., 1999). На Т-клетках было продемонстрировано участие липидных рафтов в ранних стадиях стимуляции Т-клеточного рецептора (Schade, Levine, 2002). Существуют доказательства участия липидных рафтов в аутоиммунитете. Некоторые исследования свидетельствую о корреляции между уровнем липидов, формирующих липидные рафты, и регулированием иммунной системы (Jury et al., 2007). Есть данные, что сигнальные процессы в липидных микродоменах Т-клеток здоровых людей и пациентов с такими аутоиммунными заболеваниями, как системная красная волчанка и ревматоидный артрит, имеют серьезные различия (Jury et al., 2004, 2007).
Мы предполагаем, что сигнальные платформы, образуемые липидными рафтами в Т-клетках, могут рекрутировать наряду с сигнальными белками и кальциевые каналы TRPV5, чтобы обеспечить локальное повышение кальция для выполнения множества сигнальных функций, включая фосфорилирование белков.
Список литературы
Bang S., Yoo S., Oh U., Hwang S.W. 2010. Endogenous lipid-derived ligands for sensory TRP ion channels and their pain modulation. Arch. Pharm. Res. V. 33. P. 1509.
Barbuti A., Gravante B., Riolfo M., Milanesi R., Terragni B., DiFrancesco D. 2004. Localization of pacemaker channels in lipid rafts regulates channel kinetics. Circ Res. V. 94. P. 1325–1331.
Clapham D.E. 2003. TRP channels as cellular sensors. Nature. V. 426. P. 517–524.
Fernandes E.S., Fernandes M.A., Keeble J.E. 2012. The functions of TRPA1 and TRPV1: moving away from sensory nerves. Br. J. Pharmacol. V. 166. P. 510–521.
Flockerzi V. 2007. An introduction on TRP channels. Handb. Exp. Pharmacol. V. 179. P. 1–19.
Heino S., Lusa S., Somerharju P., Ehnholm C., Olkkonen V.M., Ikonen E. 2000. Dissecting the role of the golgi complex and lipid rafts in biosynthetic transport of cholesterol to the cell surface. Proc. Natl. Acad. Sci. USA. V. 97. P. 8375–8380.
Hering H., Lin C.C., Sheng M. 2003. Lipid rafts in the maintenance of synapses, dendritic spines, and surface AMPA receptor stability. J. Neurosci. V. 23. P. 3262–3271.
Hoenderop J.G., Vennekens R., Müller D., Prenen J., Droogmans G., Bindels R.J., Nilius B. 2001. Function and expression of the epithelial Ca(2+) channel family: comparison of mammalian ECaC1 and 2. J. Physiol. V. 537. P. 747–761.
Hoenderop JGJ, Nilius B, Bindels RJM. 2002. Molecular mechanism of active Ca2+ reabsorption in the distal nephron. Annu. Rev. Physiol. V. 64. P. 529–549.
Ilangumaran S., Arni S., van Echten-Deckert G., Borisch B., Hoessli D.C. 1999. Microdomain-dependent regulation of Lck and Fyn protein-tyrosine kinases in T lymphocyte plasma membranes. Mol. Biol. Cell. V. 10. P. 891–905.
Jury E.C., Fabian Flores-Borja F., Kabouridis P.S. 2007. Lipid rafts in T cell signalling and disease. Semin. Cell Dev. Biol. V. 18. P. 608–615.
Jury E.C., Kabouridis P.S., Flores-Borja F., Mageed R.A., Isenberg D.A. 2004. Altered lipid raft-associated signaling and ganglioside expression in T lymphocytes from patients with systemic lupus erythematosus. J. Clin. Invest. V. 113. P. 1176–1187.
Kever L., Cherezova A., Zenin V., Negulyaev Yu., Komissarchik Y., Semenova S. 2019. Downregulation of TRPV6 channel activity by cholesterol depletion in Jurkat T cell line. Cell Biol. Int. V. 43. P. 965–975.
Kilsdonk E.P., Yancey P.G., Stoudt G.W., Bangerter F.W., Johnson W.J., Phillips M.C., Rothblat G.H. 1995. Cellular cholesterol efflux mediated by cyclodextrins. J. Biol. Chem. V. 270. P. 17250–17256.
Kobayashi A., Takanezawa Y., Hirata T., Shimizu Y., Misasa K., Kioka N., Arai H., Ueda K., Matsuo M. 2006. Efflux of sphingomyelin, cholesterol, and phosphatidylcholine by ABCG1. J. Lipid Res. V. 47. P. 1791–1802.
Levitan I., Christian A.E., Tulenko T.N., Rothblat G.H. 2000. Membrane cholesterol content modulates activation of volume-regulated anion current in bovine endothelial cells. J. Gen. Physiol. V. 115. P. 405–416.
Liu M., Huang W., Wu D., Priestley J.V. 2006. TRPV1, but not P2X, requires cholesterol for its function and membrane expression in rat nociceptors. Eur. J. Neurosci. V. 24. P. 1–6.
Lundbaek J.A., Andersen O.S., Werge T., Nielsen C. 2003. Cholesterol-induced protein sorting: an analysis of energetic feasibility. Biophys. J. V. 84. P. 2080–2090.
Martens J.R., Navarro-Polanco R., Coppock E.A., Nishiyama A., Parshley L., Grobaski T.D., Tamkun M.M. 2000. Differential targeting of Shaker-like potassium channels to lipid rafts. J. Biol. Chem. V. 275. P. 7443–7446.
Montell C., Birnbaumer L., Flockerzi V. 2002. The TRP channels, a remarkably functional family. Cell. V. 108. P. 595–598.
Montixi C., Langlet C., Bernard A.M., Thimonier J., Dubois C, Wurbel M.A., Chauvin J.P., Pierres M., He H.T. 1998. Engagement of T cell receptor triggers its recruitment to low-density detergent-insoluble membrane domains. Eur. Mol. Biol. Organ. J. V. 17. P. 5334–5348.
Morenilla-Palao C., Pertusa M., Meseguer V., Cabedo H., Viana F. 2009. Lipid raft segregation modulates TRPM8 channel activity. J. Biol. Chem. V. 284. P. 9215–9224.
Nijenhuis T., Hoenderop J.G.J., Nilius B., Bindels R.J.M. 2003. (Patho)physiological implications of the novel epithelial Ca2+ channels TRPV5 and TRPV6. Pflugers Arch. V. 446. P. 401–409.
Nilius B. 2007. TRP channels in disease. Biochim. Biophys. Acta. V. 1772. P. 805–812.
Patel H.H., Murray F., Insel P.A. 2008. G-protein-coupled receptor-signaling components in membrane raft and caveolae microdomains. Handb. Exp. Pharmacol. V. 186. P. 167–184.
Peng J.B., Hediger M.A. 2002. A family of calcium-permeable channels in the kidney: distinct roles in renal calcium handling. Curr. Opin. Nephrol. Hypertens. V. 11. P. 555–561.
Pizzo P., Viola A. 2003. Lymphocyte lipid rafts: structure and function. Curr. Opin. in Immun. V. 15. P. 255–260.
Pucadyil T.J., Chattopadhyay A. 2004. Cholesterol modulates ligand binding and G-protein coupling to serotonin(1A) receptors from bovine hippocampus. Biochim. Biophys. Acta. V. 1663. P. 188–200.
Sanan D.A., Anderson R.G. 1991. Simultaneous visualization of LDL receptor distribution and clathrin lattices on membranes torn from the upper surface of cultured cells. J. Histochem. Cytochem. V. 39. P. 1017–1024.
Schade A.E., Levine A.D. 2002. Lipid Raft Heterogeneity in Human Peripheral Blood T Lymphoblasts: A Mechanism for Regulating the Initiation of TCR Signal Transduction. J. Immunol. V. 168. P. 2233–22397.
Schengrund C.L. 2010. Lipid rafts: keys to neurodegeneration. Brain. Res. Bull. V. 29. P. 7–17.
Sheng R., Chen Y., Yung Gee H., Stec E., Melowic H.R., Blatner N.R., Tun M.P., KimY., Källberg M., Fujiwara T.K., Hong J.H., Kim K.P., Lu H., Kusumi A., Lee M.G., Cho W. 2012. Cholesterol modulates cell signaling and protein networking by specifically interacting with PDZ domain-containing scaffold proteins. Nat. Commun. V. 3. P. 1249.
Simons K., Toomre D. (2000). Lipid rafts and signal transduction. Nature Rev. V. 1. P. 31–39.
Slimane T.A., Lenoir C., Bello V., Delaunay J.L., Goding J.W., Chwetzoff S., Maurice M., Fransen J.A., Trugnan G. 2001. The cytoplasmic/transmembrane domain of dipeptidyl peptidase IV, a type II glycoprotein, contains an apical targeting signal that does not specifically interact with lipid rafts. Exp. Cell Res. V. 270. P. 45–55.
Szallasi A., Blumberg P.M. 2007. Complex Regulation of TRPV1 by Vanilloids. Frontiers in Neuroscience. TRP Ion Channel Function in Sensory Transduction and Cellular Signaling Cascades. Boca Raton (FL): CRC Press/Taylor & Francis; Chapter 6.
Szoke E., Börzsei R., Toth D.M., Leng O., Helyes Z., Sándor Z., Szolcsányi J. 2010. Effect of lipid raft disruption on TRPV1 receptor activation of trigeminal sensory neurons and transfected cell line. Eur. J. Pharmacol. V. 628. P. 67–74.
Vassilieva I.O., Tomilin V.N., Marakhova I.I., Shatrova A.N., Negulyaev Y.A., Semenova S.B. 2013. Expression of Transient Receptor Potential Vanilloid Channels TRPV5 and TRPV6 in Human Blood Lymphocytes and Jurkat Leukemia T Cells. J. Membr. Biol. V. 246. P. 131–140.
Vennekens R., Menigoz A., Nilius B. 2012. TRPs in the Brain. Rev. Physiol. Biochem. Pharmacol. V. 163. P. 27–64.
Xavier R., Brennan T., Li Q., McCormack C., Seed B. 1998. Membrane compartmentation is required for efficient T cell activation. Immunity. V. 8. P. 723–732.
Yeagle P.L. 1985. Cholesterol and the cell membrane. Biochim. Biophys. Acta. V. 822. P. 267–287.
Zhang W., Trible R.P., Samelson L.E. 1998. LAT palymitoylation: it’s essential role in membrane microdomain targeting and tyrosine phosphorylation during T cell activation. Immunity. V. 9. P. 239–246.
Дополнительные материалы отсутствуют.


