Цитология, 2020, T. 62, № 3, стр. 181-188
Изменения уровня деубиквитиназы Usp28 в клеточном цикле клеток аденокарциномы кишечника НСТ116 свидетельствуют о ее функциональной роли в регуляции перехода G1/S
В. М. Рябов 1, Е. Н. Петрова 1, Б. В. Попов 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
Поступила в редакцию 19.11.2019
После доработки 02.12.2019
Принята к публикации 05.12.2019
Аннотация
Usp28 является деубиквитинирующим ферментом, удаляющим убиквитин из его конъюгатов с субстратами, что предотвращает их деградацию в протеасомах. Современные публикации показывают, что Usp28 и убиквитиновая лигаза Fbw7 создают функциональную пару белков, которая контролирует опосредованную убиквитином деградацию ключевых регуляторов клеточных функций, включая Myc, Jun, Nicd, Hif1. В этой паре белков Usp28 противодействует деструктивной активности Fbw7 и играет роль фактора, способствующего опухолевому росту. Поскольку установленными мишенями Usp28 являются белки Myc и Jun, связанные с клеточным циклом, мы предположили, что Usp28 регулирует деление клеток, и ее уровень может изменяться в ходе клеточного цикла. Целью настоящей работы была оценка изменений уровня Usp28 в ходе клеточного цикла в клетках карциномы кишечника человека НСТ116. Клетки НСТ116 синхронизировали путем 72-часового культивирования в ростовой среде с низким содержанием сыворотки. В асинхронно делящихся клетках уровень Usp28 был невысоким и его локализация выявлялась как ядерно-цитоплазматическая. Общий уровень Usp28 и степень его ядерной локализации возрастали в клетках от состояния асинхронного роста к поздней фазе G1 с последующим снижением и обратным перераспределением белка из ядра в цитоплазму после завершения фазы G1. По данным иммуноблотинга колебания уровней Usp28 и фосфатазы Cdc25A в синхронизированных клетках НСТ116 в клеточном цикле совпадали. Данные иммунофлюоресценции прямо соответствовали результатам иммуноблотинга. Полученные результаты дают возможность предположить, что Usp28 может регулировать уровень и функциональную активность белка Cdc25A, контролирующего вход клетки в фазу репликации ДНК.
Usp28 является белком с мол. массой 140 кДа, который принадлежит к семейству деубиквитинирующих ферментов, удаляющих убиквитин с субстратов и отменяющих активность убиквитиновой лигазы и последующую деградацию субстратов в протеасомах (Amerik et al., 2004). Современные исследования показывают, что Usp28 и убиквитиновая лигаза Fbw7 формируют функциональную пару белков, которая контролирует опосредованную убиквитином деградацию нескольких ключевых регуляторов клеточных функций, включая Myc, Jun, Nicd, Hif1. Деградация этих субстратов с помощью Fbw7 предотвращается деубиквитиназой Usp28 (Popov et al., 2007; Flugel et al., 2012; Diefenbacher et al., 2014). В нормальных условиях Usp28 формирует комплекс с Fbw7 и препятствует убиквитинированию субстратов. В этой паре Usp28 противодействует деструктивной активности Fbw7 и играет роль фактора, способствующего росту опухоли (Popov et al., 2007; Diefenbacher et al., 2014, 2015).
Белковая протеаза Usp28 была открыта при анализе состава комплексов, формирующихся путем физического взаимодействия с р53-связывающим белком (53ВР) в ходе ответа на повреждение, вызванного двойными разрывами ДНК (Zhang et al., 2006). Usp28 опосредует стабилизацию Chk2, 53BP и индукцию апоптоза в клетках карциномы человека линии Н-460 и мышиных В-клетках с индуцированным ответом на повреждение ДНК. Потеря Usp28 повышает устойчивость клеток к апоптозу, вызванному ультрафиолетовым или рентгеновским облучением, и делает их похожими на мышиные клетки, которые не экспрессируют Chk2 и р53 (Zhang et al., 2006). Ответ на повреждение ДНК включает, в качестве одного из ключевых механизмов, остановку клеточного цикла, которая вызывается путем деградации фосфатазы Cdc25A, формирующей контрольную точку клеточного цикла G1/S, опосредованную инактивацией комплекса Cdk2/циклин Е (Busino et al., 2003; Jin et al., 2003). В ответ на повреждение ДНК Cdc25A полиубиквитинируется и деградирует, тогда как обработка клеток протеасомным ингибитором LLnL немедленно после ультрафиолетового облучения предотвращает снижение уровня фосфатазы Cdc25A (Jin et al., 2003).
Функциональная активность онкопротеина Myc связана с регуляцией клеточного деления, роста и апоптоза. Уровень Myc снижается при повреждении ДНК, что вызывается его протеасомной деградацией, опосредованной убиквитиновой лигазой Fbw7, которая в условиях повреждения ДНК теряет связь с Usp28 и вызывает полиубиквитинирование белка Myc, служащее сигналом для его деградации (Popov et al., 2007). MYC относится к генам немедленного раннего ответа на индукцию пролиферации митогенами (Waters et al., 1991). Экспрессия Myc в покоящихся клетках достаточна для их входа в клеточный цикл, тогда как торможение его экспрессии в делящихся клетках является причиной их выхода из клеточного цикла (Kaczmarek et al., 1985). К числу генов-мишеней фактора Myc, которые регулируют G1/S переход, относятся гены циклинов D2 и E1, фосфатазы CDC25A, а также факторов E2F1, E2F3 (Meyer et al., 2008). Названные гены содержат в промоторной области сайт связывания с белком Myc, который опосредует их транскрипционную активацию (Adams et al., 2000; Perna et al., 2012).
Цель настоящей работы заключалась в оценке уровней Usp28 и Cdc25A в ходе клеточного цикла в синхронизированных клетах аденокарциномы кишечника человека HCT116. Клетки НСТ116 синхронизировали с помощью 72-часового культивирования в среде с низким содержанием сыворотки (0.15%) и затем рестимулировали с помощью замены ростовой среды на полную, содержащую 10% сыворотки. Эффективность синхронизации определяли с помощью проточной цитометрии асинхронно делящихся, покоящихся и стимулированных клеток через 0, 6, 12, и 18 ч после рестимуляции. Уровень Usp28 и Cdc25A оценивали в те же временные промежутки, используя иммуноблотинг и иммунофлюоресценцию. Результаты наших экспериментов показали, что в клеточном цикле происходят изменения компартментализации и уровня деубиквитиназы Usp28, прямо соответствующие в иммуноблотинге связанным с клеточным циклом колебаниям уровня Cdc25A. Эти данные дают возможность предположить, что Usp28 может регулировать уровень и функциональную активность фосфатазы Cdc25A, которая формирует механизм контрольной точки в фазе G1 клеточного цикла.
МАТЕРИАЛ И МЕТОДИКА
Клеточные линии и культивирование клеток. В ра-боте использовали клетки кишечной аденокарциномы человека HCT116, любезно предоставленные д-ром Н.А. Барлевым (Институт цитологии РАН). Клетки культивировали в пластиковой культуральной посуде в модифицированной Дульбекко среде Игла (DMEM; Gibco, США), содержащей 50 мкг/мл пенициллина и стрептомицина (БиолоТ, Россия), 10% эмбриональной бычьей сыворотки (ФБС; Gibco, США) в СО2-инкубаторе при 6% CO2, 37°С, и влажности 100%. При достижении клетками высокой плотности (80%) проводили пересев культуры, для чего удаляли питательную среду и дважды промывали клетки раствором PBS (БиолоТ, Россия). Для отделения клеток от пластиковой поверхности использовали смесь 0.25%-ного раствора трипсина с Версеном в соотношении 1 : 1 (БиолоТ, Россия). Клетки инкубировали с данным раствором в термостате в течение 5 мин, затем их тщательно ресуспендировали и переносили в новую чашку, нейтрализуя трипсин ростовой средой с 10% ФБС. Суспензию объемом 15 мкл помещали в камеру Горяева для подсчета клеток под микроскопом. Для длительного хранения клетки ресуспендировали в 10%-ном растворе криопротектора ДМСО (Helicon, Россия) в DMEM, содержащей 10% ФБС, переносили в криовиалы и замораживали в жидком азоте.
Синхронизация клеток в клеточном цикле и проточная цитометрия. НСТ116 клетки культивировали для асинхронного роста плотностью 50–70% в 60 мм культуральных чашках, содержащих 9 мм покровные стекла (Биовитрум, Россия). Для синхронизации в клеточном цикле клетки в чашках дважды промывали PBS и культивировали в течение 72 ч в условиях голодания (в среде DMEM, содержащей 0.15% ФБС). Для активации роста клетки рестимулировали с помощью замены в культуральных чашках среды с низким содержанием сыворотки на полную, содержащую 10% ФБС. Покровные стекла с распластанными на них клетками и соответствующие клеточные осадки собирали через 0, 6, 12, и 18 ч после начала рестимуляции полной ростовой средой. Для анализа клеточного цикла путем проточной цитометрии клетки в различных точках после рестимуляции дважды промывали PBS, трипсинизировали, удаляли трипсин путем ресуспендирования в 10 мл PBS и центрифугирования при 200 g в течение 5 мин. Для окраски ядер клетки ресуспендировали в PBS, содержащем 200 мкг/мл сапонина, 50 мкг/мл йодистого пропидия, 250 мкг/мл РНКазы А (Thermo Fisher Scientific, CША), 1% бычьего сывороточного альбумина (БСА) (Amresco, США) и инкубировали 1 ч при комнатной температуре. Цитометрический анализ проводили на проточном цитометре CytoFLEX (Beckman COULTER, CША); для возбуждения и регистрации флюоресценции применяли фильтры 488 и 585–690 нм соответственно.
Денатурирующий электрофорез белков в полиакриламидном геле (ПAAГ) в присутствии додецилсульфата натрия (SDS). Для приготовления экстрактов асинхронно растущие в 100 мм культуральных чашках клетки промывали дважды PBS, отделяли от пластика при помощи специального скребка, осаждали центрифугированием (4000 g, 2 мин), инкубировали в течение 30 мин на льду в 3-х объемах лизирующего раствора, содержащего 50 мМ Трис-HCl (pH 8.0), 150 мМ NaCl, 1% NP-40, 0.1% SDS, 0.1 мМ PMSF, коктейль ингибиторов протеаз (Sigma, США) в разведении 1 : 100. Экстракты клеток центрифугировали 15 мин при 14 000 g, 4°С, супернатанты хранили при −80°С и использовали для последующих экспериментов. Концентрацию белка в экстрактах определяли методом Брэдфорд. Для этого к 100 мкл смеси компонентов коммерческого набора Pierce BCA Protein Assay Kit (Thermo Fisher Scientific, США) добавляли 2 мкл пробы белкового экстракта, смесь инкубировали при 37°С 30 мин, и определяли оптическую плотность при 562 нм на спектрофотометре NanoDrop ND 1000 (CША) в объеме 2 мкл. Концентрацию белка рассчитывали по калибровочной кривой, построенной по результатам измерений оптических плотностей образцов с известной концентрацией БСА. Выравнивали количество белка во всех пробах, добавляя соответствующее количество четырехкратного загрузочного буфера (4% SDS, 20% глицерина, 200 мМ дитиотреитола, 120 мМ Трис-HCl (рН 6.8), 0.002% бромфенолового синего) и инкубировали образцы при 95°С 5 мин. Пробу, содержащую 30–45 мкг общеклеточного белка, наносили на одну дорожку ПААГ. Электрофорез проводили в 10%-ном ПААГ с SDS при силе тока 30 мА на один гель. В качестве маркеров мол. массы на одну из дорожек наносили 3 мкл раствора белковых стандартов мол. массы (Thermo Fisher Scientific, США).
Иммуноблотинг. Электрофоретически разделенные белки переносили с геля на мембрану PVDF (Thermo Fisher Scientific, США) при помощи полусухого электропереноса. Перед этим мембрану помещали в метанол на 1 мин, обрабатывали буфером для переноса (48 мМ Трис, 39 мМ глицин, 10% метанол, 0.03% SDS). Гель с белками после электрофореза помещали на мембрану PVDF, сверху и снизу накрывали фильтровальной бумагой, смоченной буфером для переноса, и помещали в камеру Hoefer Semiphor TE 77 (Hoefer, Швеция). Электроперенос белков проводили при силе тока 90 мА в течение 1 ч. Далее производили блокировку сайтов неспецифического связывания обезжиренным 5%-ным молоком, разведенным в буфере TBST (150 мМ NaCl, 10 мМ Трис-HCl (pH 8.0), 0.05% Tween 20) в течение 1 ч. После этого мембрану отмывали в TBST (5 раз по 5 мин) и обрабатывали первыми антителами в течение ночи при 4°С, затем вторыми антителами в течение 2 ч при комнатной температуре. Антитела разводили в блокирующем растворе в соответствии с рекомендациями производителей. В качестве вторых антител использовали видоспецифические антитела, конъюгированные с пероксидазой хрена, которую визуализировали на мембране c помощью коммерческого набора реактивов Clarity Western ECL Substrate (BioRad, США). Изображения препаратов, активированных с помощью хемилюминесценции, получали на приборе ChemiDoc Touch Imaging System (BioRad, США).
Иммунофлюоресцентное окрашивание. Круглые покровные стекла диаметром 9 мм (Биовитрум, Россия) с клетками, распластанными при росте в культуре, переносили в пластиковые 35 мм чашки, однократно отмывали PBS 5 мин, фиксировали 4%-ным параформальдегидом 45 мин, обрабатывали 0.2%-ным детергентом Тритоном X-100 10 мин, промывали PBS 2 раза по 5 мин, сайты неспецифического связывания антител блокировали 1 ч раствором, содержащим 3% БСА и 0.1% Твина 20; затем на клетки наносили специфические антитела в разведении 1 : 200 в блокирующем растворе на 1 ч при комнатной температуре, промывали 3 раза по 5 мин PBS, обрабатывали 1 ч при комнатной температуре вторыми антителами, конъюгированными с флюоресцентной меткой, отмывали 3 раза по 5 мин PBS и заключали в среду Аnti-Fade (BioRad, США), уменьшающую неспецифическую флюоресценцию и содержащую краситель DAPI для окраски ДНК. Иммунофлюоресцентные изображения получали на электронном сканирующем конфокальном микроскопе Leica, используя лазеры с длиной волны 405 и 633 нм.
Антитела. В работе использовали следующие антитела: анти-Usp28 (Abcam, CША), анти-Cdc25A (Santa Cruz Biotechnology, CША), любезно предоставленные д-ром Н. Поповым (University of Wuerzburg, Германия); анти-β-актин (клон АС-15, Sigma, США); для иммуноблотинга использовали вторые антитела, конъюгированные с HRP, против Ig кролика (Cell Signaling, США) и против Ig мыши (BioRad, США); для иммунофлюоресценции в качестве вторых антител брали Alexa Fluor® 633 Fab-фрагмент козлиных антител против легких и тяжелых цепей иммуноглобулинов кролика (Invitrogen, США).
Статистический анализ. Статистическую обработку результатов проводили с использованием средней арифметической величины, ее ошибки и критерия Стьюдента (при P = 0.05), посчитанных при помощи программы Microsoft Office Exсel 2010. Уровень Usp28 определяли по соотношению этого белка с актином на одних и тех же электрофоретических блотах. Каждый эксперимент повторяли трижды, проточную цитометрию – дважды. Результаты иммуноблотинга c антителами против Cdc25A и проточной цитометрии не подвергали статистической обработке. Для количественной оценки и сравнения содержания белков на отдельных электрофоретических полосах использовали приложение GelAnalyzer2010.
РЕЗУЛЬТАТЫ
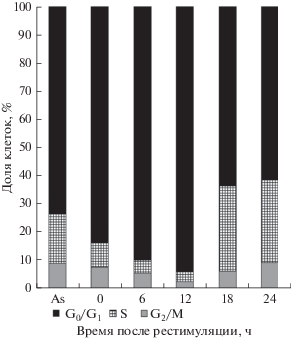
Распределение клеток НСТ116 по фазам клеточного цикла. Цитометрическая оценка показала, что 72-часовое культивирование в условиях голодания (0.15% сыворотки) эффективно синхронизирует клетки в фазах клеточного цикла. При асинхронном росте распределение клеток НСТ116 по фазам клеточного цикла было следующим: G0/G1 – 73.8%, S – 17.4%, G2/M – 8.8%. После культивирования в среде голодания доля клеток в состоянии покоя увеличивалось на 10%, а доля S-фазных клеток уменьшалось вдвое. В ходе фазы G0/G1, которая продолжалась до точки рестимуляции 12 ч (рис. 1), доля покоящихся клеток возрастала до 94.3%, а S-фазных уменьшалось до 3.6% (вдвое). Промежуток времени между 12 и 18 ч после рестимуляции клеток полной ростовой средой соответствовал переходу клеток НСТ116 из фазы G1 в фазу S, после которого доля покоящихся клеток уменьшалась от 94.3 до 63.8%, а доля клеток в S-фазе возрастала от 3.6 до 20.4% (рис. 1).
Рис. 1.
Распределение клеток аденокарциномы кишечника человека НСТ116 по фазам клеточного цикла в синхронизированных клетках. Клетки культивировали 72 ч в условиях голодания (среда, содержащая 0.15% сыворотки), затем рестимулировали путем смены среды голодания на полную, содержащую 10% ФБС. Результаты оценивали с помощью проточной цитометрии в асинхронно делящихся и синхронизированных клетках через каждые 6 ч после рестимуляции сывороткой. As – асинхронно делящиеся клетки; 0, 6, 12, 18, 24 ч ‒ временные точки после рестимуляции сывороткой, в ходе которых производили цитометрическую оценку распределение клеток по фазам клеточного цикла.
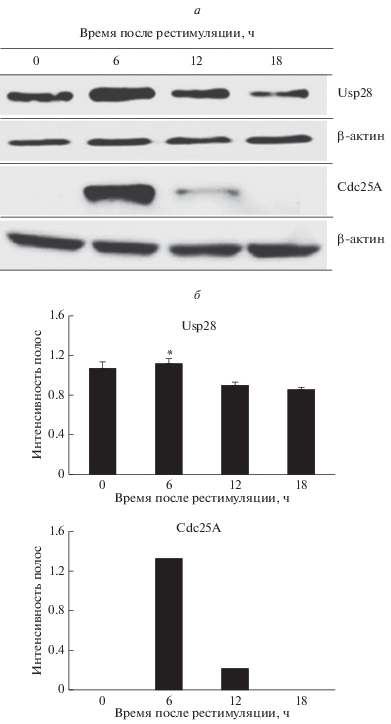
Связанные с клеточным циклом изменения уровней Usp28 и Cdc25A, выявляемые путем иммуноблотинга. В точке 0 ч в синхронизированных клетках HCT116 в иммуноблотинге выявлялось довольно большое количество деубиквитиназы Usp28, затем ее уровень возрастал до максимального значения в точки 6 ч после рестимуляции, которая соответствует поздней фазе G1, после чего уровень белка прогрессивно снижался до минимального значения в точке 18 ч, соответствующей переходу из фазы S в G2/M (рис. 2а). Сравнение уровней Usp28 в точках 6 и 18 ч выявило их достоверные различия (P < 0.05). Изменения уровня Usp28 в ходе клеточного цикла, выявленные с помощью иммуноблотинга, прямо соответствовали колебаниям уровня фосфатазы Cdc25A, который не выявлялся в покоящихся клетках, но далее повышался до максимального уровня в точке 6 ч и резко снижался после завершения фазы G (рис. 2a, б).
Рис. 2.
Изменения уровня убиквитиновой протеазы Usp28 и фосфатазы Сdc25А в экстрактах клеток аденокарциномы кишечника НСТ116, полученных в различных фазах клеточного цикла. Клетки синхронизировали как описано в подписи к рис. 1 . а – Имиджи полос Usp28 и Cdc25A в иммуноблоте. б – Диаграммы количественных изменений Usp28 и Cdc25A (относительно β-актина) в ходе клеточного цикла, полученные на основании данных иммуноблотинга; данные представляют собой средние арифметические значения и их ошибки, звездочка показывает достоверные различия по сравнению с тем же показателем в точке 18 ч, P < 0.05. Экстракты клеток, содержащие 40 мкг общего белка, разделяли в 10%-ном полиакриламидном геле с додецилсульфатом натрия с последующим иммуноблотингом. Распределение клеток по фазам клеточного цикла в указанных временных точках см. на рис. 1 .
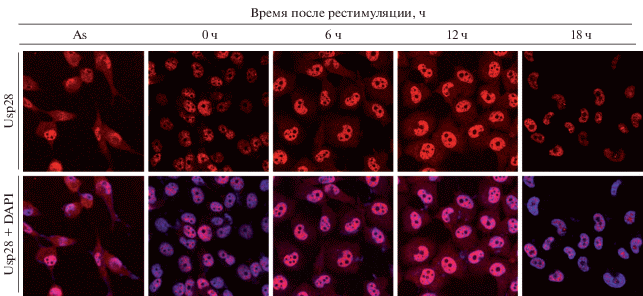
Иммунофлюоресцентная оценка уровня Usp28 в ходе клеточного цикла. Результаты иммунофлюоресцентной оценки уровня протеазы Usp28 в ходе клеточного цикла соответствовали таковым иммуноблотинга. В асинхронно делящихся клетках выявлялось довольно много белка, который локализовался как в ядре, так и в цитоплазме (рис. 3). Уровень Usp28 повышался, а его ядерная локализация возрастала, начиная с клеток в состоянии покоя до точки 12 ч в рестимулированных клетках с последующим снижением уровня продукции белка и его ядерной локализации в точке 18 ч (рис. 3).
Рис. 3.
Иммунофлюоресцентный анализ уровня и локализации Usp28 в клетках аденокарциномы кишечника человека НСТ116, синхронизированных в клеточном цикле в различное время после рестимуляции сывороткой. Имиджи получены на конфокальном сканирующем электронном микроскопе Leica (Германия) с использованием лазеров 405 и 633 нм и объектива 40×. Верхний ряд – имиджи клеток, окрашенных антителами против Usp28, нижний ряд ‒ совмещенные изображения (антитела против Usp28 + DAPI). Обозначения те же, что и на рис. 1 .
ОБСУЖДЕНИЕ
Деубиквитиназа Usp28 участвует в регуляции различных клеточных функций, включая апоптоз, перенос белков через мембрану, прогрессия клеточного цикла, ответ на повреждение ДНК, ремоделирование хроматина, и модуляция передачи сигналов (Komander et al., 2009; Fraile et al., 2012). Вклад Usp28 в регуляцию хода клеточного цикла был выявлен при анализе механизма ответа на повреждение ДНК, при котором клетки прекращают деление. Механистически это связано с опосредованной убиквитином деградацией фосфатазы Cdc25A, контролирующей переход G1 → S. Деградация Cdc25A вызывает остановку клеточного цикла в фазе G1 (Mailand et al., 2000). Уровень Cdc25A возрастает в фазе G1 благодаря действию транскрипционных факторов E2f1 и E2f3. В поздней фазе G1 фосфатаза Cdc25A убиквитинируется и деградирует (Busino et al., 2004). Гены E2F1 и E2F3 являются мишенями транскрипционного фактора c-Myc, поскольку содержат в промоторных областях сайты связывания с-Myc, которые в G1-фазных клетках взаимодействуют с белком c-Myc, индуцирующим их переход в фазу репликации ДНК (Leone et al., 2001). В свою очередь, уровень c-Myc поддерживается, например, при повреждении ДНК (в некоторых экспериментальных модельных системах) и в отдельных тканях, включая тонкий кишечник, с помощью Usp28, которая препятствует деградации этого белка убиквитиновой лигазой Fbw7 (Popov et al., 2007; Diefenbacher et al., 2014). Результаты опубликованных исследований свидетельствуют, что изменения уровня ключевых регуляторных белков клеточного цикла, которые индуцируются белком с-Myc, опосредуются деубиквитиназами. Например, уровень циклина D1 – деубиквитиназой Usp2, циклина А – деубиквитиназой Usp37, а циклина Е – деубиквитиназой Usp27 (Shan et al., 2009; Huang et al., 2011; Dong et al., 2018).
В настоящей работе мы исходили из идеи, что действие Usp28 на Cdc25A, которое выявлено при ответе на повреждение ДНК, может носить более общий характер и распространяться на фазу G1 клеточного цикла, в которой фосфатаза Cdc25A формирует контрольную точку перехода в стадию репликации ДНК. В задачу работы входила оценка изменения уровня Usp28 в ходе клеточного цикла в клетках кишечной аденокарциномы человека НСТ116. Опубликованные работы свидетельствуют, что в ткани тонкого кишечника человека Usp28 стабилизирует уровень белка c-Myc и облегчает развитие опухоли (Diefenbacher et al., 2014). Поскольку, с одной стороны, клетки линии НСТ116 происходят из тонкого кишечника, а с другой, с-Myc выполняет роль индуктора перехода G1 → S, активируя ключевые регуляторные гены циклина D1, CDC25A, E2F1, E2F3, циклина Е, мы предположили, что в клетках этой линии Usp28 может выполнять регуляторную роль в переходе G1 → S, и ее уровень будет изменяться в ходе клеточного цикла подобно тому, как изменяется уровень Usp27, стабилизирующей циклин Е (Dong et al., 2018).
В настоящей работе клетки линии НСТ116 были синхронизированы в клеточном цикле с помощью 72-часового культивирования в условиях голодания. Эффективность синхронизации оценивали с помощью проточной цитометрии, которая позволила установить, что в клетках линии НСТ116 точка 12 ч после рестимуляции ФБС соответствует G1/S-переходу (рис. 1 ). Иммунофлюоресцентно белок Usp28 ясно выявляется в асинхронно делящихся клетках и локализуется как в ядре, так и в цитоплазме (рис. 3). В ходе клеточного цикла от точки 0 ч, соответствующей состоянию покоя, до точки 12 ч, соответствующей G1/S-переходу, уровень Usp28 возрастает, и белок перемещается в ядро. Затем в точке 18 ч, соответствующей переходу из фазы S в фазы G2/M, уровень Usp28 снижается и белок перемещаться в цитоплазму (рис. 3). Результаты иммуноблотинга подтверждают данные иммунофлюоресценции, уровни Usp28 и Cdc25A возрастают в клетках НСТ116 от состояния покоя до G1/S-перехода и затем снижаются (рис. 2а, б).
Полученные нами результаты показывают, что в синхронизированных клетках аденокарциномы кишечника человека линии НСТ116 уровень убиквитинпротеазы Usp28 повышается в поздней фазе G1 и этот белок транслоцируется в ядро. Мы предполагаем, что колебания уровня Usp28, ассоциированные с клеточным циклом, могут быть связаны с ее участием в регуляции активности ее потенциальной мишени – фосфатазы Cdc25A.
Список литературы
Adams M.R., Sears R., Nuckolls F., Leone G., Nevins J.R. 2000. Complex transcriptional regulatory mechanisms control expression of the E2F3 locus. Mol. Cell Biol. V. 20. P. 3633.
Amerik A.Y. Hochstrasser M. 2004. Mechanism and function of deubiquitinating enzymes. Biochim. Biophys. Acta. V. 1695. P. 189.
Busino L., Chiesa M., Draetta G.F., Donzelli M. 2004. Cdc25A phosphatase: combinatorial phosphorylation, ubiquitylation and proteolysis. Oncogene. V. 23. P. 2050.
Busino L., Donzelli M., Chiesa M., Guardavaccaro D., Ganoth D., Dorrello N.V., Hershko A., Pagano M., Draetta G.F. 2003. Degradation of Cdc25A by beta-TrCP during S phase and in response to DNA damage. Nature. V. 426. P. 87.
Diefenbacher M.E., Chakraborty A., Blake S.M., Mitter R., Popov N., Eilers M., Behrens A. 2015. Usp28 counteracts Fbw7 in intestinal homeostasis and cancer. Cancer Res. V. 75. P. 1181.
Diefenbacher M.E., Popov N., Blake S.M., Schülein-Völk C., Nye E., Spencer-Dene B., Jaenicke L.A., Eilers M., Behrens A. 2014. The deubiquitinase USP28 controls intestinal homeostasis and promotes colorectal cancer. J. Clin. Invest. V. 124. P. 3407.
Dong L., Yu L., Bai C., Liu L., Long H., Shi L., Lin Z. 2018. USP27-mediated Cyclin E stabilization drives cell cycle progression and hepatocellular tumorigenesis. Oncogene. V. 37. P. 2702.
Flügel D., Görlach A., Kietzmann T. 2012. GSK-3β regulates cell growth, migration, and angiogenesis via Fbw7 and USP28-dependent degradation of HIF-1α. Blood. V. 119. P. 1292.
Fraile J.M., Quesada V., Rodríguez D., Freije J.M., López-Otín C. 2012. Deubiquitinases in cancer: new functions and therapeutic options. Oncogene. V. 31. P. 2373.
Huang X., Summers M.K., Pham V., Lill J.R., Liu J., Lee G., Kirkpatrick D.S., Jackson P.K., Fang G., Dixit V.M. 2011. Deubiquitinase USP37 is activated by CDK2 to antagonize APC(CDH1) and promote S phase entry. Mol. Cell. V. 42. P. 511.
Jin J., Shirogane T., Xu L., Nalepa G., Qin J., Elledge S.J., Harper J.W. 2003. SCFbeta-TRCP links Chk1 signaling to degradation of the Cdc25A protein phosphatase. Genes Dev. V. 17. P. 3062.
Kaczmarek L., Hyland J.K., Watt R., Rosenberg M., Baserga R. 1985. Microinjected c-myc as a competence factor. Science. V. 228. P. 1313.
Komander D., Clague M. J., Urbé S. 2009. Breaking the chains: structure and function of the deubiquitinases. Nat. Rev. Mol. Cell Biol. V. 10. P. 550.
Leone G., Sears R., Huang E., Rempel R., Nuckolls F., Park C.H., Giangrande P., Wu L., Saavedra H.I., Field S.J, Thompson M.A., Yang H., Fujiwara Y., Greenberg M.E., Orkin S., Smith C., Nevins J.R. 2001. Myc requires distinct E2F activities to induce S phase and apoptosis. Mol. Cell. V. 8. P. 105.
Mailand N., Falck J., Lukas C., Syljuâsen R.G., Welcker M., Bartek J., Lukas J. 2000. Rapid destruction of human Cdc25A in response to DNA damage. Science. V. 288. P. 1425.
Meyer N., Penn L.Z. 2008. Reflecting on 25 years with MYC. Nat. Rev. Cancer. V. 8. P. 976.
Perna D., Fagà G., Verrecchia A., Gorski M.M., Barozzi I., Narang V., Khng J., Lim K.C., Sung W.K., Sanges R., Stupka E., Oskarsson T., Trumpp A., Wei C.L., Müller H., Amati B. 2012. Genome-wide mapping of Myc binding and gene regulation in serum-stimulated fibroblasts. Oncogene. V. 31. P. 1695.
Popov N., Wanzel M., Madiredjo M., Zhang D., Beijersbergen R., Bernards R., Moll R., Elledge S.J., Eilers M. 2007. The ubiquitin-specific protease USP28 is required for MYC stability. Nat. Cell. Biol. V. 9. P. 765.
Shan J., Zhao W., Gu W. 2009. Suppression of cancer cell growth by promoting cyclin D1 degradation. Mol. Cell. V. 36. P. 469.
Waters C.M., Littlewood T.D., Hancock D.C., Moore J.P., Evan G.I. 1991. c-Myc protein expression in untransformed fibroblasts. Oncogene. V. 6. P. 797.
Zhang D., Zaugg K., Mak T.W., Elledge S.J. 2006. A role for the deubiquitinating enzyme USP28 in control of the DNA-damage response. Cell. V. 126. P. 529.
Дополнительные материалы отсутствуют.


