Цитология, 2020, T. 62, № 3, стр. 189-200
Цитотоксическое действие неклассифицированных ротавирусов группы К на культуры клеток T98G и U87MG in vitro
А. О. Ситковская 1, *, С. Ю. Филиппова 1, Е. Ю. Златник 1, С. А. Колпаков 2, Е. П. Колпакова 2, И. В. Межевова 1, Е. С. Бондаренко 1, С. Н. Игнатов 1, И. А. Новикова 1, Э. Е. Росторгуев 1, О. И. Кит 1
1 Ростовский научно-исследовательский онкологический институт Минздрава РФ
344037 Ростов-на-Дону, Россия
2 Ростовский научно-исследовательский институт микробиологии и паразитологии Роспотребнадзора
344000 Ростов-на-Дону, Россия
* E-mail: grankina.anastasia@mail.ru
Поступила в редакцию 16.09.2019
После доработки 03.12.2019
Принята к публикации 06.12.2019
Аннотация
Разработка новых терапевтических решений на основе применения онколитических вирусов является одним из перспективных и интенсивно развивающихся направлений в современной онкологии, в том числе и в области лечения низкодифференцированных глиом. Значительная часть исследований направлена на создание генетически модифицированных улучшенных вариантов известных вирусов с усиленной терапевтической активностью. Однако потенциал естественного многообразия вирусов человека по-прежнему остается не до конца исчерпанным. Ранее в Ростовском институте микробиологии и паразитологии были обнаружены новые штаммы вирусов, описанные впоследствии как ротавирусы группы К, которые показали выраженную противоопухолевую активность на животных с перевиваемым раком яичника крысы. С целью дальнейшего изучения перспектив применения вновь открытой группы ротавирусов в лечении опухолей головного мозга человека в настоящей работе мы предприняли исследование возможности прямого онколотического действия избранных штаммов на культуры глиальных опухолей человека U87MG и T98G in vitro. По результатам теста с МТТ было продемонстрировано наличие дозозависимой цитотоксической активности обоих изученных штаммов, максимально выраженной у штамма № 100 в концентрации 108 частиц/мл при действии на культуру клеток U87MG. Данные о цитотоксической активности изученных штаммов вирусов были подтверждены в тесте на апоптоз с использованием аннексина V, а также наблюдениями морфологических изменений, свидетельствующих в пользу развития дегенеративных изменений в исследуемых культурах клеток под действием ротавирусов группы К.
Давно известно, что вирусы обладают неоднозначным эффектом на канцерогенез и опухолевый рост. У некоторых из них выявлено проонкогенное действие (вирус папилломы человека), у других – онколитическое. Последний аспект интенсивно изучается в различных странах и включает поиск природных и конструирование искусственных вирусов, обладающих противоопухолевыми свойствами.
В настоящее время существует ряд препаратов на основе онколитических вирусов, одобренных в разных странах в качестве противоопухолевых средств: Реолизин (Reolysin, непатогенный изолят на основе немодифицированного штамма T3D ортореовируса человека 3 серотипа для лечения глиом), онкорин (Oncorine, на основе реплицирующегося аденовируса с эффекторным геном р53 дикого типа для лечения больных с назофарингеальными карциномами), ригвир (Rigvir, на основе онкотропного онколитического эховируса для лечения меланомы) (Нетёсов, 2011). Есть положительный опыт применения вакцины на основе вируса болезни Ньюкасла (Кешелава и др., 2014; Ситковская и др. 2018а; Schirrmacher, 2018). Среди вирусных конструкций наибольший интерес привлекает талимоген лагерпарепвек (Talimogene Laherparepvec, или T-VEC) – на основе биоинженерного реплицирующегося штамма HSV1 с эффекторным геном GM–CSF для лечения больных с меланомой (Andtbacka et al., 2015; Габдарахманова, 2017; Heinrich et al., 2017; Marelli et al., 2018).
В литературе также имеются данные об онколитическом действии вирусов семейства Reoviridae (Ситковская и др., 2018б). В одном из клинических испытаний 9 пациентам с глиомами высокой степени злокачественности и метастазами в мозг в неоадьювантном режиме внутривенно вводили реовирус. Было показано успешное инфицирование опухолевых клеток реовирусом (Samson et al., 2018). Введение онколитического вируса усиливало инфильтрацию опухоли цитотоксическими лимфоцитами и стимулировало интратуморальную экспрессию PD-L1, зависимую от интерферона (IFN) I и II типа. В эксперименте на мышах с перевитыми сингенными опухолями головного мозга терапия, основанная на системном введении реовируса и последующей блокаде оси PD-1/PD-L1, увеличивала выживаемость (Samson et al., 2018). Помимо этого, было продемонстрировано, что индуцированные реовирусом провоспалительные противовирусные иммунные ответы могут быть использованы для терапии гепатоцеллюлярной карциномы, ассоциированной с вирусом гепатита С (HCV), а также препятствовать репликации HCV (Samson et al., 2016). Раджани с соавторами (Rajani et al., 2016) наблюдали повышение эффективности терапии подкожной меланомы В16 у мышей при своевременном сочетании реовируса с антителом против PD-1. В этом исследовании был показан прямой онколитический эффект вируса, а также стимуляция эффекторных звеньев иммунной системы и снижение активности Т-регуляторных клеток, являющихся естественными супрессорами иммунного ответа (Rajani, 2016). В другом экспериментальном исследовании, проведенном на мышах, для терапии меланомы В16 применяли реовирус в режиме первичной вакцинации в сочетании с анти-PD-1. Данный подход значительно увеличивал выживаемость мышей при длительном лечении (Ilett et al., 2017). В исследовании противоопухолевой эффективности ингибитора гистондеацетилаз субероилланилида гидроксамовой кислоты (SAHA, также известного как Vorinostat) в сочетании с реолизином (Reolysin), запатентованным штаммом реовируса 3 серотипа (Pelareorep; Oncolytics Biotech Inc), при раке головы и шеи наблюдали инфильтрацию опухоли иммунными клетками, в том числе макрофагами, NK-клетками и CD8+ T-лимфоцитами. Противоопухолевая эффективность подобной комплексной терапии была выше, по сравнению с ее отдельными составляющими, как в случае ксенотрансплантатов опухолей человека, так и сингенных плоскоклеточных опухолей у мышей (Jaime-Ramirez et al., 2017). Описано усиление противоопухолевого действия на резистентные к реовирусу опухолевые клетки при включении в состав реовируса комплекса с катионным реагентом для трансфекции липосом, что способствует эндо-/лизосомальному выходу вируса (Samson et al., 2017).
В Ростовском институте микробиологии и паразитологии в ходе работы по адаптации ротавирусов человека группы А к росту на перевиваемых культурах клеток для применения их в качестве вакцины для детей были обнаружены и выделены штаммы, получившие рабочее название ротавирусы группы К (RVK), которые не относились ни к одной из известных групп ротавирусов человека. Штаммы были охарактеризованы как ротавирусные электронно-микроскопическими, серологическими и генетическими методами (РНК RVK выявлена у детей, больных инфекционными гастроэнтеритами), аттенуированы и в настоящее время являются апатогенными (Колпаков и др., 2014).
Поскольку при введении RVK штамма № 228 крысам с перевитой опухолью яичника было обнаружено угнетение образования асцитной жидкости, высказано предположение о возможном наличии у них противоопухолевого действия непосредственного или опосредованного через стимуляцию иммунной системы. В пользу последнего говорит развитие дальнейшей невосприимчивости животных к данной опухоли (Колпаков и др., 2019).
В совместных экспериментах РНИОИ и РНИ ИМП, проводимых с 2017 г., было показано, что введение RVK штамма № 228 увеличивает продолжительность жизни мышей с перевиваемой меланомой В16/F10 в 1.5–1.8 раза. При этом в опухоли развиваются морфологические изменения, в том числе обширные очаги некроза и дистрофические изменения в клетках (Kolpakov et al, 2019).
По данным литературы вирусы обладают как способностью к прямому онколизу, так и к стимуляции противоопухолевых механизмов иммунитета, для решения вопроса о превалировании одного из этих эффектов было проведено настоящее исследование. В нашей работе модель in vitro предполагала изучение непосредственного онколитического действия исследуемых вирусов на культуры глиом. Среди всех опухолей головного мозга, глиомы составляют около 60%, из которых до 50–70% имеют морфологические признаки низкодифференцированных глиом (High Grade Gliomas III, IV WHO 2016) и наиболее неблагоприятный прогноз. Системное введение противоопухолевых биотерапевтических препаратов при данной патологии не всегда возможно ввиду ограничения, создаваемого гематоэнцефалическим барьером. При этом вирусы, благодаря небольшому размеру, способны преодолевать это препятствие. В литературе описан противоопухолевый эффект вирусов при лечении этих опухолей (Баклаушев и др., 2015).
Целью настоящего исследования являлось изучение возможного онколитического действия ротавирусов группы К на клеточных линиях глиобластом in vitro.
МАТЕРИАЛ И МЕТОДИКА
Культура клеток. Клеточная линия T98G была получена из Коллекции культур клеток позвоночных (КККП) ФГБУН Института цитологии РАН. Клеточная линия U87MG была получена из лаборатории пролиферации клеток Института молекулярной биологии им. В.А. Энгельгардта РАН.
Культуры клеток T98G и U87MG выращивали в культуральных флаконах с площадью поверхности 75 см2 (Biofil, Китай) в 15 мл питательной среды DMEM без пирувата (Gibco, США), с добавлением 10% эмбриональной бычьей сыворотки (Биолот, Россия), 1% раствора смеси пенициллина и стрептомицина (Биолот, Россия), 1% незаменимых аминокислот (NEAA, Biological Industries, Израиль). Посевная доза клеток составляла 4 × 104 кл./см2. Культивирование клеток проводили в инкубаторе Binder (Германия) при 37°C и 5.5% СО2.
Вирусы. В работе были использованы штаммы ротавирусов, ранее выделенные в Ростовском институте микробиологии и паразитологии, получившие рабочее название ротавирусы группы К (RVK). Штаммы были охарактеризованы как ротавирусные с помощью электронно-микроскопических, серологических и генетических методов, аттенуированы и в настоящее время являются апатогенными (Колпаков и др., 2014).
Аттенуацию RVK человека проводили путем многократных пассажей (более 80) на гетерологичной культуре перевиваемых клеток эмбриона свиньи (СПЭВ). Апатогенность аттенуированных штаммов проверяли на белых беспородных мышах и крысятах, вводя им внутримышечно по 0.3 мл и 0.6 мл штаммов RVK соответственно, что составило беспрецедентно огромную величину – 30 мг на 1 г веса для мышей и 15 мг на 1 г веса у крысят. При этом все физиологические показатели, поведение, аппетит, активность и температура тела экспериментальных животных не отличались от таковых у контрольных животных в течение всего срока наблюдения – 30 сут.
Подготовка клеток для морфологического анализа. Клеточные линии T98G и U87MG были пассированы в концентрации 105 клеток/мл на предметные стекла в чашки Петри (диаметр 6 см) в питательной среде DMEM без пирувата и без сыворотки. Через 24 ч из лунки декантировали культуральную среду и добавляли по 100 мкл суспензии вируса в концентрации 108 частиц/мл в питательной среде DMEM без сыворотки, в контрольные лунки вносили равное количество среды без вируса. Через 5 мин в чашки Петри вносили по 2 мл среды для культивирования. Эксперимент повторяли три раза. После 72 ч культивирования при 37°С в атмосфере 5.5% СО2 клетки фиксировали в 4%-ном водном растворе параформальдегида (Sigma, США) в течение 30 мин при комнатной температуре. Далее покровные стекла с фиксированными клетками отмывали в фосфатном буфере, окрашивали в растворе гематоксилина по Гаррисону, обезвоживали в спиртах восходящей концентрации и монтировали на предметные стекла в среде для заключения гистологических препаратов. Клетки анализировали с помощью инвертированного микроскопа Leica DM IL LED.
МТТ-тест. Онколитическое действие RVK штаммов № 100 и № 228 определяли в цитотоксическом тесте с МТТ на двух клеточных линиях глиом U87MG и T98G. Клетки были пассированы на 24-х луночные планшеты (Biofil, Китай) по 1 × 105 клеток на лунку в питательной среде DMEM без пирувата (Gibco, США) и без сыворотки. Через 24 ч в лунки вносили серии кратных разведений вирусов с концентрациями 108, 107, 106 и 105 частиц/мл следующим образом: из лунки декантировали культуральную среду и добавляли по 100 мкл суспензии вируса в питательной среде DMEM без сыворотки, в контрольные лунки вносили равное количество среды без вируса. Через 5 мин, в течение которых происходила адгезия вирусных частиц на поверхности клеток, в лунки вносили по 1 мл культуральной среды. Каждый вариант опыта ставили в 8 повторах. После 72 ч культивирования при 37°С в атмосфере 5.5% СО2 проводили тест с МТТ по стандартной методике. Измерение оптической плотности раствора формазана производили на ИФА-ридере Stat Fax 2100 (Awareness Technology, США) при длине волны 492 нм в трех повторах. Расчет жизнеспособности производили по формуле:
Проточная цитофлуориметрия. В 6-луночные планшеты (Biofil, Китай) пассировали клетки линий U87MG по 2 × 105 клеток на лунку в питательной среде DMEM без пирувата (Gibco, США) и без сыворотки. Через 24 ч в лунки вносили вирусы в серии кратных разведений с концентрациями 108, 107, 106 и 105 частиц/мл, далее, как в МТТ-тесте. После 72 ч культивирования при 37°С в атмосфере 5.5% СО2 проводили анализ на апоптоз. С флакона снимали как прикрепленные, так и неприкрепленные клетки с использованием раствора Версена, при наличии клеточных кластеров они легко распадались на единичные клетки при пипетировании. Количество клеток, находящихся на различных стадиях апоптоза, оценивали на проточном цитофлуориметре FACSCantoII (BD, США) с использованием Annexin V-FITC Apoptosis Detection Kit (BD Pharminogen, США). В процессе апоптоза в клетках происходит транслокация мембранного фосфолипида фосфатидилсерина (PS) с внутренней стороны плазматической мембраны на внешнюю. Аннексин V представляет собой Са2+-зависимый фосфолипид-связывающий протеин, обладающий высокой аффинностью к PS, и связывающийся с мембранами, содержащими PS. Пропидиум йодид (PI) – витальный краситель, позволяющий различать дифференцировки живые и мертвые клетки. Интерпретацию результатов окрашивания производили следующим образом: Annexin V+/PI− – клетки, подвергшиеся апоптозу, Annexin V+/PI+ – клетки на поздней стадии апоптоза, Annexin V–/PI+ – некротизированные клетки, Annexin V–/PI– – живые клетки. Дополнительно для исключения нежизнеспособных клеток применяли 7-амино-актиномицин D (7-AAD).
РЕЗУЛЬТАТЫ
МТТ-тест. Результаты МТТ-теста представлены на рис. 1, из которого видно, что оба вируса обладают дозозависимым действием на исследуемые культуры. В случае низкой концентрации (105 частиц/мл) RVK штамма № 228 количество живых клеток по результатам МТТ-теста несколько увеличивалось (на 6–8%) для обеих культур. При воздействии на культуру U87MG увеличение концентрации RVK № 100 до 106, 107, 108 частиц/мл приводило к снижению данного показателя со 100% в контроле до 59.3 ± 5.6, 52.2 ± 9.0 и 62.9 ± 3.8% соответственно (t > 2.0). У штамма № 228 статистически значимого литического эффекта на данную культуру не установили, несмотря на снижение количества живых клеток на 36% (рис. 1а).
Рис. 1.
Дозозависимое цитотоксичное действие штаммов RVK на клеточные линиий глиальных опухолей. а – Культура клеток U87MG, б – культура клеток T98G. Вертикальные отрезки – ошибка среднего.
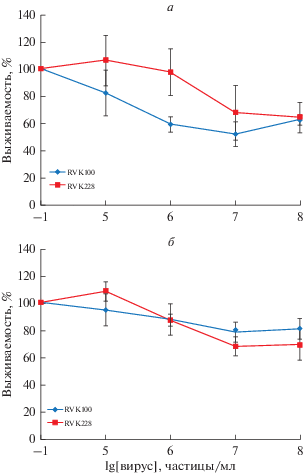
При культивировании с клетками линии T98G оба штамма вирусов демонстрировали сходные результаты. Однако литическая активность для штамма № 100 оказалась менее выраженной, чем в случае линии U87MG (рис. 1б). Повышение концентрации RVK до 108 частиц/мл не приводило к дальнейшему изменению результата МТТ-теста; в обеих культурах и при использовании обоих штаммов наблюдали выход на “плато”. Полученные кривые имеют приближенно сигмовидную форму, характерную для большинства цитотоксических агентов, однако нам не удалось вычислить IC50.
Проточная цитофлуориметрия. На клеточной линии U87MG нами были проведены дополнительные исследования интенсивности процессов апоптоза/некроза и жизнеспособности клеток после воздействия обоими штаммами RVK для уточнения результатов МТТ-теста (рис. 2).
Рис. 2.
Сравнение показателей жизнеспособности клеток U87MG в контрольном образце и после воздействия 108 частиц RVK штамм № 100. Сверху показано распределение клеток по параметрам прямого и бокового светорассеяния (FSC и SSC). Снизу показано распределение клеток, окрашенных с помощью аннексина V (Ann V) и пропидия иодида (PI). Синим цветом выделены живые клетки. Q1 – некротизированные клетки, Q2 – клетки на поздней стадии апоптоза, Q3 – живые клетки, Q4 – клетки на ранней стадии апоптоза.
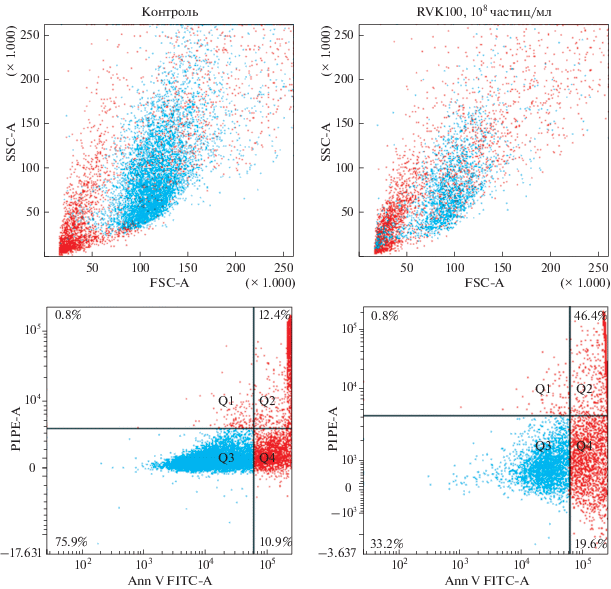
Исследование уровня апоптоза в культуре клеток U87MG после воздействия RVK штаммов № 100 и 228 в различных концентрациях показало значительное снижение жизнеспособности клеток при действии RVK штамм № 100 в сравнении с контролем и воздействием RVK штамм № 228. Наибольший цитотоксический эффект на клеточную линию был достигнут при концентрации RVK штамма № 100 108 частиц/мл. В этом случае количество живых клеток (33.2%) было меньше в 2.3 раза, чем в контроле (75.9%), доля клеток, находящихся на поздней стадии апоптоза увеличивалась по сравнению с контролем в 3.7 раз (46.4 и 12.4% соответственно), а на ранней стадии апоптоза – в 1.8 раз (19.6 и 10.9% соответственно).
Результаты анализа уровня апоптоза в культуре клеток U87MG в контроле и после воздействия RVK штаммов № 100 и 228 представлены на рис. 3. После воздействия на культуру U87MG RVK штамма № 228 в концентрации вирусных частиц 107 частиц/мл доля клеток на поздней стадии апоптоза увеличивалась в 1.9 раз по сравнению с контролем (23.3 и 12.4% соответственно) (рис. 3в).
Рис. 3.
Жизнеспособность клеток и уровень апоптоза в культуре U87MG после воздействия RVK штаммов № 100 и 228 в различных концентрациях. а – Доля живых клеток (%), б – доля клеток, погибших путем апоптоза (%), в – доля клеток на поздней стадии апоптоза (%).
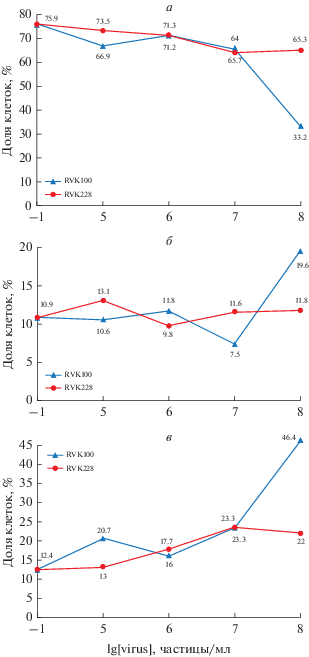
Были обнаружены различия в цитотоксическом действии RVK штаммов № 100 и 228 на клетки линии U87MG при использовании вирусных частиц в максимальной концентрации (108 частиц/мл) (рис. 3). Так, жизнеспособность клеток после действия разных штаммов RVK различалась в 1.9 раз (доля живых клеток составляла 65.3% живых клеток после действия RVK штамма № 228 и 33.2% после действия RVK штамма № 100). В образце с RVK штамма № 100 было в 1.6 раз больше (19.6%) клеток на ранней стадии апоптоза (11.8% после воздействия RVK штамма № 228) и в 2.1 раз больше (46.4%) клеток на поздней стадии апоптоза (22% после воздействия RVK штамма № 228).
Морфология клеток. Исследование морфологии показало ряд различий между клетками, культивированными с добавлением RVK штаммов № 100 и № 228, между собой и в сравнении с контрольными образцами.
Так, на препаратах с клетками линии U87MG наблюдали образование клеточных кластеров мультиполярной формы с длинными отростками. В контроле визуализировали густо заселенные крупные клеточные кластеры вариабельного размера и формы (сферической, бобовидной) с четкими округлыми краями. Кластеры клеток соединялись между собой тонкими отростками в количестве от 2 до 10 штук (рис. 4а).
Рис. 4.
Влияние RVK штамма № 100 и штамма № 228 на морфологию клеточной линии U87MG. Окрашивание гематоксилином. К – клеточный кластер. Стрелкой обозначена сеть из клеточных отростков. а – Контрольные клетки без воздействия, б – клетки после воздействия RVK штамма № 228, в – клетки после воздействия RVK штамма № 100. Об. 100×.
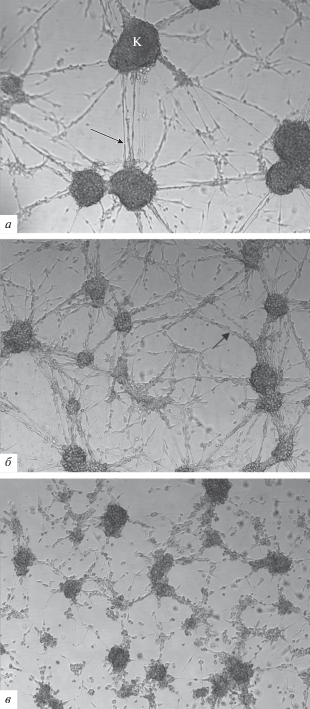
После воздействия RVK штамма № 228 кластеры клеток U87MG заметно уменьшались в размере. Наблюдали клеточные скопления сферической, овальной и полигональной формы. Отмечали разрастание отростков и образование “густых” сетей. Границы клеточных кластеров были менее сглаженными в сравнении с контрольным образцом (рис. 4б).
Наибольшее влияние на морфологические признаки культуры клеток U87MG оказало сокультивирование с RVK штамма № 100. Отмечали признаки гибели клеток: клетки легко откреплялись от поверхности культурального пластика при малейшем колебании слоя питательной среды и смены положения флакона с горизонтального на вертикальное. Наблюдали рыхлость и выраженную гранулярность клеточных кластеров. После культивирования с RVK штамма № 228 отростки клеток выглядели менее плотными, с распадающимися сетями и некоторым количеством гранул в них (рис. 4в).
При исследовании клеток линии T98G на контрольных препаратах выявляли крупные отростчатые клетки вытянутой полигональной формы с хорошо различимыми базофильными ядрами и ядрышками, базофильной цитоплазмой. Клетки располагались довольно близко друг к другу, образуя “завихрения”, которые часто описываются при гистологическом исследовании опухолевой ткани больных глиобластомой (рис. 5а). На большем увеличении наблюдали четко очерченные границы клеток, встречали ядра с неправильным контуром, неравномерно извилистым, иногда с глубокими вырезками (рис. 5б).
Рис. 5.
Влияние RVK штамма № 100 и штамма № 228 на морфологию клеточной линии T98G. Окрашивание гематоксилином. а, б – Контрольные клетки без воздействия, в, г – клетки после воздействия RVK штамма № 100, д, е – клетки после воздействия RVK штамма № 228. а, в, д – об. 100×, б, г, е – об. 200×.
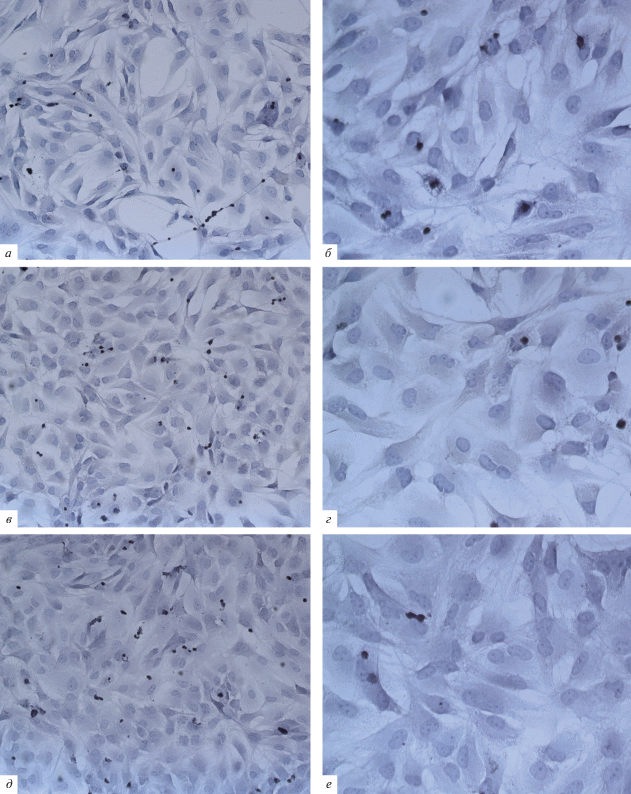
В образцах после воздействия RVK штамма № 100 клетки имели эпителиоподобную морфологию. В отличие от контрольных препаратов клетки располагались ровным монослоем без “завихрений” (рис. 5в). Встречали большое количество атипичных (“уродливых”) сегментированных базофильных ядер, границы цитоплазмы были расплывчатыми, контуры клеток менее четкими, чем в контрольном образце, но различимыми (рис. 5г).
Общая картина препаратов клеток T98G после сокультивирования с RVK штамма № 228 (рис. 5д) совпадала с описанной выше морфологической картиной, характерной для клеток, культивированных с RVK штамма № 100. Однако на большем увеличении морфология клеток имела ряд отличий. Так, клетки приобретали вытянутую овальную форму, тесно прилегали друг к другу, цитоплазма выглядела “размытой” без возможности определения клеточных границ (рис. 5е). Мы предполагаем, что в результате действия ротавируса происходила индукция формирования синцития, подобное явление описывается при исследовании вируса болезни Ньюкасла (Abdullah et al., 2014). Также есть вероятность увеличения объема цитоплазмы вследствие репликации ротавируса в клетках, так как известно, что репликация всех вирусов семейства Reoviridae осуществляется в цитоплазме клетки (Fields et al., 1991).
ОБСУЖДЕНИЕ
Одним из инновационных подходов к терапии низкодифференцированных глиом является применение онколитических вирусов (ОВ) (Павлова и др., 2014). Доклинические исследования на опухолевых клеточных линиях и на модельных животных с экспериментальными опухолями человека (включая экспериментальные глиомы) показывают высокий терапевтический потенциал ОВ, который превосходит возможности всех существующих клинико-экспериментальных методов терапии. Низкая вероятность развития внутренней резистентности в опухолевых клетках к ОВ и отсутствие значительных побочных эффектов даже при высоких дозах системного введения делают их особо привлекательными для генно-инженерной разработки улучшенных вариантов с высокой терапевтической активностью (Wollmann et al., 2012; Cheema et al., 2013).
С каждым годом потенциал противоопухолевой терапии с применением ОВ увеличивается, что подтверждается недавним одобрением вакцины T-VEC для лечения пациентов с прогрессирующей меланомой (Collichio et al., 2014; Andtbacka et al., 2015, 2016; Johnson et al., 2015). В ряде исследований показано, что ОВ помимо прямого онколиза способны восстанавливать микроокружение опухоли (Gujar et al., 2018; Samson et al., 2018; Bourgeoisdaigneault et al., 2018; Cavalcante et al., 2018, Ситковская и др., 2018а). Продолжается поиск и исследование новых онколитических вирусов. Нами проведено изучение действия ротавирусов ранее не исследованной группы К на две линии глиом in vitro.
Установлена дозозависимая цитотоксическая активность обоих изученных штаммов, максимально выраженная у RVK штамма № 100 концентрации 108 частиц/мл при действии на культуру клеток U87MG. В МТТ-тесте кривые выживаемости имели приближенно сигмовидную форму, характерную для большинства цитотоксических агентов, хотя и не удалось вычислить IC50, т. к. показатели количества погибших клеток культуры не превышали 50%. Клеточная линия U87MG при культивировании в среде без сыворотки образовывала слабо прикрепленные к клеточному пласту кластеры. В связи с этим в ходе проведения теста с МТТ при отборе среды часть клеток терялась, а числа прикрепленных к субстрату клеток оказалось недостаточно для количественной оценки. Так как с МТТ-тестом не было достигнуто однозначных результатов, мы провели дополнительное исследование уровня апоптоза на проточном цитофлуориметре в более чувствительной к ротавирусам, исходя из наших данных, культуры клеток – U87MG. Как и при МТТ-исследовании наибольшее угнетение на рост клеток оказывали RVK штамма № 100 в концентрации 108 частиц. При этом уровень живых клеток составил меньше 50%, а именно 33.2%, остальная доля клеток (66.8%) находилась на разных стадиях апоптоза, и мы считали их погибшими. Следовательно, проведение дополнительных тестов способствовало определению IC50.
Нами были показаны некоторые морфологические изменения опухолевых клеток и характера их роста после воздействия разными штаммами RVK. Активное образование отростков клеток U87MG (глиофибрил), одной из функций которых, как известно, является опорная функция, мы связываем с механизмами увеличения опухолевыми клетками адгезии к поверхности покровного стекла. Подобным, предположительно, можно объяснить и уменьшение размера кластеров, вероятно, за счет сокращения количества клеток в них. В условиях без воздействия вирусных частиц наблюдали наибольший диаметр кластеров, однако в этом случае сокращается доля клеток, контактирующих с поверхностью культуральной посуды, от общего числа клеток в кластере. Иначе говоря, чем больше кластер, тем меньше его адгезивные способности. Зачастую колебательные движения питательной среды в контрольных образцах провоцировали открепление агрегированных клеток U87MG. Однако нельзя исключать, что причиной уменьшения числа клеток в кластерах послужил вирусный онколиз, то есть прямое цитолитическое действие RVK.
Изменения морфологии T98G после воздействия штаммами RVK были менее выражены по сравнению с U87MG.
Следует отметить, что наблюдаемый характер роста культуры с образованием слабо прикрепленных кластеров клеток является нетипичным для линии U87MG согласно описанию, приводимому Европейской коллекцией аутентифицированных клеточных культур (The European Collection of Authenticated Cell Cultures (ECACC)), однако подобное явление было описано также рядом других авторов. Получаемые клеточные кластеры были охарактеризованы как онкосферы, формируемые постоянно присутствующими в культуре U87MG опухоль-инициирующими клетками, количество и онкосферообразующая способность которых контролируются эпигенетическими факторами и зависят от условий культивирования (Kozono et al., 2015). Для получения онкосфер достаточно перенести культуру в специальную среду для культивирования нейросфер, уменьшить количество сыворотки в стандартной среде культивирования или выращивать культуру в условиях низкой адгезии, при этом наблюдается увеличение экспрессии маркера стволовых клеток опухоли CD133 в получаемых онкосферах и усиление туморогенности образующих их клеток (Ledur et al., 2012; Kozono et al., 2015). Более того, данная особенность линии U87MG делает эту культуру удобным источником опухоль-инициирующих клеток, получаемых путем выделения спонтанных онкосфер или методом сепарации по CD133, что достаточно широко используется при создании in vitro и in vivo моделей для исследования биологии опухолевых стволовых клеток глиом (Zhou et al., 2011; Ledur et al., 2012; Ruggieri et al. 2012; Kozono et al., 2015; Lamour et al., 2015; Zhang et al., 2017; Jung et al., 2018). На основании имеющихся у нас данных пока сложно сделать однозначный вывод о природе образующихся в нашем эксперименте клеточных кластеров в культуре U87MG, и потребуются дополнительные исследования, чтобы установить связь получаемых нами структур с опухоль-инициирующими клетками. Однако такие очевидные параллели с данными, приводимыми в процитированных выше источниках, как сходство морфологии указанных кластеров и выраженная связь их формирования с понижением уровня сыворотки в среде культивирования, позволяют нам сделать предварительные выводы о сходстве наблюдаемых явлений и исключить возможность артефакта, связанного с заражением исследуемой культуры микоплазмой или другими патогенами.
В ходе нашего исследования была отмечена разная чувствительность культур глиом к исследованным ротавирусным штаммам, а также разная активность этих штаммов с более выраженным литическим действием RVK на клетки U87MG. Различия в реактивности использованных в исследовании клеточных линий описаны и при других воздействиях, что обусловлено известной разницей в биологии U87MG и T98G, в частности различиями в строении белка р53 (Hadjipanayis et al., 2005) или экспрессии онкосуппрессорного гена PTEN (Zhang et al., 2007). Какими особенностями исследованных нами линий обусловлена их различная чувствительность к RVK, пока сложно сказать. Известно, что литическая активность вирусов зависит, как от способности вирусной частицы прикрепляться к поверхности клетки, так и от наличия специфических внутриклеточных факторов, обеспечивающих интернализацию и пролиферацию вируса. Рецепторами к ротавирусам, обеспечивающими адгезию вирусных частиц на мембране клеток, являются остатки сиаловой кислоты (Haselhorst et al., 2009), количество и состав которых на поверхности клеток зависят от активности сиалилтрансфераз. Дальнейшая судьба вирусных частиц определяется взаимодействием множества мембранных и цитоплазматических белков, участвующих в процессах везикулярного транспорта, процессинга РНК, связывания кальция, работы протонной помпы, синтеза и хранения липидов и многих других факторов (Green et al., 2016). Особенности работы любого из этих механизмов могут определять разницу в восприимчивости клеток U87MG и T98G к RVK, однако на настоящий момент они остаются мало изученными.
Таким образом, мы допускаем возможность онколитического действия RVK на клетки T98G при увеличении концентрации штаммов ротавирусов группы K, использованных к нашей работе. При этом онколитический эффект штаммов RVK на клетки U87MG не вызывает сомнений.
Список литературы
Баклаушев В.П., Горяйнов С.А., Павлова Г.В., Потапов А.А., Чехонин В.П. 2015. Онколитические вирусы в лечении низкодифференцированных глиом. Клиническая практика. № 2. С. 46. (Baklaushev V.P., Goryainov S.A., Pavlova G.V., Potapov A.A., Chekhonin V.P. 2015. Oncolytic viruses in treatment of high-grade gliomas. Clin. Pract. № 2. P. 46.)
Габдрахманова А.Ф. 2017. Вирусный онколиз. Таврический научный обозреватель. № 1. С. 151. (Gabdrakhmanova A.F. 2017. Viral oncolysis. Tauride Sci. Observer. № 1. P. 151.)
Кешелава В.В. 2014. Рак. Реалии и возможности применения вируса болезни Ньюкасла. Рига: Palmarium Academic Publishing. 140 с. (Keshelava V.V. 2014. Cancer. The realities and possibilities of Newcastle disease virus use. Riga: Palmarium Academic Publishing. 140 p.)
Колпаков С.А., Колпакова Е.П. 2014. Новая группа ротавирусов человека семейства Reoviridae. Живые и биокосные системы. № 10. URL: http://jbks.ru/archive/issue-10/article-6. (Kolpakov S.A., Kolpakova E.P. 2014. A new group of human rotaviruses from the Reoviridae family. Living and biocos systems. № 10. URL: http://jbks.ru/archive/issue-10/article-6.)
Колпаков С.А., Колпакова Е.П., Златник Е.Ю. 2019. Штамм новой группы ротавирусов семейства Reoviridae препятствует перевиваемости и росту опухоли яичника крыс в эксперименте. Злокачественные опухоли. Т. 9. № 3. С. 135. (Kolpakov S.A., Kolpakova E.P., Zlatnik E.Yu. 2019. The strain of a new group of rotaviruses of the Reoviridae family interferes with transplantation and tumor growth of rat ovary in the experiment. Malignant tumors. V. 9. № 3. P. 135.)
Нетёсов С.В., Кочнева Г.В., Локтев В.Б., Святченко В.А., Сергеев А.Н., Терновой В.А., Тикунова Н.В., Шишкина Л.Н., Чумаков П.М. 2011. Онколитические вирусы: достижения и проблемы. Медицинский алфавит. Эпидемиология и санитария. № 3. С. 26. (Netyosov S.V., Kochneva G.V., Loktev V.B., Svyatchenko V.A., Sergeev A.N., Ternovoj V.A., Tikunova N.V., Shishkina L.N., Chumakov P.M. 2011. Oncolytic viruses: Achievements and challenges. Medical alphabet. Epidemiol. Sanitation. № 3. P. 26.)
Павлова Г.В., Баклаушев В.П., Иванова М.А., Горяйнов С.А., Рыбалкина Е.Ю., Копылов А.М., Чехонин В.П., Потапов А.А., Коновалов А.Н. 2014. Современные молекулярные подходы к диагностике и лечению низкодифференцированных глиом. Вопросы нейрохирургии. № 6. С. 85. (Pavlova G.V., Baklaushev V.P., Ivanova M.A., Goryainov S.A., Rybalkina E.Yu., Kopylov A.M., Chekhonin V.P., Potapov A.A., Konavalov A.N. 2014. Modern molecular approaches to the diagnosis and treatment of high-grade gliomas. Vopr. Neurochir. № 6. P. 85.)
Ситковская А.О., Златник Е.Ю., Новикова И.А., Кит О.И. 2018а. Вирус болезни Ньюкасла и иммунитет – эффективный альянс в борьбе против рака (обзор литературы). Сибирский онкологический журнал. Т. 17. № 6. С. 105. (Sitkovskaya A.O., Zlatnik E.Yu., Novikova I.A., Kit O.I. 2018a. Newcastle disease virus and immunity is an effective аlliance against cancer (literature review). Siberian J. Oncol. V. 17. № 6. P. 105.)
Ситковская А.О., Златник Е.Ю., Новикова И.А., Колпаков С.А., Колпакова Е.П., Потемкин Д.С., Васильченко Н.Г., Триандафилиди Е.И., Быкадорова О.В. 2018б. Исследование возможности онколитических эффектов in vitro вирусов из семейств Reoviridae и Paramyxoviridae. Известия ВУЗов. Северо-Кавказский регион. Естественные науки. 4(200) : 124–130. (Sitkovskaya A.O., Zlatnik E.Yu., Novikova I.A., Kolpakov S.A., Kolpakova E.P., Potemkin D.S., Vasilchenko N.G., Triandafilidi E.I., Bykadorova O.V. 2018b. Study of the possibility of in vitro oncolytic effects of the viruses of the families Reoviridae and Paramyxoviridae. News Universities. North Caucasus Region. Natural Science. 4(200) : 124–130.)
Abdullah J.M., Mustafa Z., Ideris A. 2014. Newcastle disease virus interaction in targeted therapy against proliferation and invasion pathways of glioblastoma multiforme. Biomed. Res. Int. Article ID 386470. https://doi.org/10.1155/2014/386470
Andtbacka R.H., Kaufman H.L., Collichio F., Amatruda T., Senzer N., Chesney J., Delman K.A., Spitler L.E., Puzanov I., Agarwala S.S., Milhem M., Cranmer L., Curti B., Lewis K., Ross M. et al. 2015. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J. Clin. Oncol. V. 33. P. 2780.
Andtbacka R.H., Ross M., Puzanov I., Milhem M., Collichio F., Delman K.A., Amatruda T., Zager J.S., Cranmer L., Hsueh E., Chen L., Shilkrut M., Kaufman H.L. 2016. Patterns of clinical response with talimogene laherparepvec (T-VEC) in patients with melanoma treated in the OPTiM phase III clinical trial. Ann. Surg. Oncol. V. 23. P. 4169.
Bourgeois-Daigneault M.C., Roy D.G., Aitken A.S., El Sayes N., Martin N.T., Varette O., Falls T., St-Germain L.E., Pelin A., Lichty B.D., Stojdl D.F., Ungerechts G., Diallo J.S., Bell J.C. 2018. Neoadjuvant oncolytic virotherapy before surgery sensitizes triple-negative breast cancer to immune checkpoint therapy. Sci. Transl. Med. V. 10 : eaao1641.
Cavalcante L., Chowdhary A., Sosman J.A., Chandra S. 2018. Combining tumor vaccination and oncolytic viral approaches with checkpoint inhibitors: rationale, pre-clinical experience, and current clinical trials in malignant melanoma. Am. J. Clin. Dermatol. V. 19. P. 657.
Cheema T.A., Wakimoto H., Fecci P.E., Ning J., Kuroda T., Jeyaretna D.S., Martuza R.L., Rabkin S.D. 2013. Multifaceted oncolytic virus therapy for glioblastoma in an immunocompetent cancer stem cell model. Proc. Natl. Acad. Sci. USA. V. 110. P. 12006.
Collichio F., Amatruda T.T., Senzer N.N., Chesney J.A., Delman K.A., Spitler L.E., Puzanov I., Doleman S., Ye Y., Vanderwalde A.M., Coffin R.S., Kaufman H.L. 2014. OPTiM: a randomized phase III trial of talimogene laherparepvec (T-VEC) versus subcutaneous (SC) granulocyte-macrophage colony-stimulating factor (GM-CSF) for the treatment (tx) of unresected stage IIIB/C and IV melanoma. J. Clin. Oncol. V. 9. P. 74.
Fields B.N., Knipe D.M., Howley P.M. 1991. Fundamental virology. 3rd Edition. Raven Press. 1064 p.
Green V.A., Pelkmans L. 2016. A systems survey of progressive host-cell reorganization during Rotavirus infection. Cell Host Microbe. V. 20. P. 107.
Gujar S., Pol J.G., Kroemer G. 2018. Heating it up: Oncolytic viruses make tumors ‘hot' and suitable for checkpoint blockade immunotherapies. Oncoimmunology. V. 7 : e1442169.
Hadjipanayis C.G., DeLuca N.A. 2005. Inhibition of DNA repair by a herpes simplex virus vector enhances the radiosensitivity of human glioblastoma cells. Cancer Res. V. 65. P. 5310.
Haselhorst T., Fleming F.E., Dyason J.C., Hartnell R.D., Yu X., Holloway G., Santegoets K., Kiefel M.J., Blanchard H., Coulson B.S., von Itzstein M. 2009. Sialic acid dependence in rotavirus host cell invasion. Nat. Chem. Biol. V. 5. P. 91.
Heinrich B., Klein J., Delic M., Goepfert K., Engel V., Geberzahn L., Lusky M., Erbs P., Preville X., Moehler M. 2017. Immunogenicity of oncolytic vaccinia viruses JX-GFP and TG6002 in a human melanoma in vitro model: studying immunogenic cell death, dendritic cell maturation and interaction with cytotoxic T lymphocytes. Onco Targets Ther. V. 10. P. 2389.
Ilett E., Kottke T., Thompson J., Rajani K., Zaidi S., Evgin L., Coffey M., Ralph C., Diaz R., Pandha H., Harrington K., Selby P., Bram R., Melcher A., Vile R. 2017. Prime-boost using separate oncolytic viruses in combination with checkpoint blockade improves anti-tumour therapy. Gene Ther. V. 24. P. 21.
Jaime-Ramirez A.C., Yu J.G., Caserta E., Yoo J.Y., Zhang J., Lee T.J., Hofmeister C., Lee J.H., Kumar B., Pan Q., Kumar P., Baiocchi R., Teknos T., Pichiorri F., Kaur B., Old M. 2017. Reolysin and histone deacetylase inhibition in the treatment of head and neck squamous cell carcinoma. Mol. Ther. Oncolytics. V. 5. P. 87.
Johnson D.B., Puzanov I., Kelley M.C. 2015. Talimogene laherparepvec (T-VEC) for the treatment of advanced melanoma. Immunotherapy. V. 7. P. 611.
Jung N., Kwon H.J., Jung H.J. 2018. Downregulation of mitochondrial UQCRB inhibits cancer stem cell-like properties in glioblastoma. Int. J. Oncol. V. 52. P. 241.
Kolpakov S.A., Kolpakova E.P., Zlatnik E.Yu., Sitkovskaya A.O., Shulgina O.G., Zolotareva E.I., Kopyltsov V.N. 2019. Oncolytic and protective effect of strain no. 228 of a new rotavirus group in the Reoviridae family on B16/F10 melanoma growth in experiment. J. Clin. Oncol. V. 37(suppl.) : e14210.
Kozono D., Li J., Nitta M., Sampetrean O., Gonda D., Kushwaha D.S., Merzon D., Ramakrishnan V., Zhu S., Zhu K., Matsui H., Harismendy O., Hua W., Mao Y., Kwon C.H., Saya H., et al. 2015 Dynamic epigenetic regulation of glioblastoma tumorigenicity through LSD1 modulation of MYC expression. Proc. Natl. Acad. Sci. USA. V. 112. P. E4055.
Lamour V., Henry A., Kroonen J., Nokin M.J., von Marschall Z., Fisher L.W., Chau T.L., Chariot A., Sanson M., Delattre J.Y., Turtoi A., Peulen O., Rogister B., Castronovo V., Bellahcène A. 2015. Targeting osteopontin suppresses glioblastoma stem-like cell character and tumorigenicity in vivo. Int. J. Cancer. V. 137. P. 1047.
Ledur P.F., Villodre E.S., Paulus R., Cruz L.A., Flores D.G., Lenz G. 2012. Extracellular ATP reduces tumor sphere growth and cancer stem cell population in glioblastoma cells. Purinergic Signal. V. 8. P. 39.
Marelli G., Howells A., Lemoine N.R., Wang Y. 2018. Oncolytic viral therapy and the immune system: A double-edged sword against cancer. Front. Immunol. V. 9. P. 866.
Rajani K., Parrish C., Kottke T., Thompson J., Zaidi S., Ilett L., Shim K.G., Diaz R.M., Pandha H., Harrington K., Coffey M., Melcher A., Vile R. 2016. Combination therapy with reovirus and anti-PD-1 blockade controls tumor growth through innate and adaptive immune responses. Mol. Ther. V. 24. P. 166.
Ruggieri P., Mangino G., Fioretti B., Catacuzzeno L., Puca R., Ponti D., Miscusi M., Franciolini F., Ragona G., Calogero A. 2012. The inhibition of KCa3.1 channels activity reduces cell motility in glioblastoma derived cancer stem cells. PLoS One. V. 7 : e47825.
Samson A., Bentham M.J., Scott K., Nuovo G., Bloy A., Appleton E., Adair R.A., Dave R., Peckham-Cooper A., Toogood G., Nagamori S., Coffey M., Vile R., Harrington K., Selby P. et al. 2016. Oncolytic reovirus as a combined antiviral and anti-tumour agent for the treatment of liver cancer. Gut. V. 67. P. 562.
Samson A., Bentham M.J., Scott K., Nuovo G., Bloy A., Appleton E., Adair R.A., Dave R., Peckham-Cooper A., Toogood G. 2017. Cationic liposome-mediated delivery of reovirus enhances the tumor cell-killing efficiencies of reovirus in reovirus-resistant tumor cells. Int. J. Pharm. V. 524. P. 238.
Samson A., Scott K.J., Taggart D., West E.J., Wilson E., Nuovo G.J., Thomson S., Corns R., Mathew R.K., Fuller M.J., Kottke T.J., Thompson J.M., Ilett E.J., Cockle J.V., van Hille P. et al. 2018. Intravenous delivery of oncolytic reovirus to brain tumor patients immunologically primes for subsequent checkpoint blockade. Sci. Transl. Med. V. 10 : eaam7577.
Schirrmacher V. 2018. From chemotherapy to biological therapy: A review of novel concepts to reduce the side effects of systemic cancer treatment (Review). Int. J. Oncol. V. 54. P. 407.
Wollmann G., Ozduman K., van den Pol A.N. 2012. Oncolytic virus therapy for glioblastoma multiforme concepts and candidates. Cancer J. V. 18. P. 69.
Zhang C., Hai L., Zhu M., Yu S., Li T., Lin Y., Liu B., Zhou X., Chen L., Zhao P., Zhou H., Huang Y., Zhang K., Ren B., Yang X. 2017. Actin cytoskeleton regulator Arp2/3 complex is required for DLL1 activating Notch1 signaling to maintain the stem cell phenotype of glioma initiating cells. Oncotarget. V. 8. P. 33353.
Zhang R., Banik N.L., Ray S.K. 2007. Combination of all-trans retinoic acid and interferon-gamma suppressed PI3K/Akt survival pathway in glioblastoma T98G cells whereas NF-kappaB survival signaling in glioblastoma U87MG cells for induction of apoptosis. Neurochem. Res. V. 32. P. 2194.
Zhou Y., Zhou Y., Shingu T., Feng L., Chen Z., Ogasawara M., Keating M.J., Kondo S., Huang P. 2011. Metabolic alterations in highly tumorigenic glioblastoma cells: preference for hypoxia and high dependency on glycolysis. J. Biol. Chem. V. 286. P. 32843.
Дополнительные материалы отсутствуют.


