Цитология, 2020, T. 62, № 3, стр. 210-219
Динамика активности матриксных металлопротеиназ и содержания белков внеклеточного матрикса в процессе репликативного старения линий мезенхимных стволовых клеток человека
И. В. Воронкина 1, 2, *, Л. В. Смагина 1, Н. Б. Бильдюг 1, А. С. Мусорина 1, Г. Г. Полянская 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: voronirina@list.ru
Поступила в редакцию 21.11.2019
После доработки 09.12.2019
Принята к публикации 13.12.2019
Аннотация
Сравнительный анализ характеристик МСК разного происхождения важен в связи с особенностями взаимодействия их с уникальным микроокружением (нишей), характерным для определенной ткани. Регуляция клеточных процессов осуществляется, в частности, через взаимодействие белков внеклеточного матрикса (ВКМ) с матриксными металлопротеиназами (ММП). В настоящей работе сравнивали динамику активностей ММП и уровней белков ВКМ в процессе репликативного старения 3-х линий МСК человека, полученных из Вартонова студня пупочного канатика человека (линия MSCWJ-1), из кожи век (линия DF-2) и из эпикардиальной жировой ткани человека, выделенной в процессе аортокоронарного шунтирования (линия ADH-MSC). Анализировали доли клеток с активностью фермента β-галактозидазы, характеризующей процесс репликативного старения, содержание белков ВКМ (фибронектина и коллагена I типа), а также активности ММП-1, ММП-2 и ММП-9 в процессе длительного культивирования. В целом, в процессе репликативного старения 3 линии различаются по характеру изменений содержания фибронектина, коллагена 1 типа и активностей ММП. Клетки линии ADH-MSC наиболее существенно отличаются от двух других линий по скорости старения, содержанию белков ВКМ и активностям ММП. Возможно, причиной такого расхождения является то, что клетки получены из ткани больного пациента.
Важность характеристик мезенхимных стволовых клеток (МСК) вытекает из особенностей их взаимодействия с уникальным микроокружением (нишей), характерным для определенной ткани, которое регулирует пролиферацию, выживаемость, миграцию, старение, дифференцировочный потенциал и другие свойства клеток посредством межклеточных взаимодействий и различных биоактивных молекул. Таким образом, происхождение МСК может определять их функциональные характеристики.
Учитывая уникальное микроокружение клеток, характерное для определенных тканей организма человека, существенный интерес представляет проведение сравнительного анализа характеристик, являющихся определяющими в поддержании статуса МСК согласно требованиям Международного общества клеточной терапии (Dominici et al., 2006; Sensebé et al., 2010), а также ряда других характеристик, ответственных за важнейшие клеточные процессы. К настоящему времени накопилось много работ по сравнительному анализу МСК человека, выделенных из разных взрослых и эмбриональных тканей, из внезародышевых органов человека, а также эмбриональных стволовых клеток (Fong et al., 2007; Hsieh et al., 2010; Nekanti et al., 2010; Fong et al., 2011; Balasubramanian et al., 2013; Bongso, Fong, 2013; Lian et al., 2016; Полянская, 2018; Полянская, Мусорина, 2018; Кольцова и др., 2019; Мусорина и др., 2019).
МСК, являясь неиммортализованными диплоидными клетками, подвергаются в процессе длительного культивирования репликативному старению. Репликативное старение – это комплексный процесс. Он характеризуется существенным снижением или прекращением пролиферации, укорочением теломер, морфологическими изменениями, увеличенной активностью β-галактозидазы, повышением уровня экспрессии туморсупрессорных генов, уменьшением репарации ДНК и антиоксидатной активности стареющих клеток благодаря снижению экспрессии соответствующих генов, уменьшением дифференцировочного потенциала, рядом эпигенетических изменений и другими признаками. Процесс репликативного старения в МСК может начинаться на ранних пассажах и постепенно усиливаться в процессе длительного культивирования (Wagner et al., 2008; Kuilman et al., 2010; Redaelli et al., 2012; Estrada et al., 2013; Savickiene et al., 2016; Danisovic et al., 2017; Кольцова и др., 2017, 2018; Alessio et al., 2018; Niedernhofer et al., 2018; Truong et al., 2018; Yu et al., 2018).
Известно, что клетки в условиях in vivo и in vitro контактируют с сетью макромолекул, образующих внеклеточный матрикс (ВКМ), состоящий из разных белков, синтезируемых самими клетками. ВКМ является одним из важнейших регуляторов клеточных процессов и представляет собой микроокружение или нишу, в которой клетки существуют. Регуляция клеточных процессов осуществляется через взаимодействие белков ВКМ с матриксными металлопротеиназами (ММП) (Kessenbrock, et al., 2010). ММП и их специфические ингибиторы влияют на фундаментальные клеточные процессы посредством участия в ремоделировании тканей и развитии органов, специфически модулируя сигнальные пути через взаимодействия c субстратами разной природы, а также путем перестройки ВКМ (Nagase et al., 2006; Page-McCaw et al., 2007; Kessenbrock et al., 2010). Изменение состава и структуры ВКМ может существенно влиять на свойства клеток.
ММП синтезируются клетками разных типов – фибробластами, кератиноцитами, фагоцитами, лимфоцитами и трансформированными клетками. Все члены семейства ММП обладают общими характерными чертами: они имеют общие участки аминокислотной последовательности, синтезируются в виде неактивных проферментов и включают цинк в качестве кофактора. Есть ряд работ, свидетельствующих об активном участии ММП и ВКМ в процессе старения разных клеточных типов, включая и МСК (Moon et al., 2004; Vigetti et al., 2006; Bertram, Hass, 2008, 2009; Kasper et al., 2009; Pitiyage et al., 2011; Madeira et al., 2012; Makpol et al., 2013; Malaquin et al., 2013; Lynch, Pei, 2014; Permatasari et al., 2014; Gutierrez-Fernandez et al., 2015; Noh et al., 2017). В настоящее время сравнительные исследования роли ВКМ и ММП в процессе репликативного старения МСК, полученных из разных источников, широко не представлены.
В связи с этим в настоящей работе сравнительно изучали содержание белков ВКМ и активности ММП в 3-х линиях МСК человека, полученных из кожи век (DF-2), из Вартонова студня пупочного канатика человека (MSCWJ-1) и из эпикардиальной жировой ткани человека (ADH-MSC) в процессе аортокоронарного шунтирования. Эти линии в процессе длительного культивирования проявляют признаки репликативного старения: существенное снижение эффективности клонирования и индекса пролиферации, значительное увеличение размеров клеток и их распластанности, появление дебриса в среде культивирования, увеличение доли клеток с выраженной активностью β-галактозидазы (Крылова и др., 2016; Кольцова и др., 2018; Мусорина и др., 2019). Учитывая их разное происхождение и наличие межлинейных различий, представляло интерес выяснить наличие различий по ряду параметров в этих линиях в процессе репликативного старения.
В настоящей работе поставлены следующие задачи: 1) культивирование клеток указанных линий в течение долгого времени; 2) сравнительный анализ процесса репликативного старения клеток по активности фермента β-галактозидазы; 3) сравнительный анализ содержания белков ВКМ фибронектина и коллагена I типа и активностей ММП-1, ММП-2 и ММП-9 для выявления корреляций между ними.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Использовали три линии МСК человека: MSCWJ-1 (полученную из Вартонова студня пупочного канатика человека), DF-2 (полученную из кожи век 45-летнего донора) и ADH-MSC (из эпикардиальной жировой ткани 50-летнего донора в процессе аортокоронарного шунтирования). Все клеточные линии получены и охарактеризованы в ЦКП “Коллекция культур клеток позвоночных” ИНЦ РАН (Санкт-Петербург). Клетки линии DF-2 и MSCWJ-1 культивировали в ростовой среде, содержащей 90% среды DMEM/F12 (Биолот, Россия) и 10% эмбриональной бычьей сыворотки (FBS) (Hyclone, США). Клетки линии ADH-MSC культивировали в ростовой среде следующего состава: 85% среды α-МЕМ (Биолот, Россия), 15% FBS (HyClone, США) и 5 нг/мл фактора роста βFGF (Sigma-Aldrich, США). Все линии культивировали при 5% СО2, 37°С и влажности 90%. Микробиологический анализ подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации в полученных линиях. Морфологию клеток изучали с помощью инвертированного микроскопа (NICON, Япония). Анализ проводили на следующих пассажах: для линии MSCWJ-1 – на 6-, 13-, 23- и 28-м; для линии DF-2 – на 9-, 13-, 22- и 25-м, для линии ADH-MSC – на 9-, 13- и 16-м пассажах.
Репликативное старение клеток. Старение оценивали по активности фермента β-галактозидазы. Клетки исследуемых линий выращивали в течение 1 сут в чашках Петри 3.5 см. Затем среду удаляли и окрашивали клетки с помощью набора реактивов (Senescence β-galactosidase staining kit; Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу репликативного старения, цитоплазма имеет ярко-синюю окраску. Анализ проводили с помощью инвертированного микроскопа (NICON, Япония) на следующих пассажах: для линии MSCWJ-1 – на 6-, 13-, 23- и 28-м; для линии DF-2 – на 9-, 13-, 22- и 25‑м, для линии ADH-MSC – на 9-, 13- и 16-м пассажах. Долю окрашенных клеток (в %) определяли путем подсчета не менее 1000 клеток в разных полях зрения на одну временную точку.
Вестерн-блот-анализ. Клетки на выбранных сроках культивирования лизировали на льду в 1 мл лизирующего буфера, содержащего 1% Тритона X-100, 50 мМ Tris-HCl, pH 7.4, 150 мМ NaCl, 5 мМ ЭДТА и 1% смеси ингибиторов протеаз (Sigma-Aldrich, США), центрифугировали при 500 g и добавляли к супернатантам буфер для проб Лэммли (90°С, 5 мин). Концентрацию белка в лизатах определяли с помощью дот-блотинга на поливинилидендифторидной (PVDF) мембране Immobilon-P (Sigma-Aldrich, США), используя краситель Кумасси R-250 (Sigma-Aldrich, США). Количественную оценку проводили с помощью программы Quantity One.
Электрофорез в полиакриламидном геле. Белки лизатов разделяли в денатурирующих условиях в присутствии SDS (Laemmli, 1970) в системе Bio-Rad (США) и переносили на PVDF-мембраны Immobilon-P (Sigma-Aldrich, США) в системе для мокрого переноса (Bio-Rad, США) в трис-глициновом буфере (pH 8.3), содержащем 10% метанола и 0.1% SDS, по стандартной методике (Towbin et al., 1979). Мембраны окрашивали с помощью поликлональных кроличьих антител против коллагена I типа (AB745, Sigma, США) или моноклональных мышиных антител против фибронектина (F6140, Sigma, США) с использованием козьих антител против IgG крысы (для коллагена I) или козьих антител против IgG мыши (для фибронектина), конъюгированных с пероксидазой хрена (Pierce, США). Разведение проводили согласно инструкциям производителя антител. Для выявления пероксидазной активности использовали субстрат SuperSignal® West Dura Extended Duration Substrate (Thermo Scientific, США). Хемилюминесцентное излучение регистрировали при помощи системы ChemiDoc (Bio-Rad, США). Для проведения количественного анализа мембраны сканировали, полученные изображения обрабатывали с помощью программы Quantity One. Статистическую обработку данных проводили с помощью программы Excel.
Зимография. Этим методом определяли активность ММП в кондиционированной клетками среде, используя желатин (для ММП-2 и ММП-9) и казеин (для ММП-1) в качестве субстратов. Пробы готовили, смешивая аликвоту среды с буфером для проб по Лэммли без дитиотриэтола и нагревания, инкубируя смесь в течение 20 мин при комнатной температуре. Электрофорез проводили в 10%-ном ПААГ, содержащем желатин или казеин в конечной концентрации 1 или 0.5 мг/мл соответственно. По окончании электрофореза гель дважды промывали по 15 мин 2.5%-ным раствором Тритона X-100, после чего инкубировали в течение 12 ч (для желатина) или 18 ч (для казеина) в буферном растворе T-PBS (100 мМ Трис-HCl, рН 7.4, 0.15 мМ NaCl, 5 мМ C-aCl2) при 37°C. Затем гель фиксировали в смеси 25%-ного изопропилового спирта и 10%-ной уксусной кислоты и далее окрашивали Кумасси бриллиантовым синим G-250 (Sigma, США). Присутствие ММП, расщепляющих субстрат, определяли по наличию неокрашенных полос в геле. Для проведения количественного анализа гель сканировали и полученные изображения обрабатывали в программе QuantScan.
Для проведения количественного анализа гели и мембраны сканировали, полученные изображения обрабатывали с помощью программы Photoshop вер. 2017.0.1, инвертируя изображение. Далее изображения анализировали с помощью программы QuantiScan, вер. 3.1. Содержание белков и активность протеаз выражали в усл. ед., принятых в программе QuantiScan (произведение количества окрашенных пикселов на интенсивность окраски пикселов).
Статистический анализ. Использовали t-критерий Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы P < 0.05. В каждом варианте проводили по 3 независимых эксперимента. На гистограммах показаны средние значения величин и ошибки среднего.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
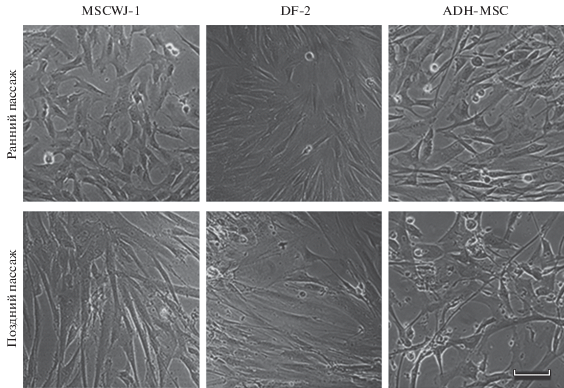
Морфология клеток. Морфологический анализ клеток трех линий (MSCWJ-1, DF-2 и ADH-MSC) при их длительном культивировании показал однородность клеточных популяций на ранних пассажах (6 и 9) со средними по размеру вытянутыми фибробластоподобными клетками (рис. 1а–в). В процессе культивирования на поздних пассажах (16, 28 и 25) морфология клеток всех линий изменялась: увеличивались размеры клеток и степень их распластанности (рис. 1г–е).
Рис. 1.
Прижизненные фотографии клеток линии MSCWJ-1, DF-2 и ADH-MSC на ранних и поздних пассажах. Ранние пассажи: 6-й (для MSCWJ-1) и 9-й (для DF-2 и ADH-MSC). Поздние пассажи: 28-й (MSCWJ-1) , 25-й (DF-2) и 16-й (ADH-MSC). Инвертированный микроскоп NICON, Япония. Об.: 10×. Масштабная линейка: 50 мкм.
Репликативное старение клеток. Процесс старения клеток всех линий при длительном культивировании оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1). Из результатов табл.1 следует, что в клетках ADH-MSC уже на пассаже 13 доля стареющих клеток увеличена по сравнению с пассажем 9 (P < 0.01). А к пассажу 16 доля стареющих клеток увеличивается в 2.8. раза по сравнению с пассажем 13 (P < 0.01) и составляет половину анализируемой клеточной популяции. Значительно медленнее проходит процесс репликативного старения в клеточных линиях MSCWJ-1 и DF-2. Доля стареющих клеток в этих двух линиях достигает уровня линии ADH-MSC только к пассажам 25–28. Причем характер процесса клеточного старения у этих двух линий различен. Так, у линии MSCWJ-1 доля стареющих клеток накапливается медленнее, чем у линии DF-2. При сравнении пассажей 13 и 22–23 доля стареющих клеток в линии MSCWJ-1 меньше, чем в линии DF-2 (P < 0.01) и не достигает уровня DF-2 даже на пассаже 28 (P < 0.05).
Таблица 1.
Доля клеток линий ADH-MSC, MSCWJ-1 и DF-2 с выраженной активностью (окраской) β-галактозидазы в процессе длительного культивирования
| Номер пассажа | ADH-MSC | MSCWJ-1 | DF-2 | |||
|---|---|---|---|---|---|---|
| число всех клеток |
доля окрашенных, % | число всех клеток |
доля окрашенных, % | число всех клеток |
доля окрашенных, % | |
| 6 | – | – | 1154 | 1.80 ± 0.40 | – | – |
| 9 | 1078 | 2.00 ± 0.42 | – | – | 1085 | 4.20 ± 0.60 |
| 13 | 1178 | 17.0 ± 1.10 | 1000 | 8.80 ± 0.90 | 1046 | 21.60 ± 1.27 |
| 16 | 1171 | 47.0 ± 1.46 | – | – | ||
| 22 | – | – | – | – | 1013 | 44.60 ± 1.56 |
| 23 | – | – | 1004 | 29.40 ± 1.44 | – | – |
| 25 | – | – | – | – | 1070 | 52.70 ± 1.53 |
| 28 | – | – | 1262 | 44.00 ± 1.40 | – | – |
Примечание. Даны средние значения и их ошибки при подсчете не менее 1000 клеток в разных полях зрения. Анализ проводили на пассажах: 6, 13, 23 и 28 (линия MSCWJ-1); 9, 13, 22- и 25 (линия DF-2); 9, 13 и 16 (линия ADH-MSC). Разница между ранними (6 или 9) и поздними (16–28) пассажами для трех линий достоверна при Р < 0.05.
Различия между линиями MSCWJ-1 и DF-2 по характеру процесса старения могут быть связаны с разными источниками получения МСК: линия MSCWJ-1 получена из внезародышевой ткани, а DF-2 – из кожи век взрослого донора. Есть данные, свидетельствующие о влиянии возраста донора на свойства МСК (Hirt-Burri et al., 2008; Siegel et al., 2013; Kornicka et al., 2015; Mohd et al., 2016; Yi et al., 2017; Zhang et al., 2018). Раннее репликативное старение в клетках ADH-MSC, возможно, связано с нарушенным микроокружением, в котором находились клетки in vivo, поскольку их донор, в отличие от здоровых доноров, имел заболевание сердца, требующее аортокоронарного шунтирования (Мусорина и др., 2019).
Динамика содержания белков ВКМ в процессе репликативного старения клеток. Динамику белков оценивали с помощью Вестерн-блот-анализа. Фибронектин необходим клеткам для адгезии и миграции и может расщепляться протеазами при образовании ВКМ. В настоящей работе использовали антитела к фибронектину, синтезируемому клетками и образующему сеть на клеточной поверхности, в отличие от фибронектина плазмы крови. Разведение проводили согласно инструкциям производителя антител.
Фибронектин. В культуре клеток MSCWJ-1 на пассаже 6 наблюдали низкий уровень фибронектина, который существенно повышался к пассажу 13 (примерно в 8 раз, рис. 2.). К пассажам 23–28 наблюдали постепенное уменьшение количества фибронектина до уровня, который был ниже его исходного значения (на пассаже 6) приблизительно в 1.7 раз. Таким образом, фаза активного старения в этих клетках сопровождается общим снижением количества фибронектина.
Рис. 2.
Уровень фибронектина (а) и коллагена I типа (б) в мезенхимных стволовых клетках человека трех линий: MSCWJ-1, DF-2 и ADH-MSC. По горизонтали указан номер пассажа для каждой линии. Содержание белка указано в усл. ед., принятых в программе QuantiScan.
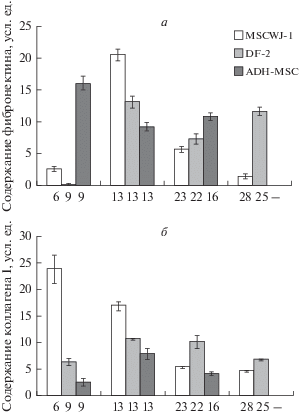
В культуре клеток DF-2 на ранней фазе старения (на пассаже 9) наблюдали небольшое количество фибронектина, которое, подобно клеточной линии MSCWJ-1, значительно увеличивалось к пассажу 13 (примерно в 110 раз, рис. 2а). Надо подчеркнуть, что в этих клетках по сравнению с MSCWJ-1 на пассаже 13 идет достаточно активное старение. В фазе активного старения клеток наблюдали колебания уровня фибронектина. Таким образом, в клетках DF-2 в целом наблюдается общее повышение количества фибронектина в фазе активного старения по сравнению с ситуацией на раннем сроке культивирования этих клеток. Сравнительный анализ динамики содержания фибронектина в этих двух линиях (MSCWJ-1 и DF-2) свидетельствует о разнонаправленном характере этого процесса при репликативном старении.
В культуре клеток ADH-MSC на пассаже 9 наблюдали большое количество фибронектина (в отличие от 2-х других линий), которое снижалось к пассажу 13, т.е. к началу фазы активного старения клеток, примерно в 1.7 раз (рис. 2а) и сохранялось примерно на этом же уровне до пассажа 16. Таким образом, фаза активного старения в клетках ADH-MSC сопровождается снижением уровня фибронектина.
Коллаген I типа. Уровень коллагена в клетках MSCWJ-1 на пассаже 6 был значительно выше, чем уровень фибронектина. Однако по мере культивирования к пассажу 13–23 его количество постепенно уменьшалось (приблизительно в 4.4 раза по сравнению с пассажем 6, рис. 3б) и сохранялось примерно на этом уровне до пассажа 28. Таким образом, процесс старения в этих клетках сопровождается значительным снижением содержания коллагена I типа. В целом, в клетках MSCWJ-1 наблюдается общая тенденция к снижению уровня белков ВКМ по мере старения клеток.
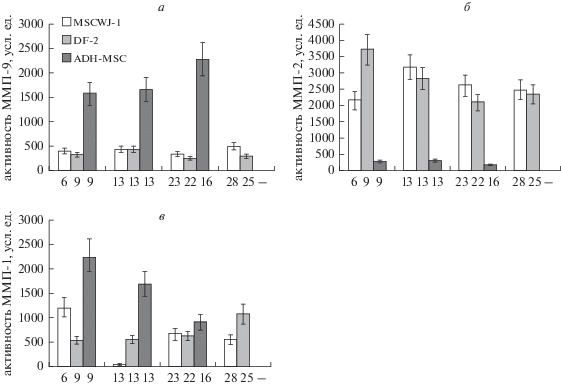
Рис. 3.
Активность ММП-9 (а), ММП-2 (б), и ММП-1 (в) в среде, кондиционированной МСК человека трех линий: MSCWJ-1, DF-2 и ADH-MSC. Активность указана в усл. ед., принятых в программе QuantiScan. По горизонтали указаны номера, соответствующие пассажам (см. рис. 2), в которые проводили отбор проб.
В культуре клеток DF-2 наблюдали повышение уровня коллагена I типа по мере культивирования от пассажа 9 к пассажу 13 примерно в 1.7 раз (рис. 2б), который сохранялся до пассажа 22 и далее снижался практически до исходного уровня (соответствующего 9 пассажу) к пассажу 25. Таким образом, в процессе старения клеток DF-2 уровень коллагена I типа претерпевает колебания с возвращением к исходному значению на поздней стадии активного старения. Сравнительный анализ линий MSCWJ-1 и DF-2 свидетельствует о разном характере динамики содержания коллагена I типа в процессе репликативного старения.
В клетках ADH-MSC на пассаже 9 наблюдали низкий уровень коллагена I типа по сравнению с уровнем фибронектина. К пассажу 13 его количество увеличивалось приблизительно в 3 раза (рис. 2б), а затем снижалось в 1.9 раз в фазе активного старения клеток (на пассаже 16). Таким образом, в культуре этих клеток коллаген I типа синтезируется на низком уровне и имеет динамику, противоположную динамике фибронектина.
Заключительный вывод из этой части работы состоит в том, что в процессе репликативного старения МСК трех исследованных линий различаются по характеру изменений содержания фибронектина и коллагена 1 типа. Кроме того, в каждой линии имелись различия по начальному содержанию фибронектина и коллагена 1 типа.
Динамика активности ММП в процессе репликативного старения клеток. В клетках линии MSCWJ-1 на пассаже 6 активность ММП-9 достаточно низкая, она почти не изменялась на протяжении всего времени культивирования (рис. 3а). Клетки линии DF-2 по динамике активности ММП-9 сходны с клетками MSCWJ-1. В отличие от них, в культуре клеток ADH-MSC наблюдали резкое повышение активности ММП-9 по мере культивирования клеток от пассажа 9 к пассажу 16. Таким образом, ММП-9, по-видимому, не участвует в процессе репликативного старения клеточных линий MSCWJ-1 и DF-2, несмотря на то что они получены из совершенно разных тканей разных, но здоровых, доноров (внезародышевая ткань и кожа век взрослого человека среднего возраста). При этом значительная активность ММП-9 наблюдается в процессе репликативного старения клеток, полученных из эпикардиальной жировой ткани человека (ADH-MSC) 50-летнего донора в процессе аортокоронарного шунтирования, т.е. от нездорового донора. Известно, что ММП-9 участвует в патологических процессах в миокарде и, в частности, является маркером сердечной недостаточности (Felkin et al., 2006; Yabluchanskiy et al., 2013).
Активность ММП-2 в клетках MSCWJ-1 в отличие от ММП-9 повышена и значительно увеличивается на пассаже 13, когда еще отсутствует активное старение (рис. 3б). Затем она постепенно снижается, достигая первоначального уровня к пассажу 23, т.е. во время фазы активного старения. Возможно, увеличение активности ММП-2 на пассаже 13 функционально связано с подготовкой клеточной популяции к процессу старения. Уровень активности ММП-2 в клетках DF-2 постепенно снижается в процессе репликативного старения по сравнению с начальной точкой на пассаже 9. В клетках линии ADH-MSC активность ММП-2, в отличие от ММП-9, находилась на очень низком уровне и практически не изменялaсь от пассажа 9 до пассажа 16, что отличает эти клетки от двух других линий.
Уровень активности ММП-1 в клетках MSCWJ-1 значительно снижался к пассажу 13, а затем повышался, но к пассажу 28 не достигал исходного уровня на пассаже 6 (рис. 3в). Процесс старения в этих клетках в целом сопровождается снижением активности ММП-1. В клетках DF-2 наблюдается значительное повышение активности ММП-1 к пассажу 25. В клетках ADH-MSC характер динамики активности ММП-1, как и в случае с другими ММП, значительно отличается от других линий: исходный уровень активности на пассаже 9 значительно выше и снижается к пассажу 16.
Связь изменений активности ММП и содержания белков ВКМ в процессе репликативного старения клеток трех линий. Предыдущие исследования клеток линии MSCWJ-1 показали отсутствие признаков репликативного старения этой линии на 6 пассаже. На более поздних пассажах уже наблюдали различия между клетками MSCWJ-1 и других линий. Отличия, связанные с вступлением клеток в фазу старения, становились заметными на 13 пассаже (Кольцова и др., 2017). Из результатов наших экспериментов можно видеть, что пассаж 13 также является переломным в ходе старения клеток всех трех линий (рис. 2, 3). До этой временной точки происходит накопление фибронектина, синтезируемого клетками линий MSCWJ-1 и DF-2, а у клеток линии ADH-MSC количество фибронектина, наоборот, снижается. Вероятно, накопление клеточного фибронектина обусловлено происхождением клеток: линия MSCWJ-1 происходит из внезародышевой ткани, характеризующейся большим количеством фибронектина и других протеогликанов (Jadalannagari, S. et al, 2017), а линия DF-2 – фибробласты, которые синтезируют этот белок в соединительной ткани. При переводе в условия in vitro эти клетки в норме синтезируют фибронектин, создавая субстрат для прикрепления к пластику. Количество же другого белка, коллагена, повышается до 13 пассажа, после чего плавно снижается у линии DF-2. А у клеток MSCWJ-1 количество коллагена снижается на протяжении всего времени старения.
Для клеток линий MSCWJ-1 и DF-2 направление изменений активности ММП-2 и содержания фибронектина в процессе старения совпадает, а для линии ADH-MSC оно имеет обратную направленность (рис. 2а, 3б). Это же относится к изменению активности ММП-1 и коллагена I – для первых двух линий оно разнонаправленно, а для третьей линии – совпадает по направлению. Для линии MSCWJ-1 изменения активности ММП-1 и количества коллагена I после 13 пассажа разнонаправлены, это же происходит и у клеток линии DF-2. Для клеток линии ADH-MSC эти изменения, напротив, совпадают (рис. 2б, 3в). По-видимому, это связано с тем, что коллагеназа ММП-1 расщепляет коллаген I, что приводит к уменьшению его количества в клеточных лизатах с увеличением активности ММП-1.
В целом, полученные результаты свидетельствуют как о различиях между линиями по активности ММП-2 и ММП-9, так и между активностями разных ММП в одной линии. Сопоставление данных, полученных в экспериментах, показало, что корреляция между динамикой активностей ММП-2 и ММП-1 и содержанием белков ВКМ имеет разную направленность (имеет разный знак) у линии ADH-MSC и двух других линий.
Несмотря на то, что ММП имеют разную субстратную специфичность (например, ММП-1 действует на коллагены, ММП-2 и ММП-9 разрушают преимущественно желатин, эластин, фибронектин, а также коллаген IV, VII и X (Nagase, Woessner, 1999), отсутствие общей корреляции между динамикой активности отдельных ММП и накоплением фибронектина и коллагена в процессе репликативного старения различных линий МСК можно объяснить комплексным воздействием этих ММП на белки ВКМ при его ремоделировании.
Наиболее значительные изменения активности 3-х исследованных ММП в процессе репликативного старения наблюдаются в линии ADH-MSC, выделенной от нездорового донора. Подчеркнем, что характеристики этой линии, исследованные ранее, также отличаются от других линий: они характеризуются ранним репликативным старением, в процессе которого существенно усиливается цитогенетическая нестабильность, связанная с большой частотой клональных хромосомных перестроек, появлением новых структурных вариантов кариотипа и снижением количества нормальных кариотипов до 6% к пассажу 16 (Мусорина и др., 2019). Большое влияние на изменения клеточных характеристик, по-видимому, оказывает микроокружение, в котором находились клетки еще до перевода в состояние in vitro.
Список литературы
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и характеристика линии мезенхимных стволовых клеток, выделенных из пульпы молочного зуба человека. Цитология. Т. 60. № 12. С. 955. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and characterization of mesenchymal stem cell line, isolated from human pulp of a deciduous tooth. Tsitologiya. V. 60. № 12. P. 955.)
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2019. Получение и характеристика линии мезенхимных стволовых клеток, выделенной из десны человека. Цитология. Т. 61. № 8. С. 658. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. The derivation and characterization of mesenchymal stem cell line, isolated from guingia of man. Tsitologiya. V. 61. № 8. P. 658.)
Кольцова А.М., Крылова Т.А., Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2017. Динамика свойств двух линий мезенхимных стволовых клеток, полученных из Вартонова студня пупочного канатика человека, при длительном культивировании. Цитология. Т. 59. № 9. С 574. (Koltsova A.M., Krylova T.A., Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The dynamics of cell properties during long-term cultivation of two lines of mesenchymal stem cells derived from Wharton’s jelly of human umbilical cord. Cell Tiss. Biol. V. 12. № 1. P. 7.)
Крылова Т.А., Мусорина А.С., Зенин В.В., Кольцова А.М., Кропачева И.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2016. Получение и характеристика неиммортализованных клеточных линий дермальных фибробластов человека, выделенных из кожи век взрослых доноров разного возраста. Цитология. Т. 58. № 11. С. 850. (Krylova T.A., Musorina A.S., Zenin V.V., Koltsova A.M., Kropacheva I.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2016. Derivation and characteristic of a non-immortalized cell lines of human dermal fibroblasts, generated from skin of the eyelids of adult donors of different age. Tsitologiya. V. 58. № 11. P. 850.)
Мусорина АС, Зенин ВВ, Турилова ВИ, Яковлева ТК, Полянская ГГ. 2019. Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека. Цитология. Т. 61. № 4. С. 272. (Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. Characterization of a nonimmortalized mesenchymal stem cell line isolated from human epicardial adipose tissue. Cell Tiss. Biol. V. 13. № 4. P. 247.)
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). В кн.: “Клеточные культуры”. ISSN 2077-6055. № 34. С. 3. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates. (Review). Digest: “Cell cultures”. ISSN 2077-6055. № 34. P. 3.)
Полянская Г.Г., Мусорина А.С. 2018. Коллекция культур клеток позвоночных: создание, деятельность, каталог. СПб: изд-во Политех.ун-та. ISBN 978-5-7422-6154-4. 185 с. (Poljanskaya G.G., Musorina A.S. 2018. Collection of vertebrate cell cultures: creation, activity, catalogue. St. Petersburg: Polytechnic University press. ISBN 978-5-7422-6154-4. 185 p.)
Alessio N., Pipino C., Mandatori D., Di Tomo P., Ferone A., Marchiso M., Melone M.A.B., Peluso G., Pandolfi A., Galderisi U. 2018. Mesenchymal stromal cells from amniotic fluid are less prone to senescence compared to those obtained from bone marrow: an in vitro study. J. Cell Physiol. V. 233. P. 8996.
Balasubramanian S., Thej C.,Venugopal P., Priya N., Zakaria Z., Sundarraj S., Majumdar A.S. 2013. Higher propensity of Wharton’s jelly derived mesenchymal stromal cells towards neuronal lineage in comparison to those derived from adipose and bone marrow. Cell Biol. Int. V. 37. P. 507.
Bertram C., Hass R. 2008. MMP-7 is involved in the aging of primary human mammary epithelial cells (HMEC). Exp. Gerontol. V. 43. P. 209.
Bertram C., Hass R. 2009. Cellular senescence of human mammary epithelial cells (HMEC) is associated with an altered MMP-7/HB-EGF signaling and increased formation of elastin-like structures. Mech. Ageing Dev. V. 130. P. 657.
Bongso A., Fong C.Y. 2013. The therapeutic potential, challenges and future clinical directions of stem cells from the Wharton’s jelly of the human umbilical cord. Stem Cell. Rev. V. 9. P. 226.
Danisovic L., Oravcova L., Krajciova L., Varchulova Novakova Z., Bohac M., Varga I., Vojtassak J. 2017. Effect of long-term culture on the biological and morphological characteristics of human adipose tissue-derived stem cells. J. Physiol. Pharmacol. V. 68. P. 149.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. Position Statement. Cytother. V. 8. P. 315.
Estrada J.C., Torres Y., Benguría A., Dopazo A., Roche E., Carrera-Quintanar L., Pérez R.A., Enríquez J.A., Torres R., Ramírez J.C., Samper E., Bernad A. 2013. Human mesenchymal stem cell-replicative senescence and oxidative stress are closely linked to aneuploidy. Cell Death Dis. V. 4. e691. https://doi.org/10.1038/cddis.2013.211
Felkin L.E., Birks E.J., George R., Wong S., Khaghani A., Yacoub M.H., Barton P.J. 2006. A quantitative gene expression profile of matrix metalloproteinases (MMPS) and their inhibitors (TIMPS) in the myocardium of patients with deteriorating heart failure requiring left ventricular assist device support. J. Heart Lung Transplant. V. 25. P. 1413.
Fong C.Y., Chak L.L., Biswas A., Tan J.H., Gauthaman K., Chan W.K., Bongso A. 2011. Human Wharton’s jelly stem cells have unique transcriptome profiles compared to human embryonic stem cells and other mesenchymal stem cells. Stem Cell Rev. V. 7. P. 1.
Fong C.Y., Richards M., Manasi N., Biswas A., Bongso A. 2007. Comparative growth behaviour and characterization of stem cells from human Wharton’s jelly. Reprod. Biomed. Online. V. 15. P. 708.
Gutiérrez-Fernández A., Soria-Valles C., Osorio F.G., Gutiérrez-Abril J., Garabaya C., Aguirre A., Fueyo A., Fernández-García M.S., Puente X.S., López-Otín C. 2015. Loss of MT1-MMP causes cell senescence and nuclear defects which can be reversed by retinoic acid. EMBO J. V. 34. P. 1875.
Hirt-Burri N., Scaletta C., Gerber S., Pioletti D.P., Applegate L.A. 2008. Wound-healing gene family expression differences between fetal and foreskin cells used for bioengineered skin substitutes. Artif. Organs. V. 32. P. 509.
Hsieh J.Y., Fu Y.S., Chang S.J., Tsuang Y.H., Wang H.W. 2010. Functional module analysis reveals differential osteogenic and stemness potentials in human mesenchymal stem cells from bone marrow and Wharton’s jelly of umbilical cord. Stem Cells Dev. V. 19. P. 1895.
Jadalannagari S., Converse G., McFall C., Buse E., Filla M., Villar M.T., Artigues A., Mellot A.J., Wang J., Detamore M.S., Hopkins R.A. 2017. Decellularized Wharton’s Jelly from human umbilical cord as a novel 3D scaffolding material for tissue engineering applications. PLoS One. V. 12. e0172098. https://doi.org/10.1371/journal.pone.0172098
Kasper G., Mao L., Geissler S., Draycheva A., Trippens J., Kühnisch J., Tschirschmann M., Kaspar K., Perka C., Duda G.N., Klose J. 2009. Insights into mesenchymal stem cell aging: involvement of antioxidant defense and actin cytoskeleton. Stem Cells. V. 27. P. 1288.
Kessenbrock K., Plaks V., Werb Z. 2010. Matrix metalloproteinases: regulators of the tumor microenvironment. Cell. V. 141. P. 52.
Kornicka K., Marycz K., Tomaszewski K.A., Marędziak M., Śmieszek A. 2015. The effect of age on osteogenic and adipogenic differentiation potential of human adipose derived stromal stem cells (hASCs) and the impact of stress factors in the course of the differentiation process. Oxide. Med. Cell Longev. V. 2015, Article ID 309169. https://doi.org/10.10.1155/2015/309169
Kuilman T., Michaloglou C., Mooi W.J., Peeper D.S. 2010. The essence of senescence. Genes Dev. V. 24. P. 2463.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature. V. 227. P. 680.
Lian J., Lv S., Liu C., Liu Y., Wang S., Guo X., Nan F., Yu H., He X., Sun G., Ma X. 2016. Effects of serial passage on the characteristics and cardiac and neural differentiation of human umbilical cord Wharton’s jelly-derived mesenchymal stem cells. Stem Cells Int. V. 2016. https://doi.org/10.1155/2016/9291013
Lynch K., Pei M. 2014. Age associated communication between cells and matrix: a potential impact on stem cell-based tissue regeneration strategies. Organogenesis. V. 10. P. 289.
Madeira A., da Silva C.L., dos Santos F., Camafeita E., Cabral J.M., Sá-Correia I. (2012). Human mesenchymal stem cell expression program upon extended ex-vivo cultivation, as revealed by 2-DE-based quantitative proteomics. PLoS One. V. 7. e43523. https://doi.org/10.1371/journal.pone.0043523
Makpol S., Jam F.A., Khor S.C., Ismail Z., Mohd Yusof Y.A., Ngah W.Z. 2013. Comparative effects of biodynes, tocotrienol-rich fraction, and tocopherol in enhancing collagen synthesis and inhibiting collagen degradation in stress-induced premature senescence model of human diploid fibroblasts. Oxid. Med. Cell Longev. V. 2013. Article ID: 298 574. https://doi.org/10.1155/2013/298574
Malaquin N., Vercamer C., Bouali F., Martien S., Deruy E., Wernert N., Chwastyniak M., Pinet F., Abbadie C., Pourtier A. 2013. Senescent fibroblasts enhance early skin carcinogenic events via a paracrine MMP-PAR-1 axis. PLoS One. V. 8. e63607. https://doi.org/10.1371/journal.pone.0063607
Mohd Ali N., Boo L., Yeap S.K., Ky H., Satharasinghe D.A., Liew W.C., Ong H.K., Cheong S.K., Kamarul T. 2016. Probable impact of age and hypoxia on proliferation and microRNA expression profile of bone marrow-derived human mesenchymal stem cells. Peer J. V. 4. e1536. https://doi.org/10.7717/peerj.1536
Moon S.K., Cha B.Y., Lee Y.C., Nam K.S., Runge M.S., Patterson C., Kim C.H. 2004. Age-related changes in matrix metalloproteinase-9 regulation in cultured mouse aortic smooth muscle cells. Exp. Gerontol. V. 39. P. 123.
Nagase H., Visse R., Murphy G. 2006. Structure and function of matrix metalloproteinases and TIMPs. Cardiovascular research. V. 69. № 3. P. 562.
Nagase H., Woessner J.F. 1999. Matrix metalloproteinases. J. Biol. Chem. V. 274. P. 21491.
Nekanti U., Rao V.B, Bahirvani A.G, Jan M., Totey S., Ta M. 2010. Long-term expansion and pluripotent marker array analysis of Wharton’s jelly-derived mesenchymal stem cells. Stem Cells Dev. V. 19. P. 117.
Niedernhofer L.J., Gurkar A.U., Wang Y., Vijg J., Hoeijmakers J.H.J., Robbins P.D. 2018. Nuclear genomic instability and aging. Annu. Rev. Biochem. V. 87. P. 295.
Noh E.M., Kim J.M., Hong O.Y., Song H.K., Kim J.S., Kwon K.B., Lee Y.R. 2017. PTEN inhibits replicative senescence-induced MMP-1 expression by regulating NOX4-mediated ROS in human dermal fibroblasts. J. Cell Mol. Med. V. 21. P. 3113.
Page-McCaw A., Ewald A.J., Werb Z. 2007. Matrix metalloproteinases and the regulation of tissue remodelling. Nat. Rev. Mol. Cell Biol. V. 8. P. 221.
Permatasari F., Hu Y.Y., Zhang J.A., Zhou B.R., Luo D. 2014. Anti-photoaging potential of Botulinum Toxin Type A in UVB-induced premature senescence of human dermal fibroblasts in vitro through decreasing senescence-related proteins. J. Photochem. Photobiol. B. V. 133. P. 115.
Pitiyage G.N., Slijepcevic P., Gabrani A., Chianea Y.G., Lim K.P., Prime S.S., Tilakaratne W.M., Fortune F., Parkinson E.K. 2011. Senescent mesenchymal cells accumulate in human fibrosis by a telomere-independent mechanism and ameliorate fibrosis through matrix metalloproteinases. J. Pathol. V. 223. P. 604.
Redaelli S., Bentivegna A., Foudah D., Miloso M., Redondo J., Riva G., Baronchelli S., Dalprà L., Tredici G. 2012. From cytogenomic to epigenomic profiles: monitoring the biologic behavior of in vitro cultured human bone marrow mesenchymal stem cells. Stem Cell Res. Ther. V. 3. https://doi.org/10.1186/scrt138
Savickienė J., Baronaitė S., Zentelytė A., Treigytė G., Navakauskienė R. 2016. Senescence-associated molecular and epigenetic alterations in mesenchymal stem cell cultures from amniotic fluid of normal and fetus-affected pregnancy. Stem Cells Int. V. 2016. Article ID: 2019498.
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. V. 98. P. 93.
Siegel G., Kluba T., Hermanutz-Klein U., Bieback K., Northoff H., Schäfer R. 2013. Phenotype, donor age and gender affect function of human bone marrow-derived mesenchymal stromal cells. BMC Med. V. 11. P. 146. https://doi.org/10.1186/1741-7015-11-146
Towbin H, Staehelin T, Gordon J. 1979. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc. Nat. Acad. Sci. V. 76. P. 4350.
Truong N. C., Bui K. H., Van Pham P. 2018. Characterization of senescence of human adipose-derived stem cells after long-term expansion. Adv. Exp. Med. Biol. V. 1084. P. 1.
Vigetti D., Moretto P., Viola M., Genasetti A., Rizzi M., Karousou E., Pallotti F., De Luca G., Passi A. 2006. Matrix metalloproteinase 2 and tissue inhibitors of metalloproteinases regulate human aortic smooth muscle cell migration during in vitro aging. FASEB J. V. 20. P. 1118.
Wagner W., Horn P., Castoldi M., Diehlmann A., Bork S., Saffrich R., Benes V., Blake J., Pfister S., Eckstein V., Ho A.D. 2008. Replicative senescence of mesenchymal stem cells: a continuous and organized process. PLoS One. V. 3. e2213. https://doi.org/10.1371/journal.pone.0002213
Yabluchanskiy A., Ma Y., Iyer R.P., Hall M.E., Lindsey M.L. 2013. Matrix metalloproteinase-9: many shades of function in cardiovascular disease. Physiol. V. 28. P. 391.
Yi Q, Liu O, Yan F, Lin X, Diao S, Wang L, Jin L, Wang S, Lu Y, Fan Z. 2017. Analysis of senescence-related differentiation potentials and gene expression profiles in human dental pulp stem cells. Cells Tiss. Organs. V. 203. P. 1.
Yu J., Shi J., Zhang Y., Zhang Y., Huang Y., Chen Z., Yang J. 2018. The replicative senescent mesenchymal stem/stromal cells defect in DNA damage response and anti-oxidative capacity. Int. J. Med. Sci. V. 15. P. 771.
Zhang M., Wang Z., Zhao Y., Zhang L., Xu L., Cao L., He W. 2018. The effect of age on the regenerative potential of human eyelid adipose-derived stem cells. Stem Cells Int. V. 2018. https://doi.org/10.1155/2018/5654917
Дополнительные материалы отсутствуют.


