Цитология, 2020, T. 62, № 3, стр. 201-209
Нуклеофосмин, коилин и аргентофильные (AgNOR) белки нейронов черного вещества головного мозга человека
В. В. Гусельникова 1, *, Д. А. Суфиева 1, Д. Э. Коржевский 1
1 Институт экспериментальной медицины
197376 Санкт-Петербург, Россия
* E-mail: Guselnicova.Valeriia@yandex.ru
Поступила в редакцию 24.12.2019
После доработки 16.01.2020
Принята к публикации 16.01.2020
Аннотация
Целью работы было изучение внутриядрышкового распределения нуклеофосмина (В23), коилина (р80), AgNOR-белков и негемового железа в нейронах черного вещества головного мозга человека. Материалом для исследования служили фрагменты среднего мозга человека (n = 10) с верифицированным отсутствием признаков нейродегенерации. Материал был фиксирован в цинк-этанол-формальдегиде – специальном фиксаторе, который обеспечивает высокую сохранность антигенных детерминант и тканевых структур. Результатом представленной работы стало получение новых данных о молекулярной и структурной организации ядрышек нейронов черного вещества головного мозга человека. Было установлено, что в ядрах нейронов черной субстанции присутствует только одно крупное (от 4.2 ± 0.4 до 6.2 ± 0.6 мкм в диаметре) ядрышко. Нуклеофосмин сосредоточен исключительно в ядрышке и распределен в нем неравномерно. Тельца Кахаля, обнаруженные в ядрах большинства нейронов черного вещества головного мозга человека, представляют собой коилинсодержащие структуры, характеризующиеся округлой или овальной формой и размерами около 1 мкм. Накопление коилина отмечено также в многочисленных внутриядерных микроструктурах, которые по локализации и морфологическим характеристикам существенно отличаются от типичных телец Кахаля. Было показано присутствие в ядрышках нейронов черной субстанции AgNOR-белков, распределение которых характеризуется значительной вариабельностью. В ядрышках отдельных нейронов черной субстанции было выявлено негемовое железо, которое в ряде случаев было сконцентрировано в пределах особого компартмента ядрышка – гигантского фибриллярного центра (GFC). Полученные данные будут способствовать прояснению роли ядрышковых белков в функционировании дофаминергических нейронов мозга человека и определению молекулярных сенсоров нуклеолярного стресса, наблюдающегося при нейроденерации.
Ядрышко – эволюционно-консервативный и наиболее крупный структурный домен клеточного ядра, присутствующий в подавляющем большинстве клеток эукариот. Основной функцией этого ядерного компартмента является формирование субъединиц рибосом. В клетках млекопитающих ядрышко включает три основных структурных компонента – фибриллярные центры (ФЦ, FCs), плотный фибриллярный компонент (ПФК, DFC) и гранулярный компонент (ГК, GC) (Raška et al., 2006; Farley et al., 2015). По современным представлениям, в FCs локализованы гены, кодирующие рРНК и некоторые белки, необходимые для транскрипции генов РНК – РНК полимераза I и ее специфический кофактор UBF, а также топоизомераза I. DFC является местом синтеза рРНК и локализации первичных транскриптов пре-рРНК, и содержит такие белки, как С23 (нуклеолин) и основной белок snoРНП – фибрилларин, который обеспечивает ранний процессинг и метилирование пре-рРНК. В GC локализованы процессирующиеся молекулы пре-рРНК и формирующиеся субъединицы рибосом, а также белки, участвующие в транспорте и созревании рибосом – основной фактор сборки рибосомных частиц белок нуклеофосмин (В23), белок Р52 и нуклеолин (С23), участвующий как в транскрипции рДНК, так и в сборке рибосом (Raška et al., 2006; Sirri et al., 2008).
В настоящее время в составе ядрышек выделяют более 700 белков, и это количество продолжает расти (Andersen et al., 2005). Исследования взаимодействия ядрышковых белков осложняются тем, что ядрышки являются динамическими структурами, в которых в зависимости от функционального состояния клетки различные белки постоянно перераспределяются между компонентами ядрышка, а также между ядрышком и другими компартментами ядра (Phair, Misteli, 2000). Динамичное изменение молекулярной организации свойственно ядрышку разных клеток как в норме, так и в условиях клеточного стресса. Характерное изменение ядрышковой организации, сопровождающееся передислокацией ядрышковых белков, снижением транскрипции пре-РНК и увеличением уровня р53 с возможной последующей индукцией апоптоза в ответ на воздействие повреждающих факторов известно под названием “нуклеолярный стресс” (Boulon et al., 2010). На сегодняшний день накоплено большое количество данных, свидетельствующих о роли нуклеолярного стресса в развитии нейродегенеративных заболеваний, таких как болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, боковой амиотрофический склероз (Hetman, Pietrzak, 2012). Так, при моделировании болезни Паркинсона у крыс было показано существенное изменение морфологии ядрышка нейронов черного вещества, что, по мнению исследователей, может служить индикатором нейродегенерации при данном заболевании (Healy-Stoffel et al., 2012). При этом структура и молекулярный состав ядрышек нейронов черного вещества остаются недостаточно охарактеризованными, в отличие от ядрышек других крупных нейронов (например, клеток коры мозжечка или нейронов спинальных ганглиев) (Casafont et al., 2007; Плешакова и др., 2018). В связи с этим изучение молекулярной и структурной организации ядрышек нейронов черного вещества, незатронутого нейродегенерацией, представляется важной задачей современной нейробиологии.
Целью данной работы стало изучение внутриядрышкового распределения белков В23 (нуклеофосмина), р80 (коилина), AgNOR-белков и негемового железа в ядрышках нейронов черного вещества головного мозга человека.
Выбор маркеров, анализируемых в рамках представленной работы, был обусловлен рядом причин. Так, белок В23, согласно литературным данным, является главным маркером ядрышек и высоко экспрессирован в нервных клетках (Pfister, D’Mello, 2015), в том числе в ядрышках катехоламинергических нейронов черного вещества (Коржевский и др., 2017). При этом В23 является основным аргентофильным белком, определяющим окрашивание ядрышек при использовании метода импрегнации серебром (AgNOR-метод). В связи с этим важным представляется сопоставление результатов окрашивания ядрышек нейронов черного вещества, полученных при использовании метода AgNOR, с характером распределения продукта иммуноцитохимической реакции при использовании антител к белку В23. Изучение распределения коилина в ядрах нервных клеток представляется интересным в связи с имеющимися в литературе данными о высокой гетерогенности коилинсодержащих структур и возможной локализации коилина не только в классических тельцах Кахаля, но и в тельцах гистоновых локусов, неканонических тельцах Кахаля (Ходюченко, Красикова, 2014; Боголюбов, 2017; Боголюбова, 2017), а также в ядрышках некоторых типов клеток (Pena et al., 2001; Tapia et al., 2010). Наконец, ранее нами были получены данные о концентрации железа в ядрышках клеток Пуркинье мозжечка и нейронов черного вещества головного мозга крысы и человека (Сухорукова и др., 2013). Предположительно, наблюдаемое нами в ядре нейронов железо является составной частью некоего железосодержащего белка, возможно, ассоциированного с белками ядрышкового организатора. Для подтверждения или опровержения данного предположения важным является проведение сравнительного исследования распределения в ядрышках нейронов железа и некоторых белков, таких как В23 и AgNOR-белков.
МАТЕРИАЛ И МЕТОДИКА
Материалом для исследования служили фрагменты среднего мозга человека (мужчин и женщин в возрасте от 25 до 87 лет, n = 10), причина смерти которых не была связана с заболеваниями и повреждениями головного мозга, а при детальном гистологическом исследовании не были выявлены признаки нейродегенерации. Материал был получен из архива отдела общей и частной морфологии Института экспериментальной медицины. Программа исследований имеет положительное заключение Локального этического комитета ФГБНУ “ИЭМ”. Материал был фиксирован в цинк-этанол-формальдегиде – специальном фиксаторе, который обеспечивает высокую сохранность антигенных детерминант при проведении иммуногистохимической реакции (Korzhevskii et al., 2015) и залит в парафин по общепринятой методике. С парафиновых блоков изготавливали срезы толщиной 5, 7 и 12 мкм, которые наклеивали на предметные стекла с адгезивным покрытием Polysine, SuperFrost Plus Gold (Menzel, Германия) или Histobond (Marienfeld, Германия). Выявление негемового железа (Fe2+ и Fe3+) осуществляли по методу Перлса с последующим усилением продукта реакции диаминобензидином (SpringBioscience, США) в соответствии с опубликованным протоколом (Григорьев и др., 2016). Гистохимическое выявление AgNOR-белков осуществляли с помощью модифицированного метода импрегнации серебром (Коржевский, 1990). Иммуногистохимическое выявление коилина осуществляли с помощью мышиных моноклональных антител (клон F-7, разведение 1 : 150, Santa Cruz Biotech, США), нуклеофосмина (B23) – с помощью мышиных моноклональных антител (клон FC82291, разведение 1 : 200, Sigma-Aldrich, США). В случае использования световой микроскопии в качестве вторичных реагентов в обоих случаях применяли MACH 2 Universal HRP Polymer (Biocare Medical, США). Визуализацию продукта реакции в данном случае проводили с помощью хромогена DAB (Spring Bioscience, США). Часть срезов после постановки иммуноцитохимической реакции подкрашивали крезиловым фиолетовым или астровым синим (Merck, Германия). В качестве положительного контроля антигена при постановке иммуногистохимических реакций на белок В23 и коилин были использованы препараты головного мозга половозрелых крыс-самцов породы Вистар. Отрицательным контролем антител служил один из срезов обрабатываемой серии препаратов, на который вместо раствора первичных антител наносили блокировочный раствор Protein Block (Spring Bioscience, США).
После постановки иммуноцитохимической реакции на белок В23 была проведена количественная оценка размера ядрышек нейронов черного вещества. Диаметр ядрышка измеряли с использованием компьютерной программы LAS EZ (Leica, Германия). Данные представляли в виде Х ± σ (среднее значение ± стандартное отклонение). Доля нейронов, имеющих гигантский фибриллярный центр (GFC), определяли при изучении ядрышка 25 случайно выбранных нервных клеток (для каждого исследованного случая), в которых ядрышко целиком попадало в срез при увеличении объектива ×100 (масляная иммерсия). Результат выражали в процентах (%). В анализ брали только те нейроны, в цитоплазме которых четко просматривались гранулы нейромеланина (т.е. дофаминергические нейроны). Полученные количественные данные обрабатывали в программе Excel (Microsoft, США).
Для исследования нуклеофосмина и коилина с помощью метода конфокальной лазерной микроскопии в обоих случаях после обработки срезов первичными антителами применяли моновалетный Fab-фрагмент антимышиного иммуноглобулина осла, меченный биотином (Jackson ImmunoResearch, США), и конъюгат стрептавидина с флуорохромом Cy2 (Jackson ImmunoResearch, США), после чего препараты без предварительного обезвоживания заключали в водорастворимую среду Fluorescence Mounting Medium (Agilent, США). Анализ полученных препаратов проводили, используя световой микроскоп Leica DM750 и конфокальный лазерный микроскоп LSM710 (Zeiss, Германия).
РЕЗУЛЬТАТЫ
Анализ препаратов после проведения иммуноцитохимической реакции на нуклеофосмин (B23) показал, что все выявляемые нейроны черного вещества головного мозга человека характеризуются наличием одного крупного ядрышка (рис. 1а, стрелка). При этом для разных лиц из изученной выборки была характерна определенная вариабельность в диаметре ядрышек, который менялся от 4.2 ± 0.4 до 6.2 ± 0.6 мкм. Присутствие в ядрах нейронов черного вещества добавочных ядрышек отмечено не было. Выявляемые при постановке иммуноцитохимической реакции на В23 ядрышки характеризовались четкостью контуров и преимущественно округлой формой и были интенсивно окрашены. В 75–100% проанализированных нейронов в составе ядрышка четко просматривалась слабо окрашенная область гигантского фибриллярного центра (giant fibrillar center, GFC). Данная структура характеризовалась округлой формой, преимущественной локализацией на периферии ядрышка и размерами 1–2 мкм в диаметре (рис. 1а).
Рис. 1.
Распределение белка В23 (а, б), AgNOR-белков (в, г), коилина (д, е) и негемового железа (ж, з) в нейронах черного вещества головного мозга человека. а – Иммуноцитохимическая реакция на белок B23 с подкраской астровым синим. Стрелка указывает на ярко окрашенное ядрышко, содержащее слабо окрашенный гигантский фибриллярный центр на периферии. НМ – нейромеланин. Объектив Plan 100×/1.25 Oil (масляная иммерсия). б – Иммуноцитохимическая реакция на белок B23, визуализация с помощью флуорохрома Cy2 (зеленый цвет). Стрелка указывает на иммунопозитивную гранулу, локализованную в области гигантского фибриллярного центра. Конфокальная лазерная микроскопия. Последовательные одиночные оптические срезы, выполненные с интервалом 0.4 мкм. Объектив Plan-Apochromat 100×/1.40 Oil DIC M27 (масляная иммерсия). в, г – Выявление аргентофильных белков методом AgNOR с подкраской астровым синим. Стрелка указывает на ядрышко: в – слабо окрашенное ядрышко с четким контуром, в его пределах просматривается практически неокрашенная область гигантского фибриллярного центра; г – слабо окрашенное ядрышко с интенсивно окрашенным гигантским фибриллярным центром. НМ – нейромеланин. Объектив Plan 100×/1.25 Oil (масляная иммерсия). д, е – Иммуноцитохимическая реакция на коилин. Стрелка указывает на слабо иммунопозитивное ядрышко с неокрашенной областью гигантского фибриллярного центра, короткая стрелка – на типичные тельца Кахаля. Иммунопозитивную реакцию на коилин дают также точечные микроструктуры, распределенные по всему объему ядра. НМ – нейромеланин. д – Микроскопия в проходящем свете. Объектив Plan 100×/1.25 Oil (масляная иммерсия). е – Конфокальная лазерная микроскопия (визуализация с помощью флуорохрома Cy2, зеленый цвет). Изображение является суперпозицией 35 оптических срезов, выполненных с интервалом 0.2 мкм. Объектив Plan-Apochromat 100×/1.40 Oil DIC M27 (масляная иммерсия). ж, з – Выявление негемового железа по методу Перлса с последующим усилением продукта реакции диаминобензидином. Стрелка указывает на ядрышко со слабо окрашенным (ж) и интенсивно (неравномерно) окрашенным (з) гигантским фибриллярным центром. Объектив Plan 100×/1.25 Oil (масляная иммерсия).
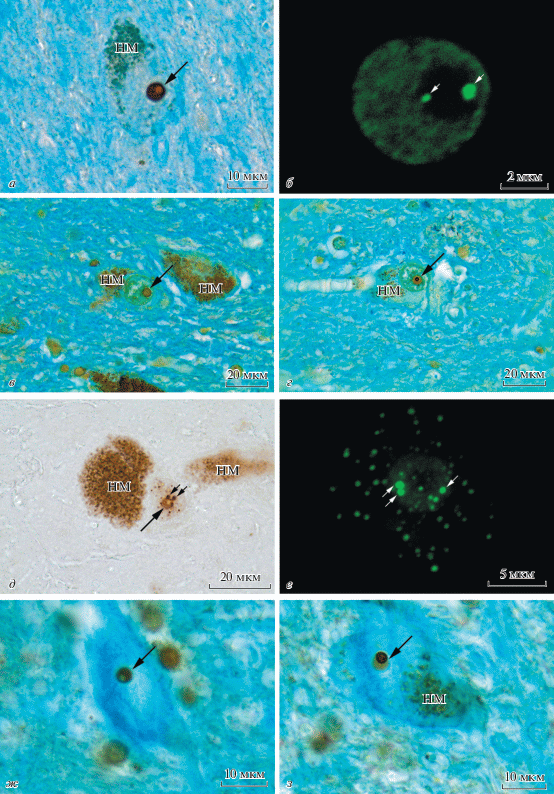
Изучение распределения белка В23 в ядрышке с применением метода конфокальной микроскопии (рис. 1б) позволило исключить возможность ложного увеличения размеров ядрышка за счет диффузии хромогена и подтвердило точность измерений. Зона GFC характеризовалась слабой флуоресценцией при реакции на белок B23. Была отмечена неравномерность в распределении белка В23 в пределах ядрышка, при которой более интенсивная флуоресценция наблюдалась по периферии данной структуры. Важным наблюдением стало то, что в пределах GFC некоторых нейронов было отмечено присутствие ярко флуоресцирующей гранулы (рис. 1б, стрелка). Данная структура, концентрирующая белок В23, была локализована, как правило, в периферической части GFC. В одном из исследованных случаев в пределах GFC наблюдались две В23-иммунопозитивные гранулы (рис. 1б, стрелка).
Для селективного выявления ядрышек в ядрах нейронов был применен также классический метод импрегнации серебром аргентофильных (AgNOR) белков, ассоциированных с ядрышковым организатором (рис. 1в, г). При анализе препаратов, обработанных импрегнационным методом, для нейронов черного вещества была отмечена выраженная гетерогенность в интенсивности и распределении окрашивания в пределах ядрышка. Так, в ядрах одних нейронов ядрышко характеризовалось слабым общим окрашиванием с четким контуром (рис. 1в, стрелка). При этом в одних клетках ядрышко было окрашено равномерно, в то время как в других (соседних) нейронах в его пределах четко просматривался GFC, который в данном случае выглядел как практически неокрашенная область округлой формы, локализованная (в большинстве случаев) на периферии слабо окрашенного ядрышка. Иногда GFC имел четко очерченный контур, сопоставимый по интенсивности окрашивания с контуром ядрышка. Для части нейронов, на фоне слабой интенсивности реакции в ядрышке в целом, была отмечена интенсивная реакция в области GFC (рис. 1г). Наконец, присутствовали нейроны, у которых ядрышко характеризовалось не только интенсивным окрашиванием GFC, но и присутствием многочисленных аргентофильных структур, выглядящих как точечные вкрапления, локализованные в пределах ядрышка вне GFC. В ряде случаев было выявлено присутствие интенсивно окрашенных структур, лежащих в пределах нуклеоплазмы вне ядрышка. Данные структуры характеризовались разнообразной формой (округлой, овальной, палочковидной и др.) и линейными размерами 1–2 мкм. Часть из них была ассоциирована с ядрышком, а часть – удалена от него.
Изучение препаратов после проведения иммуноцитохимической реакции на коилин показало, что в ядрах большинства нейронов черного вещества головного мозга человека присутствуют коилинсодержащие структуры, которые по форме, размерам и локализации соответствуют классическим тельцам Кахаля. Данные структуры имеют преимущественно округлую или овальную форму и диаметр около 1 мкм (рис. 1д, короткая стрелка). В большинстве случаев их количество в пределах одного ядра варьирует от 1 до 3. При этом хотя бы одно из выявляемых телец ассоциировано с ядрышком. Интересно отметить, что хотя в большинстве случаев ядрышки нейронов черного вещества характеризуются отсутствием коилина, в единичных случаях ядрышко оказывается иммунопозитивным по данному маркеру (рис. 1д, стрелка), причем интенсивность реакции в данном случае слабее по сравнению с таковой, отмеченной для телец Кахаля. В иммунопозитивном по коилину ядрышке четко просматривается неокрашенная область GFC. Наконец, помимо типичных телец Кахаля в ядрах нейронов черного вещества было показано присутствие структур, также характеризующихся интенсивной реакцией на коилин, но при этом существенно отличающихся от типичных телец Кахаля. Данные структуры характеризуются меньшими (по сравнению с тельцами Кахаля) размерами (менее 0.5 мкм) и в виде многочисленных иммунопозитивных точек равномерно распределены по всему объему ядра без видимой приуроченности к ядрышку или типичным тельцам Кахаля (рис. 1д). Окраска нейромеланина (НМ), присутствующая на рис. 1д, не является специфической иммуногистохимической окраской и обусловлена тем, что НМ – это пигмент, сходный с меланином кожи. Он характеризуется наличием собственной коричнево-черной окраски, которая в данном случае (рис. 1д) совпадает с цветом продукта иммуногистохимической реакции. Изучение распределения коилина с применением метода конфокальной микроскопии (рис. 1е) подтвердило данные, полученные при использовании световой микроскопии. В частности, было отмечено наличие коилина не только в тельцах Кахаля (рис. 1е, стрелка), но и в ядрышках единичных нейронов, а также в многочисленных внутриядерных микроструктурах (рис. 1е). НМ не обладает способностью к автофлуоресценции, поэтому не выявляется на препаратах, полученных с помощью конфокальной лазерной микроскопии.
Как и в случае использования метода серебрения, высокая гетерогенность в окрашивании ядрышек была отмечена при проведении реакции на железо по Перлсу (рис. 1ж, з). В ядрах одних нейронов ядрышко характеризовалось отсутствием окрашивания, в ядрах других – равномерно слабым окрашиванием. В части нейронов на фоне умеренно окрашенного ядрышка выделялась более светло окрашенная область GFC (рис. 1ж), которая иногда была отграничена от других компартментов ядрышка интенсивно окрашенной пограничной зоной. При этом в пределах GFC могли присутствовать единичные (1–2) ярко окрашенные гранулы. В части клеток все ядрышко было интенсивно окрашено (равномерно или с более интенсивно окрашенным контуром). В ядрышках некоторых клеток, на фоне общей интенсивной окраски, четко выявлялся (в виде слабо окрашенного участка округлой формы) GFC. Наконец, присутствовали клетки, в ядрах которых, наоборот, область GFC была интенсивно окрашена, в то время как все остальное ядрышко характеризовалось слабой окраской (рис. 1з). Кроме того, в нескольких случаях было отмечено присутствие в ядрах нейронов мелких (менее 1 мкм) интенсивно окрашенных структур (округлой формы, в виде точек), лежащих вне ядрышка, но иногда ассоциированных с ним.
ОБСУЖДЕНИЕ
Дофаминергические нейроны черного вещества головного мозга в настоящее время являются объектом пристального внимания со стороны исследователей. Это обусловлено тем, что массовая гибель этих нейронов наблюдается при таком распространенном нейродегенеративном заболевании, как болезнь Паркинсона. На сегодняшний день известно, что нейроны черной субстанции имеют ряд характерных особенностей, таких как наличие тирозингидроксилазы, присутствие в цитоплазме гранул нейромеланина, низкий уровень экспрессии общенейрональных маркеров – белка NeuN, белка PGP 9.5 и нейронспецифической енолазы (Сухорукова и др., 2014; Korzhevskii et al., 2019). При этом организация ядрышка нейронов черной субстанции, особенно у человека, остается малоизученной, несмотря на то, что в литературе имеются данные, свидетельствующие о возможной роли нуклеолярного стресса в патогенезе болезни Паркинсона (Parlato, Liss, 2014). Это обуславливает возрастающий интерес исследователей к ядрышку нейронов черной субстанции.
При изучении ядрышек дофаминергических нейронов в рамках представленной работы нами было отмечено, что при постановке иммуногистохимической реакции на белок В23 в большинстве ядрышек присутствует слабоокрашенная область – структура, ранее известная как ядрышковая вакуоль (Оксова, 1972). В настоящее время показано, что эта структура, часто выявляемая в ядрышках крупных нейронах при окраске основными анилиновыми красителями, в действительности представляет собой гигантский фибриллярный центр (GFC) (Casafont et al., 2007). На протяжении длительного времени присутствие в ядрышках GFC считалось признаком сниженной метаболической и транскрипционной активности клеток (Lafarga et al., 1989, 1991; Koberna et al., 2002; Raška et al., 2006). Однако впоследствии было показано, что GFC в норме присутствует в сенсорных нейронах ганглиев – клетках, для которых характерна высокая активность биогенеза рибосом (Casafont et al., 2007). По данным ультраструктурных исследований, представленным в указанной работе, GFC представляет собой область диаметром 1–2 мкм, которая характеризуется фибриллярной структурой и низкой электронной плотностью. Иммуноцитохимическое исследование показало высокое содержание в GFC фактора UBF, который, по мнению авторов, может выступать в качестве маркера этого ядрышкового субкомпартмента. Также, было продемонстрировано присутствие в составе GFC РНК-полимеразы I, ДНК-топоизомеразы I, белков SUMO-1 и Ubc9 (Casafont et al., 2007).
Нами было показано присутствие GFC в ядрышках большинства нейронов (75–100%) черного вещества головного мозга человека. Обособление GFC в данном случае не является следствием сегрегации ядрышковых компонентов, на что указывают большие размеры ядрышек нейронов. Учитывая имеющиеся в литературе данные (Casafont et al., 2007), можно предположить, что, как и в случае клеток нервных ганглиев, формирование GFC в ядрышках нейронов черной субстанции является следствием интенсивного синтеза в этих клетках рРНК. Нами было отмечено, что зона GFC в ядрышках нейронов черного вещества головного мозга человека характеризуется слабой флуоресценцией при реакции на белок B23, что свидетельствует о пониженной концентрации (но не об отсутствии) этого белка в данном ядрышковом компартменте. Важной находкой стала также идентификация в пределах GFC некоторых нейронов В23-иммунопозитивных гранул. Вопрос о функциональном значении подобного распределения данного белка в ядрышке нейронов остается открытым. Возможно, наблюдаемая морфологическая картина является следствием проекции участков плотного фибриллярного компонента ядрышка в область GFC, что было показано с помощью метода электронной микроскопии (Casafont et al., 2007). Согласно данным литературы, белок В23 может присутствовать в плотном фибриллярном компоненте ядрышка (DFC) (Raška, Dundr, 1993), поэтому в случае проецирования участков DFC в область GFC такие участки могут выглядеть как “гранулы”, лежащие в пределах GFC (при использовании метода иммуногистохимии и конфокальной микроскопии). Дальнейшие исследования с применением методов иммуноэлектронной микроскопии позволят прояснить этот вопрос.
Применение метода серебрения в рамках проведенного исследования позволило показать высокую гетерогенность в интенсивности и распределении окрашивания в пределах ядрышек отдельных нейронов. Согласно данным литературы, основными аргентофильными белками, определяющими характер окраски при постановке реакции AgNOR, являются нуклеолин (С23) и нуклеофосмин (В23) (Daskal et al., 1980; Derenzini et al., 2006). Полученные нами данные лишь частично согласуются с этим утверждением, так как при проведении иммуногистохимической реакции на В23 в большинстве нейронов распределение продукта реакции было единообразно, в то время как при постановке реакции AgNOR присутствовало множество различных вариантов распределения окрашивания. Кроме того, не было выявлено наличия гранул внутри GFC ни в одном из исследованных случаев. Такие различия в распределении окрашивания при постановке реакции AgNOR и иммуногистохимической реакции на В23 могут быть обусловлены тем, что помимо В23 аргентофильными являются и другие ядрышковые белки, такие как РНК-полимераза I, C23, pp135 и др. (Vandelaer et al., 1999). В этом случае открытым остается вопрос о том, какие белки импрегнируются в тех случаях, когда интенсивно окрашивается фибриллярный центр, так как концентрация В23 в пределах GFC низкая. Отсутствие гранул в области GFC при постановке реакции AgNOR может быть объяснено большей чувствительностью иммуногистохимической реакции по сравнению с импрегнационным методом.
Как и в случае использования метода серебрения, при постановке реакции на железо по Перлсу была отмечена высокая гетерогенность в окрашивании ядрышек. Ранее нами было показано присутствие железа в ядрышке нервных клеток крысы и человека (Сухорукова и др., 2013). При этом остается не до конца понятным, в какой форме железо накапливается в ядрышке. Несомненно, это негемовое железо (исходя из принципа использованной гистохимической реакции), поэтому оно не может присутствовать в составе таких железосодержащих белков, как нейроглобин и цитоглобин, один из которых определяется в ядре нервной клетки (Geuens et al., 2003). Согласно последним данным (Reinert et al., 2019), одним из возможных железосодержащих белков в составе ядрышек нейронов может быть ферритин. Кроме того, железо обладает способностью связываться непосредственно с РНК, причем связывающая способность с рРНК выше, чем с мРНК или тРНК, что приводит к более высокому содержанию железа в ядрышке по сравнению с другими субкомпартментами ядер нервных клеток (Reinert et al., 2019).
Интересной находкой стала также идентификация нейронов, в ядрышках которых GFC был интенсивно окрашен при реакции на железо (на фоне слабой общей окраски ядрышка), что может быть свидетельством накопления негемового железа в гигантском фибриллярном центре ядрышка нейронов черной субстанции. Функциональное значение такого концентрирования железа в нейронах черного вещества головного мозга человека остается не ясным. Дальнейшее изучение данного вопроса имеет важное значение в связи с тем, что ионы железа, как показано, способны участвовать в процессах образования свободных радикалов, неконтролируемый синтез которых приводит к повреждению клеточных макромолекул и гибели клеток (Emerit et al., 2001). Известно, что ионы железа участвуют в патогенезе нейродегенеративных заболеваний, включая болезнь Паркинсона, которая сопровождается дегенерацией нейронов черного вещества (Youdim et al., 2004).
Изучение распределения коилина в нейронах черного вещества показало, что этот белок сконцентрирован в пределах классических телец Кахаля, для которых он является маркерным белком. Однако, наряду с тельцами Кахаля, нами были выявлены другие коилинсодержащие точечные микроструктуры, которые по морфологическим характеристикам и локализации отличались от типичных телец Кахаля. Так, размер обнаруженных микроструктур визуально был меньше 0.5 мкм, в то время как, согласно данным Лафарга с соавторами (Lafarga et al., 2017), размер типичных телец Кахаля у нейронов варьирует от 0.5 до 1.5 мкм в диаметре. Количество обнаруженных микроструктур иногда превышало 30 шт/кл., что значительно выше среднего количества телец Кахаля в крупных нейронах ганглиев человека, где оно составляет 13.4 шт/кл (Lafarga et al., 2017). Наконец, описанные микроструктуры были равномерно распределены по всему объему нуклеоплазмы, что не характерно для типичных телец Кахаля, которые, как правило, ассоциированы с ядрышком.
Функциональное значение обнаруженных коилинсодержащих микроструктур остается не ясным. Возможно, их присутствие в ядрах нейронов черной субстанции связано с высокой синтетической активностью этих клеток. Так, известно, что дофаминергические нейроны нигростриальной системы, составляющие менее 1% от общего количества нервных клеток, синтезируют 80% дофамина головного мозга (Chinta, Andersen, 2005; Finkelstein, 2011). Конститутивный синтез такого количества дофамина, который осуществляется с помощью двух ферментов – тирозингидроксилазы и ДОФА-декарбоксилазы, предполагает хорошее развитие в этих клетках соответствующей молекулярной машинерии, в том числе высокий уровень синтеза snРНК и snoРНК, которые необходимы для сплайсинга пре-мРНК и биогенеза рибосом. Так как тельца Кахаля играют важную роль в биогенезе snРНК и snoРНК, можно предположить, что появление в нейронах черного вещества дополнительных коилинсодержащих структур является морфологическим проявлением высокой транскрипционной активности этих клеток. Принадлежность выявленных микроструктур к тельцам гистоновых локусов – структурам, функцией которых является участие в динамике и сборке факторов процессинга пре-мРНК генов гистонов (Ходюченко, Красикова, 2014) – кажется маловероятным, учитывая тот факт, что зрелые нейроны находятся вне митотического цикла и активный синтез белков-гистонов для них не характерен.
Таким образом, представленная работа является первым комплексным исследованием молекулярной организации ядрышка нейронов черного вещества головного мозга человека. Полученные результаты вносят дополнение в имеющиеся представления о структуре и молекулярном составе ядрышка дофаминергических нейронов. Дальнейшие исследования в этой области могут способствовать определению взаимосвязи между конкретными структурно-молекулярными характеристиками и функциональной активностью ядрышка нервных клеток, что позволит объективизировать использование ядрышковых маркеров при оценке функционального статуса нейронов, в том числе при определении ранних признаков нейродегенерации.
Список литературы
Боголюбов Д.С. 2018. Интерхроматиновые гранулы – универсальные структуры клеточного ядра: морфология, молекулярный состав, функции. Санкт-Петербург: Наука. 188 с. (Bogolyubov D.S. 2018. Interchromatin granule clusters are universal nuclear domains: morphology, molecular composition, functions. SPb: Nauka. 188 p.)
Боголюбова И.О. 2017. Гетерогенность коилинсодержащих доменов в ядрах ранних эмбрионов мыши. Цитология. Т. 59. № 4. С. 290. (Bogolyubova I.O. 2017. Heterogeneity of coilin-containing nuclear domains in early mouse embryos. Cell Tissue Biol. V. 11. № 4. P. 293.)
Григорьев И.П., Колос Е.А., Сухорукова Е.Г., Коржевский Д.Э. 2016. Современные гистохимические методы определения тканевого железа, основанные на использовании реакции Перлса. Морфология. Т. 149. № 1. С. 85. (Grigoriyev I.P., Kolos Ye.A., Sukhorukova Ye.G., Korzhevskiy D.E. 2016. Current histochemical methods of tissue iron demonstration based on Perls’ reaction. Morfologiia. V. 149. № 1. P. 85.)
Коржевский Д.Э. 1990. Метод выявления ядрышек в ядрах клеток разных тканей. Арх. анат. Т. 99. № 12. С. 58. (Korzhevskiy D.E. 1990. A method for detecting nucleoli in the nuclei of cells of different tissues. Arch. Anat. V. 99. № 12. P. 58.)
Коржевский Д.Э., Гусельникова В.В., Кирик О.В., Сухорукова Е.Г., Григорьев И.П. 2017. Пространственная организация внутриядерных структур дофаминергических нейронов мозга человека. Acta Naturae (русскоязычная версия). Т. 9. № 3. С. 85. (Korzhevskii D.E., Gusel’nikova V.V., Kirik O.V., Sukhorukova E.G., Grigorev I.P. 2017. The spatial organization of the intranuclear structures of human brain dopaminergic neurons. Acta Naturae (english version). V. 9. № 3. P. 81.)
Оксова Е.Е. 1972. О вакуолизации ядрышка нейронов коры головного мозга человека. Арх. анат. Т. 63. № 10. С. 33. (Oksova E.E. 1972. About vacuolization of the nucleolus of neurons in the human cerebral cortex. Arch. Anat. V. 63. № 10. P. 33.)
Плешакова И.М., Гусельникова В.В., Суфиева Д.А., Коржевский Д.Э. 2018. Распределение белков нуклеофосмина (B23) и триметилированного по лизину 20 гистона H4 (H4K20me3) в клетках-зернах коры мозжечка крысы. Цитология. Т. 60. № 8. С. 628. (Pleshakova I.M., Guselnikova V.V., Sufiyeva D.A., Korzhevsky D.E. Distribution of nucleophosmine proteins (B23) and hyston H4 lysine 20 (Н4К20me3) in the granule cells of the rat brain cerebellum. Cell Tissue Biol. V. 12. № 6. P. 484.)
Сухорукова Е.Г., Алексеева О.С., Коржевский Д.Э. 2014. Катехоламинергические нейроны головного мозга млекопитающих и нейромеланин. Журнал эвол. биох. и физиол. Т. 50. № 5. С. 336. (Sukhorukova E.G., Alekseeva O.S., Korzhevsky D.E. 2014. Catecholaminergic neurons of mammalian brain and neuromelanin. J. Evol. Biochem. Phys. V. 50. № 5. P. 383.)
Сухорукова Е.Г., Григорьев И.П., Кирик О.В., Алексеева О.С., Коржевский Д.Э. 2013. Внутриядерная локализация железа в нейронах головного мозга млекопитающих. Журнал эвол. биох. и физиол. Т. 49. № 3. С. 236. (Sukhorukova E.G., Grigoriev I.P., Kirik O.V., Alekseeva O.S., Korzhevskii D.E. 2013. Intranuclear localization of iron in neurons of mammalian brain. J. Evol. Biochem. Phys. V. 49. № 3. P. 370.)
Ходюченко Т.А., Красикова А.В. 2014. Тельца Кахаля и тельца гистонового локуса: молекулярный состав и функции. Онтогенез. Т. 45. № 6. С. 363. (Khodyuchenko T.A., Krasikova A.V. 2014. Cajal bodies and histone locus bodies: Molecular composition and function. Russ. J. Dev. Biol. V. 45. № 6. P. 297.)
Andersen J.S., Lam Y.W., Leung A.K., Ong S.E., Lyon C.E., Lamond A.I., Mann M. 2005. Nucleolar proteome dynamics. Nature. V. 433. P. 77.
Boulon S., Westman B.J., Hutten S., Boisvert F.M., Lamond A.I. 2010. The nucleolus under stress. Mol. Cell. V. 40. P. 216.
Casafont I., Bengoechea R., Navascués J., Pena E., Berciano M.T., Lafarga M. 2007. The giant fibrillar center: a nucleolar structure enriched in upstream binding factor (UBF) that appears in transcriptionally more active sensory ganglia neurons. J. Struct. Biol. V. 159. P. 451.
Chinta S.J., Andersen J.K. 2005. Dopaminergic neurons. Int. J. Biochem. Cell Biol. V. 37. P. 942.
Daskal Y., Smetana K., Busch H. 1980. Evidence from studies on segregated nucleoli that nucleolar silver staining proteins C23 and B23 are in the fibrillar component. Exp. Cell Res. V. 127. P. 285.
Derenzini M., Pasquinelli G., O’Donohue M., Ploton D., Thiry M. 2006. Structural and functional organization of ribosomal genes within the mammalian cell nucleus. J. Histochem. Cytochem. V. 54. P. 131.
Emerit J., Beaumont C., Trivin F. 2001. Iron metabolism, free radicals, and oxidative injury. Biomed. Pharmacother. V. 55. P. 333.
Farley K.I., Surovtseva Y., Merkel J., Baserga S.J. 2015. Determinants of mammalian nucleolar architecture. Chromosoma. V. 124. P. 323.
Finkelstein D. 2011. Towards new therapies for Parkinson’s disease. Rijeka (Croatia): InTech, 408 p.
Geuens E., Brouns I., Flamez D., Dewilde S., Timmermans J.P., Moens L. 2003. A globin in the nucleus! J. Biol. Chem. V. 278. P. 30417.
Healy-Stoffel M., Ahmad S.O., Stanford J.A., Levant B. 2012. A novel use of combined tyrosine hydroxylase and silver nucleolar staining to determine the effects of a unilateral intrastriatal 6-hydroxydopamine lesion in the substantia nigra: a stereological study. J. Neurosci. Methods. V. 210. P. 187.
Hetman M., Pietrzak M. Emerging roles of the neuronal nucleolus. 2012. Trends Neurosci. 35(5): 305–314.
Koberna K., Malinsky K., Pliss A., Masata A., Vecerova M., Fialova M., Bednar J., Raška I. 2002. Ribosomal genes in focus: newtranscripts label the dense fibrillar components and form clustersindicative of “Christmas trees” in situ. J. Cell Biol. V. 157. P. 743.
Korzhevskii D. E., Grigor’ev I.P., Sukhorukova E.G., Gusel’nikova V.V. 2019. Immunohistochemical characteristics of neurons in the substantia nigra of the human brain. Neurosci. Behav. Physiol. V. 49. P. 109.
Korzhevskii D.E., Sukhorukova E.G., Kirik O.V., Grigorev I.P. 2015. Immunohistochemical demonstration of specific antigens in the human brain fixed in zinc-ethanol-formaldehyde. Eur. J. Histochem. V. 59. P. 2530.
Lafarga M., Andres M.A., Berciano M.T., Maquiera E. 1991. Organization of nucleoli and nuclear bodies in osmotically stimulated supraoptic neurons of the rat. J. Comp. Neurol. V. 308. P. 329.
Lafarga M., Berciano M.T., Herva’s J.P., Villegas J. 1989. Nucleolar organization in granule cell neurons of the rat cerebellum. J. Neurocytol. V. 18. P. 19.
Lafarga M., Tapia O., Romero A.M., Berciano M.T. 2017. Cajal bodies in neurons. RNA Biol. V. 14. P. 712.
Parlato R., Liss B. 2014. How Parkinson’s disease meets nucleolar stress. Biochim. Biophys. Acta. V. 1842. P. 791.
Pena E., Berciano M.T., Fernandez R., Ojeda J.L., Lafarga M. 2001. Neuronal body size correlates with the number of nucleoli and Cajal bodies, and with the organization of the splicing machinery in rat trigeminal ganglion neurons. J. Comp. Neurol. V. 430. P. 250.
Pfister J.A., D’Mello S.R. 2015. Insights into the regulation of neuronal viability by nucleophosmin/B23. Exp. Biol. Med. (Maywood). V. 240. P. 774.
Phair R.D., Misteli T. 2000. High mobility of proteins in the mammalian cell nucleus. Nature. V. 404. P. 604.
Raška I., Dundr M. 1993. Compartmentalization of the cell nucleus: case of the nucleolus. Chromosome Today. V. 11. P. 101.
Raška I., Shaw P.J., Cmarko D. 2006. New insights into nucleolar architecture and activity. Int. Rev. Cytol. V. 255. P. 177.
Reinert A., Morawski M., Seeger J., Arendt T., Reinert T. 2019. Iron concentrations in neurons and glial cells with estimates on ferritin concentrations. BMC Neurosci. V. 20. P. 25.
Sirri V., Urcuqui-Inchima S., Roussel P., Hernandez-Verdun D. 2008. Nucleolus: the fascinating nuclear body. Histochem. Cell Biol. V. 129. P. 13.
Tapia O., Bengoechea R., Berciano M.T., Lafarga M. 2010. Nucleolar targeting of coilin is regulated by its hypomethylation state. Chromosoma. V. 119. P. 527.
Vandelaer M., Thiry M., Goessens G. 1999. AgNOR proteins from morphologically intact isolated nucleoli. Life Sci. V. 64. P. 2039.
Youdim M.B., Stephenson G., Ben Shachar D. 2004. Ironing iron out in Parkinson’s disease and other neurodegenerative diseases with iron chelators: a lesson from 6-hydroxydopamine and iron chelators, desferal and VK-28. Ann. N. Y. Acad. Sci. V. 1012. P. 306.
Дополнительные материалы отсутствуют.


