Цитология, 2020, T. 62, № 4, стр. 231-237
Клеточный состав культур, получаемых из ткани эндометрия
А. П. Домнина 1, *, М. А. Петросян 2
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
* E-mail: aldomnina@mail.ru
Поступила в редакцию 21.01.2020
После доработки 28.01.2020
Принята к публикации 28.01.2020
Аннотация
Одним из ключевых этапов в наступлении беременности является имплантация эмбриона и развитие плаценты. Эти процессы обеспечиваются способностью стромальных клеток эндометрия трансформироваться в децидуальные клетки. У женщин в репродуктивном периоде под воздействием половых стероидных гормонов эстрогена и прогестерона, синтезируемых в яичниках, эндометрий подвергается отслаиванию и восстановлению. Высокий регенеративный потенциал эндометрия возможен благодаря наличию в нем стволовых клеток. Современные технологии позволяют выделять эти клетки и культивировать in vitro. Знание свойств стволовых клеток эндометрия имеет значение при различных патологических состояниях, которые могут приводить к нарушению функции эндометрия и бесплодию. Настоящий обзор посвящен изучению свойств эндометриальных клеток при различных способах их получения.
В женской репродуктивной системе матка является единственным органом, в котором возможно полноценное эмбриональное развитие. Полость матки выстлана эндометрием, который состоит из двух слоев: функционального, ограничивающего полость матки и базального, примыкающего к миометрию (рис. 1а). Оба этих слоя содержат эпителиальные железы и соединительную ткань, которая включает стромальные фибробласты и сосудистую сеть (Figueira et al., 2011). Основной функцией эндометрия является обеспечение наступления и поддержание беременности на всех этапах. Человек один из немногих видов, у которых происходит менструальное кровотечение. В течение менструального цикла под влиянием последовательной смены гормонов, секретируемых яичниками, в ткани эндометрия происходят изменения, которые принято разделять на фазы: менструальную, пролиферативную и секреторную (рис. 1б).
Рис. 1.
Схематичное изображение гистологического строения эндометрия человека (а) и гистологических изменений в нем (б), происходящих в разные фазы менструального цикла.
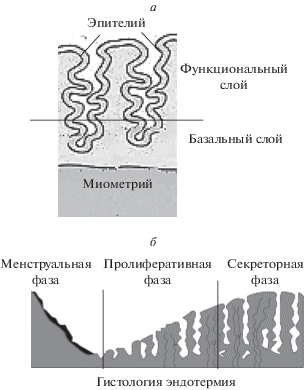
После овуляции желтое тело в яичнике секретирует прогестерон, основная роль которого заключается в децидуальной трансформации эндометрия и формировании его рецептивности. При отсутствии беременности происходит регресс желтого тела, что приводит к резкому снижению уровня циркулирующего в крови прогестерона. Это вызывает локальный воспалительный ответ в эндометрии, включающий инфильтрацию лейкоцитов, высвобождение цитокинов, отек стромы и активацию матриксных металлопротеиназ (Jabbour et al., 2006). В результате происходит отслаивание функционального слоя эндометрия (верхних двух третей). Так начинается менструальная фаза цикла. Однако у неменструирующих видов животных распад ткани и кровотечение в ответ на удаление прогестерона не происходят. Вместо отслаивания происходит реконструкция и обратные изменения в эндометрии.
Во время секреторной фазы (после овуляции до менструации) прогестерон воздействует на эндометрий, подготовленный эстрогеном. Это вызывает его децидуализацию, т.е. преобразование удлиненных эндометриальных стромальных клеток в более сферические децидуальные клетки и увеличение секреции ими пролактина, инсулиноподобного фактора роста, связывающего белок-1 (IGBP-1), гликогена и других факторов (Brosens et al., 1999; Dunn et al., 2003). Децидуализация инициируется цАМФ и начинается в периваскулярных стромальных клетках, распространяясь наружу “волной” по стромальному компоненту эндометрия. У женщин и у всех менструирующих видов децидуализация происходит спонтанно перед имплантацией. Эндометрий не менструирующих млекопитающих подвергается децидуализации только при наличии контакта между эмбрионом и эндометрием, т.е. во время имплантации (Finn, 1998). Существует высокая корреляция между степенью трофобластной инвазии во время плацентарного развития и степенью децидуализации (Finn, 1996).
Следует отметить, что эндометрий человека подвергается наиболее обширному процессу децидуализации и демонстрирует наибольшую степень трофобластной инвазии среди всех видов плацентарных животных (Ramsey et al., 1976). Считается, что эта обширная и спонтанная реакция децидуализации создает материнскую иммунную защиту частично аллогенному эмбриону, позволяя контролировать плацентарную инвазию и осуществлять отбор генетически полноценных эмбрионов (Emera et al., 2012). Поэтому менструация обязательна при отсутствии беременности, поскольку клетки эндометрия претерпевают необратимые изменения. Отслаивание децидуализированного эндометрия требует полного восстановления и регенерации обнаженной поверхности внутренней полости матки. Данный процесс придает эндометрию человека необычайную способность адаптироваться и оптимизироваться и объясняет, почему большинство женщин, страдающих рецидивирующим прерыванием беременности в результате проведенной терапии, а иногда и самопроизвольно, достигают успешной беременности (Blanks, Brosens, 2013).
Благодаря уникальной регенеративной способности эндометрия, было сделано предположение о наличии в нем стволовых клеток, которые в последующем и были обнаружены (Padykula et al., 1984; Padykula, 1991; Spencer et al., 2005; Jabbour et al., 2006). Предполагается, что эти клетки восстанавливают функциональный слой из базального слоя после менструации (Gargett et al., 2015; Masuda et al., 2015; Mutlu et al., 2015).
Клеточные популяции из эндометрия, способные пролиферировать in vitro, получают различными путями. В основном используют материал, полученный при взятии биопсии и хирургических вмешательствах, содержащий все клеточные слои эндометрия. Кроме того, клетки, способные размножаться в культуре, получают из участков эндометрия, десквамированных естественным путем при менструации (Meng et al., 2007; Musina et al., 2008; Patel et al., 2008). Основной способ выделения клеток основан на адгезивности их к пластику и способности пролиферировать в условиях in vitro. Исследование характеристик стволовых клеток в менструальном цикле показало, что клоногенность эпителиальных и стромальных клеток не изменяется в различных фазах менструального цикла (Schwab et al., 2005), что указывает на то, что количество стволовых клеток может оставаться одинаковым в течение всего цикла. Связано ли это с тем, что стволовые клетки подвергаются асимметричному отделению для поддержания эндометрия, требует дальнейшего исследования.
Эндометриальные стволовые клетки (ЭнСК) также идентифицированы в эндометрии после менопаузы (Ulrich et al., 2014). Спящий постменопаузальный эндометрий сохраняет способность реагировать на эстроген и прогестерон, и из него может быть регенерирован полностью функциональный эндометрий. Эта регенерация возможна посредством эстрогена, индуцирующего пролиферативное состояние в ЭнСК, которые могут пережить отсутствие гормонального воздействия, в отличие от дифференцированных эпителиальных клеток (Gargett et al., 2012; Janzen et al., 2013). Во время репродуктивного периода женщин ЭнСК находятся под организованным влиянием эстрогена и прогестерона, индуцирующих циклическую пролиферацию и последующую дифференцировку эндометрия.
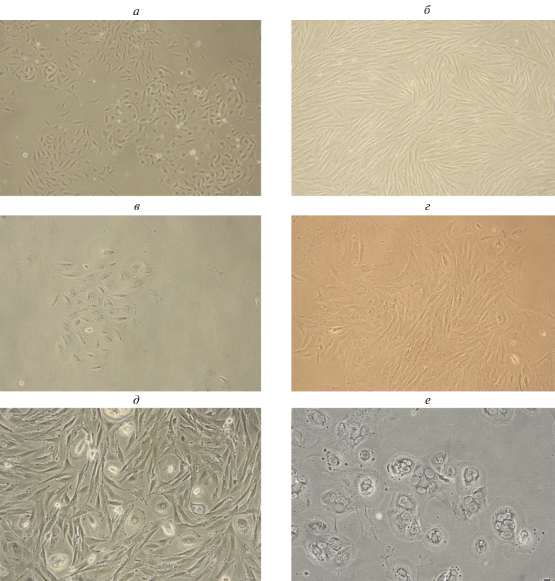
Было показано, что первичные клеточные культуры, получаемые из биоптатов эндометрия или менструальной крови, гетерогенны. На рис. 2а представлена морфология клеточных популяций, полученных из менструальной крови в течении первых 3-х сут культивирования. В первичной культуре наблюдаются клетки разных типов. При клонировании обнаруживаются два типа колоний. На рис. 2в представлены колония эпителиоподобных клеток с невысоким пролиферативным потенциалом. На рис. 2г представлена колония фибробластоподобных активно размножающихся клеток. По размерам колоний можно оценить различия скоростей размножения данных клеточных типов. Кроме того, в первичной культуре эндометриальных клеток, полученных из менструальной крови, обнаруживаются округлые клетки, которые со временем культивирования становятся многоядерными (рис. 2д, е). Эти клетки не увеличиваются в числе и со временем культивирования теряются из культуры. При дальнейшем культивировании (более 3-х пассажей) клетки менструальной крови приобретают единый тип фибробластоподобных клеток, образующих в культуре характерные завихрения (рис. 2б).
Рис. 2.
Культура клеток эндометрия, полученная из менструальной крови. а – Первичная культура через 3 сут культивирования; б – культура клеток на 5-ом пассаже; в – колония эпителиоподобных клеток; г – колония фибробластоподобных клеток; д, е – популяция округлых многоядерных клеток.
Эндометрий состоит из несколько основных типов клеток: эпителиальных, выстилающие железы и поверхность эндометрия, и фибробластоподобных, составляющие строму. Эндометриальные железы, простираются вглубь ткани от полости матки до соединения эндометрия и миометрия. Во время менструации базальный компонент железы не отслаивается и остается в базальном слое. Под влиянием повышения уровней эстрогена оставшиеся эпителиальные клетки базального слоя пролиферируют, чтобы регенерировать новые железы в восстанавливаемом функциональном слое (Gargett et al., 2012). Было высказано предположение, что оставшиеся железы базального слоя эндометрия содержат популяцию эпителиальных клеток-предшественников (Gargett, 2007). В настоящее время клетки-предшественники эпителия идентифицированы как колонии образующие единицы (CFU) в клеточных суспензиях, полученных из ткани эндометрия при гистероэктомии, содержащих клетки базального слоя (Chan et al., 2004; Schwab et al., 2005; Gargett et al., 2009). Было показано, что выделенные методом последовательного клонирования эпителиальные клетки способны создавать структуры, подобные железам эндометрия при трехмерном (3D) культивировании (Gargett et al., 2009). Был выявлен маркер, характерный для базального эпителия эндометрия (SSEA-1 или CD15), предполагаемого местоположения стволовых клеток-предшественников (Wright, Andrews, 2009; Valentijn et al., 2013).
Обнаружено, что в эндометрии содержатся клетки со свойствами мезенхимных стволовых клеток (МСК). Эти клетки первоначально были обнаружены в культурах костного мозга как клоногенные фибробласты (Friedenstein et al., 1968). Культуры адгезивных к пластику клеток костного мозга включают и МСК, и фибробласты, поэтому для отражения этой гетерогенности они были переименованы в мультипотентные мезенхимные стромальные клетки, но акроним МСК был сохранен (Gargett et al., 2015). Основными характеристиками МСК костного мозга (кМСК) были признаны адгезивность к пластику, клоногенность, способность к дифференцировке в остеогенном, хондрогенном, адипогенном направлениях и характерная экспрессия поверхностных CD-маркеров (CD29, CD44, CD73, CD90, CD105, CD146, CD312, CD342 и CD452), отличающая их от гематопоэтических стволовых клеток (Dominici et al., 2006). За последние годы МСК были идентифицированы в жировой ткани (Zuk et al., 2002), эндометрии (Schwab, Gargett, 2007; Gargett et al., 2009) и многих других органах (Crisan et al., 2008).
Клоногенные эндометриальные клетки человека (Gargett et al., 2009; Cervello et al., 2010) проявляют те же свойства in vitro, что и кМСК. Для МСК эндометрия (эМСК) были выявлены характерные маркеры (Gargett, Masuda, 2010; Lv et al., 2014). Субпопуляция клеток СD146+PDGFR-β+ составляет 1.5% эндометриальной стромы (Schwab, Gargett, 2007). Этот набор маркеров идентифицировал периваскулярное местоположение эМСК как в функциональном, так и в базальном слоях эндометрия. Это означает, что субпопуляция СD146+PDGFR-β+ может быть получена как из образцов биопсии (Schuring et al., 2011; Spitzer et al., 2012), так и содержаться в менструальной крови (Gargett, Masuda, 2010). кМСК и многие другие МСК также имеют периваскулярное расположение in vivo (Shi, Gronthos, 2003).
При скрининге суспензии эндометриальных клеток с помощью меченых магнитных шариков на периваскулярные маркеры, был идентифицирован маркер SUSD2 (суши-доменом, содержащий антиген-2, иногда называемый W5C5), характерный для клоногенных эМСК (Masuda et al., 2012; Sivasubramaniyan et al., 2013). Количество клеток с высокой экспрессией SUSD2 (SUSD2hi) увеличено в эндометрии в пролиферативной фазе цикла, что говорит об их роли в росте стромы функционального слоя. Культивируемые фибробласты из эндометрия (стромальные клетки), костного мозга и многих органов также проявляют классические свойства кМСК in vitro.
Имеются предположения о том, что истинные кМСК должны характеризоваться способностью одиночной клетки образовывать гетерогенные костные органы (костную ткань, костный мозг) (Bianco et al., 2013). Аналогично им истинные эМСК должны проявлять способность генерировать васкуляризованную строму с возможностью децидуализироваться. Этого не удалось добиться. Однако было обнаружено, что полученные методом клонирования SUSD2+-эМСК, трансплантированные под капсулу почки иммунодефицитных мышей, способны образовывать эндометриальную ткань (Cervello et al., 2011; Masuda et al., 2012). Культуры стромальных клеток эндометрия человека (фибробластов) имеют более ограниченную способность к дифференцировке in vitro (Wolff et al., 2007; Dimitrov et al., 2008). Анализ экспрессии генов показал, что периваскулярные клетки эндометрия представляют собой популяцию, отличную от стромальных фибробластов (Spitzer et al., 2012).
В эндометрии, как и во многих тканях, были обнаружены клетки сайд-популяции (СП), способные быстро удалять ДНК-связывающий краситель Hoechst 33342. Эти клетки могут быть идентифицированы в суспензии, полученной из биоптатов эндометрия с использованием двухцветной окраски методом проточной цитометрии (Goodell et al., 1997; Challen, Little, 2006). Первичные культуры эндометрия человека, выделенные из биопсии, содержит до 5% клеток (Tsuji et al., 2008; Cervello et al., 2010; Masuda et al., 2010). Наибольшее количество СП-клеток обнаруживается в пролиферативную (Tsuji et al., 2008; Masuda et al., 2010) и менструальную (Kato et al., 2007) фазы цикла. Клетки, окрашенные на основной маркер СП (ABCG2), были обнаружены в эндотелии кровеносных сосудов как в функциональном, так и в базальном слое (Tsuji et al., 2008; Masuda et al., 2010). Проточный цитометрический анализ показал, что СП содержат смешанную клеточную популяцию: CD31-эндотелиальные клетки (51%), эпителиальные клетки CD326 (EpCAM, 27%) и стромальные клетки CD10 или PDGFR-β+ (10–14%) (Miyazaki et al., 2012). Основная популяция, не удаляющая Hoechst, имеет эпителиальный и стромальный состав, подобный СП, но со значительно меньшим числом CD31- эндотелиальных клеток. Клетки СП способны генерировать эндометриальную ткань in vivo при трансплантации под капсулу почки имуннодефицитных мышей (Masuda et al., 2010; Cervello et al., 2011).
Наиболее простым способом получения клеток эндометрия является забор менструальной крови. Маркеры эндометриальных стволовых клеток (эМСК) (CD146+PDGFR-β+ или SUSD2+) выявили их периваскулярное расположение как в базальном, так и в функциональном слоях эндометрия человека, что указывает на то, что эМСК содержатся в менструальной крови (Gargett, Masuda, 2010). Как и кМСК, эМСК менструальной крови содержат смесь МСК и стромальных фибробластов. Одна группа исследователей использовала набор реактивов c-Kit (CD117) для дальнейшей очистки культивируемых клеток (Patel et al., 2008). CD117 индуцируется во время культивирования, а свежевыделенные стромальные фибробластоы эндометрия на CD117 негативны (Masuda et al., 2012). Эпителиальные клетки, как правило, не наблюдаются в культивируемой менструальной крови: они либо отсутствуют, либо не были замечены, либо были вытеснены популяциями стромальных фибробластов (Musina et al., 2008), что говорит о том, что эпителиальные предшественники более вероятно расположены в базальном слое эндометрия и не выделяются во время менструации (Gargett, Masuda, 2010).
эМСК, культивируемые из менструальной крови, являются клоногенными (Musina et al., 2008; Земелько и др. 2011), активно пролиферируют в культуре, имеют небольшое время удвоения популяции (около 20 ч) (Meng et al., 2007; Wu et al., 2014) и способны к более чем 30 удвоениям популяции (Hida et al., 2008). Они сохраняют стабильный кариотип (Meng et al., 2007). Культивированные эМСК менструальной крови экспрессируют типичные фенотипические маркеры МСК.
Таким образом, из ткани эндометрия могут быть выделены разнообразные клеточные типы в культуру in vitro. При дальнейшем культивировании с пересевами культура приобретает однородность. Первичные культуры эндометрия, полученные различными способами, могут содержать разные клеточные типы. Выделение и исследование свойств этих клеток имеет важное значение для изучения процессов регенерации эндометрия, в том числе при патологии (Maybin, Critchley, 2015). Также было показано, что культивируемые клетки эндометрия и менструальной крови, обладающие свойствами эМСК, несмотря ни гетерогенность, могут быть успешно применены для лечения различных заболеваний благодаря высокому секреторному и регенеративному потенциалу.
Список литературы
Земелько В.И., Гринчук Т.М., Домнина А.П., Арцыбашева И.В., Зенин В.В., Кирсанов А.А., Бичевая Н.К., Корсак В.С., Никольский Н.Н. 2011. Мультипотентные мезенхимные стволовые клетки десквамированного эндометрия. Выделение, характеристика и использование в качестве фидерного слоя для культивирования эмбриональных стволовых линий человека. Цитология. Т. 53. № 12. С. 919. (Zemelko V.I., Grinchuk T.M., Domnina A.P., Artzibasheva I.V., Zenin V.V., Kirsanov A.A., Bichevaia N.K., Korsak V.S., Nikolsky N.N. 2012. Multipotent mesenchymal stem cells of desquamated endometrium: isolation, characterization and use as feeder layer for maintenance of human embryonic stem cell lines. Cell Tiss. Biol. (Tsitiligiia). V. 6 1. P. 11.)
Blanks A.M., Brosens J.J. 2013. Meaningful menstruation: cyclic renewal of the endometrium is key to reproductive success. Bioessays. V. 35 P. 412.
Bianco P., Cao X., Frenette P.S., Mao. J.J., Robey P.G., Simmons P.J., Wang C.Y. 2013. The meaning, the sense and the significance: translating the science of mesenchymal stem cells into medicine. Nat. Med. V. 19. P. 35.
Brosens J.J., Hayashi N., White J.O. 1999. Progesterone receptor regulates decidual prolactin expression in differentiating human endometrial stromal cells. Endocrinol. V. 140. P. 4809.
Challen G.A., Little M.H. 2006. A side order of stem cells: the SP phenotype. Stem Cells. V. 24. P. 3.
Chan R.W., Schwab K.E., Gargett C.E. 2004. Clonogenicity of human endometrial epithelial and stromal cells. Biol. Reprod. V. 70. P. 1738.
Cervelló I., Gil-Sanchis C., Mas A., Delgado-Rosas F., Martı’nez-Conejero J.A., Gala’n A., Martı’nez-Romero A., Martı’nez S., Navarro I., Ferro J. 2010. Human endometrial side population cells exhibit genotypic, phenotypic and functional features of somatic stem cells. PLoS One. № 5. e10964. https://doi.org/10.1371/journal.pone.0010964
Cervelló I., Mas A., Gil-Sanchis C., Peris L., Faus A., Saunders P.T., Critchley H.O., Simón C. 2011. Reconstruction of endometrium from human endometrial side population cell lines. PLoS One. № 6. e21221. https://doi.org/10.1371/journal.pone.0021221
Crisan M., Yap S, Casteilla L., Chen C.W., Corselli M., Park T.S., Andriolo G., Sun B., Zheng B., Zhang L. 2008. A perivascular origin for mesenchymal stem cells in multiple human organs. Cell Stem Cell. V. 3. P. 301.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop D., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. International Society for Cellular Therapy position statement. Cytotherapy. V. 8 P. 315.
Dimitrov R., Timeva T., Kyurkchiev D., Stamenova M., Shterev A., Kostova P., Zlatkov V., Kehayov I., Kyurkchiev S. 2008. Characterization of clonogenic stromal cells isolated from human endometrium. Reproduction. V. 135. P. 551.
Dunn C.L., Kelly R.W., Critchley H.O. 2003. Decidualization of the human endometrial stromal cell: an enigmatic transformation. Reprod. Biomed. Online. V. 7. P. 151.
Emera D., Romero R., Wagner G. 2012. The evolution of menstruation: a new model for genetic assimilation: Explaining molecular origins of maternal responses to fetal invasiveness. Bioessays. V. 34. P. 26.
Figueira P.G.M., Abrão M.S., Krikun G., Taylor H.S. 2011. Stem cells in endometrium and their role in the pathogenesis of endometriosis. Ann. N.Y. Acad. Sci. V. 1221. P. 10.
Finn C.A. 1998. Menstruation: A nonadaptive consequence of uterine evolution. Q Rev. Biol. V. 73. P.163.
Friedenstein A.J., Petrakova K.V., Kurolesova A.I., Frolova G.P. 1968. Heterotopic of bone marrow. Analysis of precursor cells for osteogenic and hematopoietic tissues. Transplantation. V. 6. P. 230.
Gargett C.E. 2007. Uterine stem cells: What is the evidence? Hum. Reprod. Update. V. 13. P. 87.
Gargett C.E., Masuda H. 2010. Adult stem cells in the endometrium. Mol. Hum. Reprod. V. 16. P. 818.
Gargett C.E., Nguyen H.P., Ye L. 2012. Endometrial regeneration and endometrial stem/progenitor cells. Rev. Endocr. Metab. Disord. V. 13. P. 235.
Gargett C.E., Schwab K.E., Deane J.A. 2015. Endometrial stem/progenitor cells: The first 10 years. Human Reprod. Update. V. 22. P. 137.
Gargett C.E, Schwab K.E., Zillwood R.M., Nguyen H.P., Wu D. 2009. Isolation and culture of epithelial progenitors and mesenchymal stem cells from human endometrium. Biol. Reprod. V. 80. P. 1136.
Goodell M.A, Rosenzweig M., Kim H., Marks D.F., DeMaria M., Paradis G., Grupp S.A., Sieff C.A., Mulligan R.C., Johnson R.P. 1997. Dye efflux studies suggest that hematopoietic stem cells expressing low or undetectable levels of CD34 antigen exist in multiple species. Nat. Med. V. 3. P. 1337.
Hida N., Nishiyama N., Miyoshi S., Kira S., Segawa K., Uyama T., Mori T., Miyado K., Ikegami Y., Cui C. 2008. Novel cardiac precursor-like cells from human menstrual blood-derived mesenchymal cells. Stem Cells. V. 26. P.1695.
Jabbour H.N., Kelly R.W., Fraser H.M., Critchley H.O. 2006. Endocrine regulation of menstruation. Endocr. Rev. V. 27. P. 17.
Janzen D.M., Cheng D., Schafenacker A.M., Paik D.Y., Goldstein A.S., Witte O.N., Jaroszewicz A., Pellegrini M., Memarzadeh S. 2013. Estrogen and progesterone together expand murine endometrial epithelial progenitor cells. Stem Cells. V. 31. P. 808.
Lv F.J., Tuan R.S., Cheung K.M., Leung V.Y. 2014. Concise review: The surface markers and identity of human mesenchymal stem cells. Stem Cells V. 32. P. 1408.
Masuda H., Matsuzaki Y., Hiratsu E., Ono M., Nagashima T., Kajitani T., Arase T., Oda H., Uchida H., Asada H. 2010. Stem cell-like properties of the endometrial side population: implication in endometrial regeneration. PLoS One. № 5. e10387. https://doi.org/10.1371/journal.pone.0010387
Masuda H., Anwar S.S., Buühring H.J., Rao J.R., Gargett C.E. 2012. A novel marker of human endometrial mesenchymal stem-like cells. Cell Transplant. V. 21. P. 2201.
Masuda H., Maruyama T., Gargett C.E., Miyazaki K., Matsuzaki Y., Okano H., Tanaka M. 2015. Endometrial side population cells: potential adult stem/progenitor cells in endometrium. Biol. Reprod. V. 93. P. 84.
Maybin J.A., Critchley H.O.D. 2015. Menstrual physiology: Implications for endometrial pathology and beyond. Human Reprod. Update. V. 21. P. 748.
Meng X., Ichim T.E., Zhong J., Rogers A., Yin Z., Jackson J., Wang H., Ge W., Bogin V., Chan K.W. 2007. Endometrial regenerative cells: a novel stem cell population. J. Transl. Med. V. 5. P. 57.
Miyazaki K., Maruyama T., Masuda H., Yamasaki A., Uchida S., Oda H., Uchida H., Yoshimura Y. 2012. Stem cell-like differentiation potentials of endometrial side population cells as revealed by a newly developed in vivo endometrial stem cell assay. PLoS One. 7. № e50749. https://doi.org/10.1371/journal.pone.0050749
Musina R.A., Belyavski A.V., Tarusova O.V., Solovyova E.V., Sukhikh G.T. (2008). Endometrial mesenchymal stem cells isolated from the menstrual blood. Bull. Exp. Biol. Med. V. 145. P. 539.
Mutlu L. Hufnagel D., Taylor H.S. 2015. The endometrium as a source of mesenchymal stem cells for regenerative medicine. Biol. Reprod. V. 92. P. 138.
Padykula H.A., Coles L.G., McCracken J.A., King N.W. Jr., Longcope C., Kaiserman- Abramof I.R. 1984. A zonal pattern of cell proliferation and differentiation in the rhesus endometrium during the estrogen surge. Biol. Reprod. V. 31. P. 1103.
Padykula H.A. 1991. Regeneration in the primate uterus: The role of stem cells. Ann. N.Y. Acad. Sci. V. 622. P. 47.
Patel A.N., Park E., Kuzman M., Benetti F., Silva F.J., Allickson J.G. 2008. Multipotent menstrual blood stromal stem cells: isolation, characterization, and differentiation. Cell Transplant. V. 17. P. 303.
Ramsey E.M., Houston M.L., Harris J.W. 1976. Interactions of the trophoblast and maternal tissues in three closely related primate species. Am. J. Obstet. Gynecol. V. 124. P. 647.
Schuring A.N., Schulte N., Kelsch R., Ropke A., Kiesel L., Gotte M. 2011. Characterization of endometrial mesenchymal stem-like cells obtained by endometrial biopsy during routine diagnostics. Fertil. Steril. V. 95. P. 423.
Schwab K.E., Chan R.W., Gargett C.E. 2005. Putative stem cell activity of human endometrial epithelial and stromal cells during the menstrual cycle. Fertility Sterilit. V. 84. P. 1124.
Schwab K.E., Gargett C.E. 2007. Co-expression of two perivascular cell markers isolates mesenchymal stem-like cells from human endometrium. Hum. Reprod. V. 22. P. 2903.
Shi S., Gronthos S. 2003. Perivascular niche of postnatal mesenchymal stem cells in human bone marrow and dental pulp. J. Bone Miner. Res. V. 18. P. 696.
Sivasubramaniyan K., Harichandan A., Schumann S., Sobiesiak M., Lengerke C., Maurer A., Kalbacher H., Buhring H.J. 2013. Prospective isolation of mesenchymal stem cells from human bone marrow using novel antibodies directed against Sushi domain containing 2. Stem Cells Dev. V. 22. P. 944.
Spencer T.E., Hayashi K., Hu J., Carpenter K.D. 2005. Comparative developmental biology of the mammalian uterus. Curr. Top Dev. Biol. V. 68. P. 85.
Spitzer T.L., Rojas A., Zelenko Z., Aghajanova L., Erikson D.W., Barragan F., Meyer M., Tamaresis J.S., Hamilton A.E., Irwin J.C. 2012. Perivascular human endometrial mesenchymal stem cells express pathways relevant to self-renewal, lineage specification, and functional phenotype. Biol. Reprod. V. 86. P. 58.
Tsuji S., Yoshimoto M., Takahashi K., Noda Y., Nakahata T., Heike T. 2008. Side population cells contribute to the genesis of human endometrium. Fertil. Steril. V. 90. P. 1528.
Ulrich D., Tan K.S., Deane J., Schwab K., Cheong A., Rosamilia A., Gargett C.E. 2014. Mesenchymal stem/stromal cells in postmenopausal endometrium. Human Reprod. V. 29. P. 1895.
Valentijn A.J., Palial K., Al-Lamee H., Tempest N., Drury J., Von Zglinicki T., Saretzki G., Murray P., Gargett C.E., Hapangama D.K. 2013. SSEA-1 isolates human endometrial basal glandular epithelial cells: Phenotypic and functional characterization and implications in the pathogenesis of endometriosis. Hum. Reprod. V. 28. P. 2695.
Wolff E.F., Wolff A.B., Hongling D., Taylor H.S. 2007. Demonstration of multipotent stem cells in the adult human endometrium by in vitro chondrogenesis. Reprod. Sci. V. 14. P. 524.
Wright A.J., Andrews P.W. 2009. Surface marker antigens in the characterization of human embryonic stem cells. Stem Cell Res. V. 3. P. 3.
Wu X., Luo Y., Chen J., Pan R., Xiang B., Du X., Xiang L., Shao J., Xiang C. 2014. Transplantation of human menstrual blood progenitor cells improves hyperglycemia by promoting endogenous progenitor differentiation in type 1 diabetic mice. Stem Cells Dev. V. 23. P. 1245.
Zuk P.A., Zhu M., Ashjian P., De Ugarte D.A., Huang J.I., Mizuno H., Alfonso Z.C., Fraser J.K., Benhaim P., Hedrick M.H. 2002. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. V. 13. P. 4279.
Дополнительные материалы отсутствуют.
Инструменты
Цитология


