Цитология, 2020, T. 62, № 4, стр. 293-302
Разупорядочивающее действие растительных метаболитов на модельные липидные мембраны различной толщины
С. С. Ефимова 1, *, О. С. Остроумова 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: efimova@incras.ru
Поступила в редакцию 20.01.2020
После доработки 26.01.2020
Принята к публикации 26.01.2020
Аннотация
В работе исследовано влияние на модельные липидные мембраны малых молекул, относящихся к растительным метаболитам, флоретина, капсаицина, дигитонина, диосгенина и бетулина. Использованы метод оценки проницаемости липидных бислоев, основанный на измерении утечки флуоресцентного маркера (кальцеина) из липосом, и дифференциальная сканирующая микрокалориметрия суспензии везикул. Установлено, что интенсивность высвобождения кальцеина из 1-пальмитоил-2-олеил-sn-глицеро-3-фосфохолиновых (ПОФХ) липосом при добавке в суспензию тестируемых соединений при соотношении с липидом 1 : 50 падает в ряду капсаицин > флоретин $ \gg $ бетулин ≈ диосгенин ≈ дигитонин. При этом в случае холестерин- и эргостерин-содержащих ПОФХ-липосом активность убывает в ряду диосгенин ≈ дигитонин > бетулин > капсаицин > флоретин. Показана способность флоретина и капсаицина значительно уменьшать температуру плавления (Tm) как 1,2-дипальмитоил-sn-глицеро-3-фосфохолина (ДПФХ), так и 1,2-дистеароил-sn-глицеро-3-фосфохолина (ДСФХ) и 1,2-диарахидоил-sn-глицеро-3-фосфохолина (ДАФХ), а также увеличивать ширину соответствующих плавлению пиков на полувысоте (T1/2). Полученные результаты указывают на встраивание этих малых молекул между полярными “головками” фосфохолинов. Установлено, что при увеличении длины насыщенных цепей мембранообразующих липидов (от 16 до 20 углеводородных звеньев) абсолютные величины ∆Tm и ∆T1/2 в случае флоретина уменьшаются, а в присутствии капсаицина увеличиваются. Это может быть результатом различия в локализации флоретина и капсаицина в мембране. Стероидные сапонины слабо влияют на термотропное поведение фосфохолинов: абсолютные величины ∆Tm и ∆T1/2 уменьшаются в ряду ДПФХ, ДСФХ и ДАФХ и возрастают в ряду бетулин, диосгенин, дигитонин. Стероидные сапонины характеризуются более выраженным влиянием на термотропное поведение стерин-фосфолипидной смеси. Полученные результаты согласуются с предположением о высоком сродстве тестируемых сапонинов к стерин-содержащим мембранам.
Плазматическая мембрана является первичной мишенью действия любых экзогенных соединений на клетку. Влияние многих лекарственных препаратов и цитотоксинов сопровождается изменением барьерной функции плазматической мембраны клеток животных в результате образования ион-проницаемых пор, что, в свою очередь, может приводить к нарушению ионного гомеостаза клеток и последующей их гибели. Широко обсуждается вопрос о возможностях предотвращения пагубного действия порообразующих токсинов с помощью дополнительного введения к ним малых молекул, которые могут выступать в роли блокаторов. В то же время, если речь идет о заболеваниях, индуцированных грибковыми или бактериальными возбудителями, важным направлением является поиск путей увеличения каналообразующей активности антибиотиков нетоксичными малыми молекулами.
В литературе можно обнаружить достаточное количество примеров использования низкомолекулярных регуляторов для модуляции мембранной активности различных антибактериальных пептидов, противогрибковых липопептидов и токсинов (Rokitskaya et al., 2002; Luchian, Mereuta, 2006; Ostroumova et al., 2007a, 2007b, 2010, 2011, 2012a, 2012b, 2014; Asandei et al., 2008; Mereuta et al., 2008, 2011; Efimova et al., 2014; 2016; 2018).
Ряд биологически активных малых молекул, называемых модификаторами мембран, способен при их связывании с липидным бислоем менять эластические параметры мембраны, в том числе толщину липидного бислоя, и, тем самым, влиять на работу ионных каналов, реконструированных в такие мембраны. Встраивание малых молекул в липидные мембраны может сопровождаться изменением плотности упаковки липидов, что скажется на конформационном равновесии встроенных в бислой порообразующих агентов.
Согласно данным из литературы, зависимость активности пептидов от геометрических характеристик образующих бислой липидов и от толщины мембраны является важным фактором при определении модели порообразования (Lohner, Prenner, 1999). В частности, липиды, характеризующиеся конической формой и образующие мицеллярные фазы, потенцируют активность антимикробных пептидов, формирующих тороидальные поры (Basanez et al., 2002; Allende et al., 2005). В случае если длина гидрофобного домена полипептидной цепи отличается от толщины углеводородного кора мембраны (так называемое гидрофобное несоответствие), встраивание пептида сопровождается локальными перестройками мембраны (de Jesus, Allen, 2013; Grau-Campistany et al., 2015), а энергетические потери на деформацию мембраны отражаются в снижении активности пептида. В частности, экспериментальные работы убедительно доказывают уменьшение времени жизни грамицидиновых каналов при увеличении длины хвостов мембранообразующих липидов; при замене дипальмитоолеоилфосфохолина (16 : 1) на диэикосиноилфосфохолин (20 : 1) время нахождения грамицидиновых каналов в открытом состоянии уменьшается на порядок (Lundbaek et al., 2010; Basu et al., 2014; Hassan-Zadeh et al., 2017).
Растительные метаболиты охватывают обширный круг биологически активных соединений, используемых в современной фармакотерапии, поэтому их потенциал в качестве источника новых лекарств не вызывает сомнений. Кроме того, большинство подобных соединений малотоксично для клеток млекопитающих.
В настоящей работе были исследованы мембранные эффекты фармакологически перспективных групп таких растительных метаболитов как сапонины, алкалоиды и флавоноиды, в частности, бетулина, диосгенина, дигитонина, флоретина и капсаицина.
Сапонины, в основном, представлены группой высокомолекулярных безазотистых гликозидов растительного происхождения. Они характеризуются широким спектром фармакологического действия, включающего противовоспалительные, антиноцицептивные, жаропонижающие, противоаллергические и противораковые свойства (Yan et al., 2009; Yassin et al., 2013). Структурное разнообразие сапонинов объясняет и разнообразие их физико-химических, фармакологических и биологических свойств, которые определяют их прикладную значимость для пищевой, косметической и фармацевтической областей (Netala et al., 2015). Стероидные сапонины применяются как гипохолестеринемические средства при лечении атеросклероза. Используя дифференциальную сканирующую микрокалориметрию липосом, сформированных из димиристоилфосфатидилхолина, димиристоилфосфатидилэтаноламина и димиристоилфосфатидилсерина, было показано, что стероидные сапонины (соласодин, диосгенин и соланин) уменьшают кооперативность фазового перехода мембранообразующих липидов (Manrique-Moreno et al., 2014).
Сапонины обладают ярко выраженной гемолитической активностью, что объясняется их взаимодействием с холестерином в мембране эритроцитов (Gestetner et al., 1972). Применение сканирующей электронной микроскопии показало, что стероидные сапонины изменяют физиологическую форму эритроцитов при встраивании во внешний монослой мембраны эритроцитов (Manrique-Moreno et al., 2014). Изменение формы эритроцитов приводит к снижению кровотока, потере кислорода и повреждению тканей вследствие микрососудистой окклюзии (Winski et al., 1998; Svetina et al., 2004).
Алкалоиды применяются в клинической практике в качестве лекарственных средств уже многие десятилетия. Среди растительных алкалоидов были обнаружены сосудорасширяющие гипотензивные и антиаритмические средства, которые могут быть использованы для лечения различных сердечнососудистых патологий (Sultana, Asif, 2017). Некоторые растительные алкалоиды могут быть использованы как потенциальные средства профилактики и лечения различных типов рака. Данные, полученные на различных онкологических моделях, свидетельствуют о модулировании алкалоидом капсаицином, содержащемся в различных видах стручкового перца, множества сигнальных путей, а также онкогенов и генов опухолевых супрессоров.
В литературе обсуждаются возможности комбинированного использования капсаицина с другими противораковыми соединениями (Clark, Lee, 2016; Hashmi et al., 2018). Показано, что капсаицин существенно снижает температуру и кооперативность плавления димиристоилфосфохолина (Swain, Kumar, 2015) и дипальмитоилфосфохолина (Aranda et al., 1995). При относительно высоких концентрациях алкалоида на термограмме наблюдается выраженная деконволюция пика, соответствующeгo главному фазовому переходу, что говорит о наличии нескольких смешанных алкалоид-липидных фаз. По некоторым данным (Torrecillas et al., 2015) в мембранах из пальмитоолеоилфосфохолина капсаицин локализуется между липид-водной интерфазой и плоскостью, соответствующей положению двойной связи в ненасыщенной ацильной цепи липида. Обнаружено, что снижение жесткости мембраны в присутствии капсаицина ответственно за модулирование ионных токов, индуцированных антибиотиком грамицидином А (Lundbaek et al., 2005).
Флавоноиды относятся к полифенолам растительного происхождения и называются натуральными биологическими модификаторами реакций из-за их способности изменять реакцию организма человека на действие аллергенов, вирусов и канцерогенов. Об этом свидетельствуют их антиоксидантные, антигистаминные, противовоспалительные, а также антипаразитарные и антибактериальные свойства. В свете наблюдающегося в последние десятилетия существенного роста числа бактериальных штаммов, устойчивых к антибиотикам, особое внимание обращает на себя антибактериальная активность флавоноидов (Cowan, 1999; Middleton et al., 2000). Амфифильность молекул флавоноидов позволяет им легко встраиваться в биологические мембраны и изменять их физико-химические свойства. Именно модуляция мембраны под действием флавоноидов может влиять на скорость окисления липидов и белков, обуславливая выраженную антиоксидантную активность растительных полифенолов.
Наиболее изученным с точки зрения влияния на модельные и клеточные мембраны является флавоноид флоретин, который содержится в листьях яблони и зеленого чая (Middleton et al., 2000). Флоретин давно известен как ингибитор транспорта глюкозы клетками кишечного эпителия и эпителия почек (Yamaguchi et al., 2011). Этот флавоноид также способен ингибировать транспорт мочевины в различных клетках, включая клетки почечного эпителия, печени, эритроциты (Chou, Knepper, 1989). Обнаружена способность флоретина вызывать утечку флуоресцентного маркера из фосфохолиновых липосом (Chulkov, Ostroumova, 2015), а также вызывать падение температуры и кооперативности плавления дипальмитоилфосфохолина (ДПФХ) (Cseh et al., 2000; Ефимова, Остроумова, 2019). Показано, что при систематическом варьировании стеринового и сфинголипидного состава липосом и плоских липидных бислоев молекулы флоретина неравномерно распределяются между упорядоченными и неупорядоченными липидными доменами и, как следствие, обуславливают гетерогенность свойств одиночных каналов, образованных противогрибковым циклическим липопептидом сирингомицином Е в многокомпонентных мембранах (Efimova et al., 2016).
Целью работы было изучение термотропного поведения липидов с различной длиной углеводородных хвостов при адсорбции на бислое флоретина, капсаицина, дигитонина, диосгенина и бетулина. Полученные результаты дают представления о глубине погружения тестируемых соединений в мембрану и степени разупорядочивающего действия на бислои с разной толщиной. Эти знания имеют первостепенное значение для оценки перспектив использования растительных метаболитов в комбинированной противомикробной терапии.
МАТЕРИАЛ И МЕТОДИКА
Использованные реагенты: KCl, KOH, HEPES, ЭДТА, пентан, этанол, хлороформ, Тритон Х-100, сефадекс G-50, кальцеин, эргостерин, флоретин, капсаицин, бетулин, диосгенин и дигитонин фирмы Sigma (США); ПОФХ, ДПФХ, ДСФХ, ДАФХ и холестерин фирмы Avanti Polar Lipids (США). Химические структуры тестируемых растительных метаболитов и молекул липидов представлены на рис. 1.
Рис. 1.
Химическая структура молекул липидов и растительных метаболитов. Липиды: а – ДПФХ (16 : 0), б – ДСФХ (18 : 0), в – ДАФХ (20 : 0). Метаболиты: г – бетулин, д – диосгенин, е – дигитонин, ж – флоретин, з – капсаицин.
Определение утечки кальцеина из липосом при добавке агентов. Липосомы диаметром 100 нм получали из ПОФХ, смеси ПОФХ и холестерина или ПО-ФХ и эргостерина в соотношении 67 : 33 мол. % методом экструзии с использованием мини-экструдера производства Avanti Polar Lipids (США) как описано ранее (Ефимова и др., 2016). Полученную липидную пленку гидратировали буферным раствором, состоящим из 35 мМ кальцеина, 10 мМ HEPES, 1 мМ ЭДТА, pH 7.4. Далее липосомальную суспензию разделяли на независимые аликвоты. В каждый экспериментальный образец вводили растительные метаболиты (флоретин, капсаицин, бетулин, диосгенин и дигитонин) из исходного раствора в воде или спирте до соотношения липида и метаболита, равном 50 : 1.
Проницаемость одноламеллярных липосом для флуоресцентного маркера (кальцеина) определяли с помощью спектрофлюориметра (Флюорат Панорама-02, Россия) путем измерения интенсивности флуоресценции маркера, вытекающего из липидных везикул при длинах волн возбуждения и эмиссии 490 и 520 нм соответственно. Раствор флуоресцентного красителя (в концентрации 35 мМ) внутри липидных везикул имеет пренебрежимо малую флуоресценцию вследствие самотушения. Поскольку раствор, омывающий везикулы, не содержит кальцеина, можно зарегистрировать флуоресценцию высвобождаемого из липосом красителя. Растворители (спирт или вода) в используемых концентрациях на проницаемость везикул для кальцеина не влияют. После измерения флуоресценции экспериментального образца в течение 30–40 мин в раствор добавляли детергент Тритон Х-100 до концентрации 10 мМ из водного раствора. Это приводило к полному разрушению мембран липосом и высвобождению всего захваченного красителя.
Относительную величину утечки флуоресцентного красителя кальцеина из липосом RF (%) определяли как:
(1)
$RF = \frac{{{{I}_{i}} - {{I}_{0}}}}{{({{{{I}_{{\max }}}} \mathord{\left/ {\vphantom {{{{I}_{{\max }}}} {0.9}}} \right. \kern-0em} {0.9}}) - {{I}_{0}}}} \times 100\% ,$Дифференциальная сканирующая микрокалориметрия модифицированных везикул. Большие одноламеллярные липосомы формировали из ДПФХ, ДСФХ или ДАФХ, а также смеси ДАФХ с холестерином (90 : 10 мол. %) методом электроформации c помощью прибора Nanion vesicle prep pro (Германия). На стекла подавали переменное напряжение с амплитудой 3 В и частотой 10 Гц в течение 1 ч при температуре 55, 65 и 75°C для ДПФХ, ДСФХ и ДАФХ соответственно. Концентрация липида составляла 5 мМ. В экспериментальные образцы вводили флоретин, капсаицин, бетулин, диосгенин и дигитонин в соотношении липид : метаболит, равном 100 : 1, 50 : 1 или 10 : 1. Термограммы липосомных суспензий получали при помощи дифференциального сканирующего микрокалориметра µDSC7 (Setaram, Франция). Воспроизводимости температурной зависимости теплоемкости достигали путем повторного нагревания образца сразу после охлаждения с постоянной скоростью 0.1°C/мин. Пики на термограммах характеризовали максимальными температурами предперехода из гель- в промежуточную риппл-фазу (Tp) и основного фазового перехода (Tm) ДПФХ, ДСФХ и ДАФХ и шириной пика, соответствующего плавлению, на полувысоте (T1/2), который характеризует кооперативность основного фазового перехода. Изменение указанных параметров позволяет судить о термотропном поведении липидов при адсорбции растительных метаболитов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Все тестируемые растительные метаболиты индуцируют утечку кальцеина из липидных везикул, сформированных без и с участием стеринов. Максимальная величина высвобождения флуоресцентного маркера (RF) из ПОФХ-везикул различного состава представлена в табл. 1. Анализируя таблицу, можно сделать следующие выводы относительно действия испытанных агентов: 1) в случае липосом из чистого ПОФХ действие флоретина и капсаицина характеризуется большей эффективностью по сравнению со стероидными сапонинами – дигитонином, бетулином и диосгенином; 2) у капсаицина более сильное разупорядочивающее действие на мембранные липиды по сравнению с флоретином; 3) эффекты флоретина и капсаицина не зависят от состава мембран липосом; 4) адсорбция сапонинов на фосфолипидных мембранах практически не вызывает высвобождения маркера кальцеина из липидных везикул; 5) способность индуцировать утечку кальцеина из стерин-содержащих ПОФХ-липосом у сапонинов значительно выше, чем у флоретина и капсаицина; 6) действие сапонинов не зависит от вида мембранообразующего стерина и падает в ряду диосгенин ≈ дигитонин > бетулин. Полученные результаты могут указывать на то, что флоретин и капсаицин разупорядочивают липидные бислои, сформированные как без, так и с участием стеринов. Стероидные сапонины характеризуются более высоким сродством к стерин-содержащим мембранам, и, по всей вероятности, взаимодействие сапонинов со стеринами лежит в основе высвобождения флуоресцентного маркера из липосом. Для того чтобы ответить на вопрос о механизмах влияния растительных метаболитов на плотность упаковки мембранообразующих липидов, была проведена дифференциальная сканирующая микрокалориметрия липидных везикул.
Таблица 1.
Характеристические параметра влияния растительных метаболитов на плотность упаковки мембран липосом
| Метаболит | RF, % | –∆Tр, °C | –∆Tm, °C | ∆T1/2, °C | –∆Tр, °C | –∆Tm, °C | ∆T1/2, °C | –∆Tр, °C | –∆Tm, °C | ∆T1/2, °C | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ПОФХ (16 : 0, 18 : 1) |
ПОФХ/эргостерин | ПОФХ/холестерин | ДПФХ (16 : 0) | ДСФХ (18 : 0) | ДАФХ (20 : 0) | |||||||
| Диосгенин | 6 ± 3 | 90 ± 5 | 96 ± 4 | 0.3 ± 0.1 | 0.4 ± 0.1 | 0.5 ± 0.1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Бетулин | 4 ± 2 | 60 ± 6 | 78 ± 7 | 0.2 ± 0.1 | 0.2 ± 0.1 | 0.5 ± 0.1 | 0 | 0 | 0 | 0 | 0 | 0 |
| Дигитонин | 11 ± 5 | 90 ± 5 | 87 ± 6 | Нет | 0.7 ± 0.1 | 0.9 ± 0.1 | Нет | 0.6 ± 0.2 | 0.7 ± 0.1 | Нет | 0.1 ± 0.1 | 0.1 ± 0.1 |
| Флоретин | 40 ± 7 | 32 ± 4 | 50 ± 6 | Нет | 0.8 ± 0.2 | 1.6 ± 0.2 | Нет | 0.5 ± 0.1 | 1.2 ± 0.2 | Нет | 0.4 ± 0.1 | 0.6 ± 0.1 |
| Капсаицин | 55 ± 6 | 45 ± 7 | 63 ± 7 | Нет | 1.2 ± 0.1 | 1.4 ± 0.2 | Нет | 1.3 ± 0.2 | 1.7 ± 0.3 | Нет | 2.5 ± 0.3 | 2.1 ± 0.2 |
Примечание. RF – максимальная утечка кальцеина из липосом разного состава в присутствии растительных метаболитов в соотношении липид : метаболит, равном 50 : 1. ∆Tр, ΔTm и ΔT1/2 – соответственно изменение температуры пред-перехода, температуры максимума и полуширины соответствующего плавлению пика главного фазового перехода фосфохолина при соотношении липида и агента 50 : 1.
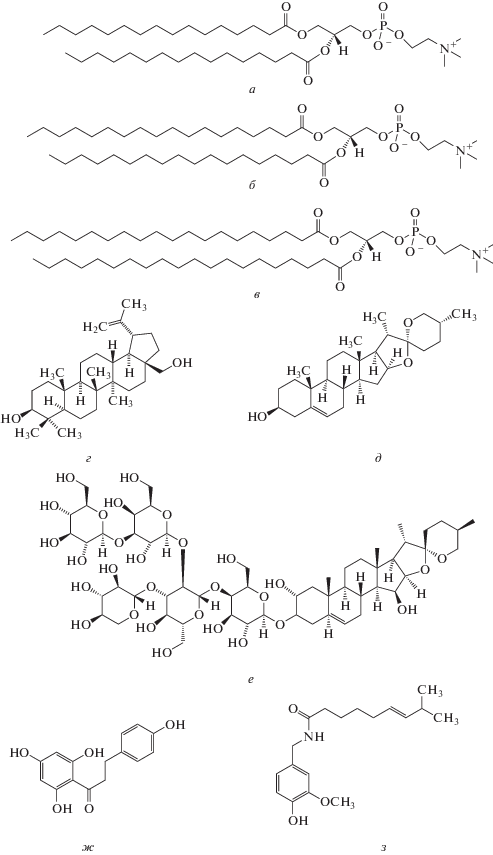
На рис. 2 представлены эндотермы фазовых переходов фосфохолинов с насыщенными углеводородными цепями различной длины в отсутствие (контроль) и в присутствии бетулина, дигитонина и диосгенина при соотношении липида и метаболита, равном 50 : 1. Рис. 3 показывает термограммы плавления ДПФХ, ДСФХ и ДАФХ в отсутствие (контроль) и в присутствии флоретина и капсаицина при соотношениях липида и метаболита, равном 100 : 1, 50 : 1 и 10 : 1. В отсутствие модификаторов температура основного фазового перехода ДПФХ, ДСФХ и ДАФХ составляет 41.3, 54.1 и 64.8°C соответственно (рис. 2, 3). При этом полуширина основного пика, которая характеризует кооперативность плавления, составляет около 0.5°C независимо от длины цепи фосфохолина. Табл. 1 демонстрирует изменения температур предперехода фосфохолинов из гель-состояния в промежуточную риппл-фазу (ΔTр) и основного фазового перехода ДПФХ, ДСФХ и ДАФХ (ΔTm), а также значения увеличения ширины основного пика на полувысоте (ΔT1/2) в присутствии флоретина, капсаицина, бетулина, диосгенина и дигитонина в соотношении с липидом 1 : 50.
Рис. 2.
Термограммы плавления (Ср(Т)) ДПФХ (а), ДСФХ (б) и ДАФХ (в) в отсутствие сапонинов и в присутствии диосгенина, бетулина и дигитонина при соотношении липида и агента, равном 50 : 1. Масштаб по высоте пика (Ср) указан на рисунке.
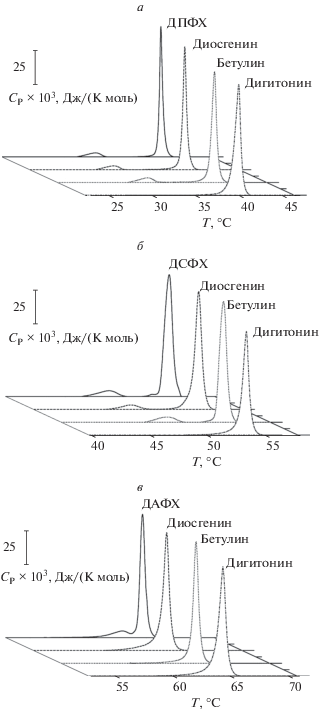
Рис. 3.
Термограммы плавления (Ср(Т)) ДПФХ (а, г), ДСФХ (б, д) и ДАФХ (в, е) в отсутствие агентов (контроль, черная линия) и в присутствии флоретина (а, б, в) и капсаицина (г, д, е) при соотношении липида и агента 100 : 1 (красные линии), 50 : 1 (зеленые линии) и 10 : 1 (синие линии).
Из представленных на рис. 2а и в табл. 1 данных видно, что стероидные сапонины влияют на термотропное поведение ДПФХ. Видно, что: 1) диосгенин и бетулин сдвигают пик, соответствующий предпереходу ДПФХ, на 0.2–0.3°C влево, а дигитонин приводит к исчезновению соответствующего пика; 2) пик, соответствующий основному фазовому переходу, в присутствии стероидных сапонинов сдвигается влево (Tm уменьшается на 0.2–0.6°C) и расширяется (T1/2 возрастает на 0.5–0.9°C). Увеличение длины углеводородных цепей молекул фосфохолинов приводит к снижению эффективности действия тестируемых соединений: 1) диосгенин и бетулин практически не влияют на термотропное поведение ДСФХ и ДАФХ в отличие от ДПФХ; 2) как и в случае ДПФХ введение дигитонина приводит к исчезновению пика, соответствующего предпереходу ДСФХ и ДАФХ, при этом модуль изменения Tm и T1/2 уменьшается в ряду ДПФХ > ДСФХ > ДАФХ (рис. 2б, в, табл. 1).
Полученные результаты указывают на то, что глубина погружения сапонинов мала и, вероятно, ограничивается областью локализации головок мембранных липидов. Несмотря на наибольшую среди тестируемых сапонинов глубину погружения в бислой дигитонина, его разупорядочивающее действие на головки оказывается недостаточно для влияния на плавление наиболее длинных арахидоиловых цепей.
Флоретин и капсаицин характеризуются ярко выраженным влияниям на термотропное поведение ДПФХ, ДСФХ и ДАФХ (рис. 3, табл. 1). Оба этих агента приводят к исчезновению пика, соответствующего предпереходу всех тестируемых фосфохолинов из гель-состояния в риппл-фазу, независимо от толщины модельных мембран. Более выраженный по сравнению с флоретином эффект капсаицина на основной фазовый переход говорит о более глубоком погружении алкалоида в липидный бислой. Встраиваясь в мембрану, флоретин и капсаицин увеличивают площадь, приходящуюся на одну липидную молекулу, подвижность углеводородных хвостов увеличивается, а температура и кооперативность основного фазового перехода падают. Деконволюция основного пика в присутствии флоретина и капсаицина в высоких концентрациях свидетельствует об образовании нескольких смешанных фаз из липидов и метаболитов. Модуль уменьшения температуры максимума и величина увеличения полуширины основного пика в присутствии флоретина снижаются, а в случае капсаицина возрастают в ряду ДПФХ, ДСФХ и ДАФХ.
Этот факт указывает на различную локализацию флоретина и капсаицина в мембране. Можно думать, что флоретин локализуется между гидрофобной и гидрофильной областями липидного бислоя и его разупорядочивающее действие затухает с ростом длины углеводородных цепей. В то же время капсаицин, благодаря собственному углеводородному хвосту, может проникать в углеводородный кор мембраны и влиять на подвижность жирнокислотных цепей липидов независимо от их длины.
Нами также исследовано действие бетулина и дигитонина на температурную зависимость фазового перехода смеси ДАФХ с холестерином (90 : 10 мол. %). Соответствующие изменения Tm и T1/2 составляют 1.1 и 0.8°C соответственно для бетулина и 2.2 и 0.9°C соответственно для дигитонина (данные не представлены). Сравнение указанных величин и параметров, характеризующих термотропное поведение чистого ДАФХ в присутствии бетулина и дигитонина, свидетельствует о высоком сродстве стероидных сапонинов к холестерину. Отсутствие выраженной деконволюции пиков на термограммах может говорить о разупорядочивающем действии сапонин-холестериновых комплексов.
Подробная количественная характеристика влияния растительных метаболитов на физико-химические свойства модельных липидных мембран позволит оценить дальнейшие перспективы их применения в фармакологических целях, в том числе в комбинированной противомикробной терапии.
Список литературы
Ефимова С.С., Остроумова О.С. 2019. Механизмы регуляции амилоид-индуцированной проницаемости модельных липидных мембран полифенолами. Цитология. Т. 61. № 3. С. 247. (Efimova S.S., Ostroumova O.S. 2019. Mechanisms of polyphenol regulation of amyloid-induced permeability of planar lipid membrane. Cell Tiss. Biol. (Tsitologiya). V. 13. P. 312.)
Ефимова С.С., Медведев Р.Я., Щагина Л.В., Остроумова О.С. 2016. Увеличение текучести модельных липидных мембран под действием местных анестетиков. Цитология. Т. 58 № 5. С. 378. (Efimova S.S., Medvedev R.Ya., Schagina L.V., Ostroumova O.S. 2016. Increasing of the fluidity of model lipid membranes under the influence of local anesthetics. Cell Tiss. Biol. (Tsitologiya). V. 58. P. 378).
Allende D., Simon S.A., McIntosh T.J. 2005. Melittin-induced bilayer leakage depends on lipid material properties: evidence for toroidal pores. Biophys. J. V. 88. P. 1828.
Aranda F.J., Villalaín J., Gómez-Fernández J.C. 1995. Capsaicin affects the structure and phase organization of phospholipid membranes. Biochim. Biophys. Acta. V. 1234. P. 225.
Asandei A., Mereuta L., Luchian T. 2008. Influence of membrane potentials upon reversible protonation of acidic residues from the OmpF eyelet. Biophys. Chem. V. 135. P. 32.
Basañez G., Shinnar A.E., Zimmerberg J. 2002. Interaction of hagfish cathelicidin antimicrobial peptides with model lipid membranes. FEBS Lett. V. 532. P. 115.
Basu I., Chattopadhyay A., Mukhopadhyay C. 2014. Ion channel stability of gramicidin A in lipid bilayers: effect of hydrophobic mismatch. Biochim. Biophys. Acta. V. 1838. P. 328.
Chou C.L., Knepper M.A. 1989. Inhibition of urea transport in inner medullary collecting duct by phloretin and urea analogues. Am. J. Physiol. V. 257. P. 359.
Chulkov E.G., Ostroumova O.S. 2015. Phloretin modulates the rate of channel formation by polyenes. Biochim. Biophys. Acta. V. 1858. P. 289.
Clark R., Lee S.-H. 2016. Anticancer properties of capsaicin against human cancer. Anticancer Res. V. 36. P. 837.
Cowan M.M. (1999). Plant products as antimicrobial agents. Clin. Microbiol. Rev. V. 12. P. 564.
Cseh R., Hetzer M., Wolf K., Kraus J., Bringmann G., Benz R. 2000. Interaction of phloretin with membranes: on the mode of action of phloretin at the water–lipid interface. Eur. Biophys. J. V. 29. P. 172.
de Jesus A.J., Allen T.W. 2013. The determinants of hydrophobic mismatch response for transmembrane helices. Biochim. Biophys. Acta. V. 1828. P. 851.
Efimova S.S., Malev V.V., Ostroumova O.S. 2016. Effects of dipole potential modifiers on heterogenic lipid bilayers. J. Membr. Biol. V. 249. P. 97.
Efimova S.S., Schagina L.V., Ostroumova O.S. 2014. Channel forming activity of cecropins in lipid bilayers. Effect of agents modifying the membrane dipole potential. Langmuir. V. 30. P. 7884.
Efimova S.S., Zakharova A.A., Medvedev R.Ya., Ostroumova O.S. 2018. Ion channels induced by antimicrobial agents in model lipid membranes are modulated by plant polyphenols through surrounding lipid media. J. Membr. Biol. V. 251. P. 551.
Efimova S.S., Zakharova A.A., Schagina L.V., Ostroumova O.S. 2016. Two types of syringomycin E channels in sphingomyelin-containing bilayers. Eur. Biophys. J. V. 45. P. 91.
Gestetner B., AssaY., Henis Y., Tencer Y., Rotman M., Birk Y., Bondi A. 1972. Interaction of leucerne saponins with steroids. Biochim. Biophys. Acta. V. 270. P. 181.
Grau-Campistany A., Strandberg E., Wadhwani P., Reichert J., Bürck J., Rabanal F., Ulrich A.S. 2015. Hydrophobic mismatch demonstrated for membranolytic peptides, and their use as molecular rulers to measure bilayer thickness in native cells. Sci. Rep. V. 5. P. 9388.
Hashmi M.A., Khan A., Farooq U., Khan S. 2018. Alkaloids as cyclooxygenase inhibitors in anticancer drug discovery. Curr. Protein Pept. Sci. V. 19. P. 292.
Hassan-Zadeh E., Hussain F., Huang J. 2017. Gramicidin peptides alter global lipid compositions and bilayer thicknesses of coexisting liquid-ordered and liquid-disordered membrane domains. Langmuir. V. 33. P. 3324.
Lohner K., Prenner E.J. 1999. Differential scanning calorimetry and X-ray diffraction studies of the specificity of the interaction of antimicrobial peptides with membrane-mimetic systems. Biochim. Biophys. Acta. V. 1462. P. 141.
Luchian T., Mereuta L. 2006. Phlorizin- and 6-ketocholestanol-mediated antagonistic modulation of alamethicin activity in phospholipid planar membranes. Langmuir. V. 22. P. 8452.
Lundbaek J.A., Birn P., Tape S.E., Toombes G.E., Søgaard R., Koeppe R.E., Gruner S.M., Hansen A.J., Andersen O.S. 2005. Capsaicin regulates voltage-dependent sodium channels by altering lipid bilayer elasticity. Mol. Pharmacol. V. 68. P. 680.
Lundbaek J.A., Collingwood S.A., Ingólfsson H.I., Kapoor R., Andersen O.S. 2010. Lipid bilayer regulation of membrane protein function: gramicidin channels as molecular force probes. J. R. Soc. Interface. V. 7. P. 373–395.
Manrique-Moreno M., Londoño-Londoño J., Jemioła-Rzemińska M., Strzałka K., Villena F., Avello M., Suwalsky M. 2014. Structural effects of the solanum steroids solasodine, diosgenin and solanine on human erythrocytes and molecular models of eukaryotic membranes. Biochim. Biophys. Acta. V. 1838. P. 266.
Mereuta L., Asandei A., Luchian T. 2011. Meet me on the other side: trans-bilayer modulation of a model voltage-gated ion channel activity by membrane electrostatics asymmetry. PLoS One. V. 6. P. e25276. https://doi.org/10.1371/journal.pone.0025276
Mereuta L., Luchian T., Park Y., Hahm K.S. 2008. Single-molecule investigation of the interactions between reconstituted planar lipid membranes and an analogue of the HP(2-20) antimicrobial peptide. Biochem. Biophys. Res. Commun. V. 373. P. 467.
Middleton E., Kandaswami C., Theoharides T.C. 2000. The effects of plant flavonoids on mammalian cells: implications for inflammation, heart disease, and cancer. Pharmacol. Rev. V. 52. P. 673.
Netala V.R., Ghosh S.B., Bobbu P., Anitha D., Tartte V. 2015. Triterpenoid saponins: A rewiew on biosynthesis, applications and mechanism of their action. Int. J. Pharm. Pharm. Sci. V. 7. P. 24.
Ostroumova O.S., Efimova S.S., Chulkov E.G., Schagina L.V. 2012a. The interaction of dipole modifiers with polyene-sterol complexes. PLoS One. V. 7. P. e45135. https://doi.org/10.1371/journal.pone.0045135
Ostroumova O.S., Efimova S.S., Mikhailova E.V., Schagina L.V. 2014. The interaction of dipole modifiers with amphotericin-ergosterol complexes. Effects of phospholipid and sphingolipid membrane composition. Eur. Biophys. J. V. 43. P. 207.
Ostroumova O.S., Efimova S.S., Schagina L.V. 2011. 5- and 4'-hydroxylated flavonoids affect voltage gating of single alpha-hemolysin pore. Biochim. Biophys. Acta. V. 1808. P. 2051.
Ostroumova O.S., Efimova S.S., Schagina L.V. 2012b. Probing amphotericin B single channel activity by membrane dipole modifiers. PLoS One. V. 7. P. 30261. https://doi.org/10.1371/journal.pone.0030261
Ostroumova O.S., Gurnev P.A., Schagina L.V., Bezrukov S.M. 2007a. Asymmetry of syringomycin E channel studied by polymer partitioning. FEBS Letters. V. 581. P. 804.
Ostroumova O.S., Kaulin Y.A., Gurnev A.P., Schagina L.V. 2007б. Effect of agents modifying the membrane dipole potential on properties of syringomycin E channels. Langmuir. V. 23. P. 6889.
Ostroumova O.S., Malev V.V., Ilin M.G., Schagina L.V. 2010. Surfactin activity depends on the membrane dipole potential. Langmuir. V. 26. P. 15092.
Rokitskaya T.I., Kotova E.A., Antonenko Y.N. 2002. Membrane dipole potential modulates proton conductance through gramicidin channel: movement of negative ionic defects inside the channel. Biophys. J. V. 82. P. 865.
Sultana S., Asif H.M. 2017. Review: medicinal plants combating against hypertension: a green antihypertensive approach. Pak. J. Pharm. Sci. V. 30. P. 2311.
Svetina S., Kuzman D., Waugh R.E., Ziherl P., Zeks B. 2004. The cooperative role of membrane skeleton and bilayer in the mechanical behaviour of red blood cells. Bioelectrochem. V. 62. P. 107.
Swain J., Kumar Mishra A. 2015. Location, partitioning behavior, and interaction of capsaicin with lipid bilayer membrane: study using its intrinsic fluorescence. J. Phys. Chem. B. V. 119. P. 12086.
Torrecillas A., Schneider M., Fernández-Martínez A.M., Ausili A., de Godos A.M., Corbalán-García S., Gómez-Fernández J.C. 2015. Capsaicin fluidifies the membrane and localizes itself near the lipid-water interface. ACS Chem. Neurosci. V. 6. P. 1741.
Winski S.L., Carter D.E. 1998. Arsenate toxicity in human erythrocytes: characterization of morphologic changes and determination of the mechanism of damage. J. Toxicol. Environ. Health A. V. 53. P. 345.
Yamaguchi K., Kato M., Suzuki M., Asanuma K., Aso Y., Ikeda S., Ishigai M. 2011. Pharmacokinetic and pharmacodynamic modeling of the effect of an sodium-glucose cotransporter inhibitor, phlorizin, on renal glucose transport in rats. Drug. Metab. Dispos. V. 39. P. 1801.
Yan L.L., Zhang Y.J., Gao W.Y., Man S.L., Wang Y. 2009. In v-itro and in vivo anticancer activity of steroid saponins of paris polyphylla var. Yunnanensis Exp. Oncol. V. 31. P. 27.
Yassin A.M., El-Deeb N.M., Metwaly A.M., Fawal G.F., Radwan M.M., Hafez E.E. 2013. Induction of apoptosis in human cancer cells through extrinsic and intrinsic pathways by balanites Aegyptiaca furostanol saponins and saponin-coated silvernanoparticles. Der. Pharm. Lett. V. 182. P. 1675.
Дополнительные материалы отсутствуют.


