Цитология, 2020, T. 62, № 4, стр. 286-292
Апоптоз клеток гепатоцеллюлярной карциномы-29 после введения карбоната лития in vivo
Ю. С. Таскаева 1, 2, *, И. С. Гогаева 1, 2, Н. П. Бгатова 1
1 Научно-исследовательский институт клинической и экспериментальной лимфологии – филиал Федерального исследовательского центра Института цитологии и генетики СО РАН
630060 Новосибирск, Россия
2 Новосибирский национальный исследовательский государственный университет
630090 Новосибирск, Россия
* E-mail: inabrite@yandex.ru
Поступила в редакцию 13.12.2019
После доработки 20.12.2019
Принята к публикации 25.12.2019
Аннотация
Гепатоцеллюлярная карцинома (ГЦК) характеризуется как крайне гетерогенный и злокачественный тип рака печени, развитие которого сопровождается рядом генетических мутаций в сигнальных путях, участвующих в процессах пролиферации, роста и гибели опухолевых клеток. На моделях различных типов опухолей было показано, что соли лития способны стимулировать апоптоз, поэтому цель настоящей работы заключалась в изучении способности карбоната лития влиять на развитие апоптоза в клетках ГЦК-29 in vivo. Методами световой и трансмиссионной электронной микроскопии показано, что в клетках ГЦК‑29 через 23 сут после ежедневного введения экспериментальным животным 20 мМ карбоната лития в мышечную ткань бедра по периферии опухоли развиваются типичные морфологические признаки апоптоза. Методом иммунофлюоресценции выявлено, что после введения лития в клетках ГЦК-29 значительно повышались уровни каспазы-3 и про-апоптотического белка Bad, при этом снижались уровни анти-апоптотического белка Bcl-2. Таким образом, полученные результаты свидетельствуют о том, что карбонат лития способствует развитию апоптоза клеток ГЦК-29 in vivo. Комбинированное использование карбоната лития и химиотерапевтических препаратов может позволить таргетно воздействовать на различные клеточные сигнальные пути в клетках ГЦК для усиления про-апоптотического лекарственного потенциала и преодоления устойчивости опухолевых клеток к апоптозу.
Гепатоцеллюлярная карцинома (ГЦК) – рак, встречающийся более чем в 90% случаев всех первичных новообразований печени и являющийся основной причиной смерти от онкологического заболевания в мире (Balogh et al., 2016; Galle, 2017). Развитие ГЦК сопровождается рядом генетических мутаций, вызывающих изменения в сигнальных путях Wnt/beta-catenin, p53, PI3K/Ras, а также при возникновении окислительного стресса и стресса эндоплазматического ретикулума (Sung et al., 2012).
Эти пути являются основными внутриклеточными сигнальными каскадами, участвующими в процессах пролиферации, роста и гибели опухолевых клеток. При этом для ГЦК особенно характерны молекулярные изменения, влияющие на процессы апоптоза: мутации в гене-супрессоре опухоли Р53 (ТР53), повышение уровней трансформирующего ростового фактора β, появление анти-апоптотического фенотипа и устойчивость к апоптозу, опосредованному рецепторами смерти (Ito et al., 1991; Lee et al., 2001; Hussain et al., 2007; Fabregat, 2009). Дисбаланс про- и анти-апоптотических сигналов, нарушение процессов клеточной гибели и пролиферации в ГЦК определяют необходимость поиска таргетной химиотерапии, направленной на усиление апоптоза ГЦК (Moreno-Càceres, Fabregat, 2015).
В последние годы активно исследуется способность солей лития влиять на рост и развитие опухолей различной локализации (Таскаева, Бгатова, 2019). Выявлено, что литий блокирует пролиферацию опухолевых клеток за счет остановки клеточного цикла на границе фаз G2/M (Erdal et al., 2005; Tsui et al., 2012), индуцирует апоптоз (Li et al., 2015) и способствует развитию аутофагии в опухолевых клетках (O’Donovan et al., 2015). Основные эффекты лития связаны, прежде всего, с его способностью ингибировать фермент киназу гликогенсинтазы 3β (GSK-3β), регулирующую процессы пролиферации, дифференцировки и апоптоза опухолевых клеток (Quiroz et al., 2004). Ранее нами было показано, что в экспериментах in vitro соли лития снижали жизнеспособность и стимулировали апоптоз в клетках гепатоцеллюлярной карциномы-29 (ГЦК-29) (Гаврилова и др., 2016; Бгатова и др., 2017).
Цель настоящего исследования заключается в изучении влияния карбоната лития на изменения морфологии опухолевых клеток и уровней белков-маркеров апоптоза в клетках ГЦК-29 in vivo.
МАТЕРИАЛ И МЕТОДИКА
Животные. Для моделирования опухолевого процесса использовали клеточную линию ГЦК-29, полученную и верифицированную сотрудниками Института цитологии и генетики СО РАН (Каледин и др., 2009). Работа выполнена на мышах-самцах линии СВА массой 18–20 г в возрасте 3 мес. Животных содержали на стандартной диете со свободным доступом к воде и пище. Клетки ГЦК-29 перевивали мышам-самцам линии СВА в брюшную полость, через 10 сут производили забор асцитической жидкости и вводили 2 × 106 клеток в 100 мкл 0.9%-ного физиологического раствора хлорида натрия в мышцу правого бедра интактным мышам. Эксперимент проводили на 2-х группах животных (по 5 мышей в каждой): мыши с имплантированными в мышцу бедра опухолевыми клетками без лечения (контрольная группа) и мыши, получавшие инъекции раствора карбоната лития (Li2CO3, 20 мМ в 100 мкл 0.9%-ного физиологического раствора) ежедневно в течение 23 дней по периферии опухоли в мышцу правого бедра. Материал для исследований (опухоль бедра) брали через 23 сут эксперимента в утренние часы. Животных выводили из эксперимента под эфирным наркозом методом краниоцервикальной дислокации.
Трансмиссионная электронная микроскопия. Образцы опухолевой ткани фиксировали в 4%-ном растворе параформальдегида, приготовленном на растворе Хенкса, дофиксировали в течение 1 ч в 1%-ном растворе тетраоксида осмия на фосфатном буфере pH 7.4, дегидратировали в этиловом спирте возрастающей концентрации и заключали в эпон. Полутонкие срезы толщиной 1 мкм получали на ультрамикротоме Leica EM UC7 (Leica Microsystems, Германия), окрашивали толуидиновым синим, и с помощью светового микроскопа LEICA DME (Leica Microsystems, Германия) выбирали образцы для электронной микроскопии. Из отобранного материала изготавливали ультратонкие срезы толщиной 70–100 нм на ультратоме Leica EM UC7 (Leica Microsystems, Германия), контрастировали насыщенным водным раствором уранилацетата и цитратом свинца. Микрофотографии получали с помощью электронного микроскопа JEM 1400 (JEOL, Япония).
Иммунофлюоресцентное окрашивание. Использовали криосрезы опухолевой ткани. Для приготовления криосрезов опухолевую ткань фиксировали 4%-ным раствором параформальдегида в течение 1 сут, после фиксации отмывали охлажденным раствором натрий-фосфатного буфера (PBS) и погружали в раствор 30%-ной сахарозы на 1 сут. После этого кусочки ткани помещали в фольгу со средой TissueTek и замораживали при –70°С. Срезы из замороженной опухолевой ткани получали на криостате HM 550ОР (Zeiss, Германия). Для проведения процедуры окрашивания криосрезы трижды отмывали раствором PBS и инкубировали в растворе PBS, содержащем 1% бычьего сывороточного альбумина и 1% тритона X-100 для блокирования неспецифического связывания. Затем срезы гибридизировали с первичными антителами к Bad (разведение 1 : 200), Bcl-2 (разведение 1 : 100) и каспазе-3 (1 : 200) в течение ночи при 4°С и далее с соответствующими вторичными антителами, конъюгированными с флюорохромом, в течение 2 ч при 37°С. Далее срезы отмывали раствором PBS и заключали в монтирующую среду, содержащую краситель DAPI. Изображения получали на флюоресцентном микроскопе Axio Observer Z1 (Zeiss, Германия).
Анализ цифровых изображений, полученных в результате иммунофлюоресцентного окрашивания, проводили с помощью программного обеспечения Image J (Wayne Rasband, США), используя закрытую тестовую систему. Для оценки результатов иммунофлюоресцентного окрашивания клеток ГЦК-29 были выбраны по 14 полей зрения для каждой исследуемой группы (общая тестовая площадь составила 0.08 мм2 для каждой группы). Данные представлены как среднее число клеток на группу, позитивно окрашенных на маркеры Bad, Bcl-2 или каспаза-3.
Статистический анализ. Среднее значение и стандартное отклонение вычисляли с помощью программного обеспечения Microsoft Excel (Microsoft, США). Достоверность различий определяли с помощью программного обеспечения Statistica 6.0 (StatSoft, США) с использованием непараметрического U-критерия Манна−Уитни при уровне достоверности 95% (P < 0.05).
Реактивы. В работе использовали Li2CO3 (Завод редких металлов, Новосибирск, Россия); ОsO4 (Sigma, США); эпон (Serva, Германия); Triton X-100 (Sigma-Aldrich, США); бычий сывороточный альбумин (Биолот, Россия); монтирующую среду с красителем DAPI (4′,6-diamidino-2-phenylindole) (Abcam, Великобритания); антитела (Abcam, Великобритания): моноклональные кролика к Bad человека, мыши и крысы (ab32445), моноклональные мыши к Bcl-2 человека и мыши (ab692), поликлональные кролика к каспазе-3 человека, мыши и крысы (ab13847), а также вторичные поликлональные антитела козла к IgG кролика, конъюгированные с Alexa Fluor®488 (ab150077) и вторичные поликлональные антитела осла к IgG мыши, конъюгированные с Al-exa Fluor®594 (ab150108).
РЕЗУЛЬТАТЫ
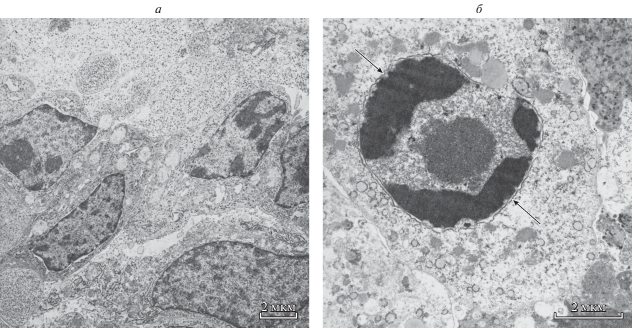
При исследовании срезов опухоли методом световой микроскопии были выявлены апоптотические изменения в отдельных клетках ГЦК-29 через 23 сут после введения экспериментальным животным 20 мМ карбоната лития в мышцу правого бедра по периферии опухоли (рис. 1). С помощью трансмиссионной электронной микроскопии были определены типичные морфологические проявления апоптоза в клетках ГЦК-29 после введения карбоната лития (рис. 2). Клетки карциномы, находящиеся в процессе апоптотической гибели, имели округлую форму, у них наблюдали фрагментацию ядра и конденсацию хроматина, уменьшение клеточного объема и цитоподий, изредка – блеббинг плазматической мембраны.
Рис. 1.
Морфологическое исследование срезов гепатоцеллюлярной карциномы 29 (ГЦК-29). Световая микроскопия. а – Контрольная группа животных без лечения; б – группа животных, получавшая 20 мМ карбоната лития ежедневно в течение 23 сут в мышцу бедра по периферии опухоли. Стрелкой отмечены характерные для апоптоза пикнотические изменения ядра. Окраска толуидиновым синим. Об.: 100×.
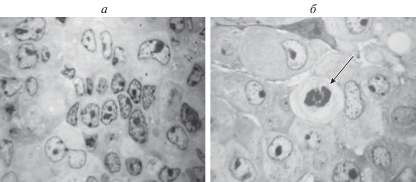
Рис. 2.
Ультраструктура клеток ГЦК-29. Трансмиссионная электронная микроскопия. а – Контрольная группа животных без лечения; б – группа животных, получавшая 20 мМ карбоната лития ежедневно в течение 23 сут в мышцу бедра по периферии опухоли. Стрелками показана конденсация хроматина в ходе апоптоза. Увел.: 8000× (а) или 15000× (б).
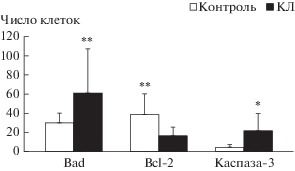
С помощью иммунофлюоресцентного исследования оценивали способность карбоната лития влиять на уровни белков-маркеров апоптоза Bad, Bcl-2 и каспазы-3 (рис. 3) в клетках ГЦК-29. Считали число клеток, позитивно окрашивающихся на данные маркеры (рис. 4). В среднем число Bad-позитивных клеток в группе контроля составляло 29.57 ± 10.44 клеток на группу. При введении карбоната лития число таких клеток значимо повышалось в 2 раза (P < 0.05) по сравнению с контрольной группой. Число каспаза-3-позитивных клеток составляло 4.71 ± 3.41 в группе контроля. Введение карбоната лития также способствовало повышению числа таких клеток в 4.6 раз по сравнению с контрольной группой (P < 0.005). Кроме того, было выявлено, что число Bcl-2-позитивных клеток в контрольной группе было равно 38.29 ± ± 21.42, а после введения карбоната лития снижалось в 2.3 раза (P < 0.005).
Рис. 3.
Иммунофлюоресцентное окрашивание срезов ГЦК-29 на маркеры апоптоза: Bad (а, б: зеленый цвет), Bcl-2 (в, г: красный цвет) и каспаза-3 (д, е: зеленый цвет). а, в, д – Контрольная группа животных без лечения; б, г, е – группа животных, получавшая 20 мМ карбоната лития ежедневно в течение 23 сут в мышцу бедра по периферии опухоли. Синий цвет – окраска ядер DAPI. Об.: 40×.
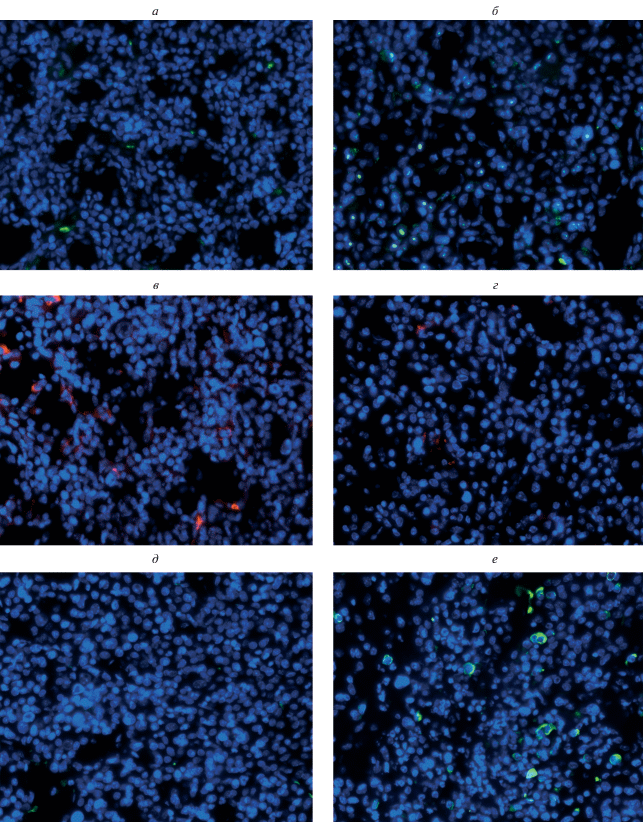
Рис. 4.
Число клеток ГЦК-29, позитивных на маркеры апоптоза Bad, Bcl-2 и каспаза-3 на тестовой площади 0.08 мм2 для каждой группы. Клетки считали в контрольной группе животных без лечения (контроль) и в группе животных, получавших 20 мМ карбоната лития ежедневно в течение 23 сут в мышцу бедра по периферии опухоли (КЛ). Различия между столбцами достоверны при *P < 0.05 или **P < 0.005.
ОБСУЖДЕНИЕ
Апоптоз – это процесс регулируемой клеточной гибели, сопровождающийся характерными морфологическими проявлениями, такими как конденсация хроматина, фрагментация ядра, блеббинг плазматической мембраны и др., и развивающийся в результате внутриклеточных изменений (внутренний путь апоптоза) или изменений в микроокружении клетки (внешний путь апоптоза) (Galluzzi et al., 2018).
Внутренний путь апоптоза инициируется нарушениями внутриклеточного гомеостаза, приводящим к пермеабилизации наружной митохондриальной мембраны, которая происходит под контролем семейства белков-регуляторов апоптоза семейства BCL-2 (Galluzzi et al., 2016). Эта группа белков состоит из про-апоптотических белков PUMA (p53-upregulated modulator of apoptosis), BIM (Bcl-2-interacting mediator of cell death), BID (BH3 interacting domain death agonist), Bad и др. и анти-апоптотических членов семейства (Bcl-2, Bcl2l1 (Bcl2 like 1), Mcl-1 (BCL2 family apoptosis regulator) и др.) (Shamas-Din et al., 2013). Повышение проницамости митохондриальных мембран и высвобождение цитохрома с в цитозоль активируют белковый комплекс, известный, как “апоптосома”, который, в свою очередь, запускает каскад реакций с участием каспаз 3, 6 и 7 (Liu et al., 1996; Kroemer et al., 2007).
Внешний путь апоптоза инициируется двумя типами рецепторов, рецепторами зависимости (при снижении их лигандов) и рецепторами смерти (активируемые лигандами), из которых наиболее хорошо изученными являются рецепторы смерти (Wajant, 2002; Gibert, Mehlen, 2015). Каскад реакций, запускаемый рецепторами смерти, сводится к образованию сигнального комплекса DISC, индуцирующего смерть (death-inducing signaling complex), и последующей активации каспаз 8, 10, 3 и других (Galluzzi et al., 2016). Митохондрии также могут участвовать во внешнем пути апоптоза за счет белка BID в каспазном каскаде реакций (Li et al., 1998).
В настоящей работе выявлено, что введение лития по периферии опухоли в течение 23 сут способствовало развитию апоптоза клеток ГЦК-29. С помощью световой и трансмиссионной электронной микроскопии были выявлены характерные морфологические проявления апоптоза в этих клетках. Методом иммунофлюоресцентного исследования получены данные, что литий повышает уровень про-апоптотического белка Bad и снижает уровень анти-апоптотического белка Bcl-2. Согласно данным из литературы литий способен стимулировать апоптоз в опухолевых клетках, что было показано in vitro на различных клеточных линиях ГЦК (Erdal et al., 2005). Кроме того, выявлено, что литий повышает уровни каспазы 3 и 8, а также р53, стимулируя TRAIL-индуцированный апоптоз в клетках ГЦК, но не оказывает подобного влияния на первичные гепатоциты (Beurel et al., 2009). Таким образом, полученные нами результаты согласуются с данными из литературы о влиянии лития на апоптоз в клетках ГЦК.
Предполагается, что литий вызывает апоптоз в опухолевых клетках за счет ингибирования GSK-3β (Zassadowski et al., 2015; Han et al., 2017). GSK-3β – основная внутриклеточная мишень лития, которая участвует во множестве сигнальных путей: PI3K/Akt/mTORC1, Ras/Raf/MEK/ERK, Wnt/бета-катенин, Hedgehog, Notch и других (McCubrey et al., 2014; Mancinelli et al., 2017). GSK-3β встречается в цитоплазме, ядре и митохондриях (Mota de Freitas et al., 2016), при этом в митохондриях содержится более высокий, чем в цитозоле, уровень нефосфорилированной активной GSK-3β; таким образом, митохондрии могут быть особенно чувствительны к литию (Bijur, Jope, 2003; Jakobsson et al., 2017).
Было показано, что литий инициировал внешний путь апоптоза за счет активации рецепторов смерти, и это было связано с ингибированием литием GSK-3β (Song et al., 2004). В то же время менее изучена способность лития влиять на внутренний путь апоптоза. Известно, что GSK-3 напрямую участвует в передаче сигналов во внутреннем пути апоптоза, повышая уровни про-апоптотических белков и снижая уровни анти-апоптотических белков (Beurel, Jope, 2006). В одной из работ было выявлено, что литий значительно увеличивал уровни Bax, одновременно снижая уровень Bcl-2, однако влияние лития на GSK-3β, вероятно, опосредующее данные эффекты, изучено не было (Matsebatlela et al., 2012). Поскольку в литературе данные о механизмах действия лития на внутренний и внешний пути апоптоза, а также вовлеченность в эти механизмы GSK-3β ограничены, комплексное исследование этих процессов должно дать представление о влиянии лития на сигнальные пути, ассоциированные с апоптозом в раковых клетках, в том числе и в ГЦК.
Наличие множества молекулярных событий, способствующих устойчивости к апоптозу при ГЦК, определяет обоснованность дальнейших исследований и разработки новых терапевтических стратегий, направленных на белки и (или) гены, связанные с апоптозом. Совместное введение карбоната лития и химиотерапевтических препаратов с альтернативными механизмами действия может позволить таргетно воздействовать на различные клеточные сигнальные пути в клетках ГЦК для усиления про-апоптотического лекарственного потенциала и преодоления устойчивости опухолевых клеток к апоптозу.
Список литературы
Бгатова Н.П., Гаврилова Ю.С., Лыков А.П., Соловьева А.О., Макарова В.В., Бородин Ю.И., Коненков В.И. 2017. Апоптоз и аутофагия в клетках гепатокарциномы, индуцированные различными формами солей лития. Цитология. 59(3) : 178–184. (Bgatova N.P., Gavrilova Yu.S., Lykov A.P., Solovieva A.O., Makarova V.V., Borodin Yu.I., Konenkov V.I. 2017. Apoptosis and autophagy in hepatocarcinoma cells induced by different forms of lithium salts. Cell Tiss. Biol. 11(4) : 261–267.)
Гаврилова Ю.С., Бгатова Н.П., Соловьева А.О., Трифонова К.Э., Лыков А.П., Бородин Ю.И., Коненков В.И. 2016. Клетки-мишени различных форм лития в гетерогенной популяции гепатокарциномы-29. Цитология. 58(3) : 186–191. (Gavrilova Y.S., Bgatova N.P., Solov’eva A.O., Trifonova K.E., Lykov A.P., Borodin Y.I., Konenkov V.I. 2016. Target cells for lithium in different forms within a heterogeneous hepatocarcinoma-29 population. Cell Tiss. Biol. 10(4) : 284–289.)
Каледин В.И., Жукова Н.А., Николин В.П. Попова Н.А., Беляев М.Д., Багинская Н.В. и др. 2009. Гепатокарцинома-29 – метастазирующая перевиваемая опухоль мышей, вызывающая кахексию. Бюл. экспер. биол. 148(12) : 664–669. (Kaledin V.I., Zhukova N.A., Nikolin V.P., Popova N.A., Belyaev M.D., Baginskaya N.V. et al. 2009. Hepatocellular carcinoma-29 – metastatic transplantable tumor of mice, causing cachexia. Bull Exp Biol Med. 148(12) : 664–669.)
Таскаева Ю.С., Бгатова Н.П. 2019. Соли лития в экспериментальной онкологии (обзор литературы). Сибирский научный медицинский журн. 39 : 12–18. (Taskaeva I.S., Bgatova N.P. 2019. Lithium salts in experimental oncology: review. Siberian Scientific Medical J. 39 : 12–18.)
Balogh J., Victor D. 3rd, Asham E.H., Burroughs S.G., Boktour M., Saharia A. et al. 2016. Hepatocellular carcinoma: a review. J. Hepatocell. Carcinoma. 3 : 41–53.
Beurel E., Jope R.S. 2006. The paradoxical pro- and anti-apoptotic actions of GSK3 in the intrinsic and extrinsic apoptosis signaling pathways. Prog Neurobiol. 79 : 173–89.
Beurel E., Blivet-Van Eggelpoël M.J., Kornprobst M., Moritz S., Delelo R., Paye F. et al. 2009. Glycogen synthase kinase-3 inhibitors augment TRAIL-induced apoptotic death in human hepatoma cells. Biochem. Pharmacol. 77 : 54–65.
Bijur G.N., Jope R.S. 2003. Glycogen synthase kinase-3 beta is highly activated in nuclei and mitochondria. Neuroreport. 14 : 2415–2419.
Erdal E., Ozturk N., Cagatay T., Eksioglu-Demiralp E., Ozturk M. 2005. Lithium-mediated downregulation of PKB/Akt and cyclin E with growth inhibition in hepatocellular carcinoma cells. Int. J. Cancer. 115 : 903–910.
Fabregat I. 2009. Dysregulation of apoptosis in hepatocellular carcinoma cells. World J. Gastroenterol. 15 : 513–520.
Galle P.R. 2017. Treating hepatobiliary cancers: the oncology way. Dig. Dis. 35 : 384–386.
Galluzzi L., Kepp O., Kroemer G. 2016. Mitochondrial regulation of cell death: a phylogenetically conserved control. Microb. Cell. 3 : 101–108.
Galluzzi L., Vitale I., Aaronson S.A., Abrams J.M., Adam D., Agostinis P., Alnemri. S., Altucci L., Amelio I., Andrews D.W., Annicchiarico-Petruzzelli M., Antonov A.V., Arama E., Baehrecke E.H., Barlev N.A., et al. 2018. Molecular mechanisms of cell death: recommendations of the Nomenclature Committee on Cell Death 2018. Cell Death Differ. V. 25. P. 486.
Gibert B., Mehlen P. 2015. Dependence Receptors and Cancer: Addiction to Trophic Ligands. Cancer Res. 75 : 5171–5175.
Han S., Meng L., Jiang Y., Cheng W., Tie X., Xia J., Wu A. 2017. Lithium enhances the antitumour effect of temozolomide against TP53 wild-type glioblastoma cells via NFAT1/FasL signaling. Br. J. Cancer. 116 : 1302–1311.
Hussain S.P., Schwank J., Staib F., Wang X.W., Harris C.C. 2007. TP53 mutations and hepatocellular carcinoma: insights into the etiology and pathogenesis of liver cancer. Oncogene. 26 : 2166–76.
Ito N., Kawata S., Tamura S., Takaishi K., Shirai Y., Kiso S. et al. 1991. Elevated levels of transforming growth factor beta messenger RNA and its polypeptide in human hepatocellular carcinoma. Cancer Res. 51 : 4080–4083.
Jakobsson E., Argüello-Miranda O., Chiu S.W., Fazal Z., Kruczek J., Nunez-Corrales S. et al. 2017. Towards a unified understanding of lithium action in basic biology and its significance for applied biology. J. Membr. Biol. 250 : 587–604.
Kroemer G., Galluzzi L., Brenner C. 2007. Mitochondrial membrane permeabilization in cell death. Physiol. Rev. 87 : 99–163.
Lee S.H., Shin M.S., Lee H.S., Bae J.H., Lee H.K., Kim H.S. et al. 2001. Expression of Fas and Fas-related molecules in human hepatocellular carcinoma. Hum. Pathol. 32 : 250–256.
Li H., Zhu H., Xu C.J., Yuan J. 1998. Cleavage of BID by caspase 8 mediates the mitochondrial damage in the Fas pathway of apoptosis. Cell. 94 : 491–501.
Li L., Song H., Zhong L., Yang R., Yang X.Q., Jiang K.L., Liu B.Z. 2015. Lithium chloride promotes apoptosis in human leukemia NB4 cells by inhibiting glycogen synthase kinase-3 beta. Int. J. Med. Sci. 12 : 805–810.
Liu X., Kim C.N., Yang J., Jemmerson R., Wang X. 1996. Induction of apoptotic program in cell-free extracts: requirement for dATP and cytochrome c. Cell. 86 : 147–57.
Mancinelli R., Carpino G., Petrungaro S., Mammola C.L., Tomaipitinca L., Filippini A. et al. 2017. Multifaceted roles of GSK-3 in cancer and autophagy-related diseases. Oxid. Med. Cell Longev. 2017 : 4629495.
Matsebatlela T., Gallicchio V., Becker R. 2012. Lithium modulates cancer cell growth, apoptosis, gene expression and cytokine production in HL-60 promyelocytic leukaemia cells and their drug-resistant sub-clones. Biol. Trace Elem. Res. 149 : 323–30.
Mazzanti R., Arena U., Tassi R. 2016. Hepatocellular carcinoma: Where are we? World J. Exp. Med. 6 : 21–36.
McCubrey J.A., Steelman L.S., Bertrand F.E., Davis N.M., Sokolosky M., Abrams S.L. et al. 2014. GSK-3 as potential target for therapeutic intervention in cancer. Oncotarget. 5 : 2881–2911.
Moreno-Càceres J., Fabregat I. 2015. Apoptosis in liver carcinogenesis and chemotherapy. Hepat. Oncol. 2 : 381–397.
Mota de Freitas D., Leverson B.D., Goossens J.L. 2016. Lithium in medicine: mechanisms of action. Met. Ions Life Sci. 16 : 557–584.
O’Donovan T.R., Rajendran S., O’Reilly S., O’Sullivan G.C., McKenna S.L. 2015. Lithium modulates autophagy in esophageal and colorectal cancer cells and enhances the efficacy of therapeutic agents in vitro and in vivo. PLoS One. 10 : e0134676.
Quiroz J.A., Gould T.D., Manji H.K. 2004. Molecular effects of lithium. Mol. Interv. 4 : 259–272.
Shamas-Din A., Kale J., Leber B., Andrews D.W. 2013. Mechanisms of action of Bcl-2 family proteins. Cold Spring Harb. Perspect. Biol. 5 : a008714.
Song L., Zhou T., Jope R.S. 2004. Lithium facilitates apoptotic signaling induced by activation of the Fas death domain-containing receptor. BMC Neurosci. 5 : 20.
Sung W.K., Zheng H., Li S., Chen R., Liu X., Li Y. et al. 2012. Genome-wide survey of recurrent HBV integration in hepatocellular carcinoma. Nat. Genet. 44 : 765–769.
Tsui M.M., Tai W.C., Wong W.Y., Hsiao W.L. 2012. Selective G2/M arrest in a p53 (Val135)-transformed cell line induced by lithium is mediated through an intricate network of MAPK and β-catenin signaling pathways. Life Sci. 91 : 312–321.
Wajant H. 2002. The Fas signaling pathway: more than a paradigm. Science. 296 : 1635–6.
Zassadowski F., Pokorna K., Ferre N., Guidez F., Llopis L., Chourbagi O. et al. 2015. Lithium chloride antileukemic activity in is GSK-3 and MEK/ERK dependent. Leukemia. 29 : 2277–2284.
Дополнительные материалы отсутствуют.


