Цитология, 2020, T. 62, № 5, стр. 367-374
Синергизм одновременного действия тяжелого металла в разной концентрации и ионизирующего излучения (или гипертермии) на выживаемость дрожжевых клеток
А. Н. Филимонова 1, М. С. Толкаева 2, Е. С. Евстратова 1, *, В. Г. Петин 2
1 Национальный медицинский исследовательский центр (НМИЦ) радиологии Минздрава РФ
249036 Обнинск, Россия
2 Медицинский радиологический научный центр им. А.Ф. Цыба – филиал “НМИЦ радиологии” Минздрава РФ
249036 Обнинск, Россия
* E-mail: ekevs7240@mail.ru
Аннотация
Представлены новые экспериментальные результаты по синергизму одновременного действия одного из трех тяжелых металлов в различных концентрациях и ионизирующей радиации (или гипертермии) на выживаемость диплоидных дрожжевых клеток Saccharomyces cerevisiae. Показано, что синергическое взаимодействие повреждений, индуцированных этими агентами при постоянной концентрации препарата, регистрируется лишь в пределах определенного температурного диапазона с оптимальным значением внутри него, при котором наблюдается максимальный синергический эффект. Увеличение концентрации препарата приводило к необходимости повышения действующей температуры для сохранения максимального синергического эффекта. При изменении концентрации раствора соли тяжелого металла, но при фиксированной мощности дозы ионизирующего излучения синергическое взаимодействие наблюдается лишь в пределах определенного диапазона концентраций изученных солей. Внутри этого диапазона имеется оптимальная концентрация, при которой наблюдается максимальный синергический эффект. Анализируются общие закономерности проявления синергизма, не зависящие от применяемых агентов, биологических объектов и тестов. Обсуждаются возможные механизмы описанных эффектов и пути их практического использования.
В работах, посвященных проблемам загрязнения окружающей среды, к тяжелым металлам относят более 40 химических элементов с большим атомным весом, обладающих свойствами металлов. Наибольшая опасность тяжелых металлов обусловлена их высокой токсичностью для живых организмов при относительно низких концентрациях, а также способностью к накоплению организмом этих элементов в бóльшей концентрации, чем они находятся в окружающей среде (Израэль, 1979; Теплая, 2013). Поступление тяжелых металлов в природную среду связано с активной деятельностью человека. Кроме антропогенных источников загрязнения биосферы тяжелыми металлами существуют и естественные, в частности извержение вулканов. Практически всегда тяжелые металлы действуют одновременно с другими поллютантами или физическими факторами окружающей среды, например с гипертермией, усиливающими клеточный эффект при их одновременном применении со многими физическими и химическими агентами (Петин и др., 2012; Petin, Kim, 2016).
При синергическом взаимодействии индуцированных повреждений наблюдаемый биологический результат комбинированного применения агентов превышает ожидаемый при независимом сложении эффектов от каждого агента. В процитированных работах для оценки степени такого взаимодействия использован коэффициент синергического усиления, показывающий, во сколько раз продолжительность одновременного применения агентов уменьшилась по сравнению с ожидаемой при независимом действии. В состав некоторых химических агентов в химиолучевой терапии входят соли тяжелых металлов (Bica et al., 2011; Ceresa et al., 2014). Изучение иммунотропных свойств дихлорида ртути выявило возможность использования его в качестве потенциального противоопухолевого средства (Арефьева и др., 2010).
Для повышения эффективности лечения в онкологии рекомендуется использовать идеи синергизма при одновременном действии гипертермии с ионизирующим излучением или лекарственными средствами (Evstratova et al., 2018). При одновременном действии агентов выявлен ряд общих закономерностей проявления синергизма, не зависящий от применяемого биологического объекта, теста и факторов, используемых в комбинациях (Петин и др., 2012; Petin, Kim, 2016). Среди таких закономерностей, выявленных в данной работе, является оригинальное влияние интенсивности действующих агентов на эффективность синергического взаимодействия – синергизм вначале возрастает с увеличением интенсивности (концентрации препаратов), достигает максимума и затем снова уменьшается. Такая закономерность наблюдалась ранее (Петин, Жураковская, 2015; Евстратова, Петин, 2018) при одновременном действии повышенной температуры и ионизирующего излучения или УФ света, или ультразвука, или неионизирующего электромагнитного поля в диапазоне сверхвысоких частот (СВЧ).
Представляло интерес изучить закономерности синергизма одновременного действия тяжелых металлов в разной концентрации и ионизирующего излучения (или гипертермии) на выживаемость дрожжевых клеток. При применении химических агентов и гипертермии в качестве количественной меры действия этих агентов можно использовать продолжительность их действия. Действительно, в случае использования химических токсикантов или повышенной температуры с ростом продолжительности их действия увеличивается число формируемых ими повреждений, а изменение концентрации препарата или действующей температуры влияет на скорость их формирования.
В связи с этим в настоящей работе были поставлены следующие задачи: 1) проанализировать влияние концентрации солей тяжелых металлов и ионизирующего излучения (или гипертермии) на выживаемость дрожжевых клеток; 2) выявить общие закономерности проявления синергизма, не зависящие от воздействующих агентов; 3) обсудить возможные механизмы описанных эффектов и пути их практического использования.
МАТЕРИАЛЫ И МЕТОДИКА
Объектом исследования служили диплоидные дрожжевые клетки Saccharomyces cerevisiae (штамм XS800), на которыe в стационарной стадии роста воздействовали химическим препаратом, содержащим соль тяжелого металла (платину, свинец или хром), отдельно и в комбинации с гипертермией (37–60°С) или ионизирующим излучением. Дрожжевые клетки выращивали на твердой питательной среде (1% пептона, 2% глюкозы, 1% дрожжевого экстракта и 2% агар-агара).
Схема эксперимента. Химический препарат помещали в суспензию клеток за 30 мин до облучения ионизирующим излучением или воздействия гипертермией. Действие осуществляли в термостатированном сосуде, в котором нужную температуру поддерживали в пределах ±0.1°С. Интервал времени между применением агентов (химического препарата и гипертермии или ионизирующего излучения) составлял 0.1–0.3 мин, что было значительно меньше общей продолжительности воздействия. Для раздельного действия гипертермии или ее одновременного применения с солью тяжелого металла 0.1 мл клеточной суспензии (с концентрация 108 кл./мл) помещали в предварительно прогретую стерильную воду (9.9 мл). Воздействие ионизирующим излучением проводили на установке “Исследователь” (Россия; γ-кванты 60Со, мощность дозы 10.8 Гр/мин).
Гипертермическую обработку осуществляли с помощью термостата медицинского водяного серии TW-2.03 (SIA “ELMI”, Латвия). В предварительно нагретые до исследуемой температуры пробирки со стерильной водой добавляли химический препарат и клеточную суспензию. При этом концентрация суспензии, которая подвергалась воздействию этих агентов, составляла 106 кл./мл.
Определение выживаемости клеток. По окончании одновременного комбинированного воздействия каждого препарата в комбинации с гипертермией или ионизирующим излучением клетки помещали в чашки Петри с питательной средой так, чтобы образовывалось 150–200 колоний. Выживаемость клеток определяли подсчетом макроколоний после 3–5-суточного выращивания дрожжевых клеток при 30°С. Все экспериментальные серии повторяли 3–5 раз. Результаты представлены в виде среднего значения и его стандартной ошибки. Детали методов культивирования, определения выживаемости, статистической обработки описаны ранее (Петин и др., 2012; Petin, Kim, 2016).
Реактивы. Использовали следующие растворы солей тяжелых металлов: цисплатин (цис-диаминдихлорплатина, Pt(NH3)2Cl2, производитель ООО ЛЭНС ФАРМ, Россия) в концентрации 0.05 и 0.25 мг/мл; йодид свинца(II), (PbI2; Sigma-Aldrich, Германия) в концентрации 0.5, 1.0, 1.5 и 2.5 мг/мл; дихромат калия (K2Cr2O7; Sigma-Aldrich, Германия) в концентрации 0.05, 0.5, 1.5 и 5 мг/мл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1 приведены зависимости выживаемости диплоидных дрожжевых клеток S. cerevisiae (штамм XS800) от продолжительности действия цисплатина (кривые 1), гипертермии (кривые 2) и одновременного применения этих агентов (кривые 4). Кривые 3 на этом рисунке – теоретически рассчитанные кривые выживаемости для независимого сложения эффектов от действия цисплатина и повышенных температур. Отметим, что при независимом действии агентов вероятность регистрируемого эффекта, в соответствии с известным положением теории вероятности (Феллер, 1967; Васина и др., 2018), определяется не простым суммированием эффектов, а произведением вероятностей эффектов, индуцированных каждым агентом в отдельности. Так, для выживаемости клеток имеем
где S – вероятность выживаемости клеток после комбинированного воздействия, а S1 и S2 – вероятности выживаемости после действия каждого из применяемых агентов в отдельности. Тогда после логарифмирования уравнения (1) имеем(2)
$\ln S = \ln {{S}_{1}} + \ln {{S}_{2}}\,\,\,\,{\text{и}}\,\,\,\,\lg S = \lg {{S}_{1}} + \lg {{S}_{2}}.$Рис. 1.
Кривые зависимости выживаемости диплоидных дрожжевых клеток Saccharomyces cerevisiae (штамм XS800) от продолжительности действия цисплатина в концентрации 0.25 мг/кг (кривые 1), повышенной температуры (кривые 2) и одновременного действия цисплатина и гипертермии (кривые 4). Температура (°С): а – 47.5; б – 50; в – 52.5; г – 55.5. Кривые 3 – теоретические кривые, рассчитанные при условии независимого сложения эффектов, индуцированных при одновременном применении этих агентов. t1 – продолжительность одновременного применения гипертермии и цисплатина, снижающая выживаемость до 10%; t2– продолжительность воздействия этих агентов, ожидаемая при независимом действии агентов (уравнение (2) и снижающая выживаемость до 10%.
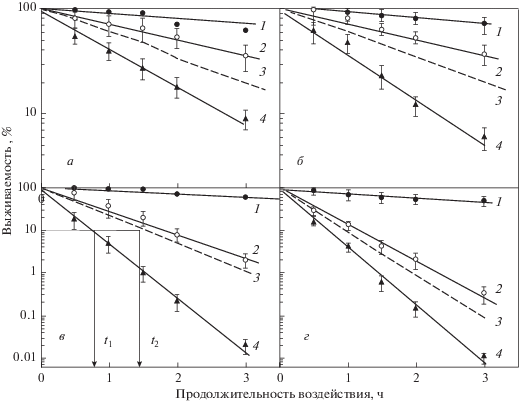
Это означает, что независимое действие двух агентов характеризуется сложением натуральных или десятичных логарифмов вероятностей выживаемости. В соответствии со статистикой Пуассона (Капульцевич, 1978) число повреждений, индуцированных фактором, вызывающим инактивацию клеток, может быть определено как
Тогда уравнение (2) означает, что суммарное число повреждений, образуемых при независимом действии двух факторов, определяется суммой повреждений, образованных каждым из действующих факторов. Уравнение (2) использовано в данной работе для расчета теоретически ожидаемых кривых выживаемости (кривые 3).
Из рис. 1 видно, что во всех случаях наблюдается их синергическое взаимодействие – экспериментальные кривые выживаемости после комбинированных воздействий расположены ниже ожидаемых при независимом сложении эффектов от каждого агента. Для количественной оценки степени синергизма мы использовали коэффициента синергического усиления k (Петин и др., 2012; Petin, Kim, 2016), определяемый отношением изоэффективных доз на теоретически ожидаемой и экспериментальной кривых доза-эффект. Вместо дозы в данном исследовании мы использовали продолжительность воздействия:
Фактически коэффициент k показывает, во сколько раз для одинакового эффекта уменьшилась продолжительность ожидаемого воздействия (t2) по сравнению с наблюдаемой в эксперименте величиной (t1). На рис. 1в стрелками указан пример расчета этого коэффициента. Аналогичный набор кривых выживаемости был получен для всех исследованных комбинированных воздействий в данной работе, что позволило количественно оценить эффективность синергического усиления.
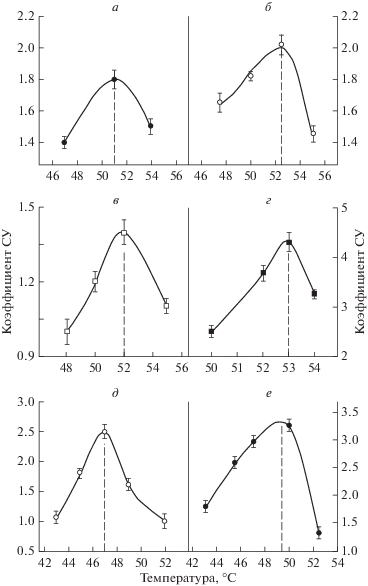
На рис. 2 приведены зависимости коэффициента синергического усиления от продолжительности применения гипертермии, действующей одновременно с одной из различных солей тяжелых металлов в разной концентрации на выживаемость диплоидных дрожжевых клеток. Видно, что во всех случаях отмечается куполообразная закономерность: синергизм сначала возрастает с увеличением действующей гипертермии, достигает максимального значения и затем снова уменьшается. Другая важная закономерность: с уменьшением концентрации препаратов максимум синергического взаимодействия смещается в область более низких температур.
Рис. 2.
Зависимость коэффициента синергического усиления (СУ) от температуры при одновременном действии соли тяжелого металла (цисплатина, PbI2 или К2Сr2O7) с гипертермией на выживаемость диплоидных дрожжевых клеток S. cerevisiae (штамм XS800). Концентрация цисплатина – 0.5 (а) и 0.25 (б) мг/мл; концентрация PbI2 – 1 (в) и 2.5 (г) мг/мл; концентрация К2Сr2O7 – 0.5 (д) и 5 (е) мг/мл.
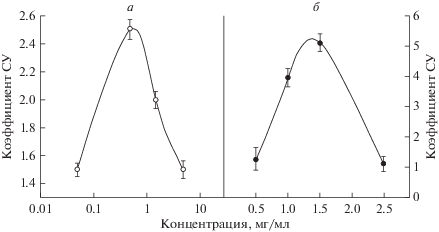
На рис. 3 приведена зависимость коэффициента синергического усиления от концентрации раствора соли тяжелого металла (а – K2Cr2O7; б – PbI2) после их одновременного действия с ионизирующим излучением (60Co, 10.8 Гр/мин) на выживаемость диплоидных дрожжевых клеток S. cerevisiae. Видно, что и в этом случае наблюдается куполообразная зависимость эффективности синергического взаимодействия от концентрации соли тяжелого металла. Любое отклонение концентрации от оптимального значения, обеспечивающего максимальное синергическое взаимодействие, приводит к снижению эффективности синергического взаимодействия.
Рис. 3.
Зависимость коэффициента синергического усиления (СУ) от концентрации раствора соли тяжелого металла K2Cr2O7 (а) или PbI2 (б) при их одновременном действии с ионизирующим излучением (60Co, 10.8 Гр/мин) на выживаемость диплоидных дрожжевых клеток S. cerevisiae (штамм XS800).
Итак, во всех случаях отмечена куполообразная зависимость коэффициента синергического усиления от действующей температуры или концентрации изученных химических агентов. Эти результаты, впервые полученные для комбинированного действия соли тяжелого металла с ионизирующим излучением (или гипертермией), подтверждают ранее выявленную закономерность проявления максимального синергического взаимодействия (Петин и др., 2012; Петин, Жураковская, 2014; Petin, Kim, 2016; Evstratova et al., 2018) после одновременного применения гипертермии с одним из различных физических факторов окружающей среды – ионизирующим излучением, УФ светом, ультразвуком, не ионизирующим электромагнитным излучением СВЧ диапазона. В этих же работах приводятся данные о синергическом взаимодействии повреждений, индуцированных различными лекарственными средствами, гипертермией или ионизирующим излучением. Описанные в данной работе закономерности синергического взаимодействия повреждений от соли тяжелого металла с повреждениями, сформированными ионизирующим излучением или гипертермией, приводятся впервые.
Ранее была предложена математическая модель, прогнозирующая закономерности синергического взаимодействия повреждений, индуцированных различными факторами окружающей среды (Петин, Комаров, 1989; Petin, Komarov, 1997). В модели выдвинута гипотеза о формировании при комбинированных воздействиях дополнительных эффективных повреждений, возникающих за счет взаимодействия субповреждений, неэффективных при действии каждого агента в отдельности. Модель прогнозирует максимальное значение коэффициента синергического усиления при равенстве субповреждений от каждого агента. Далее, при постоянной интенсивности одного из действующих агентов модель предсказывает существование оптимальной интенсивности другого фактора, обеспечивающей максимальный синергический эффект. И, наконец, из модели следует, что при снижении интенсивности одного из агентов, следует уменьшать и интенсивность другого фактора для обеспечения максимального синергического взаимодействия. Отметим, что эти прогнозируемые закономерности подтверждены в экспериментах по комбинированному действию различных агентов на выживаемость фагов, бактериальных спор, бактерий, дрожжевых клеток различного генотипа, культивируемых клеток млекопитающих и лабораторных животных при действии СВЧ излучения и окружающей температуры на нагрев кроликов (Петин и др., 2012; Petin, Kim, 2016; Жаворонков, Петин, 2018). Совокупность этих данных указывает на универсальность проявления синергизма, не зависящего от воздействующих факторов, применяемых объектов и тестов.
Используем базовые представления математической модели синергизма (Петин, Комаров, 1989; Petin, Komarov, 1997) для интерпретации результатов, представленных в настоящей работе. Очевидно, что при постоянной концентрации соли тяжелого металла с повышением действующей температуры эффективность синергического взаимодействия их повреждений вначале возрастает, достигает максимального значения и затем уменьшается (рис. 2). Отсутствие синергического взаимодействия или его небольшая эффективность при относительно низких температурах означает сравнительно малое число термических повреждений и соответствующих субповреждений. При этом для обеспечения заданного уровня эффекта (например, 10% выживаемости, рис. 1в) должно формироваться значительное число повреждений от солей тяжелых металлов. При дальнейшем повышении действующей температуры возрастает число образуемых термических повреждений и уменьшается число повреждений от химических агентов. Максимальное значение коэффициента синергического усиления достигается при равенстве химических и термических субповреждений. Дальнейшее повышение действующей температуры приводит к последовательному снижению эффекта синергизма из-за значительного увеличения числа термических субповреждений и соответствующего уменьшения числа химических субповреждений из-за уменьшения общей длительности воздействия. Поэтому эффективность синергического взаимодействия уменьшается или полностью отсутствует из-за отсутствия равенства субповреждений от каждого агента.
Показано, что при постоянной мощности дозы ионизирующего излучения и изменении концентрации соли тяжелого металла эффективность синергического взаимодействия их повреждений также вначале возрастает, достигает максимального значения и затем снова уменьшается (рис. 3). Отсутствие синергического взаимодействия или его небольшая эффективность при низких значениях концентраций соли тяжелого металла может быть следствием большого числа повреждений от ионизирующего излучения из-за сравнительно длительного облучения при значительно меньшем вкладе тяжелого металла в инактивацию клеток. Максимальный синергический эффект наблюдается при равенстве субповреждений от каждого агента. При дальнейшем повышение концентрации образуется большее число летальных повреждений от химического фактора и соответствующих им субповреждений, ответственных за синергизм, поэтому эффективность синергического взаимодействия значительно уменьшается из-за отсутствия равенства субповреждений от каждого агента.
Эксперименты в настоящей работе выполнены при сравнительно высоких температурах и концентрациях тяжелого металла. Возникает вопрос, сохранятся ли выявленные закономерности при малых концентрациях тяжелых металлов и меньших значениях действующей температуры. В данной работе и нескольких наших предыдущих публикациях было показано, что чем меньше интенсивность одного из применяемых факторов, тем при меньшей интенсивности другого фактора достигается максимальный синергизм (Petin, Zhurakovskaya, 1995; Петин, Жураковская, 2015; Евстратова, Петин, 2018; Evstratova et al., 2018). Такая закономерность указывает на принципиальную возможность существования оптимальной действующей температуры, обеспечивающей максимальное синергическое взаимодействие повреждений при малых концентрациях и интенсивностях вредных факторов, реально встречающихся в биосфере.
В целом, приведенные в настоящей работе результаты в совокупности с ранее опубликованными данными (Петин и др., 2012; Петин, Жураковская, 2014, 2015; Petin, Kim, 2016; Evstratova et al., 2018) указывают на универсальность проявления максимального синергического взаимодействия и его зависимости от интенсивности применяемых агентов. Эти закономерности имеют не только фундаментальное значение, но и должны учитываться на практике при оценке безопасности окружающей среды или оптимизации комбинированных воздействий различных агентов.
Список литературы
Арефьева А.С., Барыгина В.В., Зацепина О.В. 2010. Современные представления о влиянии соединений ртути на клеточном и системном уровне (обзор). Экология человека. 8: 35–41. (Arefieva A.S., Barygina V.V., Zatsepina O.V. 2010. Modern ideas about the effect of mercury compounds at the cellular and systemic levels (review). Human Ecology. 8: 35–41.)
Васина М.В., Васин А.А., Манохин Е.В. 2018. Теория вероятности и математическая статистика. М.: Прометей. 160 с. (Vasina M.V., Vasin A.A., and Manokhin E.V. 2018. Probability Theory and Mathematical Statistics. Moscow: Prometheu. 160 pp.)
Евстратова Е.С., Петин В.Г. 2018. Биофизическая интерпретация зависимости синергизма от интенсивности применяемых агентов. Биофизика. 63(6): 1186–1194. (Evstratova E.S., Petin V.G. 2018. Biophysical interpretation of the dependence of synergy on the intensity of the agents used. Biophysics. 63(6) : 1186–1194.)
Жаворонков Л.П., Петин В.Г. 2018. Количественные критерии микроволнового поражения. М.: ГЕОС. 2018. 232 с. (Zhavoronkov L.P., Petin V.G. 2018. Quantitative criteria for microwave damage. M.: GEOS. 232 p.)
Израэль Ю.А. 1979. Экология и контроль состояния природной среды. Л.: Гидрометеоиздат. 376 с. (Izrael Yu.A. 1979. Ecology and control of the natural environment status. Leningrad: Gidrometeoizdat. 376 p.)
Капульцевич Ю.Г. 1978. Количественные закономерности лучевого поражения клеток. М.: Атомиздат. 230 с. (Kapultsevich Yu.G. 1978. Quantitative patterns of cell responses to radiation. M.: Atomizdat. 230 p.)
Петин В.Г., Жураковская Г.П. 2014. Закономерности проявления максимального синергического взаимодействия. Рад. биол. Радиоэкология. 54(6) : 589–596. (Petin V.G., Zhurakovskaya G.P. 2014. Patterns of manifestation of the greatest synergistic interaction. Radiat. Biol. Radioecol. 54(6) : 589–596.)
Петин В.Г., Жураковская Г.П. 2015. Влияние интенсивности действующих агентов на проявление синергического взаимодействия. Рад. биол. Радиоэкология. 55(6) : 596–606. (Petin V.G., Zhurakovskaya G.P. 2015. The effect of the intensity of active agents on the manifestation of synergistic interaction. Radiat. Biol. Radioecol. 55(6) : 596–606.)
Петин В.Г., Жураковская Г.П., Комарова Л.Н. 2012. Радиобиологические основы синергических взаимодействий в биосфере. М.: ГЕОС. 219 с. (Petin V.G., Zhurakovskaya G.P., Komarova L.N. 2012. Radiobiological basis of synergistic interactions in the biosphere. Moscow: GEOS. 219 p.)
Петин В.Г., Комаров В.П. 1989. Количественное описание модификации радиочувствительности. М.: Энергоатомиздат. 192 с. (Petin V.G., Komarov V.P. 1989. Quantitative description of radiosensitivity modification. Moscow: Energoatomizdat. 192 p.)
Теплая Т.А. 2013. Тяжелые металлы как фактор загрязнения окружающей среды. Астраханский вестник экологического образования. 1(23) : 182–192. (Teplaya T.A. 2013. Heavy metals as a factor in environmental pollution. Astrakhan J. Envir. Education. 1(23) : 182–192.)
Феллер В. 1967. Введение в теорию вероятностей и ее приложения. М.: Мир, 484 с. (Feller V. 1967. Introduction to probability theory and its applications. M.: Mir. 484 p.)
Bica L., Meyerowitz J., Parker S.J., Caragounis A., Du T., Paterson B.M., Barnham K.J., Crouch P.J., White A.R., Donnelly P.S. 2011. Cell cycle arrest in cultured neuroblastoma cells exposed to a bis(thiosemicarbazonato) metal complex. Biometals. 24: 117–133. https://doi.org/10.1007/s10534-010-9380-7
Ceresa C., Bravin A., Cavaletti G., Pellei M., Santini C. 2014. The combined therapeutical effect of metal-based drugs and radiation therapy: the present status of research. Current Medical Chemistry. 21(20): 2237–2265. https://doi.org/10.2174/0929867321666140216125721
Evstratova E.S., Petin V.G., Zhurakovskaya G.P. 2018. Synergistic effects and their potential significance for the influence of natural intensities of environmental factors on cell growth. Synergy. 6 : 1–8.
Petin V.G., Kim J.K. 2016. Synergistic interaction and cell responses to environmental factors. N.Y.: Nova Science Publishers. 337 p.
Petin V.G., Komarov V.P. 1997. Mathematical description of synergistic interaction of hyperthermia and ionizing radiation. Mathem. Biosci. 146 : 115–130.
Petin V.G., Zhurakovskaya G.P. 1995. The peculiarities of the interaction of radiation and hyperthermia in Saccharomyces cerevisiae irradiated with various dose rates. Yeast. 11(6) : 549–554.
Дополнительные материалы отсутствуют.


