Цитология, 2020, T. 62, № 5, стр. 356-366
Микротрубочки и актиновые филаменты участвуют в обеспечении слияний и разделений везикул на эндоцитозном пути ЭФР-рецепторных комплексов
М. В. Харченко 1, *, М. В. Злобина 1, 3, Р. С. Каменцева 1, Е. С. Корнилова 1, 2
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Центрально-Европейский Технологический Институт, Университет Масарика
62500 Брно, Чехия
* E-mail: mariannakharchenko@gmail.com
Поступила в редакцию 02.02.2020
После доработки 21.02.2020
Принята к публикации 21.02.2020
Аннотация
Исследовали влияние разборки микротрубочек нокодазолом и деполимеризации актинового цитоскелета цитохалазином Д, а также их сочетанного действия на динамику эндоцитоза комплексов эпидермального фактора роста и его рецептора в клетках HeLa. С помощью конфокальной микроскопии показали, что в клетках, фиксированных через разные промежутки времени после стимуляции эндоцитоза, на его ранних стадиях имеет место высокая степень колокализации рецептора с маркером ранних эндосом ЕЕА1, коррелирующая с укрупнением эндосом в результате слияний, и перемещение эндосом на более поздних стадиях в околоядерную область (ОЯО). Перемещение в ОЯО зависит от микротрубочек. Нокодазол не препятствует формированию эндосом, но блокирует их слияния и перемещение. В то же время разрушение актиновых микрофиламентов, не нарушая процесса ЕЕА1-зависимых слияний и транспортировки эндосом в ОЯО, приводит к укрупнению эндосом, препятствуя разделению ранних эндосом и созревших мультивезикулярных эндосом. При разрушении обоих типов цитоскелета вновь сформированные рецептор-содержащие эндоцитозные пузырьки не укрупняются, не созревают и не перемещаются в ОЯО. Прижизненная съемка эндосом с ЭФР, связанным с квантовыми точками, подтвердила данные, полученные на фиксированных клетках, и позволила проанализировать характер перемещений эндосом. Оказалось, что редкие периоды быстрого линейного пробега сменяются длительными хаотическими колебаниями в пределах небольшой области, при этом направления линейных пробегов могут быть совершено различными, а не только в сторону ЦОМТ. Наши данные позволяют предположить, что роль микротрубочек заключается не только в обеспечении перемещения эндосом, но и в обеспечении платформы для их слияний. Это предположение может объяснить и кажущиеся хаотичными перемещения эндосом, позволяющие повысить вероятность их контактов и, следовательно, слияний.
Система тубулиновых микротрубочек и актиновых микрофиламентов выполняет в эукариотических клетках множество функций – от придания механической прочности клетке до участия в ее делении. В культивируемых эпителиальных клетках система микротрубочек организована радиально, имея центр схождения (ЦОМТ) в околоядерной области, в непосредственной близости от аппарата Гольджи и большей части лизосом. В связи с этим сложилось устойчивое представление об интерфазных микротрубочках как о “рельсах”, обеспечивающих перемещения везикул и аггресом на большие (по меркам клетки) расстояния с помощью моторных белков. Такая организация позволяет упорядочивать процессы эндоцитоза, в ходе которых везикулы с грузом, формируемые практически на всей поверхности плазматической мембраны, могут концентрироваться в околоядерной области (ОЯО), что повышает вероятность их взаимодействия, в частности, с лизосомами, и увеличивает эффективность деградации груза (Matteoni, Kreis, 1987). Радиальные микротрубочки также обеспечивают эффективность доставки экзоцитозных пузырьков и секреторных гранул от транс-сети аппарата Гольджи к плазматической мембране.
Таким образом, за микротрубочками закрепилась роль основных “транспортных артерий” в клетках разных типов. В связи с этим в последние годы интерес исследователей сместился в сторону анализа взаимодействия и роли актиновых филаментов в транспортных процессах (Delevoye et al., 2016; MacDonald et al., 2018; Muriel et al., 2016), в том числе в ремоделировании мембран везикул в ходе их слияний, тубуляции и разделения.
Однако целый ряд вопросов, часто парадоксальных, остался без ответа. Так, можно считать установленным, что эндосомы, сформировавшиеся в ходе рецептор-опосредованного эндоцитоза, перемещаются от периферии в околоядерную область клетки с помощью моторного белка динеина. По существующим оценкам, динеин развивает скорость, при которой он способен преодолеть вместе с грузом расстояние от плазматической мембраны до ОЯО за 1–5 мин (Минин, Кулик, 2004). Однако на практике это расстояние проходится в среднем за 20–40 мин. Общей точки зрения на то, чем обусловлен этот “временной парадокс кластеризации эндосом”, не существует.
Эндоцитоз рецептора ЭФР является классической моделью так называемого деградационного пути (Beguinot et al., 1984; Корнилова и др., 1987). После связывания ЭФР с рецептором на мембране формируются везикулы, которые доставляются ЭФР-рецепторные комплексы в так называемые ранние эндосомы – популяцию везикул, осуществляющих сортировку входящих грузов. В ходе этого процесса часть из них возвращается на мембрану (рециклирует), тогда как везикулы с направляемыми на деградацию грузами (ЭФР-рецепторные комплексы в их числе) увеличиваются в размерах за счет слияния друг с другом. Слияния обеспечиваются за счет того, что ранние эндосомы несут все белки, необходимые для слияний, в том числе белок заякоривания ЕЕА1 (early endosomal autoantigen 1). Этот белок считают классическим маркером ранних эндосом (Simonsen et al., 1998). В результате слияний размер эндосом увеличивается, за счет чего создается избыток мембраны, позволяющий в дальнейшем формировать внутренние пузырьки эндосом, куда отсортировываются грузы, которые после слияния с лизосомами подвергаются деградации (Babst, 2011). Такие эндосомы с внутренними пузырьками называют мультивезикулярными телами, и часто рассматривают как поздние эндосомы.
В целом описанный процесс называется созреванием. Зрелые поздние эндосомы теряют способность сливаться с ранними эндосомами, но могут взаимодействовать с лизосомами, формируя, согласно работам группы Луцио, гибридные эндолизосомы (Luzio et al., 2001). Таким образом, в ходе эндоцитоза рецептор-содержащие эндосомы укрупняются в размерах на раннем этапе и сливаются с лизосомами на позднем, перемещаясь при этом из периферической области клетки в ОЯО.
В настоящей работе, используя нокодазол и цитохалазин Д, деполимеризующие микротрубочки и актиновые филаменты соответственно, мы рассмотрели влияние целостности этих структур на такие аспекты эндоцитоза ЭФР-рецепторных комплексов в клетках HeLa, как характер перемещения, слияния (разделения) и созревания рецептор-содержащих эндосом.
МАТЕРИАЛ И МЕТОДИКА
Культивирование клеток. В работе использованы клетки карциномы шейки матки человека HeLa, полученные из Европейской коллекции клеточных культур. HeLa, экспрессирующие GFP-α-тубулин (линия HeLa H5-1), были любезно предоставлены О.В. Микитась (Институт полиомиелита и вирусных энцефалитов им. Чумакова, РАМН, Москва). Клетки культивировали в среде ДМЕМ (ПанЭко, Россия), содержащей 8% фетальной сыворотки (PAA, Австрия) при 37°С в атмосфере 5% СО2. Для клеток линии HeLa H5-1 в среду также добавляли 500 мкг/мл генетицина (G418) (Mediatechnic, США). Клетки растили до 60–70% монослоя. Для экспериментов с иммунофлуоресцентным окрашиванием клетки сеяли на покровные стекла размером 10 × 10 мм, а для прижизненной микроскопии – в камеры с тонким стеклянным дном (Nunclon Surface, Дания).
Лиганды и их производные. Для стимуляции эндоцитоза использовали рекомбинантный ЭФР (Sigma-Aldrich, США) в концентрации 50 нг/мл. Для прижизненной микроскопии лиганд метили с помощью квантовых точек (КТ) на основе CdSe/ZnS, покрытых полиэтиленгликолем (с пиками эмиссии в красной (КТ655) области спектра) и конъюгированных со стрептавидином (Invitrogen, США). Комплексы ЭФР-КТ формировали, инкубируя 4 нМ биотинилированного ЭФР (Invitrogen, США) c КТ в концентрации 1 нМ в среде ДМЕМ, содержащей 0.1% бычьего сывороточного альбумина (БСА) и 20 мМ HEPES, pH 7.4 (среда А), в течение 30 мин при 4°С, при постоянном покачивании.
Антитела. Для мечения рецептора ЭФР использовали поликлональные антитела кролика (Cell Signaling, США) в разведении 1 : 100 и моноклональные мышиные: против α-тубулина (Sigma-Aldrich, США) в разведении 1 : 2000, против EEA1 (Transduction Lab, США) в разведении 1 : 1000 и антитела, узнающие LAMP1 (маркер лизосом) (Abcam, Англия) в разведении 1 : 200. В качестве вторых антител использовали GAR-Alexa Fluor 568, GAM-Alexa Fluor 488 (Invitrogen, США), GAM-Cy3 (Jackson, США) в разведении 1 : 500. Антитела разводили в фосфатно-солевом буферном растворе (PBS, pH 7.4), содержащем 1% БСА.
Стимуляция эндоцитоза. Использовали схему предварительного связывания: ЭФР инкубировали с клетками 60 мин при 4°С для достижения равновесного связывания лиганда с рецепторами. В таких условиях интернализация лиганд-рецепторных комплексов не происходит. После отмывки с помощью PBS не связавшегося лиганда эндоцитоз стимулировали переводом клеток в среду А, не содержащую ЭФР, при 37°С на указанное время, что позволяло инициировать синхронную волну событий.
Ингибиторы. Для деполимеризации МТ клетки инкубировали в среде А, содержащей 20 мкМ нокодазола (Sigma-Aldrich, США), для стабилизации – 500 нг/мл трихостатина А (TSA) (Sigma-Aldrich, США). Для разрушения актиновых микрофиламентов использовали цитохалазин Д (Sigma-Aldrich, США) в концентрации 10 мкМ. Ингибиторы добавляли к клеткам за 30 мин до стимуляции эндоцитоза по отдельности или в комбинации. Стимуляцию эндоцитоза проводили при постоянном присутствии ингибиторов в рабочей среде.
Иммунофлуоресцентное окрашивание клеток. После окончания инкубации покровные стекла трижды промывали PBS, после чего фиксировали 3.6%-ным раствором формалина (Sigma-Aldrich, США) в PBS в течение 15 мин при комнатной температуре. Затем клетки промывали 5 раз по 3 мин раствором PBS и проводили пермеабилизацию в течение 15 мин при комнатной температуре раствором 0.5%-ного Тритона X-100 в PBS (Sigma-Aldrich, США). Неспецифическое мечение блокировали 1%-м раствором БСА в PBS в течение 30 мин при комнатной температуре. Далее клетки инкубировали с первыми антителами в течение ночи при 4°С. Далее промывали 5 раз по 2 мин раствором PBS. Инкубацию со вторыми антителами проводили 15 мин при 37°С в темноте. Затем клетки промывали, как описано выше. Препараты монтировали с использованием глицериновой заливки, содержащей 1% DABCO (Sigma-Aldrich, США).
Лазерная сканирующая конфокальная микроскопия. Распределение флуоресцентно меченых белков в клетках исследовали с помощью лазерных сканирующих конфокальных микроскопов Leica TCS SL и Leica TCS SP5 (Leica Microsystems, Германия) с иммерсионным масляным объективом с увеличением 100 × 1.40 или 63 × 1.32. Прижизненные наблюдения проводили с помощью микроскопа Leica TCS SP5 с термостатируемой камерой. Зеленую флуоресценцию возбуждали аргоновым лазером (488 нм), красную – He-Ne-лазером (543 нм). Флуоресценцию на разных длинах волн сканировали раздельно с помощью программы Leica Confocal Software. Размер изображения был 1024 × 1024 пикселей, частота сканирования 400–700 Гц. Интервал между съемкой кадров при прижизненной микроскопии составлял 1.5–3 с. Проводили 2- или 3-кратное усреднение по линиям.
Анализ и обработка изображений. Полученные изображения обрабатывали с помощью программы ImageJ 1.40g (National Institute of Health, США). Для оценки колокализации использовали плагин JACoP для ImageJ (Bolte, Cordelières, 2006). В расчет брали коэффициент Мандерса М1, отражающий долю пикселей с красным сигналом, содержащих и зеленый сигнал, по отношению к общему сигналу с красного канала (Manders et al., 1993). Для построения треков эндосом использовался плагин для ImageJ Manual Tracking (Fabrice Cordeli, Institut Curie, Франция).
Математическая обработка данных по перемещению эндосом. Для исследования направленных перемещений эндосом их координаты пересчитывали с целью изменения их ориентации по отношению к ЦОМТ. При этом строили дополнительную ось 0х′ (между координатой начала движения каждой конкретной эндосомы и ЦОМТ), по отношению к которой полученные ранее координаты xy преобразовывались по формуле параллельного сдвига и поворота осей координат:
Статистическая обработка данных. Каждый эксперимент проводили как минимум 3 раза. Числовые данные обрабатывали с помощью программы Microsoft Excel. Представленные изображения типичны для большинства клеток. Для каждой группы анализировали от трех до семи полей (15–30 клеток). На графиках приведены средние значения с доверительными интервалами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
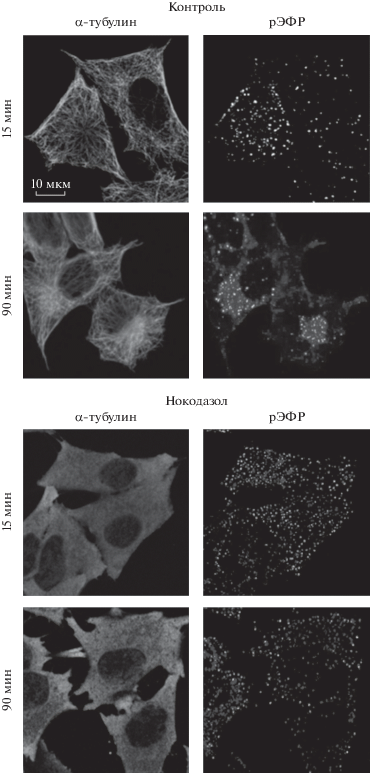
На рис. 1 представлены организация системы микротрубочек (левая колонка) и типичное распределение эндосом, содержащих рецептор ЭФР в клетках HeLa, через 15 и 90 мин после стимуляции эндоцитоза ЭФР (правая колонка). В контроле микротрубочки формируют радиальную систему, при этом на раннем этапе эндоцитоза (15 мин) множество относительно мелких ярких рецептор-содержащих везикул распределено в подмембранной области клетки. Через 90 мин общий вид микротрубочек не изменился, тогда как рецептор ЭФР локализован в крупных кластерах везикул в ОЯО, а периферические эндосомы практически отсутствуют. При инкубации клеток в присутствии нокодазола (рис. 1, нижняя панель) мы видим полностью деполимеризованные микротрубочки: тубулин равномерно распределен по всему объему цитоплазмы. В то же время эндосомы и через 15, и через 90 мин распределены по клетке, при этом их яркость и кажущийся размер незначительно уменьшаются.
Рис. 1.
Локализация эндосом при стимуляции эндоцитоза рецептора ЭФР в контрольных клетках и при действии 20 мкМ нокодазола. Представлены конфокальные изображения клеток, меченных антителами против α-тубулина (левый столбец) и рецептора ЭФР (правый столбец). Эндоцитоз стимулировали добавлением 50 нг/мл ЭФР, как описано в разделе “Материал и методика”; клетки фиксировали в указанное на рисунке время.
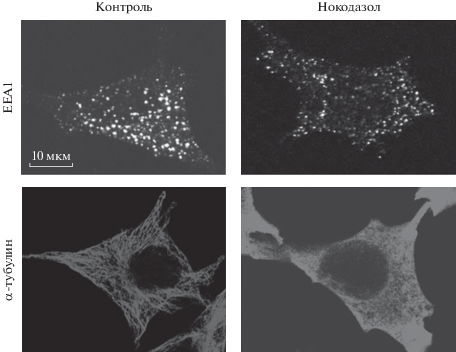
Такой же эффект наблюдается при действии нокодазола на распределение популяции везикул, несущих маркер ранних эндосом ЕЕА1 (рис. 2): в контроле, в необработанных ЭФР клетках яркие ЕЕА1-положительные эндосомы локализуются в области вокруг ядра, тогда как после деполимеризации микротрубочек они “рассыпаются” по цитоплазме, в основном по периферии, и их яркость и (или) кажущийся размер уменьшаются.
Рис. 2.
Деполимеризация микротрубочек под действием 20 мкМ нокодазола приводит к уменьшению размера ЕЕА1-везикул и изменяет их распределение в клетке. Представлены конфокальные изображения клеток, меченных антителами против EEA1 (верхний ряд) и α-тубулина (нижний ряд).
Эти данные позволяют утверждать, что микротрубочки участвуют, во-первых, в позиционировании EEA1-положительных эндосом и, во-вторых, в процессе перемещения рецептор-содержащих эндосом из примембранной области в ОЯО. Надо отметить, что наши предыдущие работы, посвященные динамике эндоцитоза рецептора ЭФР подтверждают представленные данные на рис. 1 и 2 (Kharchenko et al., 2007; Zlobina et al., 2013). В общем, эти исследования позволяют предполагать, что формирование околоядерных кластеров происходит постепенно и равномерно. Однако объяснить на основе этого представления временной парадокс кластеризации невозможно.
Поэтому мы обратились к прижизненной съемке процесса перемещения эндосом, использовав в качестве лиганда ЭФР, связанный с полупроводниковыми флуоресцентными нанокристаллами, называемыми квантовыми точками (КТ). Такой лиганд (ЭФР-КТ), содержащий 4–6 молекул ЭФР на одну КТ, интересен своей яркостью и фотостабильностью, что особенно важно для прижизненных микроскопических наблюдений. В специально проведенных работах мы показали, что ЭФР-КТ интернализуются только в комплексе с рецептором, и не вносят каких либо искажений в процессы слияний эндосом, формирования мультивезикулярных тел и перемещений эндосом по микротрубочкам (Salova et al., 2017, 2016).
Наблюдения за поведением эндосом, меченных ЭФР-КТ, показали, что характер перемещения везикул не соответствует равномерному поступательному однонаправленному движению. На рис. 3 представлены клетки с треками некоторых эндосом, которые оставались в фокальной плоскости в течение времени наблюдения. Из этих изображений видно, что на стадии пребывания ЭФР-КТ в ранних эндосомах (рис. 3а) основной тип движения – довольно хаотичное перемещение на небольшие расстояния, ограниченное небольшой областью, т.е. фактически “топтание на месте”. Но даже в тех случаях, когда отмечали относительно длинные линейные пробеги, их направление отнюдь не соответствовало перемещению к ЦОМТ. Везикула могла двигаться параллельно плазматической мембране, резко изменить направление на противоположное, остановиться и начать движение под углом 45 градусов к первоначальному. В любом случае, таких быстрых перемещений за 7 мин (с 15-ой по 22-ю) наблюдали немного, большую часть времени везикулы колебались в пределах небольших ограниченных областей.
Рис. 3.
Перемещения эндосом на разных стадиях эндоцитоза в контроле (а–г) и под действием 500 нг/мл TSA (д) и 20 мкМ нокодазола (е). Эндоцитоз стимулировали в клетках, экспрессирующих α-тубулин-GFP (зеленый цвет), добавлением ЭФР-КТ (красный цвет), как описано в разделе “Материал и методика”. а, д, е – Результирующие треки перемещения некоторых эндосом в интервале 15–22 мин после запуска эндоцитоза; е – через 40–47 мин, белыми стрелками указаны эндосомы для сравнения их кажущихся размеров. в, г – Треки эндосом в координатах, измененных так, что начало трека находится в точке (0,0), а ось 0x' показывает направление на ЦОМТ (см. “Материал и методика”).

Для наглядности мы представили все треки в измененных координатах: строили дополнительную ось 0х' между координатой начала движения каждой конкретной эндосомы (х, y) и ЦОМТ, и эти координаты преобразовывали по формуле параллельного сдвига и поворота осей координат, начальная точка трека соответствовала координатам (0,0). Таким образом, в идеальном случае треки частиц, двигавшихся к ЦОТМ, были бы выстроены от нулевой координаты вдоль оси 0х'. В реальности, из рис. 3в (график) следует, что такую “целеустремленность” проявляют единичные эндосомы. Тем не менее, на поздних сроках (40–47 мин, рис. 3б, г) эндосомы все же кластеризуются в ОЯО, и длина линейных пробегов сокращается, хотя хаотичность их направления остается. Все же в общем, можно сказать, что приближение к ЦОМТ делает эндосомы менее подвижными. Также очевидно, что суммарное расстояние, пройденное везикулой за время съемки, гораздо больше, чем расстояние, на которое она приближается к ОЯО, и время, затрачиваемое на образование кластера, будет существенно превышать то, которое требовалось бы при линейном строго направленном движении везикулы, определяемое скоростью перемещения моторного белка.
Пытаясь интерпретировать подобные данные, следует учитывать то обстоятельство, что сеть микротрубочек в использованных нами клетках HeLa, представляет собой не систему сильно натянутых строго радиальных прямых трубочек, а скорее действительно густую переплетенную сеть, в которой линейные прямые участки микротрубочек могут на плюс-концевых участках сильно изгибаться, порой приобретая кажущуюся “антипараллельность” (Howard, Hyman, 2009). К тому же эта сеть трехмерна и отдельные участки демонстрируют колебательные движения, наподобие волн.
Таким образом, разнонаправленные движения не обязательно обеспечиваются участием и динеина, и кинезина, что предполагается в модели “перетягивания каната” (Welte, 2004). Везикула, движущаяся с помощью динеина к минус-концу микротрубочки (т.е. к ЦОМТ), может просто сбиваться другой микротрубочкой, проходящей поперек ее пути, и эта везикула попадает в ячейку сети из микротрубочек и будет находиться там, пока не появится возможность прикрепиться к свободной молекуле динеина и проскочить на ней дальше. Она при этом может прикрепиться и к динеину на другой микротрубочке, идущей под углом к исходной, или к участку микротрубочки, делающей петлю и изогнутой так, что движение все в том же направлении к минус-концу трубочки кажется движением в противоположную сторону. В пользу наших рассуждений говорит тот факт, что в конечном итоге все эндосомы, которые должны попасть в ОЯО, доставляются туда, несмотря на временные затраты.
Мы проанализировали также, что происходит с ЭФР-рецепторными комплексами в живых клетках, в которых микротрубочки разрушены нокодазолом или стабилизированы ингибитором деацетилазы HDAC6 (TSA). Как известно, ацетилирование микротрубочек связано с их стабилизацией, в результате чего подавляется процесс динамической нестабильности их плюс-концов, необходимый для поиска и захвата отделившихся от мембраны только что сформированных эндосом (Matsuyama et al., 2002; Deribe et al., 2009; Lomakin et al., 2009; Gao et al., 2010). На рис. 3д показана клетка, обработанная TSA, на которой нанесены треки рецептор-содержащих эндосом через 15–22 мин после стимуляции эндоцитоза. Как мы показали, несмотря на все сложности перемещения везикул в контрольных клетках на этом сроке выявляются длинные линейные пробеги эндосом, часто направленные к центру клетки. Однако обработка TSA приводит, во-первых, к формированию запутанной сети утолщенных микротрубочек, а, во-вторых, сформированные эндосомы совершают только незначительные перемещения параллельно плоскости мембраны в довольно ограниченных областях. Следует отметить, что сами эндосомы в этом случае гораздо крупнее контрольных, что говорит о возможности слияний эндосом, но невозможности зависимых от микротрубочек перемещений в условиях их стабилизации.
В случае же разборки микротрубочек нокодазолом (рис. 3е) мы видим лишь колебательные подмембранные движения эндосом, при том, что сами они очень маленькие. Поскольку в обоих случаях мы не затрагивали сеть коритикального актина, можно предположить, что актиновые филаменты могут в какой-то мере поддерживать движение, но не линейное, а хаотичное, и также способны поддерживать слияния эндосом в присутствии стабильных микротрубочек, тогда как при их деполимеризации ни длинные перемещения, ни слияния невозможны.
Наши данные говорят в пользу того, что микротрубочки могут быть не только рельсами, по которым движутся эндосомы, но и платформами, дающими точки опоры для мембранных структур при их взаимодействии. Чтобы проверить это предположение, мы проанализировали поведение эндосом на разных стадиях эндоцитоза, включая стадию их наиболее интенсивных слияний (рис. 4) Видно, что в контроле через 15 мин после стимуляции эндоцитоза мелкие рецептор-содержащие везикулы колокализованы с ЕЕА1-положительными везикулами, что свидетельствует о начале процессов слияния и укрупнения эндосом. Действительно, через 30 мин видны укрупненные эндосомы, тогда как с 60-ой мин эти крупные эндосомы уже не колокализуются с ЕЕА1. В клетках, предобработанных нокодазолом, рецептор-содержащие везикулы формируются (как уже было показано на рис. 3) и даже колокализуются с ЕЕА1, но никакой динамики в дальнейшем не наблюдается – в отсутствие микрорубочек эндосомы так и остаются мелкими и не укрупняются, даже несмотря на частичную колокализацию с EEA1.
Рис. 4.
Локализация рецептора ЭФР и ЕЕА1 в ходе эндоцитоза в контроле и при действии 20 мкМ нокодазола и (или) 10 мкМ цитохалазина Д. Показаны совмещенные изображения клеток, меченных антителами против ЕЕА1 (зеленый цвет) и рецептора ЭФР (красный цвет). Рамкой выделены участки, представленные в увеличенном масштабе справа от каждого изображения для всех случаев. Эндоцитоз стимулировали добавлением 50 нг/мл ЭФР, клетки фиксировали в указанное на рисунке время.
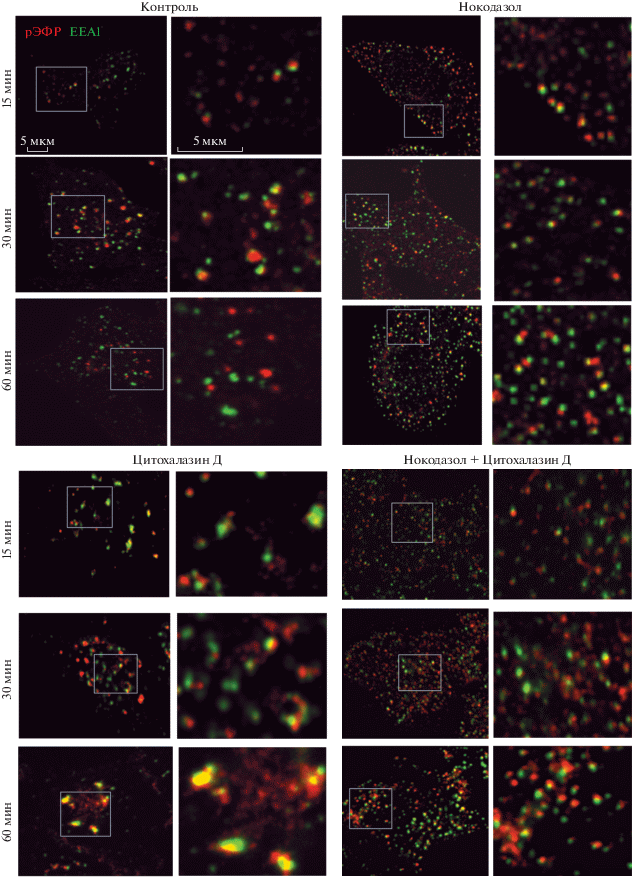
В присутствии цитохалазина Д, т.е. в условиях, когда актиновые филаменты не функционируют, а микротрубочки интактны, даже на ранних сроках наблюдается укрупнение везикул, причем через 15 мин мы видим еще не очень большие рецепторные везикулы, но существенно увеличенные ЕЕА1-позитивные ранние эндосомы. В дальнейшем процесс слияний только усиливается, приводя к формированию всего нескольких, но очень крупных рецептор- и ЕЕА1-позитивных эндосом. Если эндоцитоз стимулируется в отсутствие интактных микротрубочек и актиновых нитей, то колокализация рецептор-содержащих везикул с ЕЕА1 лишь к 90-й мин после стимуляции превышает контроль.
На рис. 5а представлена динамика колокализации рецептора ЭФР и ЕЕА1, полученная на основе обработки результатов экспериментов, аналогичных описанному выше. Мы оценивали степень колокализации, используя коэффициент Мандерса, соответствующий доле пикселей изображения, содержащих сигнал в красном канале (рецептор ЭФР) и в зеленом канале (ЕЕА1) по отношению к общему количеству пикселей с красным сигналом. Согласно этим расчетам, степень колокализации рецептора ЭФР с EEA1 максимальна через 15–30 мин после стимуляции эндоцитоза, а затем (через 60 мин) резко снижается. В параллельных экспериментах, изображения которых не представлены в этой статье, мы определяли колокализацию рецептора ЭФР с маркером лизосом Lamp1 (рис. 5б) и показали ее увеличение к 60 мин после стимуляции эндоцитоза. При действии нокодазола колокализация с ЕЕА1 была исходно меньше, чем в контроле, при этом она слегка увеличивалась к 30-ой мин, возможно, за счет примембранных слияний, и далее не изменялась, оставаясь на уровне более высоком, чем в контроле. Действительно, на рис. 4 видно, что везикулы как бы “замерли” на стадии формирования ранних двудоменных структур, локализованных вблизи от плазматической мембраны. Практически полное отсутствие колокализации с Lamp1 говорит о том, что созревания эндосом в этом случае действительно не происходит.
Рис. 5.
Колокализация рецептора ЭФР и с маркерами ранних эндосом (EEA1, а) и лизосом (Lamp1, б) в ходе эндоцитоза в контроле и при действии 20 мкМ нокодазола (Нок) и (или) 10 мкМ цитохалазина Д (ЦитД). Колокализацию оценивали с помощью коэффициента Мандерса M1 (Коэф. Мандерса) (доля пикселей, содержащих сигнал рецептора ЭФР и EEA1/Lamp1, по отношению к общему сигналу рецептора ЭФР).
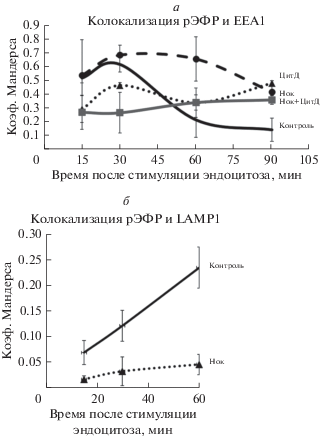
Разрушение актиновых нитей цитохалазином Д при интактных микротрубочках демонстрирует высокую степень колокализации, уменьшающуюся только после 60-ой мин и не достигающую к 90-ой мин контрольного уровня, что подтверждает наше предположение о важности актиновых филаментов для сегрегации ранних эндосом и мультивезикулярных тел. Совместное же действие нокодазола и цитохалазина Д демонстрирует очень низкую степень колокализации двух сигналов, что говорит о том, что упорядоченного процесса слияния и созревания эндосом и их разделения на поздних этапах не происходит.
Таким образом, наши данные говорят о том, что и микротрубочки, и актиновые нити способны поддерживать слияния везикул эндоцитозного пути, однако такой эффект актиновых филаментов проявляется лишь на начальной стадии в отсутствие микротрубочек или при их неспособности захватывать только что сформированные рецептор-содержащие везикулы. Если же при нефункциональных актиновых филаментах в клетке присутствуют микротрубочки, то слияния продолжаются гораздо дольше и приводят к более значительному укрупнению везикул, чем в контроле.
Кроме того, показано, что микротрубочки участвуют в слиянии аутофагосом с эндосомами (Köchl et al., 2006). Таким образом, микротрубочки являются первичным элементом цитоскелета с точки зрения обеспечения слияний, тогда как в норме функция филаментов заключается в отделении сформировавшихся мультивезикулярных тел от ЕЕА1-позитивных ранних эндосом, делая возможным их дальнейшую доставку в лизосомы и деградации ЭФР-рецепторных комплексов. Действительно, участие высокодинамичных Arp2/3-зависимых актиновых сетей в искривлении, тубуляции мембран и в процессах разделения мембранных структур были показы в ряде работ (Derivery et al., 2009).
Вполне вероятно, что процессы сближения и слияния везикул, как и их разделения, заключающиеся в реорганизации и объединении мембранных слоев в первом случае и их разрыва во втором, требуют фиксации взаимодействующих структур на определенное время на некой платформе, которой выступают микротрубочки, и эта их роль столь же важна, как и роль путей сообщения. С точки зрения этого предположения, становится понятным и кажущийся хаотичным способ-зависимого от микротрубочек перемещения везикул по клетке. Действительно, в случае непрерывного равномерного направленного движения по трубочкам вероятность контактов между эндосомами (учитывая соотношения их размера и масштаба клетки) была бы очень низка, однако кажущееся хаотичным движение с множеством остановок существенно повышает шанс таких взаимодействий.
Список литературы
Корнилова Е.С., Соркин А.Д., Никольский Н.Н. 1987. Динамика компартментализации эпидермального фактора роста в клетках А431. Цитология. Т. 29. № 8. С. 904. (Kornilova E.S., Sorkin A.D., Nikol’ski$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\iota } $ N.N. 1987.Compartmentalization dynamics of the epidermal growth factor in A431 cells. Tsitologiya. V. 29. № 8. P. 904.)
Минин А.А., Кулик А.В. 2004. Внутриклеточный транспорт. Принципы регуляции. Успехи биол. химии. Т. 44. С. 225. (Minin A.A., Kulik A.V. 2004. Intracellular transport. Principles of regulation. Uspekhi Biol. Khimii. V. 44. P. 225.)
Babst M. 2011. MVB vesicle formation: ESCRT-dependent, ESCRT-independent and everything in between. Curr. Opin. Cell Biol. V. 23. P. 452.
Beguinot L., Lyall R.M., Willingham M.C., Pastan I. 1984. Down-regulation of the epidermal growth factor receptor in KB cells is due to receptor internalization and subsequent degradation in lysosomes. Proc. Natl. Acad. Sci. USA. V. 81. P. 2384.
Bolte S., Cordelières F.P. 2006. A guided tour into subcellular colocalization analysis in light microscopy. J. Microsc. V. 224. P. 213.
Delevoye C., Heiligenstein X., Ripoll L., Gilles-Marsens F., Dennis M.K., Linares R,A, Derman L., Gokhale A., More l. E., Faundez V., Marks M.S., Raposo G. 2016. BLOC-1 brings together the actin and microtubule cytoskeletons to generate recycling endosomes. Curr. Biol. V. 26. P. 1.
Deribe Y.L., Wild P., Chandrashaker A., Curak J., Schmidt M.H.H., Kalaidzidis Y., Milutinovic N., Kratchmarova I., Buerkle L., Fetchko M.J., Schmidt P., Kittanakom S., Brown K.R., Jurisica I., Blagoev B. et al. 2009. Regulation of epidermal growth factor receptor trafficking by lysine deacetylase HDAC6. Sci. Signal. V. 2. P. ra84.
Derivery E., Sousa C., Gautier J.J., Lombard B., Loew D., Gautreau A. 2009. The Arp2/3 activator WASH controls the fission of endosomes through a large multiprotein complex. Dev. Cell. V. 17. № 5. P. 712–723.
Gao Y., Hubbert C.C., Yao T.-P. 2010. The microtubule-associated histone deacetylase 6 (HDAC6) regulates epidermal growth factor receptor (EGFR) endocytic trafficking and degradation. J. Biol. Chem. V. 285. P. 11219.
Howard J., Hyman A.A. 2009. Growth, fluctuation and switching at microtubule plus ends. Nat. Rev. Mol. Cell Biol. V. 10. P. 569.
Kharchenko M.V., Aksyonov A.A., Melikova M.M., Kornilova E.S. 2007. Epidermal growth factor (EGF) receptor endocytosis is accompanied by reorganization of microtubule system in HeLa cells. Cell Biol. Int. V. 31. P. 349.
Köchl R. Hu X.W., Chan E.Y., Tooze S.A. 2006. Microtubules facilitate autophagosome formation and fusion of autophagosomes with endosomes. Traffic. V. 7. P. 129.
Lomakin A.J, Semenova I., Zaliapin I., Kraikivski P., Nadezhdina E., Slepchenko B.M., Akhmanova A., Rodionov V. 2009. CLIP-170-dependent capture of membrane organelles by microtubules initiates minus-end directed transport. Dev. Cell. V. 17. P. 323.
Luzio J.P., Mullock B.M., Pryor P.R., Lindsay M.R., James D.E., Piper R.C. 2001. Relationship between endosomes and lysosomes. Biochem. Soc. Trans. V. 29. P. 476.
MacDonald E., Brown L., Selvais A., Liu H., Waring T., Newman D., Bithell J., Grimes D., Urbé S., Clague M.J., Zech T. 2018. HRS–WASH axis governs actin-mediated endosomal recycling and cell invasion J. Cell Biol. V. 217. P. 2549.
Manders E.M.M., Verbeek F.J., Aten J.A. 1993. Measurement of co-localization of objects in dual-colour confocal images. J. Microsc. V. 169. P. 375.
Matsuyama A. Shimazu T., Sumida Y., Saito A., Yoshimatsu Y., Seigneurin-Berny D., Osada H., Komatsu Y., Nishino N., Khochbin S., Horinouchi S., Yoshida M. 2002. In vivo destabilization of dynamic microtubules by HDAC6-mediated deacetylation. EMBO J. V. 21. P. 6820.
Matteoni R., Kreis T.E. 1987. Translocation and clustering of endosomes and lysosomes depends on microtubules. J. Cell Biol. V. 105. P. 1253.
Muriel O., Tomas A., Scott C.C., Gruenberg J. 2016. Moesin and cortactin control actin-dependent multivesicular endosome biogenesis. Mol. Biol. Cell. V. 27. P. 3305.
Salova A.V., Belyaeva T.N., Leontieva E.A., Zlobina M.V., Kharchenko M.V., Kornilova E.S. 2016. Quantum dots implementation as a label for analysis of early stages of EGF receptor endocytosis: A comparative study on cultured cells. Oncotarget. V. 7. P. 6029.
Salova A. V., Belyaeva T.N., Leontieva E.A., Kornilova E.S. 2017. EGF receptor lysosomal degradation is delayed in the cells stimulated with EGF-Quantum dot bioconjugate but earlier key events of endocytic degradative pathway are similar to that of native EGF. Oncotarget. V. 8. P. 44335.
Simonsen A., Lippé R., Christoforidis S., Gaullier J.M., Brech A., Callaghan J., Toh B.H., Murphy C., Zerial M., Stenmark H. 1998. EEA1 links PI(3)K function to Rab5 regulation of endosome fusion. Nature. V. 394. P. 494.
Welte M.A. 2004. Bidirectional transport along microtubules. Curr. Biol. V. 14. P. 525.
Zlobina M.V., Kharchenko M.V., Kornilova E.S. 2013. Analysis of EGF receptor endocytosis dynamics based on semiquantitative processing of confocal immunofluorescent images of fixed cells. Cell Tiss. Biol. V. 7. P. 382.
Дополнительные материалы отсутствуют.


