Цитология, 2020, T. 62, № 5, стр. 349-355
Перераспределение рецептора ЭФР и интегринов α5 и β1 в клетках эпителия в ответ на заражение бактериями Serratia proteamaculans
О. А. Цаплина *
Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: olga566@mail.ru
Поступила в редакцию 25.01.2020
После доработки 14.02.2020
Принята к публикации 14.02.2020
Аннотация
Для взаимодействия с окружающей средой клетки эукариот используют поверхностные рецепторы, с помощью которых патогенные и условно-патогенные бактерии могут проникать в клетки, которые в норме не фагоцитируют. Бактерии Serratia proteamaculans способны проникать в клетки эукариот, что коррелирует с активностью актин-специфической протеазы протеализин (Цаплина и др., 2009), однако клеточные рецепторы, задействованные в механизме проникновения этих бактерий неизвестны. Один из субстратов протеализина, поверхностный белок бактерий OmpX, взаимодействует с рецептором ЭФР и фибронектином. Поэтому в работе были прослежены изменения локализации ЭФР, а также α5 и β1 субъединиц интегрина, образующих рецептор фибронектина, в эпителиальных клетках M-HeLa и А549, зараженных бактериями S. proteamaculans. Оказалось, что в клетках M-HeLa в ответ на заражение происходит накопление α5- и β1-субъедениц интегрина на поверхности клетки-хозяина и интенсивное прикрепление бактерий в местах локализации α5-интегрина. В клетках А549 α5-субъединица не была выявлена, локализованная равномерно по периметру клетки β1-субъединица рецептора, в ответ нa контакт с бактериальными клетками, накапливалась в цитоплазме, а рецептор ЭФР в ответ на заражение образовывал гранулы в цитоплазме. Похожее перераспределение рецептора ЭФР происходит в ответ на связывание с ЭФР. Полученные результаты указывают на то, что инвазия бактерий S. proteamaculans в клетки эпителия разного происхождения проходит в результате взаимодействия с разными поверхностными рецепторами.
Для связи с окружающей средой клетки эукариот используют рецепторы, встроенные в мембрану клеточной поверхности. В ответ на контакт с внеклеточными компонентами, рецепторы вызывают специфические клеточные ответы. Каждая клетка обладает собственным набором рецепторов для связывания с гормонами или нейромедиаторами, цитокинами, факторами роста, с другими клетками или нерастворимыми белками внеклеточного матрикса. Рецепторами для специфического узнавания и захвата бактерий обладают только клетки иммунной системы. Однако множество патогенных и условно-патогенных бактерий уклоняются от иммунной системы, проникая в клетки эукариот, которые в норме не фагоцитируют.
Проникновение бактерий в клетки эукариот (инвазию) можно разделить на три последовательных этапа: 1) контакт и адгезия, в которых задействованы только бактериальный лиганд и рецептор клетки-хозяина; 2) полимеризация актина и формирование мембранных выростов в результате образования лиганд-рецепторных комплексов (механизм инвазии “застежка-молния”) или введение белков-эффекторов через систему секреции (“триггерный” механизм инвазии); 3) закрытие фагоцитозной чаши и деполимеризация актина (Cossart, Sansonetti, 2004).
Бактерии Serratia proteamaculans способны проникать в клетки эукариот, и эта способность коррелирует с присутствием актин-специфической протеазы протеализин (Цаплина и др., 2009). Протеализин расщепляет в актине связь Gly42–Val43, расположенную в N-концевом сегменте ДНКазной петли, который интенсивно вовлечен в контакт между мономерами в полимере актина (Цаплина и др., 2009). Нарушение этой связи усиливает динамику полимеров актина, значительно ускоряя их деполимеризацию (Tsaplina et al., 2012), а эффективность полимеризации расщепленного актина существенно усиливается актин-связывающими белками или фторидами (Tsaplina et al., 2012, 2016). Это означает, что расщепление протеализином может изменять свойства актина в направлении, благоприятном для инвазии, и таким образом способствовать инвазии бактерий, синтезирующих этот фермент. Оказалось, что трансформации неинвазивных бактерий Escherichia coli плазмидой, несущей ген протеализина, достаточно для появления у этих бактерий способности проникать в клетки эукариот (Bozhokina et al., 2011). Эти данные указывают на то, что протеализин может регулировать инвазию на стадии захвата бактерии. Однако нет данных о том, участвует ли протеализин в бактериальной инвазии на стадии адгезии.
Среди субстратов протеализина был обнаружен белок внешней мембраны бактерий OmpX и показано, что трансформация E. coli плазмидой, несущей ген OmpX, в 3 раза увеличивает адгезию бактерий к клеткам эукариот (Цаплина, 2018). Белки семейства OmpX могут отвечать за интенсивность инвазии бактерий, участвуя в адгезии патогенных E. coli (Meng et al., 2016) и Yersinia pestis (Kolodziejek et al., 2007; Tsang et al., 2010). Для белков семейства OmpX показана способность связываться с рецептором эпидермального фактора роста (ЭФР) (Wiedemann et al., 2016) и белком внеклеточного матрикса фибронектином (Tsang et al., 2010). Фибронектин на поверхности клеток эукариот связывается с интегринами – гетеродимерным рецепторами, состоящими из субъединиц α5 и β1. Кластеризация рецепторов приводит к привлечению структурных и сигнальных молекул и захвату бактерий клеткой-хозяином.
Целью данной работы было проанализировать распределение клеточных рецепторов, связывающихся с OmpX, на поверхности клетки-хозяина, в ответ на заражение условно-патогенными бактериями S. proteamaculans.
Для исследования перераспределения поверхностных рецепторов в ответ на контакт с бактериальной клеткой необходимо было выбрать несколько клеточных линий, синтезирующиx рецептор ЭФР и (или) фибронектин. Фибронектин синтезируют фибробласты, основная функция которых заключается в поддержании структурной целостности соединительных тканей путем непрерывной секреции предшественников всех компонентов внеклеточного матрикса. Ранее мы показали, что адгезия бактерий S. proteamaculans и Е.coli, синтезирующих OmpX из S. proteamaculans, на поверхности клеток эпителия, которые в норме слабо синтезируют фибронектин, приводит к увеличению экспрессия гена фибронектина (Цаплина, 2018). Эти данные позволили нам продолжить работу на клетках эпителия, синтезирующих рецептор ЭФР, в которых уровень экспрессии гена фибронектина растет в ответ на заражение бактериями. Для работы были выбраны клетки карциномы легкого человека A549 и карциномы шейки матки M-HeLa.
МАТЕРИАЛ И МЕТОДИКА
Клетки карциномы легкого человека A549 и карциномы шейки матки M-HeLa (Российская коллекция клеточных культур позвоночных, Институт цитологии РАН, Санкт-Петербург) выращивали соответственно на среде DMEM и EMEM (Биолот, Россия), содержащей 1% заменимых аминокислот (NEAA) (Sigma, США). Среды содержали 10% эмбриональной бычьей сыворотки (Sigma, США).
Бактерии S. proteamaculans росли в среде LB (Sigma, США) при 30°С с аэрацией в течение 44–48 ч до появления актиназной активности в их экстрактах (Цаплина и др. 2009). Суспензию бактерий центрифугировали при 9600 g, 10 мин. Осадок ресуспендировали в среде DMEM и добавляли к клеткам эукариот, предварительно сменив среду на свежую.
Клетки A549 и M-HeLa инкубировали с бактериями в течение 2–3 ч при 37°С в атмосфере 5% СО2. Клетки трижды отмывали фосфатно-солевым буферным раствором на каждом этапе окраски. Препараты фиксировали 3.7%-ным формалином в течение 10 мин, инкубировали 5 мин с 0.1%-ным Тритоном Х100, а затем с 1%-ным бычьим сывороточным альбумином 30 мин для предотвращения неспецифического связывания антител (но Ат еще не окрашивали). Рецепторы клеток эукариот окрашивали первичными антителами кролика против рецептора ЭФР (E235) в разведении 1 : 500, антителами мыши против β1-интегрина (P5D2), в разведении 1 : 250, антителами кролика против α5-интегрина в разведении 1 : 250 (PR7834) (все от AbCam, Великобритания). Препараты инкубировали 1 ч со вторичными антителами против кролика или мыши, сшитыми с Alexa-488, в разведении 1 : 500 (SantaCruz, США), окрашивали родамин-фаллоидином 15 мин для визуализации актинового цитоскелета и DAPI 5 мин для визуализации ДНК бактерий и клеток эпителия. Готовые препараты анализировали с помощью микроскопа Olympus FV3000 (Япония), используя систему лазеров с длинами волн 405, 488 и 561 нм.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Перераспределение интегринов в ответ на контакт с бактериями. Интегрины являются важными рецепторами клеточной адгезии. Эти гетеродимерные рецепторы обеспечивают молекулярную основу для сложного взаимодействия между внеклеточным матриксом и различными типами клеток. В клетках эукариот с фибронектином связывается в основном α5β1-интегрин. В то же время интегрины являются мишенью для бактериальных и вирусных патогенов (Hauck et al., 2012). Поверхностные белки инвазивных бактерий могут связывать α5β1-интегрины напрямую (Isberg, Leong 1990; Kwok et al., 2007) или через белок внеклеточного матрикса фибронектин (Fowler et al., 2000; Eucker, Konkel, 2012).
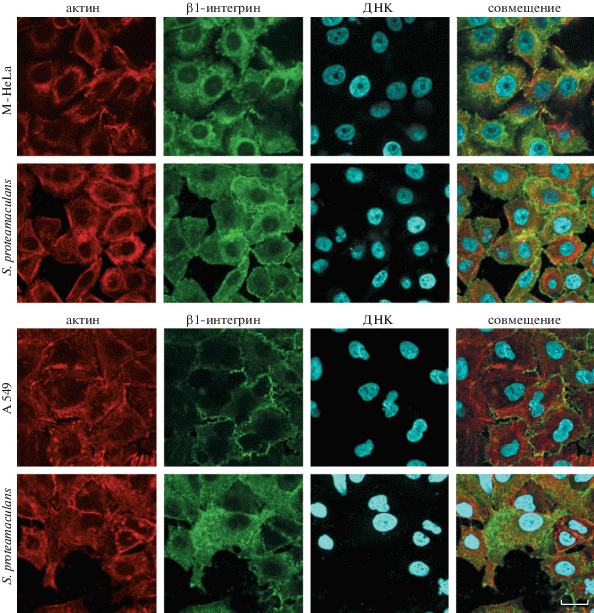
Используя конфокальную микроскопию с антителами к β1-интегрину, мы проанализировали изменение локализации рецептора в эпителиальных клетках. В контрольных клетках карциномы шейки матки человека M-HeLa β1-интегрин неравномерно покрывает периметр клеток и локализован локусами. Заражение культуры M-HeLa бактериями приводит к накоплению рецептора в мембране и через 3 ч β1-интегрин равномерно распределяется по периметру клетки-хозяина (рис. 1а). В контрольных клетках карциномы легкого человека А549 рецептор локализован равномерно по периметру клетки, а контакт с бактериальными клетками за 3 ч приводит к накоплению рецептора в цитоплазме инфицированных клеток (рис. 1б).
Рис. 1.
Распределение окраски актина и β1-интегрина в клетках M-HeLa и А549 во время инвазии условно-патогенных бактерий Serratia proteamaculans. Клетки инкубировали с бактериями, взятыми через 44 ч после посева, в течение 3 ч. Контроль – клетки, не зараженные бактериями. Цитоскелет окрашивали родамин‑фаллоидином, β1-интегрин – атителами к β1-субъединице интегрина, ДНК бактерий – красителем DAPI. Масштабная линейка: 20 мкм.
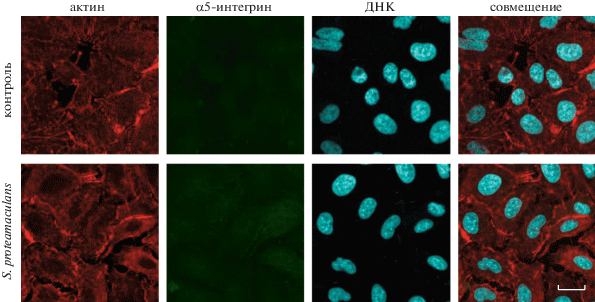
С помощью антител к α5-интегрину, второй субъединицы рецептора фибронектина, в контрольных клетках M-HeLa α5-интегрин не выявлялся. После заражения бактериями α5-интегрин накапливался на поверхности клетки-хозяина. Более того, в местах его накопления на поверхности клетки-хозяина, где он ко-локализован с актином, интенсивность прикрепления бактерий S. proteamaculans резко возрастала (показано стрелками на рис. 2). В клетках A549 антитела к α5-интегрину не выявили его ни в контрольных, ни в зараженных бактериями клетках (рис. 3). Основываясь на полученных данных, можно сделать заключение, что бактерии S. proteamaculans могут проникать в клетки M-HeLa, взаимодействуя с α5β1-интегрином, но не могут проникать по этому пути в клетки в А549.
Рис. 2.
Распределение окраски актина и α5-интегрина в клетках M-HeLa во время инвазии условно-патогенных бактерий S. proteamaculans. Клетки инкубировали с бактериями взятыми через 44 ч после посева, в течение 2 ч. Контроль – клетки, не зараженные бактериями. Цитоскелет окрашивали родамин‑фаллоидином, α5-интегрин – атителами к α5-субъединице интегрина, ДНК бактерий – красителем DAPI. Стрелками показана ко-локализация α5-интегрина и актина на поверхности клетки-хозяина. Масштабная линейка: 20 мкм.
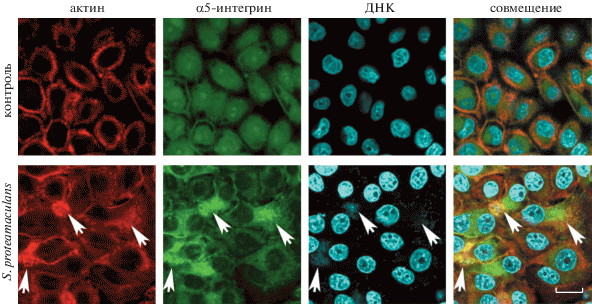
Рис. 3.
Распределение окраски актина и α5-интегрина в клетках А549 во время инвазии условно-патогенных бактерий S. proteamaculans. Клетки инкубировали с бактериями S. proteamaculans, взятыми через 44 ч после посева, в течение 2 ч. Контроль – клетки, не зараженные бактериями. Цитоскелет окрашивали родамин‑фаллоидином, α5-интегрин – атителами к α5-субъединице интегрина, ДНК бактерий – красителем DAPI. Масштабная линейка: 20 мкм.
Перераспределение рецептора ЭФР в клетках в ответ на контакт с бактериями. Поверхностные белки бактерий могут запускать собственный фагоцитоз, связываясь с рецептором ЭФР напрямую (Mölleken et al., 2013; Wiedemann et al., 2016), или используя рецептор ЭФР для передачи необходимого для инвазии сигнала (Eucker, Konkel, 2012; Kim et al., 2018).
С помощью конфокальной микроскопии и антител к рецептору ЭФР мы показали, что в клетках M-HeLa этот рецептор синтезируется в единичных клетках, а инфицирование бактериями не приводит к его глобальному перераспределению в клетках (рис. 4 ). Однако во время инвазии бактерий S. proteamaculans в клетки M-HeLa рецептор локализован в местах контакта бактерий с клеткой-хозяином (показано стрелками на рис. 4 ).
Рис. 4.
Распределение окраски актина и рецептора ЭФР в клетках M-HeLa во время инвазии условно-патогенных бактерий S. proteamaculans. Клетки M-HeLa инкубировали с бактериями S. proteamaculans, взятыми через 47 ч после посева, в течение 3 ч. Контроль – клетки, не зараженные бактериями. Цитоскелет окрашивали родамин‑фаллоидином, рецептор ЭФР – атителами к рецептору ЭФР, ДНК бактерий – красителем DAPI. Стрелками показана ко-локализация рецептора ЭФР с бактериями. Масштабная линейка: 20 мкм.
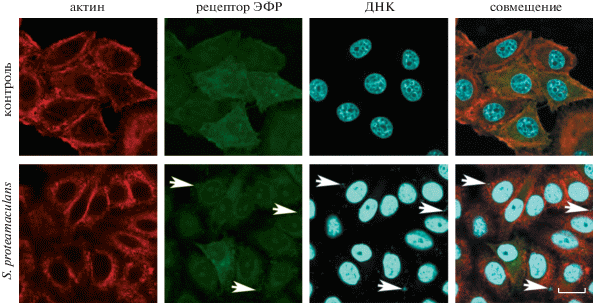
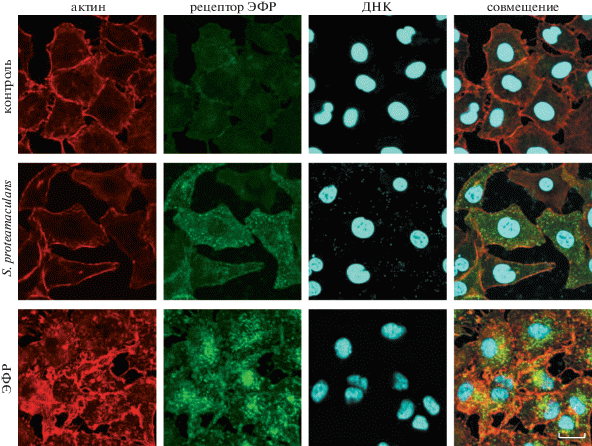
В необработанных клетках А549 рецептор ЭФР расположен равномерно по периметру клетки. Инфицирование бактериями приводит к образованию крупных гранул с рецептором ЭФР в цитоплазме клетки-хозяина (рис. 5). Обнаруженные гранулы не ко-локализованы с внутриклеточными бактериями. Эти результаты феноменологически похожи на запуск сигнального каскада в результате связывания рецептора ЭФР со своим природным лигандом ЭФР (рис. 5). Полученные данные позволяют предположить, что в процессе заражения клеток А549 бактериями рецептор ЭФР активируется и запускает сигнальные каскады, необходимые для проникновения S. proteamaculans в клетки эукариот.
Рис. 5.
Распределение окраски актина и рецептора ЭФР в клетках А549 во время инвазии условно-патогенных бактерий S. proteamaculans. Клетки А549 инкубировали с бактериями S. proteamaculans, взятыми через 45 ч после посева, или с ЭФР (100 нг/мл) в течение 2.5 ч. Контроль – клетки, не зараженные бактериями. Цитоскелет окрашивали родамин‑фаллоидином, рецептор ЭФР – атителами к рецептору ЭФР, ДНК бактерий – красителем DAPI. Масштабная линейка: 20 мкм.
ЗАКЛЮЧЕНИЕ
Таким образом, клетки эпителия M-HeLa и A549 существенно различаются по количеству и локализации поверхностных рецепторов ЭФР и α5β1-интегрина. В зависимости от набора рецепторов инфицирование интактных клеток условно-патогенными бактериями может по-разному перераспределять рецепторы клетки-хозяина и запускать сигнальные каскады, способствующие инвазии бактерий. По-видимому, инвазия бактерий в эпителиальные клетки разного происхождения проходит в результате связывания с разными поверхностными рецепторами.
Список литературы
Цаплина О.А. 2018. Участие поверхностного белка Serratia proteamaculans OmpX в адгезии бактерий к клеткам эукариот. Цитология. Т. 60. № 10. С. 817. (Tsaplina O.A. 2018. Participation of Serratia proteamaculans outer membrane protein X (OmpX) in bacterial adhesion on eukaryotic cells. Tsitologiia. V. 60. P. 817.)
Цаплина О.А., Ефремова Т.Н., Кевер Л.В., Комиссарчик Я.Ю., Демидюк И.В., Костров С.В., Хайтлина С.Ю. 2009. Выявление актиназной активности протеализина. Биохимия. Т. 74. № 6. С. 797. (Tsaplina O.A., Efremova T.N., Kever L.V., Komissarchik Y.Y., Demidyuk I.V., Kostrov S.V., Khaitlina S.Y. 2009. Probing for actinase activity of protealysin. Biochemistry (Moscow). V. 74. P. 648.)
Bozhokina E.S., Tsaplina O.A., Efremova T.N., Kever L.V., Demidyuk I.V., Kostrov S.V., Adam T., Komissarchik Y.Y., Khaitlina S.Y. 2011. Bacterial invasion of eukaryotic cells can be mediated by actin-hydrolysing metalloproteases grimelysin and protealysin. Cell Biol. Int. V. 35. P. 111.
Cossart P., Sansonetti P.J. 2004. Bacterial invasion: The paradigms of enteroinvasive pathogens. Science. V. 304. P. 242.
Eucker T.P., Konkel M.E. 2012. The cooperative action of bacterial fibronectin-binding proteins and secreted proteins promote maximal Campylobacter jejuni invasion of host cells by stimulating membrane ruffling. Cell Microbiol. V. 14. P. 226.
Fowler T., Wann E.R., Joh D., Johansson S., Foster T.J., Höök M. 2000. Cellular invasion by Staphylococcus aureus involves a fibronectin bridge between the bacterial fibronectin-binding MSCRAMMs and host cell beta1 integrins. Eur. J. Cell. Biol. V. 79. P. 672.
Hauck C.R., Borisova M., Muenzner P. 2012. Exploitation of integrin function by pathogenic microbes. Curr. Opin. Cell Biol. V. 24. P. 637.
Isberg R.R., Leong J.M. 1990. Multiple beta 1 chain integrins are receptors for invasin, a protein that promotes bacterial penetration into mammalian cells. Cell. V. 60. P. 861.
Kim W.J., Shea A.1., Kim J.H., Daaka Y. 2018. Uropathogenic Escherichia coli invades bladder epithelial cells by activating kinase networks in host cells. J. Biol. Chem. V. 293. P. 16 518.
Kolodziejek A.M., Sinclair D.J., Seo K.S., Schnider D.R., Deobald C.F., Rohde H.N., Viall A.K., Minnich S.S., Hovde C.J., Minnich S.A., Bohach G.A. 2007. Phenotypic characterization of OmpX, an Ail homologue of Yersinia pestis KIM. Microbiol. V. 153. P. 2941.
Kwok T., Zabler D., Urman S., Rohde M., Hartig R., Wessler S., Misselwitz R., Berger J., Sewald N., König W., Backert S. 2007. Helicobacter exploits integrin for type IV secretion and kinase activation. Nature. V. 449. P. 862.
Meng X., Liu X., Zhang L., Hou B., Li B., Tan C., Li Z., Zhou R., Li S. 2016. Virulence characteristics of extraintestinal pathogenic Escherichia coli deletion of gene encoding the outer membrane protein X. J. Vet. Med. Sci. V. 78. P. 1261.
Mölleken K., Becker E., Hegemann J.H. 2013. The Chlamydia pneumoniae invasin protein Pmp21 recruits the EGF receptor for host cell entry. PLoS Pathog. V. 9. e1003325. https://doi.org/10.1371/journal.ppat.1003325
Tsang T.M., Felek S., Krukonis E.S. 2010. Ail binding to fibronectin facilitates Yersinia pestis binding to host cells and Yop delivery. Infect. Immun. V. 78. P. 3358.
Tsaplina O., Efremova T., Demidyuk I., Khaitlina S. 2012. Filamentous actin is a substrate for protealysin, a metalloprotease of invasive Serratia proteamaculans. FEBS J. V. 279. P. 264.
Tsaplina O.A., Khaitlina S.Yu. 2016. Sodium fluoride as a nucleating factor for Mg-actin polymerization. Biochem. Biophys. Res. Commun. V. 479. P. 741.
Wiedemann A., Mijouin L., Ayoub M.A., Barilleau E., Canepa S., Teixeira-Gomes A.P., Le Vern Y., Rosselin M., Reiter E., Velge P. 2016. Identification of the epidermal growth factor receptor as the receptor for Salmonella Rck-dependent invasion. FASEB J. V. 30. P. 4180.
Дополнительные материалы отсутствуют.


