Цитология, 2020, T. 62, № 5, стр. 375-382
Культивирование клеток меланомы in vitro на 3D-скаффолде, приготовленном на основе желатина
А. А. Яценко 1, 2, *, В. А. Кушнарев 2, 3, Е. М. Устинов 1, Д. В. Леонов 1, В. М. Кислицкий 1, С. С. Целуйко 1, А. С. Артемьева 3
1 Амурская государственная медицинская академия Министерства здравоохранения РФ
675006 Благовещенск, Россия
2 Общество с ограниченной ответственностью “IQ Biofabric”
121205 Москва, Сколково, Россия
3 Национальный медицинский исследовательский центр онкологии им. Н.Н. Петрова Министерства здравоохранения Российской Федерации
191124 Санкт-Петербург, пос. Песочный, Россия
* E-mail: mdyatsenko@gmail.com
Поступила в редакцию 01.10.2019
После доработки 10.02.2020
Принята к публикации 19.02.2020
Аннотация
Органотипическое культивирование клеток меланомы в трехмерном (3D) матриксе, который имитирует дерму, является одним из перспективных направлений моделирования опухоли и изучения ее биологии. Целью исследования являлось изучение морфологических и иммуногистохимических характеристик клеток меланомы, полученных в результате эксцизионной биопсии кожи, при длительном 3D-культивировании на желатиновом матриксе. После 35-суточного культивирования проводили светооптический морфологический и иммуногистохимический анализ скаффолдов с использованием антител к меланоцитарным антигенам S100, SOX10, а также к мембранному антигену CD44. Через 35 сут культивирования клеток первичной культуры меланомы на желатиновых пористых скаффолдах, полученных методом выщелачивания, сохранялась экспрессия меланоцитарных антигенов и мембранного антигена CD44. Клетки меланомы были адгезированы к поверхности и разрушали матрикс скаффолда. Таким образом, разработан компонентный и количественный состав трехмерного желатинового скаффолда, обеспечивающего адгезию и пролиферацию клеток первичной культуры меланомы с сохранением экспрессии меланоцитарных антигенов и белка CD44.
Меланома – наиболее агрессивная и смертельная форма опухоли кожи. Общая пятилетняя выживаемость пациентов с отдаленными метастазами составляет 16%, а медиана общей выживаемости составляет от 4 до 6 месяцев (Faruk, 2012; Cheng et al., 2018). До недавнего времени варианты лечения включали в себя химиотерапию и попытки иммунотерапии, однако с открытием активирующих мутаций в кодоне 600 гена BRAF, характерных для 40–60% меланом, началось активное использование его ингибиторов (Hayward et al., 2017; Luke et al., 2017). Быстрый прогресс в создании и развитии данного класса препаратов связан с наличием подходящих моделей для исследований. Взаимодействие опухолевых клеток с микроокружением играет важную роль в их функционировании и регуляции, и, следовательно, является критически важным фактором ответа на терапию. Опухолевый матрикс – один из определяющих компонентов микроокружения. Клетки меланомы обладают способностью к инвазии в окружающую строму, пролиферации и миграции (Shain, Bastian, 2016; Müller, Kulms, 2018). Эффективность применяемой модели меланомы зависит от того, сохраняет ли она морфологию и антигенные свойства первичной опухоли (Vörsmann et al., 2013). Использование подобной модели требует воссоздания соответствующей цито- и гистоархитектоники (Magdeldin et al., 2017).
Большая часть исследований проводится на двухмерных (2D) клеточных культурах, в которых клетки растут в виде монослоя на культуральном пластике. Одно из существенных ограничений 2D-клеточной культуры – расположение клеток, позволяющее получить равный доступ к питательным веществам, кислороду и используемым терапевтическим молекулам. В трехмерной (3D) клеточной культуре, наоборот, ее структура позволяет создать градиент питательных веществ, зоны гипоксии и центрального некроза, морфологически имитировать динамическое взаимодействие стромы и клеток меланомы, а также изучать эпигенетические, генетические и белковые взаимодействия (Pampaloni et al., 2007).
Перечисленные эффекты зависят от гистоархитектоники скаффолда и его состава (Xiaohong, 2003; Hill et al., 2015). В настоящее время существует большое количество подходов к созданию 3D-культур, наиболее распространенный – это клеточные сфероиды, представленные одним типом клеток (Wegert et al., 2019). В ряде работ при культивировании клеток меланомы в виде сфероидов, была показана экспрессия ими меланоцитарных антигенов, в частности HMB-45 (Ramgolam et al., 2011). Однако клеточные сфероиды ограничены в размере и росте и не имеют стромы, которая, в свою очередь, значительно влияет на молекулярные и фенотипические свойства клеток (Schmidt et al., 2019). Чтобы преодолеть ограничения по размеру модели in vitro, а также спроектировать микросреду, близкую к in vivo, опухолевые клетки или даже целые сфероиды могут быть посеяны на полимерных органических каркасах или могут быть встроены в гидрогели, которые напоминают микроокружение опухоли.
Ряд работ показал возможность культивирования клеток меланомы на полимерах синтетической природы, к которым относят полимолочную кислоту и полигликолевую кислоту, матриксные материалы, такие как коллаген или желатин, коммерчески доступные Cellink Bioink, Cellink Matrigel (Lee et al., 2008; Hill et al., 2015; Naves et al., 2018), в том числе с применением метода биопечати (Lyden et al., 2018) или микрофлюидных систем (Aref et al., 2018). Однако до сих пор открыт вопрос о поиске новых материалов и методов моделирования скаффолдов, позволяющих поддерживать морфологические и молекулярно-генетические характеристики клеток меланомы при длительном культивировании.
Мы создали пористый желатиновый скаффолд, усовершенствовав описанную ранее методику (Hölzl 2016). Желатин обладает низкой иммуногенностью, а также имеет большое количество сайтов клеточной адгезии (Nikolova et al., 2019). Целью исследования являлось изучение морфологических и иммуногистохимических характеристик первичной культуры клеток меланомы кожи при 35-суточном 3D-культивировании на пористом желатиновом скаффолде.
МАТЕРИАЛ И МЕТОДИКА
Получение первичной культуры меланомы. Материал опухоли был получен при эксцизионной биопсии образца кожи спины у пациента с патологоанатомическим диагнозом поверхностно распространяющаяся пигментная меланома, pT4b. Забор материала проводили с одобрения локального этического комитета ФГБОУ ВО Амурской ГМА Минздрава России после получения информированного согласия от пациента.
Образцы опухоли помещали в однократный ФСБ (фосфатно-солевой буфер) (Биолот, Россия) со 100 МЕ/мл бензилпенициллина (Биолот, Россия) и 2 мг/мл гентамицина (Биолот, Россия). Образцы хранили в течение 1 сут при 4°С. После суточного карантина проводили их обработку для исключения контаминированных образцов. Образец помещали на 20 с в 70%-ный раствор этилового спирта, после чего дважды промывали в стерильном растворе ФСБ. Дальнейшая подготовка образца ткани соответствовала протоколу первичного эксплантата (Ian Freshney, 2006). На 5-е сут наблюдали выход опухолевых клеток из образцов. На 10-е сут кусочки кожи удаляли из чашки Петри. Дальнейшее культивирование клеток проводили на питательной среде DMEM с 10% телячьей сыворотки при 37°С и 5% СО2. Культуру пассировали 3 раза для удаления других типов клеток.
Кроме того были подготовлены цитологические мазки для морфологического и иммуногистохимического исследования с фиксацией в 95%-ном этиловом спирте.
Подготовка 3D-скаффолдов. Скаффолды были изготовлены из пищевого желатина типа Б, полученного из бычьего коллагена (ЗАО “Компания Проксима”, Россия). Желатин растворяли в 0.9% изотоническом растворе хлорида натрия при 55°С. Для создания пористой структуры использовали хлорид натрия (ООО “АО РЕАХИМ”, Россия).
Химическую фиксацию желатина производили глутаровым альдегидом (Sigma Aldrich, Германия). Готовили стандартизированные по площади образцы пористых желатиновых скаффолдов. Скаффолды получали путем нанесения 20%-ного раствора желатина на слой хлорида натрия с размером кристаллов от 4 до 50 мкм в чашке Петри в весовом соотношении 1 : 9. Чашку Петри помещали в термостат при 37°С на 24 ч. После этого проводили обработку скаффолдов 2.5%-ным раствором глутарового альдегида, приготовленного на ФСБ (pH 7.4). Выщелачивание хлорида натрия проводили с помощью последовательной инкубации образцов в деионизированной воде на протяжении 48 ч со сменой растворов каждые 24 ч. Размер готового скаффолда – 5 × 5 × 2 мм. Скаффолды перед заселением клеточной культурой подвергали паровой стерилизации при 121.1°С и давлении 2 атм. в течение 20 мин.
Заселение скаффолдов первичной культурой клеток меланомы. Снятие клеток меланомы проводили с чашек Петри на 12-е сут с помощью раствора трипсина (0.25 мг/мл) (Thermo Fisher Scientific, Германия). Полученную клеточную суспензию в объеме 300 мкл с концентрацией клеток 4 × 106 на 1 мл переносили на подготовленные скаффолды. Скаффолды с клетками меланомы культивировали в 96-луночных планшетах (Thermo Fisher Scientific, Германия) в CO2-инкубаторе при 37°С и 5%-ной концентрации СО2. Ежедневно анализировали состояние культуральной среды и морфологию клеток на скаффолде. Смену культуральной среды проводили каждые 3 сут.
Пробоподготовка для морфологического и иммуногистохимического исследования. Количество скаффолдов составило 18 образцов. Скаффолды с клетками меланомы культивировали в течение 35 сут. Морфологическое исследование скаффолдов проводили на 14 и 35 сут. Для этого по 3 образца скаффолда разделяли на 2 части и в течение 24 ч фиксировали в 10%-ном забуференном формалине (Биовитрум, Россия) для морфологического и иммуногистохимического исследования и в 1%-ном растворе глутарового альдегида (Thermo Fisher Scientific, Германия), приготовленного на ФСБ для сканирующей электронной микроскопии. Параллельно с этим проводили исследования 2-D культуры для контроля клеточной морфологии.
Для светооптической микроскопии после фиксации осуществляли проводку через изопропанол в гистопроцессоре Leica Peloris II. Скаффолды заливали в парафиновую среду “Гистомикс” (Биовитрум, Россия), с парафиновых блоков на санном микротоме (Leica SM2000R) изготавливали срезы толщиной 4 мкм, которые монтировали на предметные стекла (Menzel) для иммуногистохимического исследования. Для окраски парафиновых срезов гематоксилином и эозином был использован автоматический гистостейнер Leica ST5020.
Для сканирующей электронной микроскопии проводили последовательную дегидратацию образцов в 50%-ном, 70%-ном, 96%-ном и 100%-ном этаноле, каждый этап продолжительностью 20 мин. Окончательную дегидратацию осуществляли по методу сушки при критической точке с использованием сжиженного углекислого газа. На образцы скаффолдов перед исследованием напыляли слой золота толщиной 10 нм (SPI Module™ Sputter Coater, США). Контрастирование 2D-клеточной культуры, для сканирующей электронной микроскопии на пластике проведено с помощью стандартной методики с контрастированием при помощи хлорида лантана (Патент РФ № 2578977, 12.05.2015). Цитологические мазки изготавливали путем равномерного распределения 400 мкл суспензии клеток с концентрацией 2 × 106 на 1 мл по поверхности предметного стекла с помощью покровного стекла под углом 25°. Далее проводили сушку образцов на воздухе при 23°С до полного высыхания жидкости. Мазки фиксировали смесью ацетона и метанола в объемном отношении 1 : 1 в течение 90 с, с последующей промывкой в ФСБ в течение 5 мин с последующим иммуногистохимическим исследованием и окраской гематоксилином и эозином (Suvarna et al., 2018).
Морфологическое исследование. Структуру полученных скаффолдов оценивали с помощью светового микроскопа Olympus BX46 (Япония) и сканера гистологических препаратов Panoramic 250, 3D Histech (Венгрия) с объективом ×20. Сканирующую электронную микроскопию проводили с помощью сканирующего электронного микроскопа Hitachi-S3400N (Япония). Оценивали структуру, количество и размер пор, наличие перемычек в скаффолде, количество и характер расположения клеток меланомы (Nanou et al., 2018). Для анализа морфологических особенностей структуры скаффолдов использовали Adobe Photoshop 2019.
Иммуногистохимическое исследование. Иммуногистохимическое (ИГХ) исследование выполнено с использованием первичных антител anti-S100 (номер в каталоге 760-2523), SOX10 (номер в каталоге 760-4968), CD44 ( номер в каталоге 790-4537), Ki67 (номер в каталоге 790-4286), Ventana, США. ИГХ исследование проводили на автоматическом иммуностейнере Bench Mark Ultra (Ventana, США), по протоколам указанным в табл. 1 с системой детекции u-ltraView Universal DAB Detection Kit (номер в каталоге 760-500). Во всех случаях процедура окрашивания не отличалась от рекомендованной производителями антител.
Таблица 1.
Протокол иммуногистохимического исследования
| Использованные первичные антитела | Клон | Восстановления антигенной активности, время, температура | Время и температура инкубации с первичными антителами | Время и температура инкубации со вторичными антителами |
|---|---|---|---|---|
| SOX-10 | BS7 | Ventana Ultra CC1, 48 мин, 99°C | 32 мин, 36°C | 8 мин, 36°C |
| S-100 | Polyclonal | Ventana Ultra CC1, 60 мин, 100°C | То же | То же |
| CD44 | SP37 | Ventana Ultra CC1, 36 мин, 95°C | То же | То же |
| Ki67 | 30-9 | Ventana Ultra CC1, 36 мин, 95°C | 32 мин, 37°C | То же |
Количественную оценку иммуногистохимической реакции осуществляли на цифровых изображениях с использованием свободного программного обеспечения Qupath, модуль Cell Analysis.
РЕЗУЛЬТАТЫ
Морфологическое исследование скаффолда. Полученные с помощью метода выщелачивания скаффолды при гистологическом исследовании имеют высокую пористость, с размером пор от 1 до 100 мкм (рис. 1). Поры занимают от 35 до 45% площади скаффолда. При сканирующей микроскопии скаффолда выявляется большое количество пор различного размера и соединяющих их каналов (рис. 2).
Рис. 1.
Пористый скаффолд на основе 20%-ного раствора желатина, приготовленного методом выщелачивания. Окраска гематоксилин-эозином. Увел.: 40×.

Рис. 2.
Пористый скаффолд на основе 20%-ного раствора желатина, полученный методом выщелачивания. Сканирующая электронная микроскопия, напряжение 30 кВ, увел.: 100×.

Морфологическое и иммуногистохимическое исследование клеток меланомы. При исследовании цитологического мазка первичной культуры меланомы клетки имеют выраженный полиморфизм и эпителиоподобную форму с включениями веретеноподобных клеток на протяжении всего времени 2D-культивирования (рис. 3a, б).
Рис. 3.
Клетки первичной культуры меланомы после 2D-культивирования в течение 35 сут. а – Световая микроскопия, окраска гематоксилин-эозином, увел.: 8×. б – Сканирующая электронная микроскопия, контрастирование солями лантана, напряжение 30 кВ, увел.: 420×. в – Выявление белка S100, локализация антигена в ядре и цитоплазме, увел.: 8×. г – Выявление белка SOX10, локализация антигена в ядре, увел.: 20×. д – Выявление белка CD44, локализация антигена в цитоплазме и на мембране, увел: 20×. в, г, д – Иммуногистохимия, световая микроскопия.
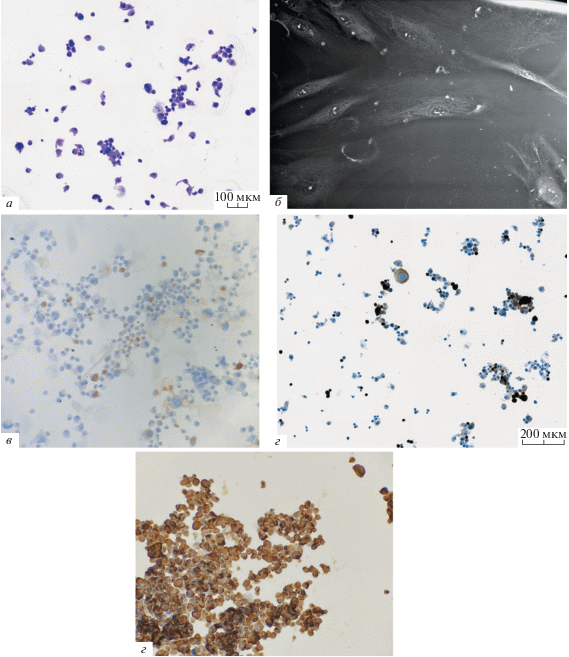
Белок S100 выявляется в 40% клеток, как в ядре, так и в цитоплазме (рис. 3в). Белок SOX10 присутствует примерно в 10% клеток первичной 2D-культуры меланомы через 35 сут с момента изоляции клеток из первичного экспланта (рис. 3г). Индекс пролиферативной активности, рассчитанный по результатам выявления Ki67, составил 10%. Экспрессия мембранного антигена CD44 отмечается в 90–95% всех клеток на 35 сут культивирования, в том числе CD44 выявляется и в цитоплазме (рис. 3д).
При морфологическом исследовании на 14 сут эксперимента скаффолды имели вид высокопористой структуры с хаотично расположенными скоплениями клеток с очаговой адгезией к скаффолду и фокальным формированием участков разрушения матрикса скаффолдов. На 35 сут группы по 5–10 клеток, адгезированных к поверхности желатинового скаффолда, образуют сфероидные скопления. Они демонстрируют инвазивный рост и разрушение подлежащих коллагеновых структур. Внутри коллагеновых балок находятся клетки меланомы, разрушающие коллагеновый матрикс с его ремоделированием (рис. 4a–в). Экспрессия меланоцитарных антигенов S100, SOX10 в клетках, культивируемых на скаффолде, и 2D-клеточной культуре сохраняется в клетках меланомы на 35 сут культивирования. Однако процентное содержание клеток, экспрессирующих белок S100, выросло в клетках скаффолда с 40% до 95%, а SOX10 – c 10% до 90%. Кроме того в 90% клеток меланомы, культивируемых на скаффолде, на 35 сутки культивирования также выявляется мембранный антиген CD44, в том числе и в цитоплазме клеток (рис. 4г–е). Индекс пролиферативной активности Ki67 составил 5%.
Рис. 4.
Клетки первичной культуры меланомы после культивирования на желатиновых скаффолдах в течение 35 сут. а – Клетки меланомы внутри желатинового матрикса скаффолда; сканирующая электронная микроскопия, увел.:151×. б, в – Клетки меланомы, разрушающие матрикс скаффолда: б – световая микроскопия, окраска гематоксилин-эозином, увел.: 30×, в – сканирующая электронная микроскопия, увел.: 854×. г – Выявление белка S-100, увел.: 20×. д – Выявление белка SOX10, увел.; 20×. е – Выявление белка CD44, увел.: 20×. г, д, е – Иммуногистохимия, световая микроскопия.
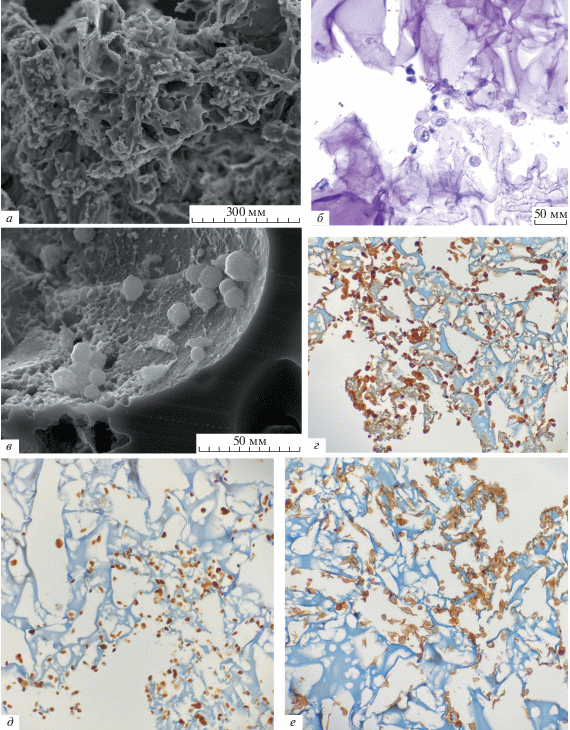
Полученные результаты свидетельствуют о том, что при культивировании клеток меланомы на скаффолдах, полученных на основе 20%-ного раствора желатина методом выщелачивания и сшитых глутаровым альдегидом, сохраняется экспрессия меланоцитарных антигенов, характерных для 2D-культуры. Однако экспрессия белка S100 возрастает в клетках, культивируемых на скаффолде.
ОБСУЖДЕНИЕ
Создание пористых скаффолдов, имеющих трехмерную структуру, на основе биологического полимера желатина, обладает рядом преимуществ по сравнению с другими полимерами. Желатин содержит большое количество сайтов адгезии для клеток, что способствует прикреплению клеток к скаффолдам, имеет низкую иммуногенность, так как сравним по химическому составу с коллагеном в тканях организма. Он биодеградирует, а также хорошо поддается модификации с помощью различных химических веществ (Rose et al., 2014).
Полученные результаты 35-суточного культивирования свидетельствуют о способности клеток меланомы адгезироваться к синтезированному скаффолду, сохраняя меланоцитарные маркеры и способность к инвазии. В местах прикрепления клеток наблюдается снижение плотности скаффолда, что может быть косвенным свидетельством выделения металлопротеиназ и других факторов, приводящих к ремоделированию матрикса. Увеличение экспрессии белка S100 и SOX10 в клетках меланомы в скаффолде, вероятно, связано с трехмерным культивированием. Белки S100 и SOX10 в клетках меланомы отвечают за рост, инвазию и пролиферацию (Graf et al., 2014; Bresnick et al., 2015).
Кроме того, интересна экспрессия антигена CD44. Ряд работ (Sapudom et al., 2017; Chen et al., 2018) рассматривают CD44 как предиктивный и прогностический маркер прогрессии и метастазирования, связывая это с аутокринной регуляцией через TGF-b1 и bFGF. При этом клетки меланомы изменяют структуру матрикса на менее плотный с формированием собственного матрикса. Эти изменения требуют дальнейшего исследования, и вероятно, связаны с матриксными металлопротеиназами, которые участвуют в ремоделировании скаффолда.
В контексте прикладного применения 3D-модель опухоли является потенциальной системой для оценки эффективности противоопухолевой терапии у пациентов на основе индивидуального подхода к лечению. Эффективность терапии может быть оценена на основании тестов цитотоксичности и морфологического анализа опухолевой ткани ex vivo в тест-системе. Такая оценка включает гистологическое исследование для оценки лечебного патоморфоза и иммуногистохимическое исследование пролиферативной активности опухоли с учетом биомаркеров Ki67 и специфических тканевых антител.
3D-моделирование опухолевой ткани с изучением иммунофенотипа и морфологии скаффолда имеет фундаментальное и прикладное значение. Сохранение экспрессии меланоцитарных маркеров и экспрессии трансмембранного гликопротеина CD44 в течение 35 сут первичной клеточной культуры, позволяет изучать факторы и механизмы инвазии, метастазирования на искусственно созданных пористых желатиновых скаффолдах in vitro.
Список литературы
Aref A., Campisi M., Ivanova E., Portell A., Larios D., Piel B., Mathur N., Zhou C., Coakley R., Bartels A., Bowden M., Herbert Z., Hill S., Gilhooley S., Carter J., et al. 2018. 3D microfluidic ex vivo culture of organotypic tumor spheroids to model immune checkpoint blockade. Lab. Chip. V. 18. P. 3129.
Bresnick A., Weber D., Zimmer D. 2015. S100 proteins in cancer. Nat. Rev. Cancer. V. 15. P. 96.
Chen C., Zhao S., Karnad A., Freeman J. 2018. The biology and role of CD44 in cancer progression: therapeutic implications. Hematol. Oncol. V. 10. P. 64.
Cheng L., Lopez-Beltran A., Massari F., MacLennan G., Montironi R. 2018. Molecular testing for BRAF mutations to inform melanoma treatment decisions: a move toward precision medicine. Modern Pathology. V. 31. P. 24.
Faruk T. 2012. Metastatic behavior in melanoma: timing, pattern, survival, and influencing factors. J. Oncology. 2012 : 64 768.
Graf S., Busch C., Bosserhoff A., Besch R., Berking C. 2014. SOX10 promotes melanoma cell invasion by regulating melanoma inhibitory activity. J. Investigat. Dermatol. V. 134. P. 2212.
Hayward NK., Wilmott JS1., Waddell N., Johansson PA., Field MA., Nones K., Patch AM., Kakavand H., Alexandrov LB., Burke H., Jakrot V., Kazakoff S., Holmes O., Leonard C., Sabarinathan R. 2017. Whole-genome landscapes of major melanoma subtypes. Nature. V. 11. P. 175.
Hill DS., Robinson ND., Caley MP., Chen M., O’Toole EA., Armstrong JL., Przyborski S., Lovat PE. 2015. A novel fully humanized 3D skin equivalent to model early melanoma invasion. Mol. Cancer Therap. V. 14. P. 2665.
Hölzl K, Lin S, Tytgat L, Van Vlierberghe S, Gu L, Ovsianikov A. 2016. Bioink properties before, during and after 3D bioprinting. Biofabrication. V. 23 P. 032002.
Ian Freshney R. 2006. Basic principles of cell culture. In: Vunjak-Novakovic G., Ian Freshney R. (Eds.). Culture of cells for tissue engineering. Wiley. P. 3.
Lee H1, Yuan C, Hammet A, Mahajan A, Chen ES, Wu MR, Su MI, Heierhorst J, Tsai MD. 2008. Diphosphothreonine-specific interaction between an SQ/TQ cluster and an FHA domain in the Rad53-Dun1 kinase cascade. Molecular Cell. V. 20 P. 767.
Luke J.J., Flaherty K.T., Ribas A., Long G.V. 2017. Targeted agents and immunotherapies: optimizing outcomes in melanoma. Nat. Rev. Clin. Oncol. V. 14. P. 463.
Lyden T., Dahlberg D. Martin M. 2018. Generating 3D artificial melanoma tumor tissues using CellMate™ hydrogels. FASEB J. V. 32. № 1_supplement. P. 677.13.
Magdeldin T., López-Dávila V., Pape J., Cameron GW., Emberton M., Loizidou M., Cheema U. 2017. Engineering a vascularised 3D in vitro model of cancer progression. Sci. Rep. V. 7. P. 44 045.
Müller I., Kulms D. 2018. A 3D organotypic melanoma spheroid skin model. J. Visual. Exp. V. 18 : 135.
Nanou A., Crespo M., Flohr P., De Bono J., Terstappen L. 2018. Scanning electron microscopy of circulating tumor cells and tumor-derived extracellular vesicles. Cancers. V. 10. P. 416.
Naves L.B., Dhand C., Ong S.T., Gandhimath C., Venugopal J.R., Almeida L., Verma K N., Lakshminarayanan R., Ramakrishna S. 2018. Electrospun linear and branched nanofibrous scaffolds for potential therapeutic application in melanoma. J. Cancer Res. Oncobiol. V. 1. P. 113.
Nikolovaa P.M., Chavali S.M. 2019. Recent advances in biomaterials for 3D scaffolds: A review. Bioact. Materials. V. 4. P. 271.
Pampaloni F., Peйнo E.G, Stelzer E.H. 2007. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biology. V. 8. P. 839.
Ramgolam K., Lauriol J., Lalou C., Lauden L., Michel L., de la Grange P., Khatib A.M., Aoudjit F., Charron D., Alcaide-Loridan C., Al-Daccak R. 2011. Melanoma spheroids grown under neural crest cell conditions are highly plastic migratory/invasive tumor cells endowed with immunomodulator function. PLOS One. V. 15. P. 18784.
Rose J.B., Pacelli S., Haj A.J.E., Dua H.S., Hopkinson A., White L.J., Rose F.R.A.J. 2014. Gelatin-based materials in ocular tissue engineering. Materials. V. 17. P. 3106.
Sapudom J., Ullm F., Martin S., Kalbitzer L., Naab J., Möller S., Schnabelrauch M., Anderegg U., Schmidt S., Pompe T. 2017. Molecular weight specific impact of soluble and immobilized hyaluronan on CD44 expressing melanoma cells in 3D collagen matrices. Acta Biomaterialia. V. 1. P. 259.
Schmidt S., Schmid R., Arkudas A., Kengelbach-Weigand A., Bosserhoff A. 2019. Tumor cells develop defined cellular phenotypes after 3D-bioprinting in different bioinks. Cells. V. 8. P. 1295. https://doi.org/10.3390/cells8101295
Shain A.H., Bastian B.C. 2016. From melanocytes to melanomas. Nat. Rev. Cancer. V. 16. P. 345.
Suvarna K., Layton C., Bancroft J. 2018. Bancroft’s theory and practice of histological techniques e-book. Philadelphia: Elsevier.
Vörsmann H., Groeber F., Walles H., Busch S., Beissert S., Walczak H., Kulms D. 2013. Development of a human three-dimensional organotypic skin-melanoma spheroid model for in vitro drug testing. Cell Death Disease. V. 4. e719. https://doi.org/10.1038/cddis.2013.249
Wegert J., Zauter L., Appenzeller S., Otto C., Bausenwein S., Vokuhl C., Ernestus K., Furtwängler R., Graf N., Gessler M. 2019. High-risk blastemal Wilms tumor can be modeled by 3D spheroid cultures in vitro. Oncogene. V. 39. P. 849.
Xiaohong W., Jukka T., Antti A., Kaija-Stiina M., Jouni Partanen P., Yliperttula M. 2003. The integrations of biomaterials and rapid prototyping techniques for intelligent manufacturing of complex organs. In: Advances in biomaterials science and biomedical applications. IntechOpen. https://doi.org/10.5772/53114
Дополнительные материалы отсутствуют.


