Цитология, 2020, T. 62, № 6, стр. 403-409
Действие экзогенных 20S-протеасом на продолжительность жизни мышей c меланомой
Е. Е. Дьяконов 1, С. В. Пономарцев 1, Т. И. Зюбко 1, А. Н. Томилин 1, 2, А. С. Цимоха 1, *
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт трансляционной биомедицины, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
* E-mail: atsimokha@incras.ru
Поступила в редакцию 18.02.2020
После доработки 02.03.2020
Принята к публикации 03.03.2020
Аннотация
Убиквитин-протеасомная система участвует в регуляции большинства основных внутриклеточных процессов, и нарушения в работе этой системы приводят к различным патологиям. Протеолитическое ядро этой системы, 20S-протеасома, была обнаружена в физиологических жидкостях как здоровых людей, так и пациентов, страдающих от различных воспалительных, аутоиммунных и онкологических заболеваний. Замечено, что концентрация внеклеточных протеасом коррелирует с тяжестью заболевания, однако функция протеасом во внеклеточном пространстве до сих пор неизвестна. Для выяснения возможных функций протеасом во внеклеточном пространстве мы оценивали эффект внутриопухолевого введения экзогенного пула очищенных из клеток 20S-протеасом на мышиной модели меланомы. Мы показали, что внутриопухолевое введение 20S-протеасом привело к небольшому (чуть меньше 20%) увеличению длительности жизни экспериментальных животных.
Большая часть регулируемого протеолиза в клетках эукариот приходится на убиквитин-протеасомную систему (Konstantinova et al., 2008). Протеолитическим “ядром” этой системы является белковый комплекс 26S-протеасома, состоящий из 20S-протеасомы и одного или двух 19S-регуляторных комплексов (Budenholzer et al., 2017). 20S-протеасома представляет собой полый цилиндр, образованный четырьмя семичленными кольцами: два внутренних кольца собраны из субъединиц β-типа, два внешних – из субъединиц α-типа (Groll et al., 1997). Три β-субъединицы (β1, β2 и β5) ответственны за протеолитическую активность протеасом. 19S-регуляторный комплекс распознает и разворачивает полиубиквитинированные субстраты, отделяя мономеры убиквитина, и обеспечивает поступление субстрата в 20S-протеасому (Glickman, Ciechanover, 2002).
Протеасомы также обнаружены во внеклеточном пространстве: плазме крови, спинномозговой и альвеолярной жидкостях (Wada et al., 1993; Sixt et al., 2007; Mueller et al., 2012) и среде, кондиционированной клетками раковых линий человека (Kulichkova et al., 2017; Tsimokha et al., 2017). Согласно данным электронной микроскопии (Zoeger et al., 2006) и масс-спектрометрии (Kulichkova et al., 2017; Tsimokha et al., 2017) внеклеточные протеасомы представлены протеолитически активными 20S-комплексами. Важным моментом в исследовании внеклеточных протеасом является тот факт, что были замечены изменения в количестве протеасом, экспортируемых из клеток крови в плазму крови, например, при опухолевой трансформации (Lavabre-Bertrand et al., 2001; Stoebner et al., 2005; Henry et al., 2009), а также в альвеолярное пространство при дыхательной недостаточности и во время воспалительных процессов в легких (Albright et al., 2009; Sixt et al., 2007, 2009). Количество экспортируемых внеклеточных протеасом изменялось также у пациентов с заболеваниями печени (Wada et al., 1993) и некоторыми аутоиммунными заболеваниями (Egerer et al., 2002). Нужно отметить, что концентрация внеклеточных протеасом может рассматриваться как прогностический параметр при лечении некоторых типов рака (Lavabre-Bertrand et al., 2001; Jakob et al., 2007; Heubner et al., 2011; de Martino et al., 2012).
На сегодняшний день ни механизм транспорта протеасом во внеклеточное пространство, ни их роль во внеклеточном пространстве не ясны. Предполагается, что накопление этих структур в межклеточном пространстве связано, прежде всего, с необходимостью удаления накапливающихся во внеклеточном пространстве белков, активации секретируемых клеткой белков-предшественников, а также процессинга антигенов (Sixt, Dahlmann, 2008; Sixt, Peters, 2010). Для выяснения возможных функций протеасом во внеклеточном пространстве, в настоящей работе мы изучили эффект введения внутрь опухоли дополнительного (экзогенного) пула очищенных из клеток 20S-протеасом на мышиной модели меланомы.
МАТЕРИАЛ И МЕТОДИКА
Клетки почки эмбриона человека линии HEK293, эмбриональные фибробласты мыши линии NIH3T3 и клетки лейкемии мыши L1210, полученные из Российской коллекции клеточных культур (Институт цитологии РАН), культивировали при 37°С в среде DMEM и RPMI-1640 (Биолот, Россия), содержащей 10% эмбриональной телячьей сыворотки (Invitrogen, США), в присутствии пенициллина и стрептомицина (Биолот, Россия). Клетки меланомы мыши линии B16/F10 любезно предоставлены д-ром Гужовой И.В. (Sverchinsky et al., 2017).
Экспрессионную конструкцию получили на основе вектора pQCXIP (Clontech, #631516), в который по сайтам рестрикции NotI и EcoRI вставлена последовательность hPSMD14-HTBH (любезно предоставлена д-ром Л. Хуанг (Wang et al., 2007)). Вместо последовательности hPSMD14 по сайтам рестрикции NotI и PacI мы вставили последовательность мышиного гена субъелиницы 20S протеасом β7 (mPSMB4), которую амплифицировали с кДНК из клеток L1210 с помощью следующих праймеров 5'-TTAGCGGCCGCATGGAAGCGTTTTGGGAGT-3' и 5'-CCCTTAATTAATTCAAAGCCACTGATCATGTG-3', включающих в себя сайты рестрикции для NotI и PacI, соответственно. Наличие и точность вставки в векторе определяли с помощью рестрикции и итоговым секвенированием (Евроген, Россия).
Трансфекцию клеток линии HEK293 проводили с помощью реагента TurboFect (Thermo, США), согласно рекомендациям фирмы изготовителя, одновременно вводя плазмиды, необходимые для сборки вирусной частицы, и ретровирусную плазмиду pQCXIP, кодирующую mPSMB4-HTBH. Через 24 ч после постановки трансфекции производили замену трансфекционной среды на новую. Культуральную среду клеток, содержащую вирусные частицы, собирали в течение последующих 2 сут, центрифугировали для удаления клеток и клеточных обломков и пропускали через фильтр 0.45 нм (Jet BioFil, Китай).
Инфекцию клеток линии L1210 ретровирусами, содержащими mPSMB4-HTBH, проводили согласно протоколу фирмы изготовителя (Clontech Laboratores, США). Через 16 ч после инфицирования производили замену трансдукционной среды на новую, содержащую антибиотик пуромицин в концентрации 5 мкг/мл (Invitrogen,США). Селекцию клеток проводили в течение 7 сут.
Выделение 20S-протеасом проводили в соответствии с методикой, модифицированной из двух, описанных ранее (Leggett et al., 2005; Wang et al., 2007). Клеточный экстракт готовили из клеток L1210, экспрессирующих меченый аффинным полипептидом белок β7-HTBH. Клетки промывали холодным PBS и лизировали в буфере А (50 мМ Na-фосфат, pH 7.5, 100 мМ NaCl, 10% глицерин, 5 мМ АТP, 1 мМ DTT, 5 мМ MgCl2, 0.5% NP-40, ингибиторы протеаз) в течение 30 мин при 4°С. Клеточные фрагменты удаляли центрифугированием при 13 тыс. об/мин в течение 30 мин при 4°С. К клеточному экстракту добавляли стрептавидин-агарозу, уравновешенную буфером А, и инкубировали в течение ночи при 4°С при постоянном перемешивании. Далее белки в комплексе со стрептавидин-агарозой осаждали центрифугированием и промывали последовательно 20 объемами буфера А, 10 объемами буфера ТЕВ (50 мМ Tрис-HCl, pH 7.5, 10% глицерин), 10 объемами буфера I (50 мМ Tрис-HCl, pH 7.5, 1 мМ EDTA, 1 мМ ATP) в присутствии 100 мМ NaCl, 5 объемами буфера I с 500 мM NaCl, инкубировали в этом же буфере в течение 1 ч при 4°С при постоянном перемешивании, после чего промывали 50 объемами этого буфера. Следующим этапом 20S-протеасомы элюировали со стрептавидин-агарозы двумя объемами буфера ТЕВ в присутствии 0.1% ТЕV-протеазы в течение 1 ч при температуре 30°С и концентрировали с применением центрифужных фильтров Amicon Ultra-0.5 (100К, Millipore, США). Концентрацию белка в пробах определяли в соответствии с классическим методом Брэдфорд (Bradford, 1976).
Вестерн-блот анализ белков проводили по стандартной методике. Белки фракционировали в денатурирующем 13%-ном ПААГ. Полученные фракции электрофоретически переносили на PVDF фильтры (BioRad Laboratories, США) в буфере, содержащем 25 мM Трис HCl, 190 мM глицин, 0.05% SDS, 10% метанола, pH 7.3. Мембрану отмывали в буфере РBS и блокировали центры неспецифического связывания антител 5%-ным обезжиренным молоком или 2.5%-ным БСА в этом же буфере. Избыток блокирующего агента отмывали буфером PBS, и мембрану инкубировали c первичными антителами против биотина, конъюгированными с пероксидазой хрена (1 : 2500, #7727, Cell Signaling, США). Белки, связавшиеся с антителами, выявляли с помощью метода усиленной хемилюминесценции SuperSignal (Thermo, США). Для этого на мембрану наносили раствор ECL и, далее, регистрировали хемилюминесцентное излучение с помощью системы гель-документирования ChemiDoc Touch Imaging System (Bio-Rad, США).
Определение пептидазной активности протеасом химотрипсин-подобного типа проводили по гидролизу флуорогенного пептида Suc-Leu-Leu-Val-Tyr-AMC (Enzo, США). Для этого 0.4 мM субстрат инкубировали с 1 мкг протеасом в течение 60 мин при температуре 37°С в буферном растворе, содержащем 50 мМ Трис-HCl, pH 7.5, 1 мМ MgCl2, 10 мМ KCl, 1 мМ DTT, 5 мМ ATP. Концентрацию продукта гидролиза AMC определяли каждые 5 мин на флуориметре FLUOstar Omega (BMG Labtech, США), измеряя экстинкцию и эмиссию при длинах волн 365 и 440 нм соответственно (Barrett, 1980).
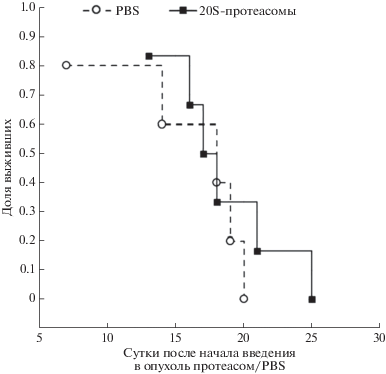
Исследование противоопухолевой активности 20S-протеасом in vivo проводили на мышах линии C57BL/6, полученных из питомника “Рапполово” РАМН, с перевивной меланомой B16/F10. Для этого начиная с 7-х сут от момента подкожной имплантации клеток B16/F10 до гибели животных производили введение 20S-протеасом в область инокуляции опухолевых клеток. Были выбраны две группы сравнения (n = 6 в каждой группе): (1) группа плацебо – введение PBS каждые 3 сут и (2) введение 20S-протеасом каждые 3 сут (12.5 мкг растворенного в PBS белка на 1 инъекцию).
Использованные реактивы. В работе использовали среду DMEM, RPMI-1640, глутамин, пенициллин/стрептомицин, трипсин, PBS (Биолот, Россия); сыворотка плодов коров, (Gibco, США); кумасси G-250 (Serva, Германия); Na-хлорацетат, метанол, этанол, соляную и уксусную кислоты, глицерин, KCl, NaOH, ферменты ДНК-рестрикции (Россия); акриламид, дитиотрейтол, трис, глицин, додецилсульфат натрия, персульфат аммония, NaCl, метилен-бис-акриламид, ЭДТА, фенилметилсульфонилфторид, ТЕМЕД, Tween-20, NP-40 (Amresco, США); обезжиренное молоко (Sigma, США); козьи антитела против иммуноглобулинов кролика конъюгированные с пероксидазой хрена (Jackson Immunoresearch, США); набор SuperSignal, реагент TurboFect, маркеры молекулярных весов, рестриктазы, TEV-протеаза, стептавидин-агароза (Thermo, США); антитела против биотина (Cell Signaling, СА).
РЕЗУЛЬТАТЫ
Для изучения роли протеасом во внеклеточном пространстве мы исследовали эффект введения в опухоль дополнительного (экзогенного) пула очищенных из клеток 20S-протеасом in vivo. Для очистки 20S-протеасом из клеток мыши линии L1210 β7-субъединица 20S-протеасомного комплекса была помечена на С-конце пептидом HTBH (Guerrero et al., 2006; Wang et al., 2007) (рис. 1а). Ранее мы показали, что экспрессия в клетках человека линии К562 протеасомного белка β7, удлиненного на С-конце таким пептидом, позволяет быстро выделять функционально активные 26S- и 20S-протеасомы с высокой степенью очистки (Артамонова и др., 2014; Kulichkova et al., 2017). В данной работе мы клонировали в вектор pQCXIP последовательность гена β7-субъединицы мыши, чтобы избежать иммуногенности при введении очищенных протеасом мышам.
Рис. 1.
Аффинная очистка протеасом из клеток L1210, стабильно экспрессирующих меченный белок β7-HTBH. (а) – Схема получения плазмидной конструкции pQCXIP-β7-HTBH на основе вектора pQCXIP (Clontech, #631 516), в который по сайтам NotI и PacI была ранее вставлена последовательность hPSMD14, а по сайтам PacI и EcoRI – последовательность HTBH, содержащая последовательности His6 (H), сайт расщепления TEV-протеазой (Т) и сигнальную последовательность для биотинилирования in vivo (B) (по Wang et al., 2007). (б) – Вестерн-блот анализ разделенных в системе денатурирующего электрофореза белков клеточного экстракта клеток человека К562, экспрессирующих субъединицу протеасом β7-HTBH, и клеток мыши L1210, контрольных и экспрессирующих субъединицу протеасом β7-HTBH. (в) – Электрофоретичекое разделение белков 20S- и 26S-протеасом (20S и 26S соответственно), аффинно очищенных из клеток L1210, стабильно экспрессирующих меченый белок β7-HTBH. Денатурирующий электрофорез в 13%-ном ПААГ 10 мкг очищенных протеасом. Расположение белков 19S-регулятора и 20S-протеасом указаны справа. (г) – Анализ химотрипсин-подобной пептидазной активности 20S- и 26S-протеасом, очищенных из клеток мыши L1210, экспрессирующих субъединицу протеасом β7-HTBH. Для контроля за специфичностью протеасомной активности в реакцию добавлен ингибитор протеасомной активности MG132 в количестве 1 мкМ. Представлены средние значения и стандартные отклонения трех независимых определений флуоресценции освобожденного AMC (100 ед. флуоресценции соответствует освобождению 50 пмоль продукта; концентрация протеасом в пробах составляет 0.5 мкг). Серый столбец (ПС) – пептидазная активность протеасомы, черный столбец (+MG132) – пептидазная активность протеасомы после добавления протеасомного ингибитора MG132.
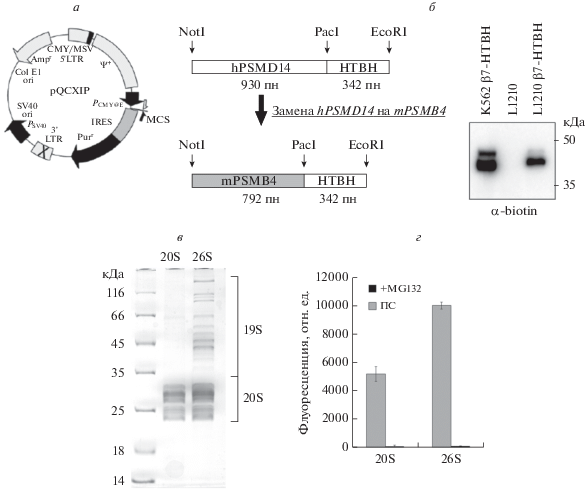
Мы использовали вирусный способ доставки конструкции в клетки, поскольку временные трансфекции приводят к сверхэкспрессии исследуемого гена лишь в течение недолгого промежутка времени (до 72 ч), и для выделения протеасом в большом количестве это не слишком удобно. Мы трансфецировали клетки линии HEK293 вектором pQCXIP-mPSMB4-HTBH, а также плазмидами, необходимыми для сборки вирусов. Через 2 сут после трансфекции собранные вирусы, несущие нашу конструкцию, были добавлены к клеткам мыши линии L1210, из которых после 7 сут селекции при концентрации пуромицина 5 мкг/мл, была получена стабильная клеточная линия. Экспрессию меченого белка β7-HTBH в прошедшей селекцию клеточной линии мыши проверили с помощью вестерн-блотинга с антителами к аффинному тэгу (рис. 1б). Следующим этапом стал анализ возможности очистки 26S- и 20S-протеасом за счет аффинного связывания стрептавидина c биотинилированным участком пептида HTBH. Картина распределения протеасомных белков в системе электрофореза в присутствии SDS показана на рис. 1в и аналогична представленной ранее (Kulichkova et al., 2017). Чтобы показать, что очищаемые нами 26S- и 20S-протеасомы сохраняют свою интактность, мы определили химотрипсин-подобную пептидазную активность по гидролизу флуорогенного пептида, специфического для этого каталитического центра протеасомы (рис. 1г). В качестве контроля за специфичностью пептидазной активности мы использовали протеасомный ингибитор MG132.
Ранее мы показали отсутствие цитотоксического эффекта в присутствии экзогенного пула 20S-протеасом в среде культивирования клеток (Diakonov et al., 2019). Мы добавляли очищенные 20S-протеасомы к клеткам и анализировали их влияние на клеточную морфологию, на жизнеспособность клеток и на распределение клеток по клеточному циклу. Кроме того, мы показали, что очищенные 20S-протеасомы стабильно сохраняются в среде культивирования клеток в течение 16 ч и не обладают пенетративной активностью по отношению к клеткам-реципиентам. Таким образом, мы ожидаем, что внутриопухолевое введение экзогенных 20S-протеасом не будет оказывать токсический эффект ни на опухолевые клетки, ни на клетки микроокружения опухоли, однако мы сможем оценивать эффект их повышенного присутствия во внеклеточном пространстве внутри опухоли на выживаемость экспериментальных животных.
Следующий этап работы был проведен на мышах линии С57Bl/6 с использованием культуры клеток меланомы В16. Мышей C57Bl/6, привитых подкожно 2 млн перевитых клеток B16/F10, разделили на две группы, которые обрабатывали различными способами, начиная с 7 сут после инокуляции опухолевых клеток. Животным в группе 1 вводили в область инокуляции опухолевых клеток PBS (группа плацебо, n = 6), животным группы 2 (n = 6) вводили в область инокуляции опухолевых клеток очищенные из клеток L1210 20S-протеасомы (12.5 мкг белка на 1 инъекцию). Инъекции повторяли через каждые три дня до смерти последнего животного. Кривые выживаемости мы оценивали по методу Каплана и Мейера (рис. 2). Как мы и ожидали, внутриопухолевое введение 20S-протеасом привело пусть к небольшому (чуть меньше 20%), но увеличению длительности жизни экспериментальных животных. Гибель мышей в контрольной группе 1 произошла в течение 15.6 ± 5.3 сут, тогда как в группе 2, получавших 20S-протеасомы, смерть животных была отложена до 18.3 ± 4.2 сут.
ОБСУЖДЕНИЕ
Вопрос о роли протеасом во внеклеточном пространстве связан с вопросом об их транспорте из клеток. Большое число исследований указывают на то, что повышенный уровень внеклеточных протеасом часто сопряжен с патофизиологическим состоянием быстро пролиферирующих клеток и опухолевой ткани (Wada et al., 1993; Egerer et al., 2002; Jakob et al., 2007; Ma et al., 2008). Стоит заметить, что поскольку убиквитин-протеасомная система является одним из основных регуляторов пролиферации клеток (Reed, 2006), повышенный уровень протеасом наблюдается в различных линиях раковых клеток (Kumatori et al., 1990; Bhui-Kaur et al., 1998). В связи с этим предполагалось, что повышенный уровень внеклеточных протеасом может быть связан с их секрецией опухолевыми клетками или высвобождением протеасом из разрушающихся опухолевых клеток (Wada et al., 1993). Однако если опухолевые клетки погибают не по пути апоптоза, а, например в результате механического разрушения из-за их большого размера, некроза клеток или цитолиза, вызванного Т-клетками или макрофагами, все виды клеточных компонентов могут высвобождаться во внеклеточное пространство, в том числе и 26S-протеасомы. Если допустить тот факт, что в условиях низкого уровня АТФ во внеклеточном пространстве 26S-комплекс диссоциирует на 19S- и 20S-комплексы, мы все равно фиксировали бы во внеклеточном пространстве белки 19S-регулятора. Однако популяция протеасом во внеклеточном пространстве представлена активными 20S-комплексами (Zoeger et al., 2006; Kulichkova et al., 2017; Tsimokha et al., 2017). Таким образом, быстрая пролиферация и цитолиз опухолевых клеток не могут быть единственным источником внеклеточных протеасом, поскольку у пациентов с доброкачественными заболеваниями печени также наблюдается повышенное количество протеасом в крови (Wada et al., 1993). Частое послеоперационное повышение протеасом в крови и в альвеолярном пространстве тоже указывает на то, что источником внеклеточных протеасом являются поврежденные клетки (Egerer et al., 2002), однако в отдельных случаях после хирургического вмешательства не было замечено повышения концентрации внеклеточных протеасом (Roth et al., 2005). С другой стороны, заметно повышенный уровень протеасом был зафиксирован в крови пациентов, страдающих от сепсиса, тяжелых травм, сильных ожогов, острого перитонита (Matuszczak et al., 2015, 2018a, 2018b; Roth et al., 2005), что позволяет сделать вывод, что как раз иммунологическая активность или иммунный ответ является причиной раннего повышения уровня внеклеточных протеасом. Это согласуется с данными, что у пациентов c аутоиммунными заболеваниями также был обнаружен повышенный уровень внеклеточных протеасом (Egerer et al., 2002). Однако остается вопрос, чем обусловлен повышенный уровень секреции протеасом раковыми клетками в культуре по сравнению с нормальными клетками (Kulichkova et al., 2017). Возможно, что именно повышенный уровень секреторной активности раковых клеток и приводит к необходимости повысить уровень протеасом во внеклеточном пространстве, чтобы своевременно удалять накапливающиеся там белки или производить процессинг антигенов или сигнальных молекул. В защиту этой гипотезы свидетельствует, например, процессинг 20S-протеасомой секретируемого остеопонтина, который играет ключевую роль при некоторых патологиях, включая рак и аутоимунные заболевания (Dianzani et al., 2017). Внеклеточные протеасомы в результате процессинга отщепляют от С-конца остеопонтина пептид, обладающий высокой хемотаксической активностью. В случае рассеянного склероза цепь внеклеточная протеасома–остеопонтин рассматривают как часть воспалительного механизма, регулирующего чередование фаз рецидива/ремиссии. При этом предполагается сложное взаимодействие между изоформами внеклеточных протеасом и остеопонтином и рассматривается возможность его потенциального клинического применения (Dianzani et al., 2019). Интересно также, что антиангиогенный и противоопухолевый белок эндостатин, способствующий уменьшению опухоли, является фрагментом молекулы коллагена XVIII, и его эндогенная продукция зависит от активности конкретного протеолитического фермента, идентифицированного как внеклеточная 20S-протеасома (Reiss-Pistilli et al., 2017). Таким образом, появление протеасом во внеклеточном пространстве, вероятно, вызвано необходимостью разрушения накапливающихся белков, активации секретируемых клеткой белков-предшественников и также процессинга антигенов, поэтому внутриопухолевое введение экзогенного пула 20S-протеасом пусть незначительно, но увеличивало продолжительность жизни животных. При этом важно отметить, что полученные результаты являются предварительными и необходимы дальнейшие исследования для изучения эффекта введения в опухоль дополнительного (экзогенного) пула очищенных из клеток 20S-протеасом in vivo.
Список литературы
Артамонова Т.О., Ходорковский М.А., Цимоха А.С. 2014. Масс-спектрометрический анализ аффинно-очищенных протеасом из клеток миелогенной лейкемии человека линии К562. Биоорганическая химия. Т. 40. № 6. С. 1. (Artamonova T.O., Khodorkovskii M.A., Tsimokha A.S. 2014. Mass spectrometric analysis of affinity-purified proteasomes from the human myelogenous leukemia K562 cell line. Russ. J. Bioorg. Chem. V. 40. № 6. P. 664.)
Albright J.M., Romero J., Saini V., Sixt S.U., Bird M.D., Kovacs E.J., Gamelli R.L., Peters J., Majetschak M. 2009. Proteasomes in human bronchoalveolar lavage fluid after burn and inhalation injury. J. Burn Care. Res. V. 30. P. 948.
Barrett A.J. 1980. Fluorimetric assays for cathepsin B and cathepsin H with methylcoumarylamide substrates. Biochem. J. V. 187. P. 909.
Bhui-Kaur A., Therwath A., Henry L., Chiesa J., Kurkure A., Scherrer K., Bureau J.P. 1998. Increased prosomal proteins in breast cancer cells and in neighboring normal cells in Parsi and non-Parsi populations. J. Cancer Res. Clin. Oncol. V. 124. P. 117.
Bradford M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. V. 72. P. 248.
Budenholzer L., Cheng C.L., Li Y., Hochstrasser M. 2017. Proteasome structure and assembly. J. Mol. Biol. V. 429. P. 3500.
de Martino M., Hoetzenecker K., Ankersmit H.J., Roth G.A., Haitel A., Waldert M., Klatte T. 2012. Serum 20S proteasome is elevated in patients with renal cell carcinoma and associated with poor prognosis. Br. J. Cancer. V. 106. P. 904.
Diakonov E.E., Selenina A.V., Tomilin A.N., Tsimokha A.S. 2019. Evidences against vesicle-dependent trafficking and involvement of extracellular proteasomes into cell-to-cell communications. Biochem. Biophys. Res. Commun. V. 508. P. 368.
Dianzani C., Bellavista E., Liepe J., Verderio C., Martucci M., Santoro A., Chiocchetti A., Gigliotti C.L., Boggio E., Ferrara B.J.S.r. 2017. Extracellular proteasome-osteopontin circuit regulates cell migration with implications in multiple sclerosis. Sci Rep. V. 7. P. 43718.
Dianzani C., Vecchio D., Clemente N., Chiocchetti A., Martinelli Boneschi F., Galimberti D., Dianzani U., Comi C., Mishto M., Liepe J.J.C. 2019. Untangling extracellular proteasome-osteopontin circuit dynamics in multiple sclerosis. Cells J. V. 8. P. 262.
Egerer K., Kuckelkorn U., Rudolph P.E., Ruckert J.C., Dorner T., Burmester G.R., Kloetzel P.M., Feist E. 2002. Circulating proteasomes are markers of cell damage and immunologic activity in autoimmune diseases. J. Rheumatol. V. 29. P. 2045.
Glickman M.H., Ciechanover A. 2002. The ubiquitin-proteasome proteolytic pathway: destruction for the sake of construction. Physiol. Rev. V. 82. P. 373.
Groll M., Ditzel L., Lowe J., Stock D., Bochtler M., Bartunik H.D., Huber R. 1997. Structure of 20S proteasome from yeast at 2.4 A resolution. Nature. V. 386. P. 463.
Guerrero C., Tagwerker C., Kaiser P., Huang L. 2006. An integrated mass spectrometry-based proteomic approach: quantitative analysis of tandem affinity-purified in vivo cross-linked protein complexes (QTAX) to decipher the 26 S proteasome-interacting network. Mol. Cell. Proteomics. V. 5. P. 366.
Henry L., Lavabre-Bertrand T., Vercambre L., Ramos J., Carillo S., Guiraud I., Pouderoux P., Bismuth M., Valats J.C., Demattei C., Duny Y., Chaze I., Funakoshi N., Bureau J.P., Daurès J.-P. 2009. Plasma proteasome level is a reliable early marker of malignant transformation of liver cirrhosis. Gut. V. 58. P. 833.
Heubner M., Wimberger P., Dahlmann B., Kasimir-Bauer S., Kimmig R., Peters J., Wohlschlaeger J., Sixt S.U. 2011. The prognostic impact of circulating proteasome concentrations in patients with epithelial ovarian cancer. Gynecol. Oncol. V. 120. P. 233.
Jakob C., Egerer K., Liebisch P., Turkmen S., Zavrski I., Kuckelkorn U., Heider U., Kaiser M., Fleissner C., Sterz J., Kleeberg L., Feist E., Burmester G.R., Kloetzel P.M., Sezer O. 2007. Circulating proteasome levels are an independent prognostic factor for survival in multiple myeloma. Blood. V. 109. P. 2100.
Konstantinova I.M., Tsimokha A.S., Mittenberg A.G. 2008. Role of proteasomes in cellular regulation. Int. Rev. Cell. Mol. Biol. V. 267. P. 59.
Kulichkova V.A., Artamonova T.O., Lyublinskaya O.G., Khodorkovskii M.A., Tomilin A.N., Tsimokha A.S. 2017. Proteomic analysis of affinity-purified extracellular proteasomes reveals exclusively 20S complexes. Oncotarget. V. 8. P. 102134.
Kumatori A., Tanaka K., Inamura N., Sone S., Ogura T., Matsumoto T., Tachikawa T., Shin S., Ichihara A. 1990. Abnormally high expression of proteasomes in human leukemic cells. Proc. Natl. Acad. Sci. USA. V. 87. P. 7071.
Lavabre-Bertrand T., Henry L., Carillo S., Guiraud I., Ouali A., Dutaud D., Aubry L., Rossi J.F., Bureau J.P. 2001. Plasma proteasome level is a potential marker in patients with solid tumors and hemopoietic malignancies. Cancer. V. 92. P. 2493.
Leggett D.S., Glickman M.H., Finley D. 2005. Purification of proteasomes, proteasome subcomplexes, and proteasome-associated proteins from budding yeast. Methods. Mol. Biol. V. 301. P. 57.
Ma W., Kantarjian H., O’Brien S., Jilani I., Zhang X., Estrov Z., Ferrajoli A., Keating M., Giles F., Albitar M. 2008. Enzymatic activity of circulating proteasomes correlates with clinical behavior in patients with chronic lymphocytic leukemia. Cancer. V. 112. P. 1306.
Matuszczak E., Sankiewicz A., Debek W., Gorodkiewicz E., Milewski R., Hermanowicz A.J. 2018a. Immunoproteasome in the blood plasma of children with acute appendicitis, and its correlation with proteasome and UCHL1 measured by SPR imaging biosensors. Clin. Exp. Immunol. V. 191. P. 125.
Matuszczak E., Tylicka M., Debek W., Hermanowicz A., Ostrowska H. 2015. The comparison of C-proteasome activity in the plasma of children after burn injury, mild head injury and blunt abdominal trauma. Adv. Med. Sci. V. 60. P. 253.
Matuszczak E., Weremijewicz A., Komarowska M., Sankiewicz A., Markowska D., Debek W., Gorodkiewicz E., Milewski R., Hermanowicz A.J. 2018b. Immunoproteasome in the plasma of pediatric patients with moderate and major burns, and its correlation with proteasome and UCHL1 measured by SPR imaging biosensors. J. Burn. Care Res. V. 39. P. 948.
Mueller O., Anlasik T., Wiedemann J., Thomassen J., Wohlschlaeger J., Hagel V., Keyvani K., Schwieger I., Dahlmann B., Sure U., Sixt S.U. 2012. Circulating extracellular proteasome in the cerebrospinal fluid: a study on concentration and proteolytic activity. J. Mol. Neurosci. V. 46. P. 509.
Reed S. I. 2006. The ubiquitin-proteasome pathway in cell cycle control. Results. Probl. Cell Differ. V. 42. P. 147.
Reiss-Pistilli M.L., Schuppan D., Barroso M.M., Assunção-Miranda I., Farias S., Lery L., Bauer M., Juliano L., Juliano M.A., Coelho-Sampaio T. 2017. An extracellular proteasome releases endostatin from human collagen XVIII. Angiogenesis. V. 20. P. 125.
Roth G.A., Moser B., Krenn C., Roth-Walter F., Hetz H., Richter S., Brunner M., Jensen-Jarolim E., Wolner E., Hoetzenecker K., Boltz-Nitulescu G., Ankersmit H.J. 2005. Heightened levels of circulating 20S proteasome in critically ill patients. Eur. J. Clin. Invest. V. 35. P. 399.
Sixt S.U., Adamzik M., Spyrka D., Saul B., Hakenbeck J., Wohlschlaeger J., Costabel U., Kloss A., Giesebrecht J., Dahlmann B., Peters J. 2009. Alveolar extracellular 20S proteasome in patients with acute respiratory distress syndrome. Am. J. Respir. Crit. Care. Med. V. 179. P. 1098.
Sixt S.U., Beiderlinden M., Jennissen H.P., Peters J. 2007. Extracellular proteasome in the human alveolar space: a new housekeeping enzyme? Am. J. Physiol. Lung Cell. Mol. Physiol. V. 292. P. 1280.
Sixt S.U., Dahlmann B. 2008. Extracellular, circulating proteasomes and ubiquitin – incidence and relevance. Biochim. Biophys. Acta. V. 1782. P. 817.
Sixt S.U., Peters J. 2010. Extracellular alveolar proteasome: possible role in lung injury and repair. Proc. Am. Thorac. Soc. V. 7. P. 91.
Stoebner P.E., Lavabre-Bertrand T., Henry L., Guiraud I., Carillo S., Dandurand M., Joujoux J.M., Bureau J.P., Meunier L. 2005. High plasma proteasome levels are detected in patients with metastatic malignant melanoma. Brit. J. Dermatol. V. 152. P. 948.
Sverchinsky D.V., Lazarev V.F., Semenyuk P.I., Mitkevich V.A., Guzhova I.V., Margulis B.A. 2017. Peptide fragments of Hsp70 modulate its chaperone activity and sensitize tumor cells to anti-cancer drugs. FEBS Lett. V. 591. P. 4074.
Tsimokha A.S., Zaykova J.J., Bottrill A., Barlev N.A. 2017. Extracellular proteasomes are deficient in 19S subunits as revealed by iTRAQ quantitative proteomics. J. Cell. Physiol. V. 232. P. 842.
Wada M., Kosaka M., Saito S., Sano T., Tanaka K., Ichihara A. 1993. Serum concentration and localization in tumor cells of proteasomes in patients with hematologic malignancy and their pathophysiologic significance. J. Lab. Clin. Med. V. 121. P. 215
Wang X., Chen C.F., Baker P.R., Chen P.L., Kaiser P., Huang L. 2007. Mass spectrometric characterization of the affinity-purified human 26S proteasome complex. Biochemistry. V. 46. P. 3553.
Zoeger A., Blau M., Egerer K., Feist E., Dahlmann B. 2006. Circulating proteasomes are functional and have a subtype pattern distinct from 20S proteasomes in major blood cells. Clin. Chem. V. 52. P. 2079.
Дополнительные материалы отсутствуют.