Цитология, 2020, T. 62, № 6, стр. 446-454
Кратковременное воздействие полиаллиламина на клетки китайского хомячка линии RJK с множественной лекарственной устойчивостью ведет к дестабилизации структуры их кариотипа
Т. М. Гринчук 1, *, М. А. Шилина 1, Л. Л. Алексеенко 1, В. П. Иванова 2
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт эволюционной физиологии и биохимии имени И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: grintat@bk.ru
Поступила в редакцию 02.03.2020
После доработки 18.03.2020
Принята к публикации 20.03.2020
Аннотация
Биологически активный полимер полиаллиламин (ПАА) используют для формирования микрокапсул, для адресной доставки лекарственных средств и формирования многослойных пленок, покрывающих биомедицинские имплантаты, чтобы обеспечить первичный контакт клеток с искусственной поверхностью при заживлении поврежденных тканей. Задача настоящего исследования заключалась в оценке влияние ПАА в сублетальной концентрации на структуру клеточного генома на уровне кариотипа. В качестве модельной системы были использованы трансформированные фибробласты легкого китайского хомячка CHL V-79 RJK (RJK), резистентные к бромистому этидию (RJKБЭ), вызывающему множественную лекарственную устойчивость (МЛУ). Анализ большого числа метафазных пластинок с применением G-бэндинга показал, что воздействие ПАА в высокой концентрации на клетки RJKБЭ приводит к разнонаправленной дестабилизации кариотипа, а именно к анеуплоидии и возникновению хромосомных аберраций и изменению длины гомогенно/дифференциально окрашенных областей (ГОО/ДОО). Эти изменения рассматриваются как морфологическое проявление МЛУ. Из полученных результатов следует, что использование синтетических биотранспортеров в медицинских целях требует тщательного предварительного изучения их токсичности, в том числе с использованием цитогенетических и молекулярных методов.
Разработка искусственных биополимерных носителей, способных выступать в роли переносчиков лекарственных препаратов в очаги поврежденных клеток, в том числе опухолевых и (или) инфицированных, а также в роли субстрата в заместительной терапии, является новым этапом в развитии клеточной и тканевой биотехнолигии (Nair et al., 2006; Vergaro et al., 2011; Insua et al., 2016). Успешное использование таких носителей в медицинской практике зависит от их эффективного взаимодействия с клетками-реципиентами или их макромолекулами. Биологические риски, ограничивающие широкое их использование в медицинской практике, определяются тем, насколько они биологически нейтральны, т.е. какова степень их токсичности. По некоторым данным полимерные носители, проникая внутрь клетки или взаимодействуя с белками внеклеточного матрикса, могут оказывать воздействие как на различные функции клеток, так и на структуру разнотипных клеточных элементов, включая ядро (Wang et al., 2012). К числу таких носителей относится биологически активный полимер полиаллиламин (ПАА). ПАА представляет собой водорастворимый биодеградируемый синтетический поликатион. Данный поликатион используют для формирования микрокапсул для доставки медицинских препаратов и многослойных пленок, покрывающих биомедицинские имплантаты, чтобы обеспечить первичный контакт клеток с искусственной поверхностью при заживлении поврежденных тканей (Wang et al., 2012; Martinez et al., 2016). Ограничением широкого использования ПАА в медицинских целях может стать его потенциальная токсичность, обусловленная наличием в структуре первичных аминогрупп (Boussif et al., 1999; Pathak et al., 2007; Moby et al., 2008; Martinez et al., 2011). Одним из наиболее широко используемых тестов на токсичность биополимеров является клеточная адгезия на синтетических носителях и жизнеспособность клеток, адгезированных на них.
Ранее на фибробластах китайского хомячка (линия RJK) было показано, что степень адгезии этих клеток на твердой поверхности, покрытой ПАА, усиливалась или ингибировалась в зависимости от его концентрации. Установлена зависимость адгезивных свойств клеток от концентрации, в которой ПАА находится в культуральной среде (Иванова и др., 2010). Концентрация ПАА, равная 100 мкг/мл для клеток RJK оказалась сублетальной. Половина клеточной популяции после обработки ПАА по результатам окраски клеток трипановым синим была не жизнеспособной. Использование МТТ-теста показало, что выжившие клетки имели низкую метаболическую активность (Иванова и др., 2010).
В многочисленных работах на клетках человека и грызунов с наследуемыми изменениями белков плазматической мембраны в результате селекции на устойчивость к некоторым цитостатикам, алкалоидам и антибиотикам показано, что резистентность к одному из агентов вызывает перекрестную устойчивость к другим ядам этой группы. Этот эффект в научной литературе рассматривается как множественная лекарственная устойчивость (МЛУ) (Липская и др. 1994). Установлено, что возникновение МЛУ в клетках обусловлено увеличением экспрессии трансмембранного Р-гликопротеина и достигается, как правило, в результате амплификации и сверхэкспрессии генов семейства mdr (Shen et al., 1986; Endicott, Ling, 1989; Juranka et al., 1989; Липская и др., 1994).
Существуют данные о том, что геном клеток с повреждением проницаемости клеточной мембраны в результате воздействия агентов группы МЛУ может претерпевать изменения, фиксируемые на уровне кариотипа (Kopnin et al., 1985; Гринчук и др.,1988, 1998; Demidova et al., 1991). Специфическим маркером клеток с МЛУ является наличие возникшего de novo дополнительного генетического материала в виде гомогенно-дифференциально окрашенных областей (ГОО/ДОО) на хромосомах и (или) мелких хроматиновых образований в виде микро-хромосом (МХ) в кариотипическом наборе или двойных мини-хромосом в цитоплазме (Kopnin et al., 1985; Sen et al., 1987; Гринчук и др., 1988, 1998; Bradley et al., 1989; Меликсетян и др., 1999; Demidova et al., 1991). В литературе данные образования трактуются как морфологические проявления амплификации генов. На клетках RJK это показано не только молекулярными методами, но и микрофлуориметрическим анализом, в основе которого лежит цитофлуориметрическое определение содержания ДНК в отдельных хромосомах кариотипического набора (Липская и др., 1994; Гринчук и др., 1986, 1996; Агафонова и др., 2013).
Анализируя свойства ПАА с целью использования данного поликатиона в составе биотранспортеров, мы поставили задачу экспериментально оценить воздействие высокой дозы ПАА на генетический аппарат клеток с МЛУ. В качестве модельной системы мы использовали трансформированные клетки фибробластов RJK, резистентные к агенту, вызывающему МЛУ – бромистому этидию (БЭ). Анализ большого числа метафазных пластинок с применением G-бэндинга позволил оценить влияние ПАА в высокой (сублетальной) концентрации на структуру клеточного генома RJK с МЛУ на уровне кариотипа.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Использованная в работе клеточная линия RJK, устойчивая к БЭ, была получена в Институте цитологии РАН (Санкт-Петербург) в результате последовательной селекции клеток на повышающую устойчивость к данному агенту (Воробьева, Игнатова, 1983). В настоящей работе были использованы клетки 2-ой ступени селекции, устойчивые к БЭ в концентрации 5 мкг/мл и сохраняющие это свойство в течение длительного времени (клетки RJKБЭ).
Культивирование. Клетки культивировали на среде ДМЕМ/F12 (Биолот, Россия), содержащей 10% эмбриональной телячьей сыворотки (Gibco, США), смесь пеницилина и стрептомицина (50 мкг/мл; Gibco, США), при стандартных условиях – в атмосфере 5% СО2 при температуре 37°С. Пересев осуществляли 2–3 раза в неделю с помощью 0.25%-ного раствора трипсина (Биолот, Россия).
Обработка клеток ПАА. Концентрация ПАА при обработке клеток составляла 100 мкг/мл. Поликатион ПАА добавляли в субмонослойную клеточную культуру. Время воздействия ПАА составляло 1.5 ч. Затем клетки дважды отмывали от поликатиона в растворе PBS (Sigma, США), добавляли полную культуральную среду и через 24 ч приготавливали препараты для кариотипирования.
Кариотипирование. В клеточную культуру во время логарифмической фазы роста для накопления клеток в стадии метафазы добавляли метастатик колхицин (Merck, США), в конечной концентрации 3.6 мкг/мл. Время действия КХ подбирали экспериментально. Через определенное время культуральную среду, содержашую колхицин, удаляли, а клетки открепляли от пластика ферментативно с помощью 0.25%-ного трипсина. Суспензию центрифугировали, осадок ресуспензировали, проводили гипотоническую обработку 0.56%-ным раствором КСl (Реахим, Россия) и фиксировали их на холоде смесью метанола с ледяной уксусной кислотой (3 : 1) (3 смены фиксатора, общее время фиксации 1.5 ч). Фиксированный материал раскапывали на охлажденные влажные предметные стекла. Препараты в течение 1 нед. высушивали при комнатной температуре, после чего метафазные пластинки окрашивали на G-диски красителем Гимза (BDH, Англия) в PBS после их предварительной трипсинизации (трипсин 0.25%; Биолот, Рроссия). Метафазные пластинки анализировали под световым микроскопом Ampleval (Zeiss, Германия) при увеличениях объектива 20× и 100×. Хромосомы идентифицировали в соответствии со стандартной номенклатурой (Ray, Mohandas, 1975). В каждом случае анализировали не менее 30 метафазных пластинок.
РЕЗУЛЬТАТЫ
Кариотип клеток RJK, устойчивых к БЭ (RJKБЭ), соответствовал кариотипу клеток исходной линии (чувствительной к БЭ) и был представлен наличием 4-х не перестроенных хромосом, типичных для клеток китайского хомячка в норме: двумя копиями хромосомы 2, одной копией хромосомы 3 и хромосомы 8, а также 15-тью маркерными хромосомами (Z1–Z15). Характерная особенность RJKБЭ, отличающая данные клетки от клеток исходной линии RJK, чувствительных к БЭ (Гринчук и др. 1988), выражалась в присутствии в кариотипическом наборе дополнительного генетического материала в виде областей ГОО/ДОО в двух хромосомах набора, являющихся производными китайского хомячка (хромосомы Z1 и Z6) (рис. 1). В хромосоме Z6 область ГОО/ДОО находилась в локусе 1q26 (Ray, Mohandas, 1975) по месту локализации гена МЛУ (mdr) дикого типа. Длина ДОО/ГОО в клетках в пределах популяции варьировала. Изменение длины ГОО/ДОО по отношению к общей длине хромосомы влияло на хромосомный индекс и топологию хромосомы, которую они маркировали (рис. 2). В этой связи в проанализированной клеточной популяции наряду с клетками, имеющими типичную топологию Z6 (короткое р-плечо > длинного q-плеча), которые преобладали (90%), присутствовали клетки (10%), в которых Z6 была равноплечей (р = q). Отклонения от нормы были связаны с хромосомными поломками и нарушением копийности. Отклонения носили случайный характер. Поломки хромосом были выявлены только в 2-х метафазных пластинках из 42 проанализированных (табл. 1А).
Рис. 1.
Кариотип клеток RJK, устойчивых к бромистому этидию (RJKБЭ), в стандартных условиях: n = 18 + МХ. Делеция p-плеча (del) хромосомы Z2, ДОО (дифференциально окрашенная область) в хромосоме Z6, хромосома Z15 отсутствует. Здесь и на рис. 3: MX – микрохромосома, n – число хромосом.
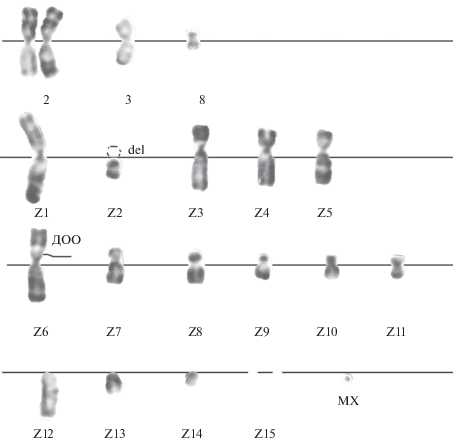
Рис. 2.
Структурные варианты хромосомы Z6 в клетках RJKБЭ в нормальных условиях культивирования и после обработки ПАА. A – хромосома Z6 стандартной морфологии, типичная для клеток исходной линии RJK; В–Е – варианты хромосомы Z6, маркирующие клетки RJK, устойчивые к БЭ (RJKБЭ). A–F – варианты хромосомы Z6, обнаруженные в клетках RJK-БЭ после обработки ПАА. A–D – короткое p-плечо меньше длинного q-плеча, E – p-плечо и q-плечо равны, F – p-плечо больше q-плеча.
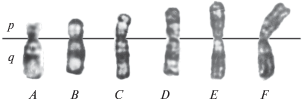
Таблица 1.
Кариотипические особенности клеток линии RJKБЭ в норме (А) и после воздействия ПАА (Б)
| А | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро, № п.п. | Кариотипические отклонения в клетках RJKБЭ | ||||||||||||||||
| Хромосома | |||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 2 | n | 2n | n | n | n | HSR | n | n | – | n | – | n | n | n | – | n | n |
| 3 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 4 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 5 | n | 2n | n | trpter | n | HSR | n | n | n | n | n | n | n | n | n | n | 2n |
| 6 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | – | n | n | 2n | 2n |
| 7 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 8 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 9 | n | n + n (trpter) | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 10 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 11 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 12 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 13 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 14 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 15 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 16 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 17 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | – | n |
| 18 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | – | n |
| 19 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 20 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 21 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 22 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 23 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 24 | n | 2n | n | n | n | n | n | n | n | n | n | n | – | n | n | 2n | n |
| 25 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | – | n | n |
| 26 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 27 | – | 2n | – | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 28 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | – | n | – | 2n |
| 29 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 30 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 31 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 32 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | – | n |
| 33 | n | 2n | n | n | n | n + HSR | n | n | n | n | n | n | n | n | – | n | n |
| 34 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | – | n | n | n | n |
| 35 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 36 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 37 | n | 2n | n | n | – | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 38 | n | 2n | n | n | n | HSR | n | 2n | n | n | 2n | n | n | n | n | n | n |
| 39 | n | 2n | n | n | n | HSR | n | n | n | n | n | – | n | n | n | n | n |
| 40 | n | 2n | n | n | n | HSR | n | n | n | n | n | 2n | n | n | – | n | 2n |
| 41 | n | 2n | – | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 42 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | – | n | n | n |
| Б | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро, № п.п. |
Хромосома в клетках RJKБЭ после воздействия ПАА | ||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | n + delq | n | 2n | HSR | n | n | – | 2n | n | – | n | 2n | n | n | n |
| 2 | n | n | n | n | n | HSR | n | n | n | 2n | n | – | 2n | n | – | n | n |
| 3 | n | 2n | n | n | n | HSR | n + delqter | n | n | n | – | n | n | – | n | n | – |
| 4 | n | n | n | delqter | n | HSR | n | n | n | – | n | n | n | n | n | n | – |
| 5 | n +delqter | 2n | n | – | n | HSR | n | n + delqter | – | 3n | – | n | n | n | n | 2n | n |
| 6 | n | 2n | delqter | n | n | HSR | n | n + delq | n | n | n | n | delp | n | – | n | n |
| 7 | n | 2n | n | n + delqter | n | HSR | n | n | n | n | n | n | n | – | n | n | – |
| 8 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | 2n | n | n | n |
| 9 | n | 2n | n + delq | 2n | 2n | HSR | n | n + delq | 2n | – | – | delp | – | n | n | n | – |
| 10 | n | 2n | – | n + delq | n | HSR | n | N | n | n | n | – | n + delq | n | n | n | n |
| 11 | n | 2n | n | – | – | HSR | 2n | n + delq | n | n | n | n | n | n | n | – | – |
| 12 | n | n | n | n | n | HSR | delp | n | – | – | n | n | delp | n | n | – | – |
| 13 | n | 2n | 3n | n | – | HSR | n | n | – | n | n | n | n | n | n | n | n |
| 14 | p + q | 2n | n | n + delq | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 15 | n | n +delq | n | n | n | n + HSR | n | delq | – | n | n | n | n | – | delp | n | n |
| 16 | n | n | n | n | n | HSR | n | n | n | n | n | n | n | – | n | n | n |
| 17 | delpter | 2n | n | n | n | HSR | p + q | n + delq | n | n | n | n | – | n | delp | n | – |
| 18 | n | n | n + delq | n + delq | n | HSR | n | – | n | n | n | n | n | 2n | n | – | – |
| 19 | n | 2n | n | n | n | HSR | n + delq | n | n | 2n | n | n | n | n | n | n | n |
| 20 | – | 2n | n | n | n | HSR | n | n | n | – | n | n | n | n | n | n | n |
| 22 | n | 2n | n | n | n | HSR | n | n + delq | n | n | n | n | n | n | n | n | n |
| 23 | n | 3n | n | N | n | HSR | n | n | n | n | n | n | delp | n | – | n | – |
| 24 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | n |
| 25 | n + (p + q) | 2n + delpter | 2n | 2n | 2n | 2HSR | 2n | 2n | n | n | n | n | n | 2n | n | – | – |
| 26 | n | 2n | n | n + delp | n | HSR | n | n | 2n | n | n | – | – | n | n | – | – |
| 27 | n | 2n | n | n + delq | n | HSR | n + delq | n + delq | n | n | n | n | n | n | n | – | – |
| 28 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 29 | n | 2n | n | – | n | n + HSR | n | n + delq | n | n | n | – | – | – | – | n | – |
| 30 | 2n | n | n + qmed | n | n | HSR | delpter | n | n | n | n | n | n | n | n | n | n |
| 31 | n + (p + q) | 2n | – | n | n | HSR | n | n | n | n | n | – | n | n | n | n | n |
| 32 | n | 2n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
| 33 | n | 2n | qter | n | n | HSR | n | n | n | n | n | n | n | 2n | n | n | – |
| 34 | n | 2n | n | n | n | HSR | n | n + delq | n | n | n | – | n | 2n | – | n | n |
| 35 | n + (pter) | 3n | n | n | n | HSR | n | n | n | n | n | n | n | n | n | n | – |
Обозначения: n – нормальная хромосома; 2n и 3n – две и три копии нормальной хромосомы соответственно; (–) – отсутствие хромосомы; HSR – копия с дополнительным материалом в виде ГОО/ДОО; (n + HSR) – 1 нормальная копия хромосомы плюс 1 копия с ГОО/ДОО; (n + delq) – 1 нормальная копия плюс 1 копия с делецией q-плеча; (n + delqter) – 1 нормальная копия плюс 1 копия с терминальной делецией q-плеча; (p + q) – прицентромерная поломка с сохранением материала; trpter – терминальная транслокация в p- плече; delp – делеция p-плеча; delq – делеция q-плеча; (n + (p + q)) – 1 нормальная копия и 1 копия с прицентромерной поломкой; qter – терминальная поломка в q-плече с сохранением материала; (n + (pter)) – 1 нормальная копия и 1 копия с терминальной поломкой в p-плече с сохранением материала; (n + qmed) – 1 нормальная копия и 1 копия с медиальной поломкой в q-плече с сохранением материала.
Клетки RJKБЭ, обработанные ПАА, по составу хромосом не отличались от клеток, не обработанных данным поликатионом. Анализируемая клеточная популяция характеризовалась вспышкой кариотипической нестабильности, связанной с хромосомными поломками и анеуплоидизацией (рис. 3а, б). Число копий той или другой хромосомы в пределах кариотипа могло варьировать от 0 до 3. Хромосомные поломки были выявлены в 26 клетках из 35 проанализированных. Повышенной морфологической нестабильностью характеризовались хромосомы 2, 3, Z1, Z3, Z4, Z5 и Z11 (табл. 1Б). Существенно, что из 35 проанализированных метафазных пластинок только одна имела нормальный кариотип. Остальные характеризовались теми или иными кариотипическими дефектами. Помимо этого, увеличилось число клеток с более длинными ГОО/ДОО. При этом уменьшилось число клеток, где р-плечо было меньше q-плеча и увеличилось число клеток, где р-плечо и q-плечо были равными. На этом фоне появились клеточные варианты, где за счет увеличения длины ГОО в хромосоме Z6 р-плечо стало больше q-плеча (рис. 3). Несмотря на повышенную нестабильность, модальный класс числа хромосом RJKБЭ после обработки ПАА был явно выражен и варьировал в диапазоне, близком модальному классу клеток, не обработанных ПАА (табл. 1).
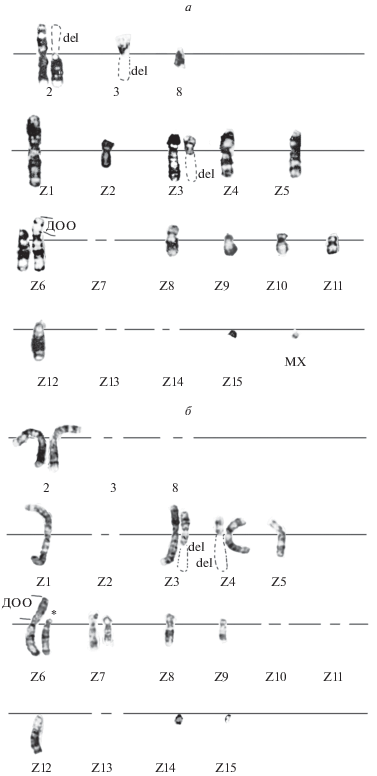
Рис. 3.
Кариотипы клеток линии RJK, устойчивых к БЭ (RJKБЭ), после обработки ПАА: n = 18 + МХ (а) и n = 17 (б). а – Делеции (del): в p-плече хромосомы 2, в q-плечах хромосом 3 и Z3; хромосомы Z7, Z13, Z14 отсутствуют; ДОО в хромосоме Z6. б – Делеции (del): в q-плече хромосом Z3 и Z4; хромосомы 3, 8, Z2, Z10, Z11, Z13 отсутствуют; ДОО в хромосоме Z6; Z6* – хромосома со стандартной морфологией, типичной для клеток исходной линии RJK.
Полученные данные позволили заключить, что воздействие ПАА на клетки китайского хомячка линии RJK-БЭ приводит к изменению их генетического статуса, значительно изменяя степень стабильности генетического аппарата на уровне кариотипа.
ОБСУЖДЕНИЕ
Использование биополимерных носителей для доставки лекарственных препаратов – новая область в терапии многочисленных заболеваний человека, в том числе онкологических. В связи с тем, что в процессе лечения основного заболевания у пациента может возникнуть МЛУ, необходимо знать, насколько используемые биополимерные транспортеры биологически нейтральны и не оказывают ли они самостоятельного токсического действия на геном клеток реципиента с МЛУ. В настоящей работе для получения представления о возможном влиянии ПАА на генетический аппарат клеток с МЛУ мы сравнили стабильность кариотипа трансформированных клеток линии RJK, обработанных и не обработанных ПАА в сублетальной концентрации. На основании полученных данных сделан вывод, что воздействие поликатиона ПАА в высокой концентрации на клетки RJKБЭ приводит к разнонаправленной дестабилизации кариотипа, а именно, к анеуплоидии и возникновению изменений морфологии хромосом.
Анеуплоидия – это один из важнейших факторов в эволюционных преобразованиях генома. Известно, что возникновение анеуплоидии связано с нарушением механизма клеточного деления, приводящего к неправильному расхождению хромосом в митозе. Сбой в программе клеточного деления может быть, как спонтанным, так и индуцированным. Сила воздействия того или иного стресс-фактора на клетку тоже может быть разной (Wang et al., 2013).
Обсуждая причины возникновения повышенной анеуплоидии в клетках RJKБЭ после обработки ПАА можно с огромной долей вероятности говорить о том, что это связано с высокой токсичностью тестируемого препарата. Нарушение регулярности и скорости расхождения хромосом при этом может сопровождаться возникновением хромосомных поломок. Возникновение хромосомных поломок при неправильном их расхождении может приводить к потере какой-то части бесцентромерного материала, или его перемещению в другие хромосомные локусы. Возникшие генетические дефекты приводят к изменению положения тех или иных генов и могут способствовать изменению уровня их экспрессии (Wang et al., 2013), что в определенных случаях может вести к усилению трансформированного фенотипа. В качестве другого фактора, способствующего усилению клеточной трансформации, можно рассматривать функциональные изменения в структуре генома, связанные с изменением экспрессии генов (Kellems, 1992; Липская и др., 1994; Гринчук и др., 1996).
В клетках RJK с приобретением устойчивости к БЭ было выявлено повышение экспрессии и амплификации гена mdr. На уровне кариотипа увеличение генной экспрессии для клеток с МЛУ связывают с появлением de novo дополнительного генетического материала в виде ГОО/ДОО на хромосомах (Sen et al., 1987; Bradlеy et al., 1989). Клетки RJK-БЭ также маркируются ГОО/ДОО (локус1q26) в месте локализации гена mdr дикого типа (Гринчук и др. 1993). Наличие амплификации и сверхэкспрессии гена mdr в данных клетках подтверждено методами молекулярного (Гринчук и др., 1993; Липская и др., 1994) и микрофлуориметрического анализа (Гринчук и др., 1986, 2007; Афгафонова и др., 2013). ГОО/ДОО при этом рассматриваются, как морфологические маркеры амплификации mdr.
По полученным в настоящей работе данным обработка ПАА клеток RJK-БЭ приводит к увеличению в популяции числа клеток с более длинными ГОО. Исходя из положения о том, что длина ГОО/ДОО (по крайней мере на первых этапах селекции) может отражать уровень устойчивости клеток к селективному агенту (Липская и др., 1994), данные об удлинении ГОО в клетках RJKБЭ после обработки ПАА позволили нам интерпретировать их как проявление усиления амплификации гена mdr в клетках, устойчивых к БЭ. Таким образом, в условиях эксперимента мы установили, что в популяции устойчивых к БЭ клеток, претерпевших обработку ПАА, наблюдается тенденция к увеличению длины ГОО в хромосоме Z6, рассматриваемой как морфологический маркер амплификации гена mdr. Полученные данные являются доказательством того, что клеточный геном под воздействием ПАА дестабилизируется и не только на структурном уровне, но и на функциональном.
Принимая во внимание полученные в настоящей работе данные, мы пришли к заключению, что к использованию биотранспортеров с ПАА в медицинских целях нужно подходить с осторожностью. Контакт клеток пациентов, имеющих в своем анамнезе МЛУ, с биотранспортерами, включающими ПАА, может спровоцировать усиление дестабилизации генетического аппарата клеток пациента с исходно нестабильным геномом. Усиление генетической нестабильности, в свою очередь, может способствовать прогрессии трансформированного генотипа опухолевых клеток.
Все сказанное выше позволяет заключить, что использование синтетических биотранспортеров в медицинских целях требует тщательного предварительного изучения их токсичности, в том числе с применением цитогенетических и молекулярных методов.
Список литературы
Агафонова Н.А, Сакута Г.А., Розанов Ю.М., Штейн Г.И., Кудрявцев Б.Н. 2013. Микрофлуориметрия содержания ДНК в индивидуальных хромосомах человека с помощью анализатора изображений. Цитология Т. 5. № 4. С. 338. (Agafonova N.A., Sakuta G.A., Rozanov Yu.M., Shtein G.I., Kudryavtsev B.N. 2013. Microfluorimetry of the DNA content in individual human chromosomes using an image analyzer. Tsitologiya V. 55. № 4. P. 338.)
Воробьева О.А., Игнатова Т.Н. 1983. Особенности признаков трансформированного фенотипа клеток китайского хомячка, устойчивых к бромистому этидию. В кн.: Всесоюзное совещание по генетике соматических клеток в культуре М. 90 С. (Vorobyova O.A., Ignatova T.N. 1983. Features of the signs of the transformed phenotype of Chinese hamster cells resistant to ethidium bromide. In the book: All-Union Conference on the Genetics of Somatic Cells in Culture M. P. 90.)
Гринчук Т.М., Игнатова Т.Н., Сорокина Е.А., Арцыбашева И.В., Паньшина Ю.Т. 1988. Хромосомный полиморфизм клеток млекопитающих с множественной лекарственной устойчивостью. Анализ кариотипа клеток китайского хомячка, устойчивых к бромистому этидию, на ранних пассажах первых ступеней селекции. Цитология. Т. 30. № 3. С. 312. (Grinchuk T.M., Ignatova T.N., Sorokina E.A., Artsybasheva I.V., Panshina Yu.T. 1988. Chromosomal polymorphism of multidrug-resistant mammalian cells. Analysis of the karyotype of Chinese hamster cells resistant to ethidium bromide in the early passages of the first stages of selection. Tsitologiya. V. 30. № 3. P. 312.)
Гринчук Т.М., Липская Л.А., Арцыбашева И.В., Сорокина Е.А., Паньшина Ю.Т., Игнатова Т.Н. 1996. Изменчивость кариотипа клеток китайского хомячка CHL V-79 RJK, характеризующихся множественной лекарственной устойчивостью, обусловленная амплификацией генов семейства mdr. Цитология. Т. 38. № 2. С. 161. (Grinchuk T.M., Lipskaya L.A., Artsybasheva I.V., Sorokina E.A., Panshina Yu.T., Ignatova T.N. 1996. The variability of the karyotype of Chinese hamster cells CHL V-79 RJK, characterized by multidrug resistance, due to the amplification of genes of the mdr family. Tsitologiya. V. 38. № 2. P. 161).
Гринчук Т.М., Липская Л.А., Васюхин В.И., Сорокина Е.А., Арцыбашева И.В., Игнатова Т.Н. 1993. Амплификация и сверхэкспрессия генов mdr в клетках китайского хомячка CHL V-79 RJK, устойчивых к бромистому этидию, сочетается с наличием кариотипических маркеров амплификации. Цитология. Т. 35. № 6/7. С. 86. (Grinchuk T.M., Lipskaya L.A., Vasyukhin V.I., Sorokina E.A., Artsybasheva I.V., Ignatova T.N. 1993. Amplification and overexpression of mdr genes in CHL V-79 RJK Chinese hamster cells resistant to ethidium bromide is combined with the presence of karyotypic amplification markers. Tsitologiya. V. 35. № 6/7. P. 86.)
Гринчук Т.М., Павленко М.А., Липская Л.А., Сорокина Е.А., Тарунина М.В., Березкина Е.В., Ковалева З.В., Игнатова Т.Н. 1998. Устойчивость к адриамицину клеток миелогенного лейкоза человека K562 коррелирует с направленной дестабилизацией генома – амплификация гена MDR 1 и неслучайными изменениями в структуре кариотипа. Цитология. Т. 40. № 7. С. 652. (Grinchuk T.M., Pavlenko M.A., Lipskaya L.A., Sorokina E.A., Tarunina M.V., Berezkina E.V., Kovaleva Z.V., Ignatova T.N. 1998. Adriamycin resistance of human myelogenous leukemia K562 cells correlates with targeted destabilization of the genome – amplification of the MDR 1 gene and nonrandom changes in the structure of the karyotype. Tsitologiya V.40. № 7. P. 652.)
Гринчук Т.М., Сухих Т.Р., Сорокина Е.А., Арцыбашева И.В., Паншина Ю.Т., Розанов Ю.М., Кудрявцев Б.Н., Игнатова Т.Н. 1986. Микрофлуориметрическая оценка содержания ДНК в отдельных хромосомах подтверждает цитогенетически детектируемую амплификацию ДНК в структурных вариантах хромосомы 1 клеток китайского хомяка со стабильной устойчивостью к множественным лекарственным препаратам. ДАН СССР. Т. 286. № 3. С. 712. (Grinchuk T.M., Sukhikh T.R., Sorokina E.A., Artsybasheva I.V., Panshina Yu.T., Rozanov Yu.M., Kudryavtsev B.N., Ignatova T.N. 1986. Microfluorimetric assessment of DNA content in individual chromosomes confirms the cytogenetically detectable amplification of DNA in structural variants of chromosome 1 of Chinese hamster cells with stable resistance to multiple drugs. DAN USSR. V. 286. № 3. P. 712.)
Гринчук Т.М., Ушал И.Е., Арцыбашева И.В., Павленко М.А., Кудрявцев Б.Н. 2007. Микрофлуориметрический анализ динамики изменений генома, сопровождающих амплификацию генов mdr в фибробластах китайского хомячка CHL V-79 RJK с множественной лекарственной устойчивостью. Цитология. Т. 49. № 12. С. 1011. (Grinchuk T.M., Ushal I.Ye., Artsybasheva I.V., Pavlenko M.A., Kudryavtsev B.N. 2007. Microfluorimetric analysis of the dynamics of genome changes accompanying amplification of mdr genes in Chinese hamster fibroblasts CHL V-79 RJK multidrug resistant. Tsitologiya V. 49. № 12. P. 1011.)
Иванова В.П., Гринчук Т.М., Алексеенко Л.Л., Арцыбашева И.В., Гаврилова И.И. 2010. Влияние синтетического поликатиона полиаллиламина на адгезию и жизнеспособность фибробластов китайского хомячка CHL V-79 RJK с разной степенью устойчивости к нагреву. Цитология. Т. 52. № 9. С. 729. (Ivanova V.P., Grinchuk T.M., Alekseenko L.L., Artsybasheva I.V., Gavrilova I.I. 2010. The effect of the synthetic polycation polyallylamine on the adhesion and viability of fibroblasts of the Chinese hamster CHL V-79 RJK with varying degrees of resistance to heat. Tsitologiya. V. 52. № 9. P. 729.)
Липская Л.Л., Ефимова Е.В.,Гринчук Т.М., Некрасова Т.П. Арцыбашева И.В., Ковалева З.В., Березкина Е.В., Васюхин В.И., Игнатова Т.Н. 1994. Амплификация генов семейства mdr в клетках грызунов, устойчивых к бромистому этидию. ДАН. Т. 338. № 4. С. 6541. (Lipskaya L.L., Efimova E.V., Grinchuk T.M., Nekrasova T.P. Artsybasheva I.V., Kovaleva Z.V., Berezkina E.V., Vasyukhin V.I., Ignatova T.N. 1994. Amplification of mdr family genes in rodent resistant ethidium bromide cells. RAS. V. 338. № 4. P. 6541.)
Мелексетян М.Б., Березкина Е.В., Павленко М.А., Гринчук Т.М. 1999. Исследование механизмов лекарственной устойчивости двух клеточных линий хронического промиелолейкоза человека линии K562, резистентных к ингибиторам ДНК-топоизомеразы II адриомицину и этопозиду. Цитология. Т. 41. № 7. С. 615. (Meleksetyan M.B., Berezkina E.V., Pavlenko M.A., Grinchuk T.M. 1999. Investigation of the mechanisms of drug resistance of two cell lines of chronic human promyeloleukemia of the K562 line, resistant to DNA topoisomerase II inhibitors adriomycin and etoposide. Tsitologiya. V. 41. № 7. P. 615.)
Boussif O., Delair T., Brua C., Veron L., Pavirani A., Kolbe H.V. 1999. Synthesis of polyallylamine derivatives and their use as gene transfer vectors in vitro. Bioconjug. Chem. V. 10. P. 877.
Bradley G., Neik M., Ling V. 1989. P-glycoprotein expression in multidrug-resistant human ovarian carcinoma cell lines. Cancer Res. V. 49. P. 2790.
Demidova N.S., Chernova O.V., Sianova E.Y., Goncharova A.S.,Kopnin B.P. 1991. Newly formd cromosoma-like structure in independent mouse P 388 sublines with developed in vitro mdr1 gene amplification. Somat. Cell Mol. Genet. V. 17. P. 581.
Endicott J.F., Ling V. 1989. The biochemistry of P-glycoprotein-mediated multidrug resistance. Annu. Rev. Biochem. V. 58. P. 137.
Insua I., Wilkinson A., Fernandez-Trillo F. 2016. Polyion complex (PIC) particles: Preparation and biomedical applications. Eur. Polymer. J. V. 81. P. 198.
Juranka P.F., Zaslawny R.L. Ling V. 1989. P-glycoprotein: multidrug- resistance and a superfamily of membrane-associated transport proteins. FASEB J. V. 3. P. 2583.
Kellems R.E. 1992. Gene amplification in mammalian cells. In: Gene amplification and cancer. Marcel Dekker, Inc. P. 371.
Kopnin B.P., Massino J.S., Gudkov A.V. 1985. Regula pattern of karyotypic study of colchicines, adriablastin and methotrexate resistance. Chromosoma. V. 95. P. 25.
Martinez J.S., Keller T.C.S., Schlenoff J.B. 2011. Cytotoxicity of free versus multilayered polyelectrolytes. Biomacromol. V. 12. P. 4063.
Martinez J.S., Schlenoff J.B., Keller T.C.S. 2016. Collective epithelial cell sheet adhesion and migration on polyelectrolyte multilayers with uniform and gradients of compliance. Exp. Cell Res. V. 346. P. 17.
Moby V., Kadi A., de Isla N., Stoltz J.F., Menu P. 2008. Polyelectrolyte multilayer films: effect of the initial anchoring layer on the cell growth. Biomed. Mater. Eng. V. 18. P. 199.
Nair L.S., Laurencin C.T. 2006. Polymers as biomaterials for tissue engineering and controlled drug delivery. Adv. Biochem. Eng. Biotechnol. V. 102. P. 47.
Pathak A., Aggarwal A., Kurupati R.K., Patnaik S., Swami A., Singh Y., Kumar P., Vyas S.P., Gupta K.C. 2007. Engineered polyallylamine nanoparticles for efficient in vitro transfection. Pharm. Res. V. 24. P. 1427.
Ray M., Mohandas T. 1975. Proposed banding nomenclature for the Chinese hamster chromosomes (Cricetulus gruseus). Cytogenet. Cell Genet. V. 16. P. 83.
Sen S., Teeter L., D., Kuo T. 1987. Specific gene amplification associated with consistent chromosomal abnormality in independently established multidrug-resistant Chinese hamster ovary cells. Chromosoma. V. 5. P. 117.
Shen D.W., Carderelli., Hwang J., Cornwell M., Richert N., Ishii S., Pastan I., Gottesnan M.M. 1986. Multiple drug-resistence human KB carcinoma cells independently selected for high-level resistance to colchicine, adriamycine or vinblastin show changes in expression of specific proteins. J. Biol. Chem. V. 261. P. 7762.
Vergaro V., Scarlino F., Bellomo C., Rinaldi R., Vergaro D., Maffia M., Baldassarre F., Giannelli G., Zhang X., Lvov Y.M., Leporatti S. 2011. Drug-loaded polyelectrolyte microcapsules for sustained targeting of cancer cells. Adv. Drug Delivery Rev. V. 63. P. 847.
Wang B., Zhang X., Mao Z., Gao C. 2012. Cellular uptake of covalent poly(allylamine hydrochloride) microcapsules and its influences on cell functions. Macromol. Biosci. V. 12. P. 1534.
Дополнительные материалы отсутствуют.


