Цитология, 2020, T. 62, № 7, стр. 503-510
Экспозиция фосфатидилсерина в клетках карциномы Льюис под действием анфена натрия и пероксида водорода
Е. М. Миль 1, *, В. И. Бинюков 1, В. Н. Ерохин 1, А. А. Албантова 1, А. А. Володькин 1, А. Н. Голощапов 1
1 Институт биохимической физики им. Н.М. Эмануэля РАН
119334 Москва, Россия
* E-mail: elenamil2004@mail.ru
Поступила в редакцию 27.03.2020
После доработки 08.04.2020
Принята к публикации 09.04.2020
Аннотация
Исследовано апоптотическое действие антиоксиданта анфена натрия, пространственно затрудненного фенола, который обладает противоопухолевой активностью, в частности, тормозит развитие опухолевых клеток саркомы 37. Обнаружено, что введение анфена натрия (10–4 М) в культуру клеток карциномы Льюис мышей уже через 1–1.5 ч приводило к экспозиции фосфатидилсерина и началу процесса апоптоза в клетках (по флуоресценции аннексина V-FITC). При совместном действии H2O2 (5 мкМ) и анфена натрия увеличивалась проницаемость клеток для акридинового оранжевого, а также возрастало до 80–100% число апоптотических клеток. При этом в опухолевых клетках наблюдали образование как единичных, так и многочисленных апоптотических телец внутри клетки. В этих же условиях в клетках селезенки (спленоцитах) здоровых мышей было обнаружено меньшее число апоптотических клеток (14–16%), вероятно, за счет действия только на клетки, готовые к апоптозу. Ранее нами было обнаружено действие анфена натрия на антиапоптотические белки семейства Bcl-2 и сделано предположение, что это соединение приводит к апоптозу митохондриальным путем. Поскольку H2O2 в низких концентрациях может выступать в качестве вторичного мессенджера и стимулировать внешний путь апоптоза, предполагается, что совместное действие H2O2 и анфена натрия приводит к усилению апоптоза за счет активации митохондриального и внешнего сигнального пути.
Известно, что при апоптозе – естественном процессе программируемой клеточной смерти, не возникает воспаления окружающих тканей. Процесс сопровождается конденсацией хроматина, уменьшением объема ядра и распадом его на отдельные части. Сама клетка фрагментируется на отдельные апоптотические тельца. В начале и во время апоптоза на внешней поверхности клеточной мембраны клетки экспонируется фосфатидилсерин, что стимулирует поглощение клеток фагоцитами (Czabotar et al., 2014; Shiratsuchi et al.,1998).
Как известно, апоптоз, необходимый для обновления и жизнедеятельности клеток, в опухолевой клетке подавлен. Этому способствуют мутации ряда белков, (таких, как общий регулятор, страж генома, белок р53), а также увеличение стабильности антиапоптотических белков (таких как Bcl-2). В ряде опухолей обнаружено увеличение содержания белков, разрушающих апоптосому и препятствующих действию каспаз (XIAP и AVEN), необходимых элементов апоптотического процесса (Liling et al., 2003).
Одной из стратегий противоопухолевой терапии является поиск препаратов и создание новых веществ направленного воздействия, в том числе вызывающиx запуск процесса апоптоза по митохондриальному пути. Пространственно затрудненный фенол – антиоксидант анфен натрия, синтезированный в Институте биохимической физики РАН (Москва), способен тормозить свободно-радикальное окисление и взаимодействовать с пероксидными радикалами в клетке. Он также обладаeт биологической и противоопухолевой активностью, в частности тормозит развитие опухоли при трансплантации мышам опухолевых клеток саркомы 37 (Ерохин др., 2007; Володькин и др., 2013).
Ранее нами было обнаружено, что в клетках карциномы Льюис препарат способен воздействовать на антиапоптотические белки семейства Bcl-2, снижая их содержание, что свидетельствовало о начале апоптоза по митохондриальному пути (Миль и др., 2017, 2018). В то же время пути, которые повышают стабильность раковых клеток, остаются недостаточно изученными. Поэтому мы экспериментально проверили возможность повышения эффективности действия фенольного антиоксиданта анфена натрия, который вызывает апоптоз клеток, при сочетанном воздействии препарата с пероксидом водорода (Н2О2) в низкой концентрации.
Современные методы позволяют наблюдать процессы, происходящие внутри клеток, с использованием флуорофоров, регистрируемых по флуоресценции. Использование акридинового оранжевого (АО) и бромида этидиума (БЭ) позволяют оценить доли живых, апоптотических и мертвых клеток. В то же время аннексин V, конъюгированный с FITC, специфически связываясь с фосфатидилсерином, экспонируемым на поверхность мембраны клеток, позволяет выявить клетки на ранних и поздних стадиях апоптоза.
В работе исследовано апоптотическое действия анфена натрия (10–4 М) в сочетании с Н2О2 (5 мкМ) на клетки карциномы Льюис, а также на нормальные клетки – спленоциты мышей в условиях культивирования. Н2О2 – это природное соединение, которое вырабатывается в клетке в результате окислительных процессов в органеллах клетки в очень низких концентрациях. В настоящее время обнаружено разнонаправленное действие Н2О2 в разных компартментах клетки. В то же время действие экзогенного Н2О2 зависит от его концентрации. Установлено, что в низких концентрациях (1–10 мкМ) это соединение действует в клетке как вторичный мессенджер, а при концентрациях от 100 до 500 мкМ вызывает окислительный стресс (Storozhevykh et al., 2007; Mueller et al., 2008; Ткачук и др., 2012; Hennquez-Olguin et al., 2019).
Учитывая эти свойства, в работе использовали малую концентрацию Н2О2. Можно было предполагать, что сочетание двух агентов (Н2О2 и анфена натрия) позволит стимулировать процесс апоптоза в опухолевых клетках.
МАТЕРИАЛ И МЕТОДИКА
Лабораторные животные. В работе были использованы мыши-гибриды первого поколения F1 (C57Bl 1/2 DBA) (возраст 3–4 мес., масса 25 г), полученных из питомника лабораторных животных “Пущино”. Животных содержали в соответствие с правилами, принятыми Европейской конвенцией по защите животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). В экспериментах с клетками селезенки использованы те же мыши. Мышей умерщвляли методом декапитации под эфирным наркозом.
Опухолевые клетки и экспериментальные опухоли. Клетки карциномы Льюис выделяли из опухоли на 14-е сутки после соответствующей трансплантации опухолевых клеток. Опухоль для получения суспензии клеток измельчали в физиологическом растворе, затем диспергировали многократным пропусканием суспензии клеток через фильеру диаметром 1 мм, далее фильтровали через нейлоновую сетку (100 мкм), осаждали центрифугированием при 150 g и ресуспендировали осадок для получения суспензии клеток. Ее затем вводили реципиентам по 0.2 мл в мышцу бедра задней лапы из расчета 7 × 106 клеток на одну мышь, либо использовали в экспериментах in vitro. Число клеток определяли в камере Горяева. Спленоциты из селезенки здоровых мышей выделяли аналогичным способом. При изучении действия исследуемых соединений на клетки опухоли или спленоциты, клетки переводиди в среду 199 на растворе Хенкса (Институт полиомиелита и вирусных энцефалитов РАН) путем 2-х кратного центрифугирования при 150 g и ресуспендирования осадка.
Клетки культивировали в среде 199 при 37°С в различных условиях: в контроле, в присутствии 10–4 М анфена, 5 мкМ Н2О2 и при одновременном присутствии 5 мкМ Н2О2 и анфена натрия (10–4 М). Через определенные промежутки времени (1–3 ч) к взятым аликвотам клеток добавляли флуорофоры для последующих измерений. Количество флуоресцирующих клеток (%) определяли по 20–30 микрофотографиям нескольких препаратов в световом и флуоресцентном режиме в одном поле зрения путем подсчета клеток, используя программу ImageJ. В контрольных клетках по флуоресценции БЭ было определено не более 3% мертвых и поврежденных клеток.
Анфен натрия (2-(карбокси)-2-(N-ацетиламино)-3-(3',5'-ди-трет-бутил-4'-гидроксифенил)-пропаната натрия) был синтезирован в Институте Химической физики РАН (Москва) в ряду других препаратов из класса пространственно затрудненных фенолов (Володькин и др., 2013). Они обладают антиоксидантными свойствами и действуют на многие биохимические мишени в клетке, в том числе на супероксиддисмутазу (SOD) и протеинкиназу С (Бурлакова и др., 1998; Ерохин и др., 2007).
Флуоресцентнная микроскопия. Для выяснения состояния клеток карциномы Льюис при их культивировании с исследуемыми соединениями использовали флуорофоры АО, БЭ, а также аннексин V-FITC. Для этого к взятым аликвотам культивируемых клеток вводили флуорофоры и инкубировали с ними в течение 5 мин. Препараты для флуоресцентной микроскопии готовили на предметном стекле. Наносили суспензию клеток объемом 20 мкл. Использовали покровное стекло. Количество клеток в поле зрения образца при увеличении объектива 40× было около 150. Далее образцы исследовали на флуоресцентном микроскопе.
Использовали лабораторный микроскоп Carl Zeiss Jena (Германия) дополнительно оборудованный оптическими системами возбуждения на диодных лазерах, фильтрации и регистрации на камеру (HD CCD). Использовали объективы с увеличением 40× или 100×, длину волны возбуждающего света 450 нм и фильтр, отсекающий возбуждающий свет. Флуорофор АО флуоресцирует в цитоплазме живых клеток, а БЭ позволяет регистрировать флуоресценцию апоптотических и мертвых клеток, связываясь с ДНК фрагментированных ядер и белками живых клеток. Флуоресценцию аннексина V, коньюгированного с красителем FITC, клеток селезенки регистрировали на конфокальном микроскопе Axio Observer Z1 Carl Zeiss Jena (Германия) при возбуждение 488 нм, используя объектив 100×. Образцы готовили на покровных стеклах. Количество клеток в поле зрения около 40.
Статистическая обработка. Использовали программу Statistica 6, определяли значения средних величин и 95%-ных доверительных интервалов. Для определения процентного содержания флуоресцирующих клеток в образцах делали выборку флуоресцирующих и всех клеток из 20–30 микрофотографий с помощью программы ImageJ.
Использованные реактивы и среды: эфир для наркоза (Медхимпром, Россия); бромид этидия (Amresco, США); акридиновый оранжевый (Scharlau, Испания); аннексин V-FITС (AnnexinV fitc/7AAD; Beckman Coulter Company USA:); фосфатно-солевой буферный раствор (pH 7.3–7.5) (Amresco, США); БСА (Sigma, США); HEPES (Biomedicals, Германия); среда 199 на растворе Хенкса (Институт полиомиелита и вирусных энцефалитов РАН, Москва), КCl (Serva, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для выяснения механизма действия противоопухолевого соединения анфена натрия было изучено влияние его и низких концентраций пероксида водорода, а также их совместного действия на культивируемые клетки карциномы Льюис.
Использование флуорофоров AO и БЭ позволило определить изменение состояния клеток при воздействии этих препаратов. Было обнаружено, что флуорофор БЭ в клетках карциномы Льюис вызывал несколько видов флуоресценции: зеленую (живые клетки), желтую или желто-оранжевую (апоптотические) и красную (некротические клетки). В контрольных образцах суспензии клеток обнаруживали около 3% мертвых клеток и этот низкий уровень оставался стабильным в течении эксперимента (1–3 ч). Это позволило проследить за изменением во времени доли живых и апоптотических клеток. Как видно из рис. 1 и 2, при действие анфена натрия число апоптотических клеток сначала увеличивалось (в течение 2 ч), а затем снижалось. Такое двоякое действие могло быть проявлением антиоксидантных свойств анфена натрия. Однако при совместном введении 5 мкМ Н2О2 и анфена натрия апоптотическое действие препаратов значительно усиливалось (число клеток с желтым и оранжевым свечением значительно увеличивалось), причем сам Н2О2 в концентрации 5 мкМ не вызывал такого действия (рис. 2 ).
Рис. 1.
Изменение количества апоптотических клеток карциномы Льюис (по флуоресценции БЭ в клетках) в зависимости от времени их культивирования с анфеном натрия (АН) в концентрации 10–4 М (кривая 1) и с 5 мкМ Н2О2 в сочетании с АН в той же концентрации (кривая 2). Даны средние значения и их 95%-ные доверительные интервалы.
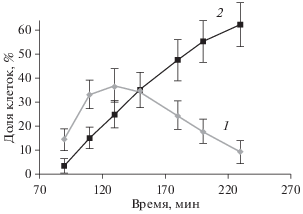
Рис. 2.
Микрофотографии флуоресцирующих клеток (окрашенных БЭ) карциномы Льюис после их культивирования (3 ч при 37°С) в контроле, в присутствии 5 мкМ Н2О2 и 10–4 М анфена натрия (АН) раздельно и совместно. Зеленое свечение – окраска белков БЭ, желтое и желто-оранжевое – БЭ в ДНК апоптотических клеток. Об.: 40×.
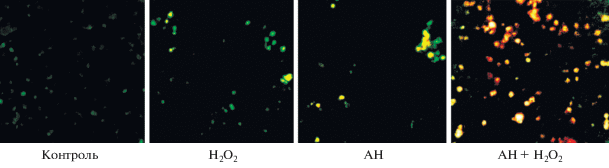
Действие пероксида водорода и его совместное действие с анфеном натрия было исследовано также с помощью красителя АО, который позволяет оценить состояние плазматической мембраны клеток. Обнаружено, что при культивировании клеток с Н2О2 (5 мкМ), а также Н2О2 (5 мкМ) совместно с анфеном натрия (10–4 М) через 1 ч происходило 2-кратное увеличение числа флуоресцирующих клеток. Это можно объяснить увеличением проницаемости мембраны клеток под действием малых концентраций Н2О2 или с действием иных механизмов, связанных с различными путями воздействия на клетку.
Усиление апоптотического эффекта при совместном действии анфена натрия и Н2О2 было обнаружено также с помощью флуорофора аннексина V-FITC по увеличению числа клеток, экспонирующих фосфатидилсерин (флуоресценция аннексин V-FITC указывает на появление фосфатидилсерина на поверхности клеток, свидетельствующее о начале процесса апоптоза).
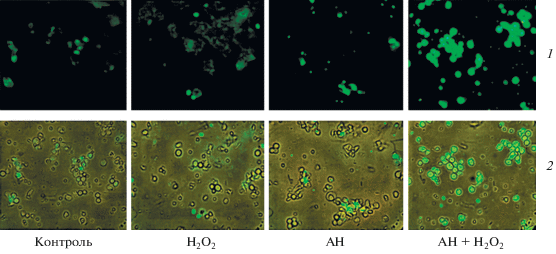
На рис. 3 видно, что после культивирования клеток в контроле и при действии Н2О2 обнаруживается незначительное количество апоптотических клеток. При действии анфена натрия количество апоптотических клеток составило 45–50%, а при совместном его действии с Н2О2 количество флуоресцирующих с аннексином V-FITС клеток достигало 90–100%. Эти данные совпадали с данными, полученными с использованием флуорофора БЭ (рис. 1 и 2 ), и подтверждают увеличение апоптоза при совместном введении этих соединений.
Рис. 3.
Флуоресценция аннексина V-FITС в клетках карциномы Льюис после их культивирования (3 ч при 37°С) в контроле, в присутствии 5 мкМ Н2О2 и 10–4 М анфена натрия (АН) раздельно и совместно (микрофотографии 1), а также совмещение флуоресцентного и светового изображений (микрофотографии 2). Об.: 40×.
При большем увеличении на флуоресцентном микроскопе через 3 ч культивирования клеток и воздействия этих соединений можно было наблюдать (по флуорисценции аннексина V-FITС) клетки (рис. 4), находящиеся на разных стадиях процесса апоптоза, а также изменение внутреннего строения клеток. Как видно на рис. 4 , в клетках карциномы Льюис обнаруживаются флуоресцирующие внутриклеточные образования. Вероятно, это апоптотические тельца, ограниченные мембранами с экспонированным фосфатидилсерином. Число апоптотических телец варьировало от единиц до нескольких десятков, также можно было наблюдать разрыв клеточной мембраны и выход телец во внеклеточное пространство.
Рис. 4.
Микрофотографии флуоресцирующих клеток карциномы Льюис после их культивирования (3 ч при 37°С) в присутствии 5 мкМ Н2О2 совместно с 10–4 М АН. Флуорофор: аннексин V-FITС. а – Совмещение флуоресцентного и светового изображений; об.: 100×. б – Последовательное образование апоптотических телец в опухолевой клетке (реконструкция из нескольких микрофотографий).

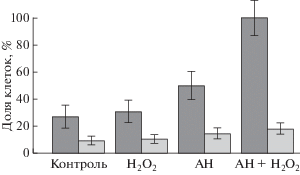
Далее в работе было изучено действие исследуемых соединений на нормальные клетки – спленоциты (преимущественно лимфоциты), выделенные из селезенки мышей и культивированные в аналогичных условиях (рис. 5). В контрольных спленоцитах количество апоптотических клеток было незначительным (до 5%). При действии анфена натрия на суспензию клеток селезенки оно составило 10–12%, а при совместном введении анфена натрия с Н2О2 – 14–16%. Можно предположить, что действие этих соединений на нормальные клетки вызывает апоптоз тех клеток, которые уже готовы к нему, и не затрагивает большинства здоровых клеток.
Рис. 5.
Диаграмма изменения количества флуоресцирующих клеток карциномы Льюис (темные столбцы) и спленоцитов здоровых мышей (светлые столбцы) после их культивирования (3 ч при 37°С) в контроле, в присутствии 5 мкМ Н2О2 и 10–4 М анфена натрия (АН) раздельно и совместно. Флуорофор: аннексин V-FITС. По данным флуоресцентной (клетки карциномы) и конфокальной (спленоциты) микроскопии. Даны средние значения и их 95%-ные доверительные интервалы.
Как известно, процесс апоптоза характеризуется сложными биохимическими реакциями, протекающими в клетке и в ядре. Ранее нами методом иммуноблотинга было показано, что анфен натрия в суспензии опухолевых клеток карциномы Льюис через 1–1.5 ч резко снижал содержание антиапоптотического белка Bcl-2, что могло приводить к запуску апоптоза по митохондриальному пути. Мы предположили, что анфен натрия непосредственно связывается с регуляторным доменом BH3 белка Bcl-2. (Миль и др., 2018).
Известно, что антиапоптотическая активность Всl-2 основана на его способности препятствовать образованию пор в митохондриях и олигомеризации белков апоптоза Bax/Bak, а также непосредственно связывать цитохром c и вытеснять его из апоптосомы, предотвращая тем самым активацию каспаз (Laudanski et al., 2001).
При этом происходит процесс фрагментации ядра, образование апоптотических телец, число которых увеличивается, что приводит к разрыву мембраны клеток и высвобождению апоптотических телец во внеклеточное пространство, что наблюдалось при действии Н2О2 и анфена натрия (рис. 4б). Следует отметить, что начало апоптоза клеток после воздействия анфена, выявленное с помощью флуорофоров, совпадает по времени с обнаруженным ранее методом иммуноблотинга резким снижением содержания антиапоптотического белка Bcl-2 (димера и мономера), что говорит о начале апоптоза по митохондриальному пути.
Эффект усиления апоптотического действия при действии анфена натрия и Н2О2 в низкой концентрации требует дальнейшего изучения. По-видимому, этот эффект может быть связан с воздействием на разные сигнальные молекулярные пути идущие в клетке.
Так, ранее было обнаружено, что в клетках рака легкого, обработанных экзогенным Н2О2 (50–100 мкМ) для образования окислительного стресса, наблюдаются картины апоптоза (аннексин V‑FITC‑флуоресцирующих клеток), снижение уровня белков Bcl‑2 и про‑каспазы‑3, а также повышение активности каспаз 3 и 8 (Park, 2018).
Считается, что в низкой концентрации (1–10 мкМ) Н2О2 является сигнальной молекулой, вторичным мессенджером, который запускает процессы на поверхности и внутри клетки (Ткачук и др., 2012). Показано, что такие малые концентрации Н2О2 вызывают митотические процессы и влияют на дифференциацию клеток. Концентрации в пределах 1–100 мкМ стимулируют МАР-киназные каскады, активируя в том числе киназы р38 и JNK в лимфоцитах, что, по-видимому, связано со стимулированием внешнего пути апоптоза (Часовских, 2008). Согласно литературным данным, в малых концентрациях Н2О2 стимулирует тирозиновые фосфатазы, воздействуя на области цистеин-содержащих сайтов и через ряд стадий приводит к сборке гомолога ферментативного комплекса NADPH-оксидазы NOX2 (Storozhevykh et al., 2007; Mueller etal., 2008; Ткачук и др., 2012; Hennquez-Olguin et al., 2019).. В этих работах делается вывод, что Н2О2 может являться вторичным мессенждером, который передает сигнал от поверхностных рецепторов, приводя к фосфорилированию и дефосфорилированию ряда киназ и активации MAP-киназного каскада, что может стимулировать внешний путь апоптоза.
Таким образом, в работе показано, что пространственно затрудненный фенол анфен натрия вызывает апоптотические изменения клеток карциномы Льюис, фрагментацию ДНК и выход фосфатидилсерина на поверхность мембраны клеток. Начало этого процесса совпадает по времени со снижением содержания белка Bcl-2 (Миль и др., 2018), свидетельствующем о начале митохондриального пути апоптоза.
Низкие концентрации Н2О2 могут стимулировать поверхностные трансмембранные рецепторы и затем активировать ряд сигнальных путей с участием MAP-киназ в процессах апоптоза, передавая сигналы в том числе и на митохондрии (Часовских, 2008). При введении анфена натрия и Н2О2 в малой концентрации наблюдается увеличение числа апоптотических клеток. Это позволяет предположить, что сигналы апоптоза в этом случае поступают как по внешнему, так и по внутреннему митохондриальному пути, приводя к активация процесса.
Мы предполагаем, что синтетический антиоксидант анфен натрия в сочетании с H2O2 может быть более эффективным противоопухолевым средством по сравнению с анфеном натрия для некоторых типов опухолей.
Список литературы
Бурлакова Е. Б., Пальмина Н. П., Мальцева Е. Л. 1998. Природный (альфа-токоферол) и синтетический (калиевая соль фенозана) антиоксиданты как регуляторы активности протеинкиназы в широком диапозоне концентраций. Биол. мембраны. Т. 15. № 2. С. 199. (Burlakova E.B., Palmina N.P., Maltseva E.L. 1998. Natural (α-tocopherol) and synthetic (phenosan potassium salt) antioxidants regulate the protein kinase C activity in a broad concentration range. Membrane and Cell Biology. V. 12. № 2. P. 251.)
Володькин А.А., Ерохин В.Н., Бурлакова Е.Б., Заиков Г.Е., Ломакин С.М. 2013. Строение и биологические свойства 1-карбокси-1-(n-метиламид)-2-(3,5-ди-третбутил- 4-гидроксифенил)-пропанатов натрия и калия. Хим. физика. Т. 32. № 2. С. 66. (Volodkin A.A., Erokhin V.N., Burlakova E.B., Zaikov G.E., Lomakin S.M. 2013. Structure and biological properties of 1-carboxy-1-(n-methylamide)-2-(3,5-di-tert-butyl-4-hydroxyphenyl)-propanates of sodium and potassium. Chem. Phys. V. 32. № 2. P. 66.)
Ерохин В.И., Кременцова В.Н., Семёнов В.А., Бурлакова Е.Б. 2007. Влияниеантиоксиданта-бета-(4-гидрокси-3,5-дитретбутилфенил)пронионовой кислоты (фенозана) на развитие злокачественных новообразований. Изв. акад. наук. Сер. биол. № 5. С. 583. Erokhin V.N., Krementsova A.V., Semenov V.A., Burlakova E.B. 2007. Effect of antioxidant β-(4-hydroxy-3,5-ditertbutylphenyl)propionic acid (phenosan) on the development of malignant neoplasms. Biol. Bull. V. 34. № 5. С. 485.)
Миль Е.М., Бинюков B.И., Ерохин B.Н. 2018. Действие перспективного противоопухолевого фенольного антиксиданта анфена натрия на белки семейства Bcl-2. Докл. акад. наук. Т. 482. № 5. С. 598. (Mil E.М., Binyukov V.I., Yerokhin. 2018. Effect of Promising Antitumor Phenolic Antioxidant Anphen Sodium on the Bcl-2 Family Proteins. Dokl. Akad. Nauk. V. 482. № 1. P. 268.)
Миль Е.М., Ерохин В.Н., Бинюков В.И., Семёнов В.А., Албантова А.А., Блохина С.В. 2017. Снижение уровня белка Bcl‑2 при развитии карциносаркомы Льюис. Бюл. экспер. биол. мед. Т. 164. № 11. С. 630. (Mil E.M., Erokhin V.N., Binyukov V.I., Semenov V.A., Albantova A.A., Blokhina S.V. 2018. Decrease in Bcl-2 potein level during the development of Levis carcinosarcome. Bull. Exp. Biol. Med. V. 164. № 5. P. 673.)
Ткачук В.А., Тюрин–Кузьмин П.А., Белоусов В.В., Воротников А.В. 2012. Пероксид водорода как новый вторичный посредник. Биол. мембраны. Т. 29. № 1/2. С. 21. (Tkachuk V.A., Tyurin-Kuzmin P.A., Belousov V.V., Vorotnikov A.V. 2012. Hydrogen peroxide as a new secondary messenger. Biol. Membrany. (Russ.). V. 29. P. 1.)
Часовских Н.Ю. 2008. Роль протеинкиназ JNK и р38 в регуляции апоптоза мононуклеарных лейкоцитов крови при окислительном стрессе. Бюл. сиб. мед. № 4. С. 38. (Chasovskikh N.Yu. 2008. The role of protein kinases JNK and p38 in the regulation of apoptosamononuclear leukocytes in blood under oxidative stress. Bull. Sib. Med. (Russ.). № 4. P. 38.)
Czabotar P.E., Lessene J., Stresser A., Adams J.M. 2014. Control of apoptosis by the BCL-2 protein family: implications for physiology and therapy. Nat. Rev. Mol. Cell Biol. V. 15. P. 49.
Hennquez-Olguin C., Boronat S., Cabello-Verrugio C., Jaimo-vich E., Hidalgo E., Jensen1 T.E. 2019. The emerging roles of nicotinamide adenine dinucleotide phosphate oxidase 2 in skeletal muscle redox signaling and metabolism. Antioxid. Redox. Sign. V. 3. P. 1371.
Laudanski J., Niklinska W., Burzykowski T., Chyczewski L., Niklinski J. 2001. Prognostic value of serum p53 antibodies in patients with resected non-small cell lung cancer. Eur. Respir. V. 1. P. 660.
Liling Y., Tetsuo M., Shigeo S., Mikiko M., Hirosh S., Takao I.Y., Tomoko O., Takashi T. 2003. Predominant suppression of apoptosome by inhibitor of apoptosis protein in non-small cell lung cancer H460 cells: therapeutic effect of a novel polyarginine-conjugated Smac peptide. Cancer Res. V. 63. P. 831.
Mueller A.S'., Klomann S.D., Wolf N.M., Schneider S., Schmidt R., Spielmann J., Stanql G., Eder K., Pallauf J. 2008. Redox Regulation of Protein Tyrosine Phosphatase 1B by manipulation dietary selenium affects of thetriglyceride concentration in rat liver. J. Nutr. V. 138. P. 2328.
Park WH. 2018. Hydrogen peroxide inhibits the growth of lung cancer cells via the induction of cell death and G1‑phase arrest. Oncol. Rep. V. 40. P. 1787.
Shiratsuchi A, Osada S. Kanazawa S. Makanishi Y. 1998. Essential role of phosphatidylserine externalization in apoptosing cell phagocytosis by macrophages. Biochem. Biophvs Res. Commun. (BBRS). V. 246. P. 549.
Storozhevykh T.P., Senilova Y.E., Persiyantseva N.A., Pinelis V.C., Pomytkin I.A. 2007. Mitochondrial respiratory chain is involved in insulin-stimulated hydrogen peroxide production and plays an integral role in insulin receptor autophosphorylation in neurons. BMC Neurosci. V. 8. P. 84.
Дополнительные материалы отсутствуют.


