Цитология, 2020, T. 62, № 7, стр. 522-532
Оценка показаний автоматизированного счетчика клеток
А. М. Соловьёва 1, С. А. Александрова 2, *
1 Санкт-Петербургский политехнический университет Петра Великого
195251 Санкт-Петербург, Россия
2 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: alekssvet2205@gmail.com
Поступила в редакцию 27.02.2020
После доработки 13.04.2020
Принята к публикации 14.04.2020
Аннотация
Традиционно подсчет числа клеток и определение доли жизнеспособных клеток в популяции осуществляют в камере Горяева. Автоматизированное оборудование (счетчики клеток различных фирм) не только позволяет проводить подсчет клеток в широком диапазоне концентраций, но и дает дополнительные возможности для измерения и других клеточных параметров. Однако в процессе определения числа и доли жизнеспособных мезенхимных стволовых клеток (МСК) костного мозга человека (линия FetMSC) в популяции было замечено, что показания автоматического счетчика (АС) клеток ТС20тм (Bio-Rad, США) значительно отличаются от определяемых в камере Горяева: общее число клеток отличалось в большую сторону, а доля жизнеспособных клеток – в меньшую. Поэтому цель настоящей работы заключалась в выявлении причин, влияющих на точность измерения, и модификации методики (инструкции) проведения измерений. Нами выявлено, что на конечный результат оказывают влияние следующие факторы: присутствие в суспензии клеток белковых компонентов кондиционированной или ростовой сред, а также частиц трипанового синего. На основании полученных данных предлагается модификация существующей методики использования АС. Прилагающаяся к АС программа TC20 Data Analyzer позволила получить данные о распределении клеток по размерам (диаметру) в популяции, а также развернутую информацию о числе и доле жизнеспособных клеток.
Мезенхимные стволовые клетки (МСК) показали свою перспективность для целей регенеративной медицины за счет наличия у них трофической, паракринной и иммуномодуляторной функций. Кроме того, их способность к дифференцировке в клетки стромы делает возможным их использование в составе тканеинженерных конструкций. Однако для терапевтического эффекта требуется использование большого количества клеток (Murphy et al., 2013; Ge et al., 2014; Caplan et al., 2018), которое обычно нарабатывается в процессе культивирования in vitro. Точная информация о числе клеток позволяет прогнозировать темпы роста культуры и рассчитывать начальное число клеток, которое необходимо взять, чтобы получить желаемое число клеток за определенный период времени. Вторым важным параметром, требующим отслеживания при культивировании клеток in vitro, является жизнеспособность клеток – способность поддерживать состояние, необходимое для выполнения ими специфических функций и реализации митотического потенциала (Герасимов, Попандопуло, 2007).
Традиционно подсчет клеток и определение доли жизнеспособных клеток осуществляют в камере Горяева (Полянская и др., 2019). Этот способ является достаточно субъективным и требует хороших знаний сотрудника о нормальной и патологической морфологии изучаемого типа клеток. Кроме того, при концентрациях клеток, лежащих за пределами интервала (0.2–2) × 106 кл./мл, подсчет в камере Горяева не обеспечивает точного результата. Автоматизированное оборудование (счетчики клеток различных фирм) не только позволяет проводить подсчет клеток в более широком диапазоне концентраций, но и дает дополнительные возможности измерения различных характеристик и параметров клеток.
Автоматический счетчик (АС) клеток ТС20тм (Bio-Rad, США) позволяет проводить подсчет числа и доли жизнеспособных клеток различных типов диаметром от 6 до 50 мкм в диапазоне концентраций от 50 тыс. до 10 млн. кл./мл. Помимо этих параметров счетчик выдает дополнительную информацию о долях в популяции клеток разного диаметра. Клеточный диаметр является важным параметром в оценке рисков при введении суспензии клеток в кровеносное русло.
Среднее значение диаметра МСК человека составляет 10–30 мкм (Moll, 2015), тогда как сосуды микроциркуляторного русла имеют диаметр от 5 до 20 мкм. В ряде исследований было показано, что при введении в кровеносное русло слишком крупные МСК способны вызывать обструкцию (закупорку) сосудов и приводить к инфарктам (Ge et al., 2014; Moll, 2015). Следовательно, клетки должны быть менее 20 мкм для того, чтобы не вызывать обструкцию сосудов. В работе Петрова и Цупкиной (2017) было показано, что при длительном культивировании на подложке происходит увеличение размеров распластанных МСК, что соответственно отражается на увеличении диаметра клеток в суспензионном состоянии. В процессе культивирования увеличивается также разнообразие клеток в популяции по размерам (Yin et al., 2018). Следовательно, в процессе наработки большого количества клеток (с целью масштабирования для производства клеточных продуктов) возможно увеличение среднего клеточного диаметра. Однако изучение динамики этих процессов возможно при использовании систем, достоверно отражающих исследуемые показатели.
В процессе работы с использованием счетчика клеток ТС20тм (Bio-Rad, США) при определении числа клеток линии FetMSC и доли жизнеспособных клеток в популяции нами было замечено, что его показания значительно отличаются от определяемых в камере Горяева: общее число клеток отличалось в большую сторону, а доля жизнеспособных клеток – в меньшую. Поэтому цель настоящей работы заключалась в выявлении и устранении причин, влияющих на точность измерения, и при необходимости – и модификации методики (инструкции) проведения измерений.
МАТЕРИАЛ И МЕТОДИКА
Клеточная культура. В работе использовали клеточную линию FetMSC (Коллекция культур клеток позвоночных Института цитологии РАН, Санкт-Петербург), полученную из МСК костного мозга 5–6-недельного эмбриона человека) 10-го пассажа после декриоконсервации. Клетки культивировали в питательной среде DMEM c глутамином (Росмедбио, Россия), содержащей 10% эмбриональной телячьей сыворотки (ЭТС; Hyclone, США) и 1% готовой смеси антибиотиков пенициллина и стрептомицина (Sigma-Aldrich, США). Морфологию клеток в процессе культивирования in vitro визуализировали и контролировали с помощью инвертированного микроскопа Nikon Eclipse TS100 (Nikon Instruments Inc., США). Для подсчета числа клеток и определения их жизнеспособности клетки снимали с поверхности культуральной посуды готовым раствором трипсина и ЭДТА (Sigma-Aldrich, США), после чего добавляли к ним питательную среду, ресуспендировали и центрифугировали 3 мин при 200 g. Клеточный осадок разбавляли питательной средой и осторожно перемешивали до получения суспензии. Аликвоты суспензии использовали для измерений.
Счет жизнеспособных клеток в камере Горяева. В качестве красителя, выявляющего нежизнеспособные клетки, использовали 0.4%-ный раствор трипанового синего (ТС). Раствор готовили согласно инструкции производителя счетчика клеток: навеску сухого ТС (C34H28N6O14S4; Mikroskopie, Германия) добавляли к раствору 0.81%-ного хлорида натрия NaCl (Sigma-Aldrich, США) и 0.06%-ного тригидрата гидрофосфата калия K2HPO4 ⋅ 3H2O (Merck, Германия) в дистиллированной воде, перемешивали до растворения при комнатной температуре, затем пропускали через фильтр с диаметром пор 0.22 мкм и хранили в емкости из темного стекла при температуре 4°С. Для подсчета числа жизнеспособных клеток клеточную суспензию смешивали с раствором ТС в отношении 10 : 1, каплю суспензии помещали в камеру. С помощью микроскопа считали окрашенные и неокрашенные клетки. Число клеток в 1 мл (концентрация, С) определяли по формуле: С = kn × 104, где n – число клеток, подсчитанных в камере Горяева, k – коэффициент разведения (при окраске 0.4%-ным раствором ТС в соотношении 10 : 1 значение k = = 1.1). Жизнеспособность (V) популяции вычисляли по формуле и выражали в %:
где m – число окрашенных клеток, N – общее число клеток (Полянская и др., 2019).Счет жизнеспособных клеток с помощью АС. Для измерения числа жизнеспособных клеток с помощью ТС20тм (Bio-Rad, США) клеточную суспензию смешивали с раствором ТС в соотношении 1 : 1, наносили в камеру счетной пластины прибора. В процессе измерения с экрана счетчика получали следующую информацию: общее число клеток в 1 мл, число неокрашенных (живых) клеток, долю жизнеспособных клеток (%), дату и время измерения, гистограмму распределения клеток по размерам в выбранном диапазоне и фотографию содержимого счетной пластины. Результаты последнего измерения переносили в персональный компьютер и анализировали с помощью программы ТС20 Data Analyzer. Программа дает более детальное изображение счетной камеры и развернутую информацию о числе и жизнеспособности клеток, причем отдельно для клеток каждого размера.
Схема эксперимента. Клетки линии FetMSC культивировали на флаконах для роста адгезивных клеток, снимали с поверхности стандартным методом, число клеток подсчитывали в камере Горяева. Суспензию клеток FetMSC в концентрации 710 тыс. кл./мл разбавляли в 1.5, 2 и 2.5 раза ростовой средой, получая концентрации, равные 473, 355 и 284 тыс. кл./мл соответственно. Эти суспензии являлись калибровочными. Проводили сравнение калибровочных значений со значениями, полученными в камере Горяева и АС. Анализировали по три повторности для каждого измерения. Вычисляли среднее значение и его ошибку. Данные АС анализировали при помощи программы TC20 Data Analyzer.
Кроме того, при помощи АС исследовали растворы, которые могут влиять на точность измерений: 1) 0.4%-ный раствор красителя ТС; 2) компоненты полной питательной среды; 3) компоненты кондиционированной в течение 4 сут питательной среды.
На основании полученных данных модифицировали существующую методику использования АС.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнение показаний камеры Горяева и АС с калибровочными значениями. После проведения измерений выбранных показателей у калибровочных суспензий клеток FetMSC было выявлено, что значения числа клеток (концентрации в 1 мл, С) и доли жизнеспособных клеток (V, %), полученные с помощью камеры Горяева, практически соответствуют калибровочным, в то время как те же показатели, полученные с помощью АС, значительно отличаются от них (табл. 1).
Таблица 1.
Значения концентрации (С) и показателя жизнеспособности клеток (V), полученные с помощью камеры Горяева и АС
| С калибровочная, тыс. кл./мл |
Полученные значения | |||
|---|---|---|---|---|
| камера Горяева | АС | |||
| С, тыс. кл./мл | V, % | C, тыс. кл./мл | V, % | |
| 473 | 495 ± 11 | 100 ± 0 | 670 ± 53 | 89.4 ± 4.5 |
| 355 | 390 ± 20 | 97.5 ± 2.5 | 557 ± 45 | 86.5 ± 2.9 |
| 284 | 280 ± 15 | 95.0 ± 2.5 | 368 ± 42 | 66.7 ± 3.3 |
Так, значения концентрации клеток, полученные при использовании камеры Горяева, отличались от калибровочных не более, чем на 10%. В то же время значения концентрации клеток, полученные при использовании АС, превосходили калибровочные на 31–35%. Жизнеспособность при измерении в камере Горяева имела высокие и сходные значения для всех трeх образцов (95–100%). Однако жизнеспособность клеток при измерении с помощью АС была меньше, чем при оценке в камере Горяева на 10–15% для первых двух разведений (1.5 и 2 раза), а при разведении в 2.5 раза ее значение отличалось на 30% и доходило до 66.7%.
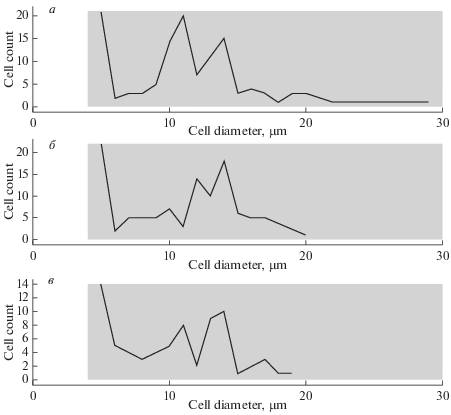
Анализ данных, полученных в АС, с помощью программы TC20 Data Analyzer. Для того чтобы определить, чем может быть вызвана столь большая разница между калибровочными значениями и значениями, полученными в АС, данные всех трех образцов дополнительно проанализировали с помощью программы TC20 Data Analyzer. В результате были получены гистограммы распределения числа клеток по их размеру (диаметру) (рис. 1). Анализировали клеточные элементы в диапазоне от 5 до 50 мкм (эти границы установлены прибором). Основное число элементов было представлено в диапазоне размеров 10–20 мкм, однако у всех образцов размеры значительной доли клеток, распознанных АС, находились в диапазоне 5–6 мкм. На основании этих данных мы предположили, что часть популяции, обладающая малыми размерами, возможно, представлена не клетками, а какими-либо артефактами, распознаваемыми АС как клетки, что может приводить к значениям, не соответствующим реальной ситуации.
Рис. 1.
Изображения гистограмм распределения числа клеток по диаметру для калибровочных суспензий, полученные при помощи программы TC20 Data Analyzer. Полученную суспензию клеток FetMSC разбавляли в 1.5 (а), 2 (б) и 2.5 (в) раза ростовой средой. По оси абсцисс – диаметр, мкм; по оси ординат – число клеток.
Полученные результаты и наши предположения подтверждаются данными литературы, касающимися сведений о размерах МСК человека. Так, было показано, что МСК, полученные из мононуклеарной фракции костного мозга человека, после сортировки по антителам STRO-1BRIGHT/VCAM-1+ обладают размером 10–12 мкм (Gronthos et al., 2003). Согласно данным другой работы, размер МСК костного мозга лежит в пределах 10–30 мкм, а большая часть популяции имеет размеры 17–21 мкм (Yin et al., 2018). Размер МСК плаценты на 6-м пассаже находится в пределах 15–50 мкм при среднем значении диаметра 26.5 ± 0.4 мкм (Ge et al., 2014).
Выявление природы элементов (артефактов) размером 5–10 мкм. В связи с результатами анализа данных, полученных в АС, встал вопрос относительно природы элементов малых размеров, распознаваемых АС как клетки (артефактов), которые вносили значительный вклад в измеряемые показатели. Так как в аликвоте клеточной суспензии (для измерения) обычно содержатся также полная питательная ростовая среда и краситель ТС, можно предположить влияние компонентов этих растворов на результат измерений. Такими примесями могут быть агрегировавшие частицы ТС, белки ЭТС, а также продукты жизнедеятельности клеток, выделяющиеся в кондиционированную среду. Чтобы проверить эти предположения, при помощи АС были проанализированы растворы ТС, ростовой и кондиционированной сред.
Во всех трёх растворах счетчиком были обнаружены элементы, распознаваемые как клетки (рис. 2). Оказалось, что в растворе ТС концентрация артефактов в 1 мл составляла 84 тыс., в ростовой среде – 97.5 тыс., в кондиционированной – 106.3 тыс. (табл. 2). Сравнение значений концентраций бесклеточных растворов с калибровочным (710 тыс./мл) говорит о том, что неклеточные элементы могут вносить вклад в показатели порядка 15%. Кроме того, несмотря на отсутствие в исследуемых растворах клеток, счетчиком были выданы значения “жизнеспособности” (от 9 до 36.3%), которые могли искажать показатели и занижать общее значение жизнеспособности клеток в суспензии. Большинство элементов имело размеры от 5 до 10 мкм, однако в кондиционированной среде отдельные элементы достигали размера 24 мкм (рис. 2в). Важно отметить, что концентрация распознанных частиц была близка к разнице между концентрациями FetMSC, полученными при подсчете в АС и камере Горяева.
Рис. 2.
Изображения бесклеточного содержимого в счетной камере АС (справа) и соответствующие им гистограммы распределения числа артефактов по диаметру (слева), полученные при помощи программы TC20 Data Analyzer. Расворы: а – 0.4%-ный раствор трипанового синего; б – кондиционированная среда; в – ростовая среда. По оси абсцисс – диаметр, мкм: по оси ординат – число элементов.
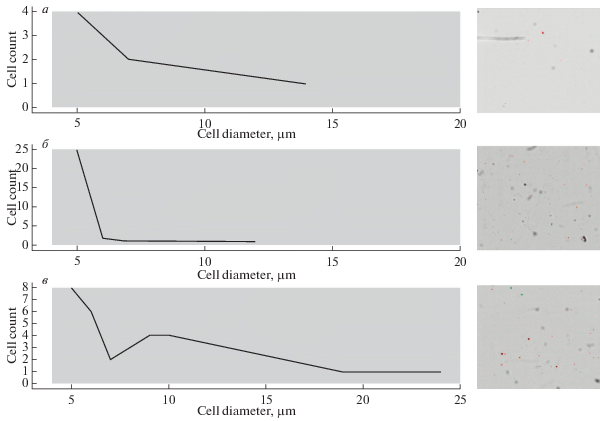
Таблица 2.
Значения концентрации (С) и “жизнеспособности” (V) элементов в бесклеточных растворах, полученные с помощью АС
| Раствор | С, тыс./мл | V, % |
|---|---|---|
| ТС | 84.0 ± 2.5 | 9.0 ± 2.2 |
| Ростовая среда, содержащая ЭТС | 97.5 ± 4.1 (166.0 ± 7.3) |
36.3 ± 12.7 |
| Кондиционированная среда клеток FetMSC | 106.3 ± 6.8 (173.0 ± 16.3) |
34.5 ± 8.1 |
При измерении показателя “жизнеспособность” для бесклеточных сред их смешивали с ТС в соотношении 1 : 1. При этом получали число элементов в 1 мл (концентрацию), близкое к разнице между значениями этого показателя, измеренного в АС и камере Горяева (табл. 2).
Таким образом, мы установили, что изучаемые растворы вносят погрешность при использовании АС при определении значений концентрации клеток показателя их жизнеспособности. Наличие в суспензии клеток большого количества артефактов будет увеличивать общее число элементов в растворе, а, следовательно, и показатели концентрации (числа) клеток. Кроме того, так как артефакты обладают низким значением “жизнеспособности”, их присутствие в суспензии клеток занижает общее значение клеточной жизнеспособности. Несмотря на то, что большое число артефактов имело размер в диапазоне значений 5–6 мкм и соответствовало участкам гистограмм с повышенными значениями при измерении суспензии (рис. 1), достаточно большое их число имело и бóльшие размеры (в пределах 7–10 мкм). Поэтому можно заключить, что основная часть элементов, попадающих в интервал 5–10 мкм, не являeтся клетками и вносит погрешность в измерения.
Концентрация и доля жизнеспособных клеток для разных по диаметру субпопуляций клеток FetMSC. На основании полученных данных о размерах артефактов, которые могут вносить погрешность в измерения при помощи АС, нами определены значения концентрации клеток и их жизнеспособности отдельно для размерного интервалов 5–10 мкм и размера больше 10 мкм (табл. 3).
Таблица 3.
Значения концентрации (С) и жизнеспособности клеток (V), полученные с помощью АС, для разных по размеру (D) субпопуляций клеток FetMSC
| С калибровочная, тыс. кл./мл | С, 103 кл./мл, D >10 мкм | V, % | С, 103 кл./мл, D <10 мкм | V, % |
|---|---|---|---|---|
| 473 | 487.2 ± 38.5 | 100 ± 0 | 184.3 ± 14.5 | 59.3 ± 6.6 |
| 355 | 373.7 ± 30.1 | 98.5 ± 0.5 | 184.6 ± 14.9 | 62.3 ± 5.4 |
| 284 | 227.4 ± 20 | 86.4 ± 2.3 | 141.0 ± 16ю1 | 35.5 ± 3.8 |
При выборе интервала значений размера выше 10 мкм получали значения концентрации клеток и жизнеспособности, близкие к калибровочным и полученным с помощью камеры Горяева (табл. 1). При этом значения концентраций были ниже тех, которые определяются для всего размерного диапазона клеток, а значения показателя жизнеспособности – выше.
Значения концентраций, полученные для диапазона 5–10 мкм, оказались очень близки к значениям концентраций частиц (элементов), содержащихся в питательных средах (табл. 2). Значения жизнеспособности в этом интервале составляли от 35 до 62%, что также соответствовало жизнеспособности элементов. Что касается нежизнеспособных (мeртвых) клеток, то они были немногочисленны, выявлялись в большом диапазоне диаметра (14–24 мкм) и не имели значительного влияния на показатели.
Можно заключить, что в диапазоне 5–10 мкм в основном находятся не клетки, а частицы красителя и компоненты (скорее всего, белки) питательной среды, а также дебрис, который формируется в процессе жизнедеятельности клеток. Следовательно, при анализе данных не стоит учитывать значения клеточных параметров в этом интервале. При использовании программы АС TC20 для измерения числа и жизнеспособности FetMSC для большей точности результатов рекомендуется выбирать диапазон размеров клеток от 10 мкм.
С учетом полученных данных мы предлагаем модифицировать методику использования АС, которая прилагается в инструкции к прибору. Кроме того, в инструкции не было описания работы программы TC20 Data Analyzer, которая позволяет получить данные о распределении клеток по размерам (диаметру) в популяции, а также развернутую информацию о числе и доле жизнеспособных клеток. Поэтому ниже мы даем детальную инструкцию по отработанной и адаптированной нами методике.
При работе с любым типом клеток рекомендуется сначала провести “калибровку” счетчика: приготовить несколько образцов суспензии клеток разных известных концентраций (определенных в камере Горяева) и выявить диапазон размеров, дающий значения, которые максимально соответствуют теоретическим.
Пошаговая инструкция работы с автоматическим счетчиком ТС20тм.
1) Поместить счетную пластину с образцом клеточной суспензии (рис. 3) в порт для пластины счетчика клеток (рис. 3а).
Рис. 3.
Изображения экрана автоматического счетчика (АС) ТС20тм в процессе работы. а – Помещение счетной пластины с образцом клеточной суспензии в АС; б – запуск операции подсчета; в – этап Focusing; г – этап Counting ; д – этап выбора нижнего и верхнего порогов значения клеточного диаметра для подсчета; е – результаты операции подсчета; ж – зависимости числа живых (зеленая кривая) и мертвых (красная кривая) клеток от значения клеточного диаметра; з – выбор опции View image; и – изображение содержимого счетной пластины; к – зависимости числа живых (зеленая) и мертвых (красная) клеток от клеточного диаметра и общая информация об операции подсчета для всего интервала клеточного диаметра; л – зависимости числа живых (зеленая) и мертвых (красная) клеток от значения клеточного диаметра с общей информацией об операции подсчета для выбранного интервала клеточных диаметров (10–22 мкм); м, н – выбор опции Export data; о – сохранение общей информации для последних 100 измерений; п – сохранение подробной информации для последнего измерения.
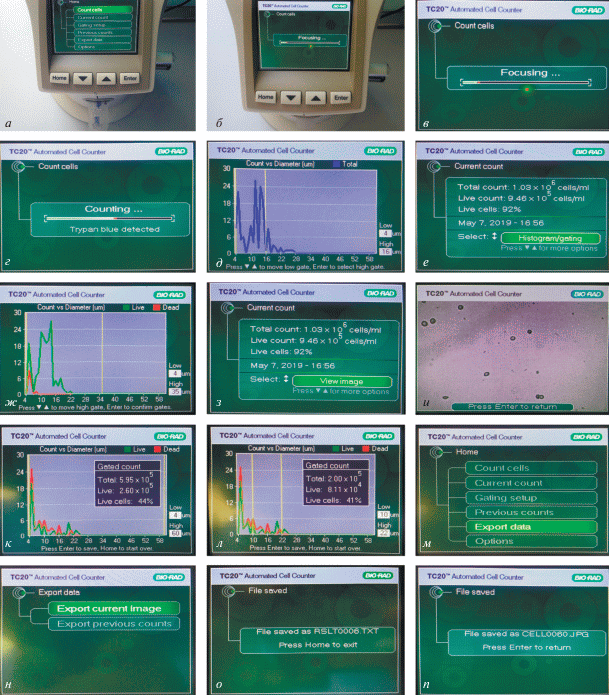
2) Операция подсчета (экран Processing) запустится автоматически (рис. 3б). Далее на экране появится надпись Focusing (рис. 3в), через несколько секунд – Counting (рис. 3г). На этом этапе производится подсчет общего числа клеток и определение наличия в суспензии клеток красителя ТС. Если счетчик детектирует наличие ТС в суспензии, на экран Counting будет выведена надпись Trypan blue detected.
3) После подсчета на экране счетчика можно увидеть гистограмму, показывающую распределение клеток по размерам (диаметру клеток) (рис. 3д). По оси OX – диаметр клетки, по OY – число клеток данного диаметра в счетной камере. На данном этапе (рис. 3д) нужно установить нижний и верхний пороги значений диаметра клеток. После выбора определенного интервала размеров счётчик посчитает число клеток, размеры которых находятся в выбранном интервале (желтые линии на рис. 3д показывают границы интервала).
4) На экране счетчика появится информация об общем числе клеток для выбранного диапазона размеров, дате и времени измерения (рис. 3е). При помощи опции Histogram/Select можно увидеть гистограмму распределения клеток по размерам в выбранном диапазоне (рис. 3ж). При наличии ТС на экран счетчика выводится информация об общей концентрации клеток, концентрации неокрашенных ТС (жизнеспособных) клеток, доле жизнеспособных клеток (%), дате и времени измерения. В этом случае будут даны две гистограммы распределения: зеленая (для окрашенных клеток) и красная (для неокрашенных клеток). При помощи опции View Image можно увидеть изображение содержимого счетной пластины (рис. 3з и 3и).
На данном этапе также можно выбирать разные диапазоны размеров клеток. Для этого достаточно нажать кнопку Enter, после чего можно установить нижнюю и верхнюю границы размеров клеток. Для каждого выбранного интервала на экране появится информация о концентрации и жизнеспособности клеток, размеры которых находятся в выбранном интервале (на рис. 3к, л проиллюстрирована ситуация для двух различных размерных интервалов).
5) Счетчик ТС20 сохраняет информацию о концентрации и жизнеспособности клеток за последние 100 измерений. Для загрузки на свой флеш-диск нужно вставить его в USB-порт A. Затем выйти в главное меню, нажав клавишу Home. В главном меню выбрать опцию Export data (рис. 3м), затем – Export previous counts (рис. 3н) и на флеш-диск скопируется текстовый файл с расширением .txt, где в виде списка представлены данные о числе клеток и их жизнеспособности за последние 100 измерений (рис. 3о). Здесь же указывается дата и время каждого из измерений.
Для последнего измерения, помимо информации о концентрации, жизнеспособности клеток, дате и времени подсчета, возможно получить дополнительную информацию о распределении числа клеток по размерам в виде гистограмм. Для загрузки данных о последней операции подсчета в разделе Export data необходимо выбрать опцию Export current image. (рис. 3н) Счетчик загрузит на флеш-диск изображение содержимого счетной камеры с расширением .jpeg и выведет на экран сообщение с именем файла (рис. 3п). В изображении находится информация об операции подсчета: гистограммы, численные данные, фотографии.
Обработка результатов измерений с помощью программы TC20 Data Analyzer. Для обработки данных последнего измерения фирмой-производителем предоставляется программное обеспечение TC20 Data Analyzer. С его помощью можно анализировать распределение клеток по размерам, рассматривать клеточные популяции различных размеров, получать данные о концентрации и жизнеспособности клеток для этих популяций, а также проводить сравнительный анализ различных измерений.
Экран анализа данных, полученных из АС для последнего измерения, приведен на рис. 4. В нижнем левом углу расположена информация о числе клеток в мл, концентрации и доле (%) жизнеспособных клеток, интервале клеточных размеров, в котором проводится измерение, дате и времени проведения измерения (рис. 4г). Вверху экрана находится изображение содержимого счетной камеры (рис. 4а) и таблица с данными о количестве клеток для каждого значения клеточного диаметра (рис. 4б), а ниже – графическое представление таблицы (рис. 4в). Таблица на рис. 4в показывает концентрацию клеток каждого размера (Total cell count) в счетной камере, а также, сколько из этих клеток являются живыми (Live cell count) и сколько – мертвыми (Dead cell count). На графике (рис. 4в) показаны соответствующие кривые общего числа клеток (синяя кривая), живых неокрашенных клеток (зеленая кривая) и мeртвых окрашенных (красная кривая).
Рис. 4.
Экрана программы TC20 Data Analyzer после проведения анализа данных. а – Изображение содержимого счетной камеры, б – таблица с данными о числе клеток для каждого значения клеточного диаметра; в – графическое представление данных таблицы: синим цветом показано общее число клеток, зеленым – число жизнеспособных клеток, красным – число мертвых клеток; г – данные о проведенном измерении.
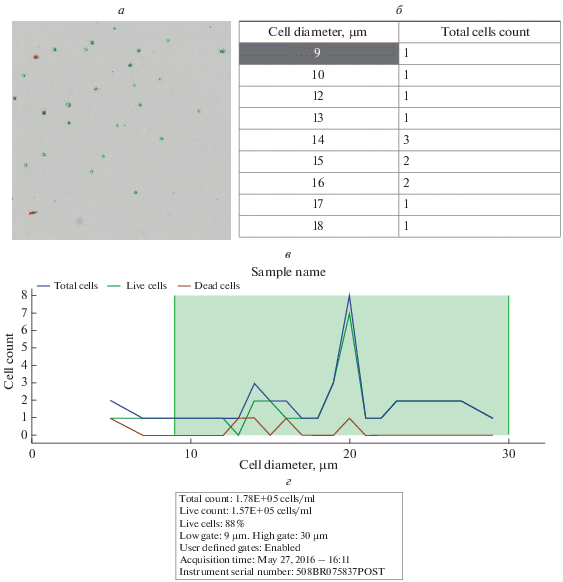
Пользуясь этой информацией, можно узнать размер клеток, наиболее характерный для данной популяции, определить долю клеток определенного размера из общего количества клеток. В отсутствие в суспензии клеток красителя ТС не выдается значение жизнеспособности, все клетки на изображении метятся синим цветом, а в таблице присутствует только графа Total cell count.
Программное обеспечение TC20 Data Analyzer позволяет проводить ряд манипуляций с полученными данными. Можно просматривать и увеличивать изображение содержимого счетной камеры, что позволяет получить представление о форме клеток, детектировать наличие в суспензии клеточных агрегатов и чужеродных частиц. При работе с гистограммой можно выставлять нижний и верхний пороги размера клеток, при этом как на гистограмме, так и в таблице будет отображаться информация о количестве и жизнеспособности клеток в конкретном интервале размеров. Это удобно при работе с неоднородной популяцией клеток (в которой существуют клетки разных размеров), так как программа дает возможность анализировать каждую размерную популяцию отдельно. Также если известен точный диапазон размеров клеток, выбор границы размеров помогает отсечь ненужную погрешность в результатах, которая может быть вызвана наличием в клеточной суспензии каких-либо чужеродных частиц нехарактерных размеров.
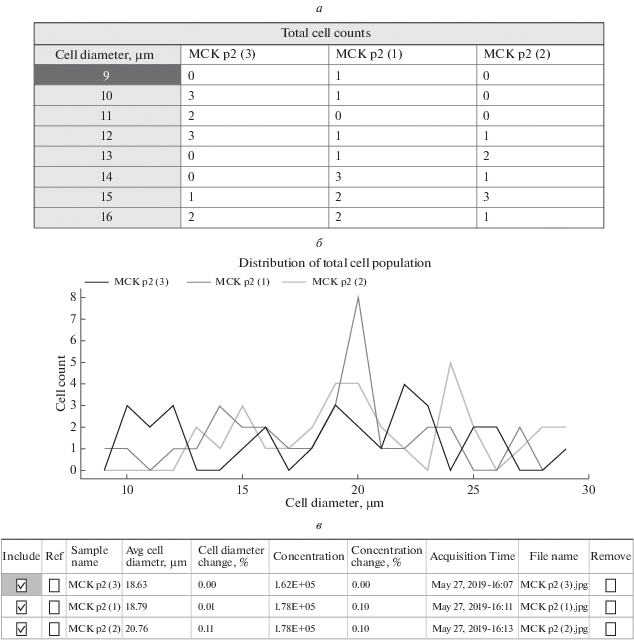
Если проводится несколько измерений, программное обеспечение дает возможность проводить сравнительный анализ этих измерений (рис. 5). Можно сравнивать число клеток, как общее, так и соотношение живых и мертвых клеток путем выбора опции Total, Live либо Dead в окне Cell populаtion. Дополнительно для сравнения представлен такой параметр, как средний размер клеток в популяции (окно Avg. Cell Diameter). Как и при анализе единичного измерения, дается таблица распределения числа клеток по размерам и соответствующая гистограмма. Анализ данных таблицы и гистограммы помогает определять, есть ли какие-либо сходства распределения числа клеток по размерам в нескольких измерениях, существуют ли характерные для данного типа клеток размеры. Однако нет возможности сразу сравнивать показатели жизнеспособности для нескольких измерений.
Рис. 5.
Сравнительный анализ нескольких измерений (на примере трех) в программе TC20 Data Analyzer. а, б – Таблица с данными числа клеток для каждого значения клеточного диаметра для трех измерений и графическое представление этих данных соответственно (кривые, различающиеся цветом); в – таблица с данными среднего диаметра клеток в популяции.
ЗАКЛЮЧЕНИЕ
Итак, мы показали, что подсчет числа клеток FetMSC (при разных разведениях клеточной суспензии) в камере Горяева дает значения, совпадающие с показаниями для калибровочных растворов, в то же время как значения, полученные в АС, имеют значительные отличия от них (число клеток завышено, жизнеспособность занижена). Показано, что используемые бесклеточные растворы (раствор ТС, ЭТС в культуральной среде, а также продукты жизнедеятельности клеток, выделяющиеся в кондиционированную среду) вносят погрешность в показания АС. Наличие в суспензии клеток большого количества чужеродных частиц (артефактов) увеличивает общее число элементов в растворе. Так как артефакты обладают низким значением жизнеспособности, их присутствие в суспензии снижает общее значение реального показателя доли жизнеспособных клеток. Нами принято решение считать интервал 5–10 мкм интервалом, вносящим погрешность в измерения. При выборе интервала размеров клеток выше 10 мкм мы получали значения концентрации клеток и их жизнеспособности, совпадающие с калибровочными и полученными при помощи камеры Горяева.
Список литературы
Герасимов И.В., Попандопуло А.Г. 2007. Оценка жизнеспособности клеток по их морфометрическим параметрам на примере культивируемых фибробластов. Цитология. Т. 49. № 3. С. 204. (Gerasimov I.V., Popandopulo A.G. 2007. Estimation of cell viability using their geometrical parameters by the example of cultivated fibroblasts. Tsitologiya. V. 49. № 3. P. 204.)
Петров Ю.П., Цупкина Н.В. 2017. Сравнение формы мезенхимных стромальных клеток кролика в течение пяти пассажей после получения первичной культуры. Цитология. 59. № 1 С. 62. (Petrov Yu.P., Tsupkina N.V. 2017. A comparison of cell morphology in rabbit mesenchymal stromal cells within 5 passages after receiving the primary culture. Tsitologiya. V. 59. № 1. P. 62.)
Полянская Г.Г, Ефремова Т.Н., Кольцова А.М., Мусорина А.С., Шарлаимова Н.С. Яковлева Т.К. 2019. Методическое пособие по работе с клеточными культурами человека и животных. Спб: Политех-пресс. 114 с. (Polyanskaya G.G., Efremova T.N., Koltsova A.M., Musorina A.S., Sharlaimova N.S., Yakovleva T.K. 2019. A training manual for working with cell cultures of animals and humans. St.Petersburg: Politech-Press. 114 p.)
Caplan A.I. 2018. Mesenchymal stem in regenerative medicine. In: Principles of regenerative medicine. NYC: Acad. Press. P. 219.
Ge J., Guo L., Wang S., Zhang Y., Cai T., Zhao R.C., Wu Y. 2014. The Size of mesenchymal stem cells is a significant cause of vascular obstructions and stroke. Stem Cell Rev. Rep. V. 10. P. 295.
Gronthos S., Zanettino A.C.W., Hay S.J., Shi S., Graves S.E., Kortesidis A., Simmons P.J. 2003. Molecular and cellular characterization of highly purified stromal cells derived from human bone marrow. J. Cell Science. V. 116 P. 1827.
Moll G., Blanc K.L. 2015. Engineering more efficient multipotent mesenchymal stromal (stem) cells for systemic delivery as cellular therapy. ISBT Science Series. V. 10. (Suppl. 1). P. 357.
Murphy M.B, Moncivais K., Caplan A.I. 2013. Mesenchymal stem cells: environmentally responsive therapeutics for regenerative medicine. Exp. Mol. Med. V. 45. P. 54.
Yin L., Wu Y., Yang Z., Tee C.A., Denslin V., Lai Z., Lim C.T., Lee E.H., Han J. 2018. Microfluidic label-free selection of mesenchymal stem cell subpopulation during culture expansion extends the chondrogenic potential in vitro. Lab. Chip. V. 18. P. 878.
Дополнительные материалы отсутствуют.


