Цитология, 2020, T. 62, № 7, стр. 473-486
Асцитная гепатома Зайдела как континуум для опухолевых клеток в транзитном состоянии
Н. П. Терюкова 1, *, Г. В. Андреев 1, И. В. Воронкина 1, 2, Е. И. Сахенберг 1, С. А. Снопов 1, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Институт экспериментальной медицины РАН
197376 Санкт-Петербург, Россия
* E-mail: npter@yandex.ru
** E-mail: snopov@inras.ru
Поступила в редакцию 20.03.2020
После доработки 07.04.2020
Принята к публикации 08.04.2020
Аннотация
Ранее из адгезивной клеточной линии асцитной гепатомы Зайдела крыс мы получили дочерние сублинии двух типов – голоклональные и мероклональные, клетки которых различались по морфологии (фибробластоподобные и эпителиоподобные соответственно), клоногенности в тестах in vitro и туморогенности in vivo. Для выявления потенциальной роли прикрепляющихся клеток гепатомы Зайдела в процессе метастазирования мы сравнили все ее сублинии с монослойными линиями других гепатоцеллюлярных опухолей по параметрам, определяющим инвазивные и миграционные свойства клеток. Установили, что клетки голоклональных сублиний характеризуются повышенной активностью матриксной металлопротеиназы 1, индивидуальным типом миграции и высокой скоростью движения по сравнению с клетками других линий. Клетки всех монослойных линий гепатомы Зайдела секретировали активные формы матриксной металлопротеиназы 9 и транслоцировали в ядро внутриклеточный домен молекулы адгезии эпителиальных клеток (EpCAM), что свидетельствует о приобретении клетками инвазивного фенотипа и активации сигнального пути Wnt-β-катенина. Мы предполагаем, что клональные сублинии, полученные нами из асцитной гепатомы Зайдела, представлены клетками в транзитных состояниях между эпителиальным и мезенхимным фенотипами.
Процесс метастазирования включает ряд последовательных этапов, называемых метастатическим каскадом, в ходе которого клетки отделяются от первичной опухоли, мигрируют в сосудистое русло и с током крови/лимфы достигают органов-мишеней, где инициируют рост вторичных опухолей. Считают, что данный процесс осуществляется особой субпопуляцией опухолевых стволовых клеток (ОСК) – метастатических опухолеинициирующих клеток или метастатических ОСК (Baccelli, Trumpp, 2012; Liao et al., 2014), обладающих и стволовыми свойствами, и способностями к инвазии в подлежащие ткани, миграции и формированию вторичных опухолей. Предполагают, что существуют две группы ОСК – стационарные ОСК и мобильные, или “мигрирующие ОСК”, которые отвечают за быстрый инвазивный рост и диссеминацию опухолевых клеток (Brabletz et al., 2005a).
Фенотип мигрирующей ОСК первичной опухоли может формироваться в зоне инвазивного роста в результате эпителиально-мезенхимного перехода (ЭМП) (Brabletz et al., 2005b, Mani et al., 2008). Индукция ЭМП и координация активности транскрипционных факторов, участвующих в регуляции этого процесса осуществляется с участием многих сигнальных путей (TGF-β, Wnt-β-catenin, Notch, EGF, HGF, FGF, PDGF, HIF), интегрированных в единую сеть под управлением ERK1/2-сигнального пути (Zucchini-Pascal et al., 2013; Yeung, Yang, 2017). В результате ЭМП утрачивается полярность клеток, их эпителиоидная форма, разрушаются плотные межклеточные контакты за счет подавления экспрессии гена E-кадхерина, изменяется организация актинового цитоскелета, клетки становятся фибробластоподобными, приобретают подвижность и начинают экспрессировать мезенхимные маркеры, в числе которых N-кадхерин, виментин, фибронектин, ММП.
Первичная солидная гепатома Зайдела была индуцирована у крыс 4-диметиламиноазо-бензолом, а асцитная опухоль образовалась из нее спонтанно в процессе опухолевой прогрессии: многоклеточные островки, практически лишенные стромы, инвазировали опухолевую капсулу и отделились от массы опухоли в перитонеальную полость, инициируя рост асцитной опухоли; анализ островков показал, что между собой они были функционально разнородны, но каждый островок имел признаки однородного клона (Зайдела, 1963). Особенностью данной опухоли является высокая частота метастазирования в паратрахеальные лимфатические узлы: уже на 5-е сут после внутриперитонеального введения крысам асцита от животных с гепатомой метастазы этой локализации обнаруживались в 90–100% случаев (Киселева, Паникаровский, 1964).
Современные представления о процессе опухолевой прогрессии позволяют считать, что в зоне инвазивного роста клетки солидной гепатомы Зайдела подверглись ЭМП. Подтверждением этого стали наши данные об активации в клетках асцитной опухоли ERK2/MAP-киназы – ключевого регулятора ЭМП (Терюкова и др., 2005). Предполагают, что транзит клеток между двумя фенотипами – эпителиальным и мезенхимным – является не двухфазным, не мгновенным, а представляет собой множество динамических переходных состояний, порождая клеточные субпопуляции с нестабильным фенотипом (Nieto et al., 2016). Роль таких субпопуляций, находящихся в переходных состояниях, в процессе метастазирования гепатомы Зайдела не определена.
В работе Тюряевой с соавторами (2010) была установлена гетерогенность клеток гепатомы Зайдела по клеточному составу. В первичной культуре клетки разделялись на две естественные фракции – прикрепляющиеся к субстрату и флотирующие, причем каждая из фракций содержала клетки разных типов. Для изучения клеточной организации асцитной опухоли и определения роли отдельных субпопуляции в метастазировании мы перевели клетки многоклеточных островков в культуру in vitro и путем длительного отбора получили две клеточные линии – монослойную и суспензионную, различающиеся между собой по адгезивности к субстрату и туморогенности (Терюкова и др., 2013). Затем с помощью метода предельных разведений мы селектировали из монослойной линии два типа клональных сублиний (Терюкова и др., 2016) – с признаками ОСК и опухолевых прогениторных клеток (ОПК). Признаки ОСК определены у 3-х голоклональных сублиний (получены из голоклонов, в тестах на стволовость in vitro формируют гепатосферы, при реклонировании производят в основном голоклоны, в экспериментах in vivo инициируют рост асцитной гепатомы). Признаки ОПК – у 2-х мероклональных сублиний (получены из мероклонов, при реклонировании производят в основном мероклоны, не туморогенны). Клетки голоклональных (3Н, 5F и 6Н) и мероклональных (1Е и 9С) сублиний имеют, соответственно, преимущественно фибробластоподобную или эпителиоподобную морфологию, растут с формированием рыхлого или плотного монослоя и, судя по этим характеристикам, могут отличаться по подвижности и по роли в процессе опухолевой прогрессии на этапе ЭМП.
Ранее при изучении опухолеассоциированных антигенов мы идентифицировали в составе наружных мембран клеток асцитной гепатомы Зайдела ряд белков, в том числе два гликопротеина – басигин, который известен как индуктор ММП, и EpCAM (Терюкова и др., 2010). В настоящей работе мы продолжили предыдущие исследования (Терюкова и др., 2016; Петров и др., 2017, 2018; Teryukova et al., 2018) и сравнили клетки полученных нами клональных сублиний между собой, а также с клетками постоянных линий других гепатоцеллюлярных опухолей по нескольким параметрам: по секреции ММП, которая важна для осуществления инвазии метастатическими ОСК; по скорости движения, которая отражает способность метастатических ОСК к миграции и диссеминированию; по экспрессии EpCAM и локализации его внутриклеточного домена EpICD, который задействован в сигнальном пути, помогающем клеткам поддерживать низкодифференцированный статус и стимулирующем их пролиферацию, повышенную миграционную активность и инвазивность.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Работа выполнена на клетках культивируемых линий гепатомы Зайдела – монослойной и суспензионной, полученных после эксплантации в культуру клеток асцитной опухоли, клональных сублиниях монослойной линии – 1Е, 3Н, 5F, 6H, 9С, и на клетках постоянных монослойных линий – гепатомы НТС крысы, гепатом MH-22a и BWTG3 мыши, гепатобластомы HepG2 человека – из Российской коллекции клеточных культур позвоночных Института цитологии РАН. Клетки монослойных линий культивировали в среде DMEM (Биолот, Россия) c L-глутамином, содержащей 4.5 г/л глюкозы (Биолот, Россия), 10% сыворотки эмбриональной телячьей (СЭТ) Sus-Biol (Биолот, Россия) и 20 мкг/мл гентамицина, в атмосфере 5% CO2 при 37°С. Клетки суспензионной линии гепатомы Зайдела культивировали в среде RPMI-1640 (Биолот, Россия) c 10% СЭТ при тех же условиях.
Протеолитическую активность ММП определяли в культуральной среде на 4-е сут после посева клеток с помощью метода зимографии как описано ранее (Воронкина и др., 2008). При проведении электрофореза в качестве субстрата использовали желатин – для определения ММП-2 и ММП-9, и казеин – для определения ММП-1. После инкубации гель окрашивали Кумасси синим R-250. При этом зоны, содержащие ММП, проявлялись в виде неокрашенных полос. Для количественной оценки активности ММП гели сканировали и полученные изображения обрабатывали с помощью программы QuantiScan 2.1. Результаты денситометрии (за вычетом значений активности ММП в питательной среде) представляли в виде гистограмм.
Миграцию клеток оценивали с помощью теста на зарастание “царапины”. Клетки выращивали в чашках Петри примерно до 90% конфлюэнтности. Формирующийся монослой повреждали путем нанесения “царапины” вдоль диаметра чашки с помощью наконечника для автоматического дозатора и меняли среду в чашках на свежую для удаления открепившихся клеток. Далее клетки культивировали в среде DMEM с добавлением 10% СЭТ. Cразу после нанесения “царапины”, а также через 24 и 48 ч культивирования клетки фотографировали с помощью цифровой камеры Canon PowerShot A1100 IS через окуляр (6.3×) инвертированного микроскопа ЛОМО Биолам П-1 (объектив 2.5×). Регистрацию процесса зарастания “царапины” в режиме цейтраферной видеосъемки проводили в течение 24 ч с помощью микроскопа AxioObserver.Z1 (Carl Zeiss MicroImaging GmbH, Германия), оборудованного устройствами для долговременного прижизненного наблюдения за клетками (поддержание температуры, влажности и СО2) с интервалами времени между кадрами 2 мин. Использовали объектив Plan-Neofluar ×10/0,25 и цифровую камеру – AxioCam HRm с разрешением 1388 × 1040 пикс. Метод наблюдения – дифференциальный интерференционный контраст, адаптированный для работы с пластиком (PLASDIC). Заданные условия эксперимента поддерживались автоматически программой AxioVision 4.8.2 (Carl Zeiss MicroImaging GmbH, Германия).
Длину пути (скорость миграции) рассчитывали для выбранных случайным образом после цейтраферной съемки индивидуальных клеток, которые находились в поле зрения на протяжении 10 ч в середине 24-часового срока наблюдения. Оцифрованные изображения анализировали с помощью программы ImageJ. В каждой линии отбирали 30 клеток с помощью генератора случайных чисел, определяли координаты их положения в каждом из 30 измерений, сделанных с интервалом 20 мин, и рассчитывали пройденный ими путь и среднюю скорость.
Экспрессию и локализацию EpCAM в клетках клональных сублиний определяли с помощью метода непрямой иммунофлуоресценции и последующей сканирующей лазерной конфокальной микроскопии. Клетки выращивали на покровных стеклах, фиксировали в течение 15 мин в 4%-ном растворе параформальдегида (Santa-Cruz Biotechnology, США), приготовленного на 10 мМ фосфатном буфере, содержащем 150 мМ NaCl (рН 7.4), и пермеабилизировали с помощью 0.5%-ного раствора Тритона Х-100. Для разведения антител и промывки препаратов использовали тот же буфер с добавлением 0.1% Твин-20. В работе использовали первичные козлиные антитела к EpCAM (A-20) (Santa-Cruz Biotechnology, США) и вторичные ослиные антитела против козлиных IgG, коньюгированные с FITC. Клетки обрабатывали первичными антителами (разведение 1 : 50) в течение ночи при 4°С. Обработку клеток вторичными антителами (разведение 1 : 200) проводили в течение 1 ч в темноте при комнатной температуре. Для визуализации ядер ДНК клеток окрашивали DAPI (Santa-Cruz Biotechnology, США) в течение 1 мин при концентрации 1 мкг/мл. Препарат заключали в среду Fluoroshield (Sigma, США), и иммунофлуоресцентные изображения клеток получали на электронном конфокальном микроскопе Leica TCS SP5 с использованием лазеров с длинами волн 488 и 543 нм и масляно-иммерсионного объектива 40×.
Статистическая обработка данных. Для всех количественных параметров определяли среднее арифметическое, стандартное отклонение и ошибку среднего. Достоверность различий между линиями рассчитывали с помощью t-критерия Стьюдента. Различия считали достоверными при Р < 0.05.
РЕЗУЛЬТАТЫ
Повышенная активность ММП-9 и ММП-1, секретируемых клетками монослойных линий гепатомы Зайдела. Мы сравнили полученные после эксплантации в культуру суспензионную и монослойную линии гепатомы Зайдела по активности секретируемых ММП-1, -2 и -9, участие которых в ЭМП инвазивных гепатоцеллюлярных карцином (ГК) считается доказанным (Scheau et al., 2019). По результатам зимографии оказалось, что при невысокой активности ММП-1 и ММП-2 клеточные линии принципиально различались по активности ММП-9 (рис. 1а, б). На зимограмме четко видно, что гетерогенные по составу клетки монослойной линии секретировали активные формы ММП-9 с мол. массой 80–84 кДа, отсутствующие в культуральной среде суспензионной линии (рис. 1а).
Рис. 1.
Активность коллагеназы ММП-1 и желатиназ ММП-2 и ММП-9 в культуральной среде клеточных линий гепатоцеллюлярных опухолей.
Представлены зимограммы (а, в) и гистограммы (б, г), построенные по результатам денситометрии гелей (за вычетом значений активности ММП в исходной питательной среде): а, б – клетки монослойной (1) и суспензионной (2) линий гепатомы Зайдела и питательные среды DMEM (3) и RPMI-1640 (4) с добавлением 10% СЭТ, используемые для их культивирования соответственно; в, г – клетки постоянных гепатоцеллюлярных линий MH-22a (1), BWTG3 (2), HepG2 (3), НТС (4) и сублиний монослойной гепатомы Зайдела – трех голоклональных 3Н (6), 5F (7), 6H (8) и двух мероклональных 1Е (5), 9С (9); 10 – среда DMEM с добавлением 10% СЭТ, используемая для их культивирования. Выявлена секреция активных форм ММП-9 у клеток всех монослойных линий гепатомы Зайдела (и родительской, и дочерних) и повышенная активность ММП-1 у клеток ее голоклональных сублиний.
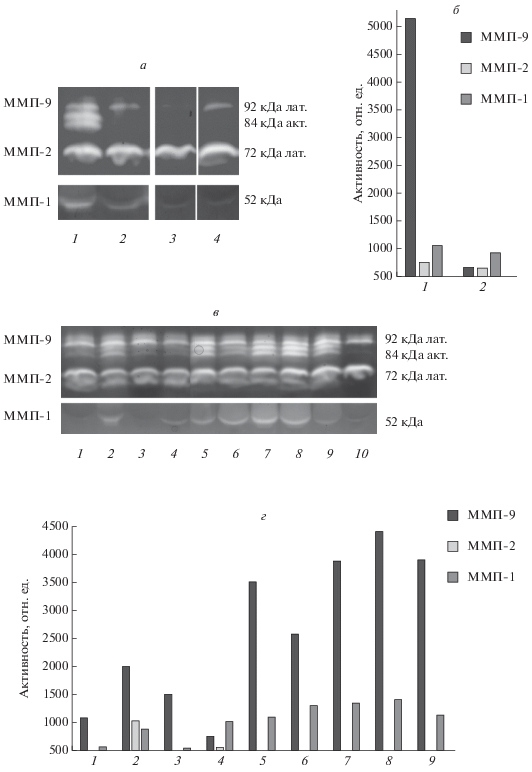
На рис. 1в, г представлены результаты определения активности тех же ММП в клетках клональных сублиний гепатомы Зайдела и в клетках монослойных линий других гепатоцеллюлярных опухолей. На зимограмме видно, что клетки всех клональных сублиний секретировали активные формы ММП-9, и по активности фермента многократно превышали клетки постоянных линий гепатом МН-22а, BWTG3, НТС и гепатобластомы HepG2. Также следует отметить, что клетки голоклональных сублиний 3Н, 5F и 6Н характеризовались более высокой (примерно в 1.4 раза) активностью ММП-1, чем клетки мероклональных сублиний или клетки постоянных линий. Полученные данные, на наш взгляд, позволяют предположить, что как высокий уровень активности ММП-9 у клеток всех клональных сублиний, так и повышенный уровень активности ММП-1 у клеток голоклональных сублиний связан с опухолевой прогрессией и переходом клеток к миграторному фенотипу.
Индивидуальный тип миграции и высокая скорость клеток голоклональных сублиний гепатомы Зайдела. Сравнение подвижности клеток голоклональных и мероклональных сублиний гепатомы Зайдела мы начали с теста на зарастание “царапины” в его обычной постановке, регистрируя ширину образовавшегося свободного пространства в монослое в начале и в конце эксперимента. В ходе такого тестирования мы наблюдали активное сближение краев “царапины” у клеток мероклональных сублиний (рис. 2а–в), тогда как у клеток голоклональных линий в пространстве царапины через 48 ч оказывались одиночные клетки, не составлявшие целостного монослоя (рис. 2г–е).
Рис. 2.
Тест на зарастание “царапины”. Клетки выращивали до 85–90% конфлюэнтности монослоя и удаляли его часть, нанося “царапину” с помощью наконечника для автоматического дозатора. Ширину “царапины” фиксировали сразу после нанесения (а, г, ж), а также через 24 ч (б, д, з) и 48 ч (в, е, и) культивирования клеток. Наблюдали восстановление монослоя через 48 ч клетками мероклональной сублинии гепатомы Зайдела (а–в), миграцию в свободное пространство “царапины” одиночных клеток ее голоклональной сублинии (г–е) и слабую миграционную активность (ж–и) клеток гепатобластомы HepG2 человека.
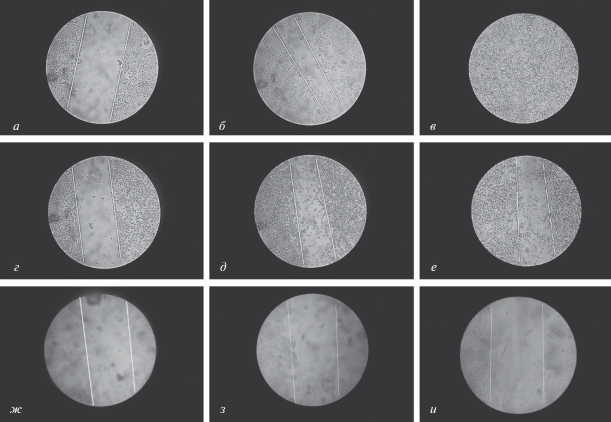
Иная картина наблюдалась для клеток гепатобластомы HepG2, у которых за 48 ч не происходило ни сближения краев “царапины”, ни проникновения в свободное пространство одиночных клеток, что свидетельствует об их низкой миграционной активности. При этом клеточный монослой по краям “царапины” заметно уплотнялся за счет пролиферации клеток в присутствии 10% СЭТ (рис. 2ж–и).
Для дальнейшего сопоставления характера и скорости движения клеток исследуемых линий мы использовали видеоматериалы проводившейся длительной (20–24 ч) цейтраферной съемки (видеомикроскопии). Анализ видеоизображений показал, что в зависимости от степени дедифференцировки клетки гепатом используют коллективный и (или) индивидульный способы миграции.
Коллективная (или групповая, щитовая) миграция наблюдалась при движении эпителиоподобных клеток гепатом Зайдела, НТС и фибробластоподобных клеток гепатомы BWTG3. Движение клеток в экспериментальную рану начиналось в течение первого часа после нанесения царапины: лидирующие клетки увеличивались по площади (распластывались) и формировали плоские ламеллиподии, обеспечивающие продвижение клеточных пластов в свободное пространство “царапины” (рис. 3а–г, рис. 4г).
Рис. 3.
Тест на зарастание “царапины”: коллективный тип миграции эпителиоподобных клеток. Через 30–60 мин после нанесения “царапины” в клеточном монослое проводили цейтраферную съемку в течение 24 ч с интервалами между кадрами 2 мин. На рисунках представлены 1-й, 100-й, 200-й … 600-й кадры. Наблюдали сближение клеточных пластов (и появление в пространстве “царапины” одиночных клеток мезенхимного типа) у монослойной родительской линии гепатомы Зайдела (а), дочерних мероклональных сублиний 1Е (б) и 9С (в) и гепатомы НТС (г) крысы. Движение практически отсутствовало у клеток мышиной гепатомы МН-22а (д).

Рис. 4.
Тест на зарастание “царапины”: миграция фибробластоподобных клеток. Цейтраферную съемку начинали через 30–60 мин после нанесения “царапины” в клеточном монослое и проводили ее в течение 24 ч с интервалами между кадрами 2 мин. На рисунках представлены 1-й, 100-й, 200-й …600-й кадры. Наблюдали индивидуальный тип миграции клеток голоклональных сублиний 3Н (а), 5F (б), 6H (в) и коллективный тип миграции клеток мышиной гепатомы BWTG3 (г).

Для монослойной линии гепатомы Зайдела (рис. 3а) и в меньшей степени для обеих мероклональных сублиний гепатомы Зайдела (рис. 3б, в) и постоянной линии гепатомы НТС (рис. 3г) характерным было появление в пространстве “царапины” фибробластоподобных клеток, которые отделялись от пластов эпителиоподобных клеток. При этом одиночные клетки линии НТС сдвигались только к центру “царапины”, тогда как клетки гепатомы Зайдела хаотично перемещались в разных направлениях свободного пространства. По мере зарастания “царапины” клетки гепатомы Зайдела, использующие индивидуальный способ передвижения, восстанавливали контакты с клетками смыкающихся пластов и приобретали эпителиоподобную морфологию. Можно предположить, что клетки, изменяющие таким образом форму при движении, находятся в переходных между эпителиоподобным и мезенхимным состояниях.
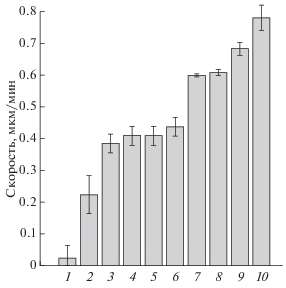
По скорости миграции эпителиоподобные клетки монослойной линии гепатомы Зайдела, ее мероклональных сублиний (1Е и 9С) и гепатомы НТС почти не отличались: в среднем, она составляла соответственно 0.44 ± 0.02, 0.39 ± 0.04, 0.41 ± 0.03 и 0.41 ± 0.03 мкм/мин (рис. 5). Клетки гепатомы BWTG3, морфология которых ближе к фибробластоподобной, также начинали движение внутрь свободного пространства “царапины” в тесном контакте друг с другом (рис. 4г), демонстрируя коллективный тип клеточной миграции. Через 12–15 ч обнаруживались группы клеток и отдельные клетки с более высокой подвижностью, однако их контакты с клеточным пластом и направление миграции сохранялись. Средняя скорость коллективной миграции фибробластоподобных клеток гепатомы BWTG3 составляла 0.22 ± 0.01 мкм/мин, т.е. не была выше скорости коллективного движения эпителиоподобных клеток (рис. 5).
Рис. 5.
Скорость миграции клеток в тесте на зарастание “царапины”. Анализировали движение индивидуальных клеток, находившиxся в поле зрения на протяжении 10 ч в середине 24-часового срока наблюдения. Используя генератор случайных чисел, отбирали 30 клеток и с помощью программы ImageJ определяли координаты положения клетки в каждом из 30 измерений, сделанных с интервалом 20 мин, рассчитывали пройденный клеткой путь и среднюю скорость. Выявили высокую скорость индивидуальной миграции клеток мезенхимного типа в монослойной линии гепатомы Зайдела (10) и голоклональных сублиниях 3Н (9), 6Н (8) и 5F (7); а также неодинаковую среднюю скорость эпителиоподобных клеток при коллективном типе их миграции в сравниваемых линиях: умеренно высокую – в монослойной линии гепатомы Зайдела (6), ее мероклональных сублиниях 1Е (3), 9С (4) и линии гепатомы НТС (5), умеренную – в линии гепатомы BWTG3 (2) и низкую – в линии гепатомы MH-22a (1).
Клетки мышиной гепатомы MH-22a, которые также ближе к фибробластоподобным, несмотря на появившуюся возможность миграции в свободное пространство “царапины”, за весь период наблюдения практически не изменили положения краев царапины (рис. 3д). Лишь у единичных клеток этой линии обнаруживались тонкие протрузии и индивидуальное движение.
Иную картину мы наблюдали у фибробластоподобных клеток моноклональной линии гепатомы Зайдела и ее дочерних голоклональных сублиний 3H, 5F и 6Н, которые демонстрировали индивидуальный тип миграции с активным и неупорядоченным движением клеток в свободном пространстве “царапины” без существенного сближения краев рыхлых клеточных пластов (рис. 4а–в). Cредние скорости миграции фибробластоподобных клеток всех перечисленных линий были высокими и составляли 0.78 ± 0.04 мкм/мин для монослойной линии гепатомы Зайдела, и 0.68 ± 0.07, 0.60 ± 0.03 и 0.61 ± 0.03 мкм/мин для ее голоклональных сублиний 3H, 5F и 6H соответственно.
В целом, скорости индивидуальной миграции у фибробластоподобных клеток гепатомы Зайдела оказывались примерно в 1.5–1.8 раз выше, чем средние скорости у коллективно мигрирующих эпителиоподобных клеток гепатом Зайдела и НТС, и в 2.7–3.0 раза выше, чем таковые у фибробластоподобных клеток гепатомы BWTG3 (рис. 5).
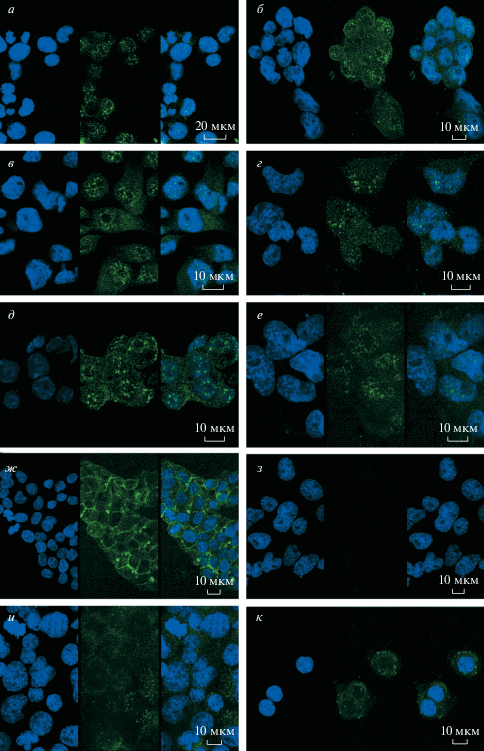
Ядерная локализация EpICD в клетках гепатомы Зайдела. Для изучения экспрессии и локализации гликопротеина EpCAM в клетках культивируемых линий мы использовали антитела, полученные к его внутриклеточному домену EpICD. Регистрация иммунофлуоресценции EpICD показала, что культивируемые линии гепатом различались по экспрессии EpCAM, и если в клетках BWTG3 (рис. 6з) специфическое EpICD-свечение отсутствовало, то в клетках линий НТС (рис. 6и) и МН-22а (рис. 6к) наблюдали слабую диффузную флуоресценцию в области цитоплазмы и (или) плазматических мембран. Клетки гепатобластомы HepG2 характеризовались интенсивным свечением EpICD вдоль плазматических мембран и более слабым свечением цитоплазмы, что находится в полном соответствии с данными других авторов о мембранной локализации EpCAM в клетках этой линии (Yamashita et al., 2007; Kim et al., 2014). Иную локализацию EpICD-иммунофлуоресценции мы обнаружили во всех линиях гепатомы Зайдела – в клетках родительской монослойной линии, ее голоклональных (3Н, 5F, 6H) и мероклональных (1Е, 9С) сублиний (рис. 6а–е соответственно), у которых она определялась преимущественно в ядрах. При этом в ядрах крупные, ярко флуоресцирующие зерна, как правило, формировали кольцеподобные структуры вокруг ядрышек; цитоплазма клеток окрашивалась слабо и диффузно, свечения наружных мембран не наблюдалось.
Рис. 6.
Экспрессия и локализация EpCAM в клетках культивируемых линий гепатоцеллюлярных опухолей. Для обнаружения транслокации EpCAM вследствие его внутримембранного протеолиза использовали антитела к его внутриклеточному домену EpICD (зеленый цвет). Для визуализации ядер использовали DAPI (синий цвет). Выявили различия в локализации EpICD в клетках исследованных линий: в монослойной линии гепатомы Зайдела (а), ее голоклональных (б–г) и мероклональных сублиниях (д, е) EpICD-флуоресценцию наблюдали в ядрах клеток (свечение в виде ярких гранул) и в цитоплазме (диффузное свечение); клетки гепатобластомы HepG2 (ж) характеризовались интенсивным свечением EpICD вдоль плазматических мембран и более слабым свечением цитоплазмы; в клетках линий НТС (и) и МН-22а (к) наблюдали слабую диффузную флуоресценцию в области цитоплазмы и (или) плазматических мембран; в клетках BWTG3 (з) специфического EpICD-свечения не выявлено.
ОБСУЖДЕНИЕ
Метастазирование продолжает оставаться главной проблемой в борьбе с онкологическими заболеваниями. Карциноматозный выпот в брюшной полости (асцит) появляется вследствие опухолевого поражения брюшины и может наряду с единичными опухолевыми клетками содержать флотирующие многоклеточные островки. Природа и биологическое значение этих структур изучены недостаточно. Предполагают, что сфероидные клеточные колонии, присутствующие в асцитной жидкости пациентов с карциномой яичников существуют как форма выживания опухолевых клеток в асците (Shield et al., 2009). По мнению авторов этой работы, после открепления от первичной опухоли одиночные клетки подвержены апоптозу, а процесс их агрегации служит защитным механизмом против аноикиса. Последующие этапы метастазирования обусловлены прикреплением сфероидов к внутренней оболочке брюшной полости, их дезагрегацией до одиночных клеток и инфильтрацией мезотелия (Burleson et al., 2004, 2006).
Рост асцитной гепатомы Зайдела в перитонеальной полости крыс сопровождается образованием флотирующих многоклеточных островков, которые различаются по адгезивности. Подтверждением этого являются наши наблюдения за клетками при их эксплантации в культуру in vitro: при культивировании в питательной среде с 10% СЭТ часть островков прикреплялась к подложке и клетки формировали монослой, тогда как другие островки оставались в суспензии. Мы предполагаем, что в условиях in vivo часть многоклеточных островков асцитной опухоли также прикрепляется к внутренней оболочке брюшной полости крыс, клетки инвазируют сквозь нее и диссеминируют в отдаленные органы-мишени.
Подтверждением инвазивности прикрепляющихся клеток гепатомы Зайдела являются полученные нами данные о высокой активности ММП-9, секретируемых клетками монослойной линии, и обнаружение в культуральной среде активных форм желатиназы В, присущих клеткам высокометастатических опухолей. На критическую роль активации этих желатиназ в опухолевом росте и инвазии указывает также целый ряд других исследований. Например, в образцах ГК и панкреатических аденокарцином методом зимографии выявлено, что активность ММП-2 увеличивается по сравнению с соседней нормальной тканью за счет обеих форм ММП-2, в то время как активность ММП-9 растет в результате появления активных форм этой желатиназы (Määttä et al., 2000). Установлено, что высокая метастатическая активность клеточных линий ГК человека сочетается с высокой активностью ММП-9, оверэкспрессия которой в образцах опухоли пациентов с ГК имеет важное прогностическое значение (Chen et al., 2012). Показано также, что клетки высокоинвазивной линии А431, полученные путем селекции от родительской линии клеток, характеризуются высоким уровнем активности ММП-9 (Kao et al., 2008). Доказана связь между высокой активностью ММП-9 и промоцией ЭМП (Lin et al., 2011): активация ММП-9 в клетках метастатической линии стимулирует фенотипические изменения (появление веретенообразных клеток), которые сопровождаются изменениями в активности генов, связанных с клеточной адгезией, реорганизацией цитоскелета, полярностью клеток и миграцией. Предполагают, что активация ММП-9 является не только следствием ЭМП, но и сама ММП-9 в кооперации с транскрипционным фактором SNAIL1 участвует в регуляции ЭМП (Farina, Mackay, 2014; Scheau et al., 2019).
Таким образом, высокая активность ММП-9 в фибробластоподобных клетках голоклональных и эпителиоподобных клетках мероклональных сублиний гепатомы Зайдела и секреция ими активных форм этого фермента прямо свидетельствуют о том, что данные клетки пребывают в состоянии ЭМП, в отличие от клеток всех других гепатоцеллюлярных линий, исследованных в наших экспериментах.
Участие коллагеназы ММП-1 в опухолевой прогрессии и метастазировании изучено в меньшей степени, но в отдельных работах показана связь между активностью этого фермента у опухолевых клеток, скоростью их миграции, инвазии и диссеминации (Pulukuri, Rao, 2008; Cierna et al., 2014). В наших экспериментах прослеживалась определенная согласованность между активностью ММП-1 и скоростью миграции клеток: так, наиболее высокая активность ММП-1 и максимальная скорость миграции были выявлены в группе клеток голоклональных сублиний гепатомы Зайдела, и наоборот, минимальная скорость передвижения при низкой активности ММП-1 были обнаружены в клетках постоянных линий гепатомы мыши МН-22а и гепатобластомы HepG2.
Изучение подвижности клеток с помощью традиционного теста на зарастание царапины оказалось информативным не для всех исследованных нами гепатоцеллюлярных линий. Тест оказался приемлемым только для тех постоянных линий, клетки которых двигались в составе многоклеточных пластов, сближение которых приводило к сужению пространства “царапины”. Действительно, по скорости и степени такого сужения за время наблюдения можно судить о средней скорости движения клеток в составе указанных пластов. Оказалось, однако, что такой простой замер сужения “царапины” не годится для оценки двигательной активности клеток при индивидуальном типе их миграции.
Ранее длительное наблюдение за клетками монослойной линии гепатомы Зайдела с использованием цейтраферной съемки позволило нам анализировать поведение индивидуальных клеток, способы, направление и скорость их миграции, изменчивость клеточной морфологии, а также продолжительность клеточного цикла и некоторые другие параметры (Петров и др., 2017, 2018). В настоящей работе с помощью цейтраферной съемки мы определили у клеток голо- и мероклональных сублиний различия в типах миграции (в составе многоклеточного пласта и индивидуально-автономный), в способах движения индивидуальных клеток (мезенхимном и амебоидно-псевдоподиальном), наблюдали переходы клеток от коллективного к индивидуальному типу движения и смену способов их движения от одного к другому.
Еще одним новым и важным результатом настоящей работы следует считать обнаружение нами ядерной локализации EpICD – цитоплазматического домена EpCAM в клетках всех 6 монослойных клеточных линий (родительской и 5 клональных сублиний), полученных после эксплантации в культуру in vitro клеток асцитной гепатомы Зайдела.
Экспрессия EpCAM в клетках ГК регулируется активностью Wnt-beta-катенин-сигнального пути, непосредственным геном-мишенью которого является EpCAM. В большинстве нормальных EpCAM-позитивных эпителиальных тканей функциональная роль EpCAM сводится только к межклеточной гомотипической адгезии. Однако в опухолях эпителиального происхождения и в опухолеинициирующих клетках EpCAM участвует в передаче митогенного сигнала и поддержании низкодифференцированного статуса. Трансмембранный гликопротеин EpCAM с мол. массой 32–42 кДа состоит из эктодомена EpEX, трансмембранного домена и короткого С-терминального эндодомена EpICD. Активация EpCAM-зависимого сигнального пути начинается c регулируемого внутримембранного протеолиза Ep-CAM, в результате которого эктодомен EpEX отщепляется в межклеточную среду, а эндодомен EpICD – в цитоплазму, где в комплексе с FHL2, бета-катенином и Lef-1 перемещается в ядро и связывается с ДНК для непосредственного участия в регуляции транскрипции генов репрограммирующих факторов и генов ЭМП, таких как виментин и SNAIL1 (Munz et al., 2009; Lin et al., 2012; Hachmeister et al., 2013; Oishi et al., 2014).
В серии работ на образцах опухолей эпителиального происхождения различного гистогенеза с использованием антител к эндодомену EpICD и к эктодомену EpEX показано, что плохой прогноз онкозаболевания коррелирует со сменой мембранной локализации эндодомена на ядерную (Ralhan et al., 2010; Fong et al., 2014). Установлено, в том числе и на клетках ГК, что гиперэкспрессия EpICD значительно увеличивает пролиферацию, миграционную активность и инвазивность опухолевых клеток (Jachin et al., 2014; Park et al., 2016), а снижение экспрессии эпителиальных маркеров, включая EpCAM, на поверхности циркулирующих опухолевых клеток происходит в соответствии с реализацией программы ЭМП и сопровождается повышением уровня экспрессии мезенхимных маркеров (Gorges et. al., 2012; Gires et al., 2014; Raimondi et al., 2015).
Зрелые гепатоциты не экспрессируют EpCAM. У человека EpCAM обнаруживается в 35% случаев ГК, из них EpCAM- и α-фетопротеин-позитивные опухоли (как гепатома Зайдела) принадлежат к подтипу ГК, подобных печеночным стволовым клеткам (Yamashito et al., 2008, 2009). EpCAM-позитивные популяции клеток, выделенные из клеточных линий ГК человека, содержат высоко туморогенные клеточные субпопуляции с характеристиками ОСК (Kimura et al., 2010). Ранее мы идентифицировали EpCAM в составе фракции наружных мембран клеток асцитной гепатомы Зайдела (Терюкова и др., 2010) и предположили, что клетки полученных нами сублиний могут отличаться между собой по локализации в них EpCAM, а точнее, его внутриклеточного домена EpICD. Учитывая возможность внутримембранного протеолиза EpCAM для его определения в клетках культивируемых линий гепатомы Зайдела и других гепатоцеллюлярных линий в настоящей работе мы использовали антитела к EpICD. В результате диффузное EpICD-окрашивание цитоплазмы было обнаружено у клеток большинства линий, за исключением BWTG-3, но интенсивная флуоресценция в области плазматических мембран была установлена только для клеток гепатобластомы HepG2. Отличием всех линий гепатомы Зайдела (как клеток голоклональных сублиний – с мезенхимным фенотипом и индивидуальным типом миграции, так и клеток мероклональных сублиний – с их эпителиоподобной морфологией и коллективным типом миграции) явилась транслокация EpICD с плазматической мембраны в ядро. По всей вероятности, именно ядерной локализацией внутриклеточного домена EpCAM обусловлен высокий пролиферативный потенциал обоих типов дочерних сублиний гепатомы Зайдела (Терюкова и др., 2016). Следует отметить, что мы впервые получили из перевиваемой in vivo опухоли клеточные линии c ядерной локализацией EpICD. Мы предполагаем, что транслокация EpICD с плазматической мембраны в ядро является надежным маркером опухолевых клеток, находящихся в транзитном состоянии между эпителиальным и мезенхимным фенотипом.
Секреция активных форм ММП-9, ядерная локализация EpICD, изменение морфологии клеток от эпителиоподобной к мезенхимной и обратно в процессе коллективной миграции клеток мероклональных сублиний, фибробластоподобная морфология при индивидуальном типе миграции клеток голоклональных сублиний являются, на наш взгляд, достаточными основаниями, чтобы рассматривать эти клеточные субпопуляции в качестве обязательных участников цепи событий, объединенных понятиями ЭМП и обратного мезенхимно-эпителиального перехода (МЭП). Мы предполагаем, что инвазируя опухолевую капсулу первичной солидной гепатомы Зайдела, клетки образующейся асцитной опухоли оказались в транзитном состоянии между эпителиальным и мезенхимным фенотипом. При этом, голоклональные сублинии произошли от тех клоногенных клеток асцитной гепатомы Зайдела, которые в процессе ЭМП достигли относительно стабильного мезенхимного фенотипа, а мероклональные сублинии – от клоногенных клеток, пребывавших в нестабильных транзитных состояниях незавершенного ЭМП (Nieto et al., 2016). Вероятно, благодаря свойству легко “разворачиваться” от эпителиоидного фенотипа к мезенхимному и обратно, потомки таких клеток-прародительниц в мероклональных сублиниях и составляют популяцию фенотипически более гетерогенных клеток, находящихся в континууме ЭМП–МЭП, у которых межклеточные контакты ослаблены, но сохраняются, так же как сохраняется или легко восстановима способность к адгезии, возможно, используемая клеточными островками асцитной гепатомы для закрепления на субстрате (брюшине).
Выявленные в наших работах при культивировании in vitro отличия клеток голоклональных сублиний гепатомы Зайдела по морфологии, по характеру роста в монослое, по клоногенности, по типу и скорости миграции, по активности коллагеназы ММП-1 и по туморогенности после их введения в перитонеальную полость беспородных крыс позволяют с высокой вероятностью считать, что именно клетки-прародительницы этих сублиний относятся к субпопуляции метастатических ОСК асцитной гепатомы Зайдела. Для подтверждения нашей гипотезы необходимы дополнительные исследования in vivo по изучению способности клеток голоклональных сублиний инициировать рост гетерогенной по клеточному составу асцитной формы опухоли и вторичных опухолевых узлов.
Список литературы
Воронкина И.В., Кирпичникова К.М., Смагина Л.В., Кожухарова И.В., Гамалей И.А. 2011. Изменение активности матриксных металлопротеиназ первичных эмбриональных фибробластов мыши в процессе культивирования. Цитология. Т. 53. № 1. С. 49. (Voronkina I.V., Kirpichnikova K.M., Smagina L.V., Kozhucharova I.V., Gamaley I.A. 2011. Dynamics of matrix metalloproteinases activity of primary murine embryonic fibroblasts during cultivation. Tsitologiya. V. 53. № 1. P. 49.)
Зайдела Ф. 1963. Применение асцитной гепатомы для изучения цитологии рака. Вопр. онкол. Т. 9. № 5. С. 25. (Zajdela F. 1963. Application of an ascitic hepatoma for studying of cytology of cancer. Vopr. Onkol. V. 9. № 5. P. 25.)
Киселева Н.С., Паникаровский В.В. 1964. Динамика развития отдаленных метастазов при асцитных опухолях крыс. Вопр. онкологии. Т. 10. № 3. С. 41. (Kiseleva N.S., Panikarovskii V.V. 1964. Dynamics of the development of remote metastases of ascites tumors in rats. Vopr. Onkol. V. 10. № 3. P. 41.)
Петров Ю.П., Терюкова Н.П., Сахенберг Е.И., Иванов В.А., Снопов С.А. 2017. Сравнение продолжительности клеточного цикла монослойной линии гепатомы Зайдела и ее сублиний 3H и 9C в культуре. Цитология. Т. 59. № 3. С. 185. (Petrov Y.P., Teryukova N.P., Sakhenberg E.I., Ivanov V.A., Snopov S.A. 2017. Comparison of cell cycle duration in the monolayer cell line of hepatoma Zajdela and its sublines 3H and 9C cultured in vitro. Tsitologiya. V. 59. № 3. P. 185.)
Петров Ю.П., Терюкова Н.П., Снопов С.А. 2018. Поведение клеток монослойной линии гепатомы Зайдела в области экспериментальной раны. Цитология. Т. 60. № 4. С. 299. (Petrov Yu.P., Teryukova N.P., Snopov S.A. 2018. The behavior of Zajdela hepatoma monolayer line cells of in the space of experimental wound. Tsitologiya. V. 60. № 4. P. 299.)
Терюкова Н.П., Блинова Г.И., Иванов В.А. 2013. Клетки гепатомы Зайдела при культивировании in vitro. Цитология. Т. 55. № 1. С. 36. (Teryukova N.P., Blinova G.I., Ivanov V.A. 2013. Zajdela hepatoma cells cultured in vitro. Tsitologiya. V. 55. № 1. P. 36.)
Терюкова Н.П., Ивашкина П.А., Миргородская О.А., Иванов В.А. 2005. Выявление и идентификация опухолеассоциированного гетероорганного антигена гепатомы Зайдела в составе негистоновых белков хроматина. Цитология. Т. 47. № 12. С. 1048. (Teryukova N.P., Ivashkina P.A., Mirgorodskaya O. A., Ivanov V. A. 2005. Detection and identification of a tumor-associated heteroorganic antigen of Zajdela hepatoma in non-histone proteins of chromatin. Tsitologiya. V. 47. № 12. P. 1048.)
Терюкова Н.П., Миргородская О.А., Серебрякова М.В., Иванов В.А. 2010. Выявление и идентификация опухолеассоциированных антигенов в составе фракции, обогащенной плазматическими мембранами клеток асцитной гепатомы Зайдела. Цитология. Т. 52. № 10. С. 827. (Teryukova N.P., Mirgorodskaya O.A., Serebryakova M.V., Ivanov V.A. 2010. Detection and identification of tumor-associated antigens in the fraction enriched with plasma membranes of the Zajdela hepatoma cells. Tsitologiya. V. 52. № 10. P. 827.)
Терюкова Н.П., Сахенберг Е.И., Иванов В.А., Снопов С.А. 2016. Получение и характеристика клональный линий монослойной гепатомы Зайдела с признаками опухолевых стволовых и прогениторных клеток. Цитология. Т. 58. № 11. С. 832. (Teryukova N.P., Sakhenberg E.I., Ivanov V.A., Snopov S.A. 2017. Establishment and characterization of monolayer hepatoma Zajdela clonal lines with signs of cancer stem cells and progenitor cells. Tsitologiya. V. 58. № 11. P. 832.)
Тюряева И.И., Филатова Н.А., Розанов Ю.М., Демин С.Ю., Блинова Г.И., Иванов В.А. 2010. Морфологическая и функциональная гетерогенность клеток асцитной гепатомы Зайдела крысы. Цитология. Т. 52. № 10. С. 817. (Tiuriaeva I.I., Filatova N.A., Rozanov Yu.M., Demin S.Iu., Blinova G.I., Ivanov V.A. 2010. Morphological and functional heterogeneity of rat ascitic hepatoma Zajdela cells. Tsitologiya. V. 52. № 10. P. 817.)
Baccelli I., Trumpp A. 2012. The evolving concept of cancer and metastasis stem cells. J. Cell Biol. V. 198. P. 281. https://doi.org/10.1083/jcb.201202014
Brabletz T., Jung A., Spaderna S., Hlubek F., Kirchner T. 2005a. Opinion: Migrating cancer stem cells – an integrated concept of malignant tumour progression. Nat. Rev. Cancer. V. 5. P. 744. https://doi.org/10.1038/nrc1694
Brabletz T., Hlubek F., Spaderna S., Schmalhofer O., Hiendlmeyer E., Jung A., Kirchner T. 2005b. Invasion and metastasis in colorectal cancer: Epithelial-mesenchymal transition, mesenchymal-epithelial transition, stem cells and β-catenin. Cells Tissues Organs. V. 179. P. 56. https://doi.org/10.1159/000084509
Burleson K.M., Boente M.P., Pambuccian S.E., Skubitz A.P. 2006. Disaggregation and invasion of ovarian carcinoma ascites spheroids. J. Transl. Med. V. 4. P. 6. https://doi.org/10.1186/1479-5876-4-6
Burleson K.M., Casey R.C., Skubitz K.M., Pambuccian S.E., Skubitz A.P. 2004. Ovarian carcinoma ascites spheroids adhere to extracellular matrix components and mesothelial cell monolayers. Gynecol. Oncol. V. 93. P. 170. https://doi.org/10.1016/j.ygyno.2003.12.034
Cierna Z., Mego M., Janega P., Karaba M., Minarik G., Benca J., Sedlácková T., Cingelova S., Gronesova P., Manasova D., Pindak D., Sufliarsky J., Danihel L., Reuben J.M., Mardiak J. 2014. Matrix metalloproteinase 1 and circulating tumor cells in early breast cancer. BMC Cancer. V. 14. P. 472. https://doi.org/10.1186/1471-2407-14-472
Chen R., Cui J., Xu C., Xue T., Guo K., Gao D., Liu Y., Ye S., Ren Z. 2012. The significance of MMP-9 over MMP-2 in HCC invasiveness and recurrence of hepatocellular carcinoma after curative resection. Ann. Surg. Oncol. V. 19. P. 375. https://doi.org/10.1245/s10434-011-1836-7
Farina A.R., Mackay A.R. 2014. Gelatinase B/MMP-9 in tumour pathogenesis and progression. Cancers (Basel). V. 6. P. 240. https://doi.org/10.3390/cancers6010240
Fong D., Seeber A., Terracciano L., Kasal A., Mazzoleni G., Lehne F., Gastl G., Spizzo G. 2014. Expression of EpCAM(MF) and EpCAM(MT) variants in human carcinomas. J. Clin. Pathol. V. 67. P. 408. https://doi.org/10.1136/jclinpath-2013-201932
Gorges T.M., Tinhofer I., Drosch M., Röse L., Zollner T.M., Krahn T., von Ahsen O. 2012. Circulating tumour cells escape from EpCAM-based detection due to epithelial-to-mesenchymal transition. BMC Cancer. V. 12. P. 178. https://doi.org/10.1186/1471-2407-12-178
Gires O., Stoecklein N.H. 2014. Dynamic EpCAM expression on circulating and disseminating tumor cells: causes and consequences. Cell Mol. Life Sci. V. 71. P. 4393. https://doi.org/10.1007/s00018-014-1693-1
Hachmeister M., Bobowski K.D., Hogl S., Dislich B., Fukumori A., Eggert C., Mack B., Kremling H., Sarrach S., Coscia F., Zimmermann W., Steiner H., Lichtenthaler S.F., Gires O. 2013. Regulated intramembrane proteolysis and degradation of murine epithelial cell adhesion molecule EpCAM. PloS One. 8(8) : e 71836. https://doi.org/10.1371/journal.pone.0071836
Jachin S., Bae J.S., Sung J.J., Park H.S., Jang K.Y., Chung M.J., Kim D.G., Moon W.S. 2014. The role of nuclear EpICD in extrahepatic cholangiocarcinoma: Association with β-catenin. Int. J. Oncol. V. 45. P. 691. https://doi.org/10.3892/ijo.2014.2472
Kao W.T., Lin C.Y., Lee L.T., Lee P.P.H., Hung C.C., Lin Y.S., Chen S.H., Ke F.C., Hwang J.J., Lee M.T. 2008. Investigation of MMP-2 and -9 in a highly invasive A431 tumor cell sub-line selected from a Boyden chamber assay. Anticancer Res. V. 28(4B). P. 2109.
Kim J.W., Kim E.Y., Kim S.Y., Byun S.K., Lee D., Oh K.J., Kim W.K., Han B.S., Chi S.W., Lee1 S.C., Bae K.H. 2014. Identification of DNA aptamers toward epithelial cell adhesion molecule via cell-SELEX. Mol. Cells. V. 37. P. 742. https://doi.org/10.14348/molcells.2014.0208
Kimura O., Takahashi T., Ishii N., Inoue Y., Ueno Y., Kogure T., Fukushima K., Shiina M., Yamagiwa Y., Kondo Y., Inoue J., Kakazu E., Iwasaki T., Kawagishi N., Shimosegawa T., Sugamura K. 2010. Characterization of the epithelial cell adhesion molecule (EpCAM)+ cell population in hepatocellular carcinoma cell lines. Cancer Sci. V. 101. P. 2145. https://doi.org/10.1111/j.1349-7006.2010.01661.x
Liao W.-T., Ye Y.-P., Deng Y.-J., Bian X.-W., Y.-Q. 2014. Metastatic cancer stem cells: From the concept to therapeutics. Am. J. Stem Cells. V. 3. P. 46.
Lin C.-W., Liao M.-Y., Lin W.-W., Wang Y.-P., Lu T.-Y., Wu H.-C. 2012. Epithelial cell adhesion molecule regulates tumor initiation and tumorogenesis via activating reprogramming factors and epithelial-mesenchymal transition gene expression in colon cancer. J. Biol. Chem. V. 287. P. 39449. https://doi.org/10.1074/jbc.M112.386235
Lin C.-Y., Tsai P.-H, Kandaswami C.C., Lee P.-P., Huang C.J., Hwang J.-J., Lee M.-T. 2011. Matrix metalloproteinase-9 cooperates with transcription factor Snail to induce epithelial-mesenchymal transition. Cancer Sci. V. 102. P. 815. https://doi.org/10.1111/j.1349-7006.2011.01861.x
Määttä M., Soini Y., Liakka A., Autio-Harmainen H. 2000. Differential expression of matrix metalloproteinase (MMP)-2, MMP-9, and membrane type 1-MMP in hepatocellular and pancreatic adenocarcinoma: Implications for tumor progression and clinical prognosis. Clin. Cancer Res. V. 6. P. 2726.
Mani S.A., Guo W., Liao M.J., Eaton E.N., Ayyanan A., Zhou A.Y., Brooks M., Reinhard F., Zhang C.C., Shipitsin M., Campbell L.L., Polyak K., Brisken C., Yang J., Weinberg R.A. 2008. The epithelial-mesenchymal transition generates cells with properties of stem cells. Cell. V. 133. P. 704. https://doi.org/10.1016/j.cell.2008.03.027
Munz M., Baeuerle P.A., Gires O. 2009. The emerging role of EpCAM in cancer and stem cell signaling. Cancer Res. V. 69. P. 5627. https://doi.org/10.1158/0008-5472.CAN-09-0654
Nieto M.A., Huang R.Y.-J., Jackson R.A., Thiery J.P. 2016. EMT: 2016. Cell. V. 166. P. 21. https://doi.org/10.1016/j.cell.2016.06.028
Oishi N., Yamashita T., Kaneko S. 2014. Molecular biology of liver cancer stem cells. Liver Cancer. V. 3. P. 71. https://doi.org/10.1159/000343863
Park S.Y., Bae J.S., Cha E.J., Chu H.H., Sohn J.S., Moon W.S. 2016. Nuclear EpICD expression and its role in hepatocellular carcinoma. Oncol. Rep. V. 36. P. 197. https://doi.org/10.3892/or.2016.4789
Pulukuri S.M.K., Rao J.S. 2008. Matrix metalloproteinase-1 promotes prostate tumor growth and metastasis. Int. J. Oncol. V. 32. P. 757.
Raimondi C., Nicolazzo C., Gradilone A. 2015. Circulating tumor cells isolation: the “post-EpCAM era”. Chin. J. Cancer Res. V. 27. P. 461. https://doi.org/10.3978/j.issn.1000-9604.2015.06.02
Ralhan R., Cao J., Lim T., Macmillan C., Freeman J.L., Walfish P.G. 2010. EpCAM nuclear localization identifies aggressive thyroid cancer and is a marker for poor prognosis. BMC Cancer. V. 10. P. 331. https://doi.org/10.1186/1471-2407-10-331
Scheau C., Badarau I.A., Costache R.C., Mihai G.L., Didilescu A.C., Constantin C., Neagu M. 2019. The role of matrix metalloproteinases in the epithelial-mesenchymal transition of hepatocellular carcinoma. Anal. Cell Pathol. (Amst). V. 2019. P. 9 423 907. https://doi.org/10.1155/2019/9423907
Shield K., Ackland M.L., Ahmed N., Rice G.E. 2009. Multicellular spheroids in ovarian cancer metastases: Biology and pathology. Gynecol. Oncol. V. 113. P. 143. https://doi.org/10.1016/j.ygyno.2008.11.032
Teryukova N.P., Malkova V.V., Sakhenberg E.I., Ivanov V.A., Bezborodkina N.N., Snopov S.A. 2018. On reprogramming of tumor cells metabolism: Detection of glycogen in the cell lines of hepatocellular origin with various degrees of dedifferentiation. Cytotechnology. V. 70. P. 879. https://doi.org/10.1007/s10616-018-0200-1
Yamashita T., Forgues A.B.M., Wang X.W. 2007. Activation of hepatic stem cell marker EpCAM by wnt-catenin signaling in hepatocellular carcinoma. Cancer Res. V. 67. P. 10 831. https://doi.org/10.1158/0008-5472.CAN-07-0908
Yamashita T., Forgues M., Wang W., Kim J.W., Ye Q., Jia H., Budhu A., Zanetti K.A., Chen Y., Qin L.X., Tang Z.Y., Wang X.W. 2008. EpCAM and alpha-fetoprotein expression defines novel prognostic subtypes of hepatocellular carcinoma. Cancer Res. V. 68. P. 1451. https://doi.org/10.1158/0008-5472.CAN-07-6013
Yamashita T., Ji J., Budhu A., Forgues M., Yang W., Wang H.Y., Jia H., Ye Q., Qin L.X., Wauthier E., Reid L.M., Minato H., Honda M., Kaneko S., Tang Z.Y., Wang X.W. 2009. EpCAM-positive hepatocellular carcinoma cells are tumor-initiating cells with stem/progenitor cell features. Gastroenterology. V. 136. P. 1012. https://doi.org/10.1053/j.gastro.2008.12.004
Yeung K.T., Yang J. 2017. Epithelial-mesenchymal transition in tumor metastasis. Mol. Oncol. V. 11. P. 28. https://doi.org/10.1002/1878-0261.12017
Zucchini-Pascal N., Peyre L., Rahmani R. 2013. Crosstalk between beta-catenin and Snail in the induction of epithelial to mesenchymal transition in hepatocarcinoma: Role of the ERK1/2. Int. J. Mol. Sci. V. 14. P. 20 768. https://doi.org/10.3390/ijms141020768
Дополнительные материалы отсутствуют.


