Цитология, 2020, T. 62, № 8, стр. 591-600
Са2+-проводящие канонические TRP-каналы в мышечных волокнах m. LAL мыши
Л. Ф. Нуруллин 1, 2, *, Е. М. Волков 1, **
1 Казанский государственный медицинский университет
420012 Казань, Россия
2 Казанский институт биохимии и биофизики – обособленное структурное подразделение
Федерального исследовательского центра РАН
420111 Казань, Россия
* E-mail: lenizn@yandex.ru
** E-mail: euroworm@mail.ru
Поступила в редакцию 20.04.2020
После доработки 04.05.2020
Принята к публикации 04.05.2020
Аннотация
Методами флуоресцентной микроскопии показано, что в состав мембран скелетных мышечных волокон мыши входят канонические TRP-каналы (TRPC) четырех подсемейств, включающих 7 известных классифицированных подтипов. В зоне нервно-мышечного соединения наибольшее представительство имеют каналы TRPC5, а наименьшее – TRPC2. Некоторые подтипы TRPC-каналов (1, 3, 4 и 5) тесно сопряжены с мембранами саркоплазматического ретикулума мышечных волокон, при этом наибольшее представительство в этих структурах имеют каналы TRPC5. Локальная концентрация TRPC-каналов всех подтипов (1–7) исключительно в зоне нервно-мышечного контакта отсутствует, что не подтверждает гипотезу о возможном нейротрофическом контроле за распределением каналов данного семейства в мышечном волокне.
В составе широкого представительства Ca2+-проводящих каналов TRP (transient receptor potential) имеется семейство TRPC-каналов (transient receptor potential canonical), состоящее из четырех подсемейств и включающих семь подтипов (TRPC1– TRPC7) (Montell et al., 2002; Montell, 2005; Plant, Schaefer, 2005; Owsianik et al., 2006; Peng et al., 2015). Каналы семейства TRPC классифицируются на подтипы прежде всего с учетом различий в субмолекулярном строении, а также в соответствии с их проводящими (электрофизиологическими) характеристиками и фармакологическими свойствами, в частности по их чувствительности к диацилглицерину (DAG), инозитол-3-фосфату (IP3) и ряду других агонистов и блокаторов (Montell et al., 2002; Montell, 2005; Sobo-loff et al., 2007).
Известно, что семейство TRPC-каналов идентифицировано в составе ряда клеточных типов, включая скелетные мышечные волокна млекопитающих (Vazquez et al., 2004; Kunert-Keil et al., 2006; Krüger et al., 2008), где некоторые из известных подтипов функционально связаны с Са2+-депо (Franco-Obregon, Lansman, 1994; Prakria, Lewis, 2015) саркоплазматического ретикулума (СР) и могут принимать участие в регуляции мышечного сокращения (Stiber et al., 2008; Zanou et al., 2010; Brinkmeier, 2011). Каналопатии, вызванные мутациями генов, ответственных за экспрессию пептидных молекул каналов этого семейства приводят к тяжелым миопатиям и нарушениям развития скелетных мышечных волокон (Nilius et al., 2007; Feske, 2010), что указывает на их важность в механизмах функционирования скелетной мускулатуры. В то же время качественно-количественное представительство подсемейств каналов разных подтипов в скелетных мышечных волокнах млекопитающих остается до конца не исследованным. Остается неясным их распределение по мышечным мембранам, а также их локализация по отношению к Са2+-депо СР.
Известно, что характер распределения чувствительных к ацетилхолину (АХ) рецепторно-канальных комплексов на постсинаптической мембране скелетных мышечных волокон млекопитающих находится под нейротрофическим контролем (Brenner, Sakmann, 1983; Волков, 1989), а именно: в иннервированной мышце АХ-чувствительные рецепторно-канальные комплексы сосредоточены исключительно в зоне синаптического контакта (Fambrough, 1979; Bailey et al., 2003; Unwin, 2013), тогда как после денервации они распределяются по всей поверхности мембраны мышечных волокон (Albuquerque, McIsaac, 1970; Guzzini et al., 2008). В иннервированной мышце млекопитающих плотность потенциал-чувствительных Na+-каналов в зоне синаптического контакта выше по сравнению с остальной частью мышечной мембраны (Beam et al., 1985; Caldwell et al., 1986; Bailey et al., 2003), а после денервации это различие утрачивается (Caldwell et al., 1986; Caldwell, Milton, 1988). Таким образом, распределение как хемочувствительных (Волков, 1989; Lupa, Caldwell, 1991), так и потенциал-чувствительных ионных каналов (Волков, 1990; Lupa, Caldwell, 1991) в мембране мышечных волокон млекопитающих находится под влиянием двигательной иннервации.
По аналогии с этим феноменом можно предположить, что и распределение различных подтипов Са2+-проводящих каналов семейства TRPC также может иметь ориентированную локализацию, например, иметь привязку к зоне синаптического контакта. В таком случае это можно расценить как неоспоримый аргумент в пользу гипотезы нейротрофического контроля за характером распределения TRPC-каналов в мышечном волокне.
Таким образом, целью настоящего исследования стала идентификация и изучение характера распределения семи подтипов TRP-каналов, входящих в состав четырех известных подсемейств TRPС Са2+-управляемых катион-проводящих каналов в скелетной мускулатуре млекопитающих на примере m. LAL лабораторной мыши методами флуоресцентной микроскопии. В соответствии с заявленной целью были сформулированы следующие задачи исследования: 1) идентификация и количественная сравнительная оценка представительства разных подтипов TRPC-каналов в синаптических и внесинаптических зонах мышечных волокон; 2) выявление пространственной связи идентифицированных TRPC-каналов с СР мышечных волокон.
МАТЕРИАЛ И МЕТОДИКА
Объект исследования. Работы выполнена на лабораторных мышах линии BALB/c. Выделенные нервно-мышечные препараты мышцы длинного поднимателя уха m. levator auris longus (m. LAL) закрепляли с помощью иголок на дне чашек Петри, залитых смолой Sylgard, и перфузировали раствором Кребса–Рингера (состав в мМ: 125 NaCl, 2.5 KCl, 1 NaH2PO4, 2 CaCl2, 1 MgCl2, 12 NaHCO3, 11 глюкозы, pH 7.2–7.4) около 30 мин при комнатной температуре (22 ± 1°С).
Иммунофлуоресцентное окрашивание. В течение 30 мин выделенные препараты фиксировали в 2%-ном растворе p-формальдегида, отмывали 3 раза по 30 мин в фосфатном буферном растворе (pH 7.2). Мышцы последовательно инкубировали в следующих растворах: 0.5%-ном растворе Тритона X-100 30 мин; в растворе, содержащем 5% нормальной козьей сыворотки, 1% бычьего сывороточного альбумина (БСА) и 0.5% Тритона X-100 15 мин и в растворе, содержащем 1% БСА и 0.5% тритона X-100 (раствор А) еще 15 мин. Все растворы были приготовлены на фосфатном буфере (pH 7.2). Препараты инкубировали в течение 12 ч при температуре 4°С в растворе А с поликлональными антителами к каналам TRPC известных подтипов (TRPC1, TRPC2, TRPC3, TRPC4, TRPC5, TRPC6, TRPC7) и белку синаптофизину (все в разведении 1 : 200). Препараты отмывали в растворе А 3 раза по 30 мин и инкубировали 1 ч при комнатной температуре с соответствующими вторичными антителами, конъюгированными с Alexa 488 или 647 (разведение 1 : 800) в растворе А. Окрашивание постсинаптических никотиновых АХ-рецепторов производили с помощью тетраметилродамин-α-бунгаротоксина (TMR-α-Б, 20 мкг/мл) в течениe 30 мин. Таким образом, область двигательного нервного окончания на нервно-мышечных препаратах выявляли при помощи окрашивания антителами на белок синаптических везикул – синаптофизин (Nurullin et al., 2019; Нуруллин, Волков, 2020). Постсинаптическую мембрану холинергических синапсов окрашивали TMR-α-Б – специфическим блокатором никотинового АХ-рецептора (Krause, Wernig, 1985; Nurullin et al., 2011).
Для подтверждения специфичности связывания поликлональных антител с соответствующими белками проводили контрольные эксперименты. Для негативного контроля препарат инкубировали с вторичными антителами без предшествующей инкубации с первичными антителами. Для позитивного контроля препарат инкубировали с первичными антителами в присутствии иммуногенного пептида, на который вырабатывались первичные антитела. Отсутствие окрашивания в контрольных экспериментах указывает на специфичность связывания антител с соответствующими пептидами.
Микроскопическое исследование и анализ изображений. После отмывки в фосфатном буфере препараты помещали в раствор фосфатного буфера с глицерином (1 : 1) и размещали на предметном стекле для проведения микроскопического исследования на лазерном сканирующем конфокальном микроскопе Leica TCS SP5 MP (Leica Microsystems, США) с применением масляного иммерсионного объектива 63×/1.4. Для возбуждения эмиссии флуорофоров применяли аргоновый и гелий-неоновый лазеры, используя длину волны возбуждения 488 (для флуорофора Alexa 488), 543 (для тетраметилродамина, TMR) и 633 (для Alexa 647) нм.
Анализ полученных конфокальных изображений проводили в программе ImageJ (NIH, США). На полученных при окрашивании на TRPC-каналы и АХ-рецепторы изображениях для дифференциального анализа мы выделяли три зоны: 1 – зону проекции нервно-мышечного контакта (синаптическую зону мышечных волокон) (рис. 1в, цифра 1); 2 – зону проекции саркоплазматического ретикулума (СР) мышечного волокна (внесинаптическую зону мышечных волокон) (рис. 1в, цифра 2); 3 – внесинаптическую зону, не относящуюся к зонам 1 и 2 (рис. 1в, цифра 3).
Рис. 1.
Пример выделения зон на изображении для дифференциального анализа площадей окрашивания. а – Определение границ зоны 1 по окрашиванию никотиновых ацетилхолиновых (АХ) рецепторов TMR-α-Б; б – окрашивание препарата антителами на каналы TRPC; в – три зоны, выделяемые в ходе обработки изображения препарата, окрашенного на TRPC-каналы: цифра 1 – зона проекции нервно-мышечного контакта (синаптическая зона мышечных волокон); 2 – зона проекции саркоплазматического ретикулума (СР) мышечного волокна (внесинаптическая зона мышечных волокон); 3 – внесинаптическая зона, не относящаяся к зонам 1 и 2. Масштабная линейка – 10 мкм.
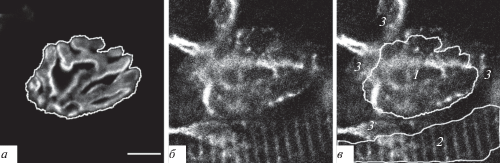
Границы зоны проекции нервно-мышечного контакта (зона 1) определялись по окрашиванию TMR-α-Б никотиновых АХ-рецепторов (рис. 1а). Границы зоны проекции СР мышечного волокна (зона 2) определялись в районах, в которых присутствовало окрашивание на TRPC-каналы в виде “светящихся ребер” и отсутствовало окрашивание на синаптофизин и АХ-рецепторы (рис. 1а, б). На изображениях, для каждого подтипа TRPC-каналов, оценивали части (%) площади окрашивания отдельно для зоны 1 и зоны 2. Для зоны 3 площадь окрашивания не оценивали, поскольку не представлялось возможным определить четкие границы этой зоны (рис. 1б, в).
В программе ImageJ на изображениях размером 512 × 512 пикселей при помощи инструмента свободного выделения обводили зону проекции нервно-мышечного контакта и зону проекции СР мышечного волокна (рис. 1а, в, цифры 1 и 2). В обозначенных зонах проводили подсчет площади окрашивания (%). Статистический анализ полученных данных, проводили в программе Microsoft Excel с использованием t-критерия Стьюдента.
Использованные реактивы. Смола Sylgard, p-формальдегид, трис, фосфатный буферный раствор (состав (мМ): 137 NaCl, 2.7 KCl, 4.3 Na2SO4, 1.4 KH2PO4, pH 7.2), Тритон X-100, нормальная козья сыворотка, бычий сывороточный альбумин, TMR-α-Б, глицерин (Sigma-Aldrich, США); первичные поликлональные антитела и соответствующие им иммуногенные пептиды (Alomone Labs, Израиль); антитела вторичные Alexa 488 и Alexa 647 (Thermo Fisher Scientific, США).
РЕЗУЛЬТАТЫ
В состав семейства TRPC-каналов входят четыре подсемейства, которые мы для удобства обозначили как А, Б, В и Г соответственно. В состав подсемейства А входит один канал подтипа TRPC1. Это неселективный Са2+-проводящий канал, исходный родоначальник всех основных канонических подтипов (Zitt et al., 1996; Ramsey et al., 2006). Подсемейство Б также включает один канал подтипа TRPC2, который является DAG-активируемым Са2+-проводящим каналом (Vannier et al., 1999; Leinders-Zufall et al., 2018). Подсемейство В состоит из трех подтипов, а именно: TRPC3-лиганд-активируемый (неселективный) Са2+-проводящий канал (Halaszovich et al., 2000; Kalwa et al., 2015); TRPC6-IP3-независимый DAG-активируемый селективный Са2+-проводящий канал (Hofmann et al., 1999; Kalwa et al., 2015) и TRPC7-DAG-активируемый неселективный Са2+-проводящий канал (Okada et al., 1999; Kalwa et al., 2015). Наконец, подсемейство Г имеет TRPC4-IP3-активируемый селективный Са2+-проводящий канал и TRPC5-рецепторно-управляемый с участием вторичных посредников (неселективный) Са2+-проводящий канал (Okada et al., 1998; Schaefer et al., 2000).
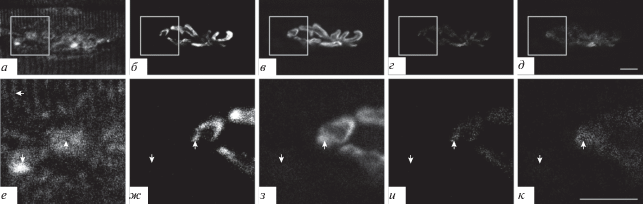
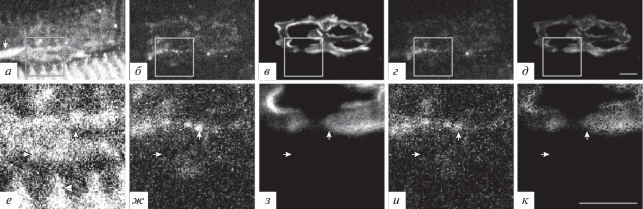
Подсемейство А. Каналы подтипа TRPC1. Иммуногистохимическое окрашивание нервно-мышечного препарата m. LAL с помощью антител на TRPC1-каналы выявило иммунопозитивную реакцию на этот подтип канала (рис. 2а, е). Окрашивание на TRPC1-каналы частично совпадало с окрашиванием антителами на белок синаптофизин (рис. 2а, б, г, е, ж, и, стрелки вверх) и с окрашиванием TMR-α-Б рецепторов к АХ (зона 1) (рис. 2а, в, д, е, з, к, стрелки вверх). Необходимо отметить, что окрашивание на TRPC1-каналы было выявлено и во внесинаптической зоне (зона 3) (рис. 2е−к, стрелки вниз). При окрашивании в ряде зон светящиеся пятна формировались в чередующиеся линейные группы, разделенные неокрашенными пространствами, что визуально походило на структуру типа “светящиеся ребра” (зона 2) – чередование светлых и темных полос (рис. 2а, е, стрелка влево).
Рис. 2.
Выявление TRPC1-каналов при флуоресцентном тройном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к TRPC1-каналу; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г – Программно-обработанное изображение, полученное при совмещении изображений а, б (TRPC-канал и синаптофизин), демонстрирующее только совпадающие при наложении изображений светлые пиксели (и – увеличенная область изображения г); д – совмещение изображений а, в (TRPC-канал и TMR-α-Б), демонстрирующее только совпадающие при наложении изображений светлые пиксели (к – увеличенная область, выделенная на изображении д). Стрелки вверх – совпадение окрашивания на TRPC1-каналы с синаптофизином и с АХ-рецепторами; стрелки вниз – окрашивание на TRPC1-каналы во внесинаптической области; стрелка влево – структуры типа “светящиеся ребра”.
Здесь и на рис. 2–8: на нижней панели рисунков представлены увеличенные области, соответствующие выделенным квадратам на верхней панели. Масштабная линейка: 10 мкм.
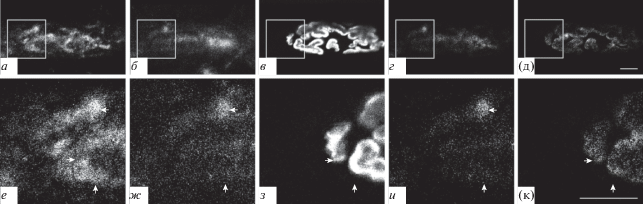
Подсемейство Б. Каналы подтипа TRPC2. Окрашивание препарата на TRPC2 также выявило четкую иммунопозитивную реакцию. Окрашивание при этом частично совпадало с окрашиванием антителами на белок синаптофизин (рис. 3а, б, г, е, ж, и, стрелки влево) и с окрашиванием TMR-α-Б рецепторов к АХ (зона 1) (рис. 3а, в, д, е, з, к, стрелки вправо). Окрашивание на TRPC2-каналы наблюдали и во внесинаптической зоне (зона 3) (рис. 3е−к, стрелки вверх). Структуры типа “светящиеся ребра” не выявлялись.
Рис. 3.
Присутствие TRPC2-каналов при тройном флуоресцентном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к каналу TRPC2; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки влево – совпадение окрашивания на TRPC2-каналы с синаптофизином; стрелки вправо – совпадение окрашивания на TRPC2-каналы с АХ-рецепторами; стрелки вверх – окрашивание на TRPC2-каналы во внесинаптической области.
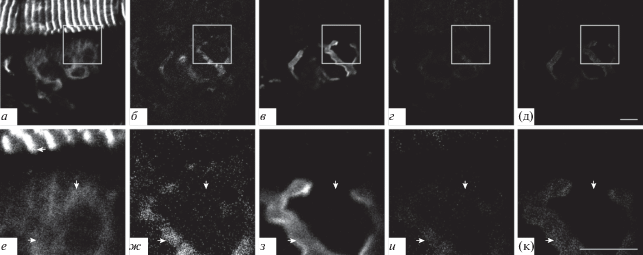
Подсемейство В. Каналы подтипа TRPC3. Окрашивание препаратов на наличие TRPC3-каналов, показало частичное совпадение их окрашивания с окрашиванием на белок синаптофизин (рис. 4а, б, г, е, ж, и, стрелки вправо) и АХ-рецепторы (зона 1) (рис. 4а, в, д, е, з, к, стрелки вправо). Окрашивание на TRPC3-каналы наблюдали и во внесинаптической зоне (зона 3) (рис. 4е−к, стрелки вниз). Окрашиваниe на TRPC3-каналы в мышечных волокнах показало наличие четко выраженных “светящихся ребер” (зона 2) (рис. 4а, е, стрелка влево).
Рис. 4.
Наличие TRPC3-каналов при флуоресцентном тройном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к каналу TRPC3; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки вправо – совпадение окрашивания на TRPC3-каналы с синаптофизином и с АХ-рецепторами; стрелки вниз – окрашивание на TRPC3-каналы во внесинаптической области; стрелка влево – структуры типа “светящиеся ребра”.
Подсемейство В. Каналы подтипа TRPC6. Окрашивание на TRPC6-каналы совпадало с окрашиванием антителами на белок синаптофизин (рис. 5а, б, г, е, ж, и, стрелки вверх) и с окрашиванием TMR-α-Б рецепторов к АХ (зона 1) (рис. 5а, в, д, е, з, к, стрелки вверх). Окрашивание на TRPC6-каналы наблюдали во внесинаптической зоне (зона 3) (рис. 5е−к, стрелки влево). “Светящиеся ребра” не выявлялись.
Рис. 5.
Обнаружение TRPC6-каналов при тройном флуоресцентном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к каналу TRPC6; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки вверх – совпадение окрашивания на TRPC6-каналы с синаптофизином и с АХ-рецепторами; стрелки влево – окрашивание на TRPC6-каналы во внесинаптической области.
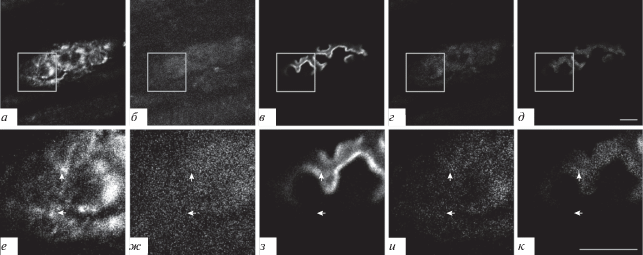
Подсемейство В. Каналы подтипа TRPC7. Окрашивание препаратов на эти каналы совпадало с окрашиванием на белок синаптофизин (рис. 6а, б, г, е, ж, и, стрелки вниз) и АХ-рецепторы (зона 1) (рис. 6а, в, д, е, з, к, стрелки вниз). Кроме того, окрашивание на TRPC7-каналы наблюдали во внесинаптической зоне (зона 3) (рис. 6е−к, стрелки вправо). Необходимо отметить достаточно выраженное окрашивание на TRPC7-каналы на аксоне двигательного нейрона, подходящего к нервно-мышечному синапсу (рис. 6а, стрелка влево). “Светящиеся ребра” тоже не наблюдали.
Рис. 6.
TRPC7-каналы, выявляемые при флуоресцентном тройном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к каналу TRPC7; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки вниз – совпадение окрашивания на TRPC7-каналы с синаптофизином и с АХ-рецепторами; стрелки вправо – окрашивание на TRPC7-каналы во внесинаптической области; стрелка влево – окрашивание на TRPC7-каналы на аксоне двигательного нейрона.
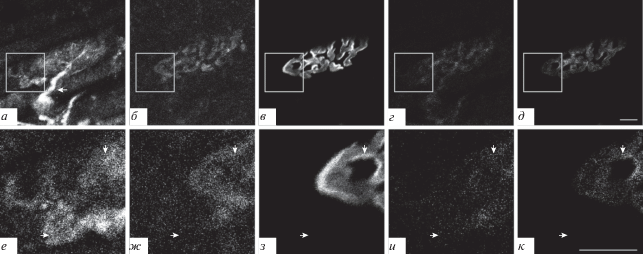
Подсемейство Г. Каналы подтипа TRPC4. Окрашивание на эти каналы совпадало с окрашиванием на белок синаптофизин (рис. 7а, б, г, е, ж, и, стрелки вниз) и АХ-рецепторы (зона 1) (рис. 7а, в, д, е, з, к, стрелки вниз). При этом окрашивание на TRPC4-каналы было и во внесинаптической зоне (зона 3) (рис. 7е−к, стрелки вправо). Эти каналы обнаруживали и в виде четко определяемых “светящихся ребер” (зона 2) (рис. 7а, е, стрелка влево).
Рис. 7.
TRPC4-каналы, обнаруженные при флуоресцентном тройном окрашивании препарата m. LAL мыши. а, е – Окрашивание антителами к каналу TRPC4; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки вниз – совпадение окрашивания на TRPC4-каналы с синаптофизином и с АХ-рецепторами; стрелки вправо – окрашивание на TRPC4-каналы во внесинаптической области; стрелка влево – структуры типа “светящиеся ребра”.
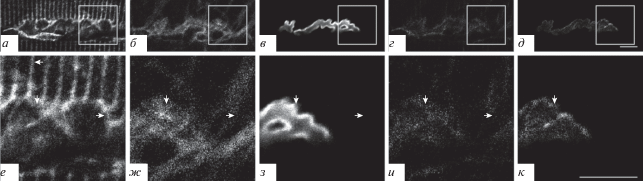
Подсемейство Г. Каналы подтипа TRPC5. Как и в предыдущих случаях, окрашивание препаратов на TRPC5 совпадало с окрашиванием на белок синаптофизин (рис. 8а, б, г, е, ж, и, стрелки вверх) и АХ-рецепторы (зона 1) (рис. 8а, в, д, е, з, к, стрелки вверх). Кроме того, окрашивание на TRPC5-каналы наблюдали во внесинаптической зоне (зона 3) (рис. 8е−к, стрелки вправо) и выявляли яркие образования – “светящиеся ребра” (зона 2) (рис. 8а, е, стрелка влево). Необходимо отметить наличие окрашивания на TRPC5-каналы в зоне проекции аксона двигательного нейрона, подходящего к нервно-мышечному синапсу (рис. 8а, стрелка вниз).
Рис. 8.
Флуоресцентное тройное окрашивание препарата m. LAL мыши, демонстрирующее наличие TRPC5-каналов. а, е – Окрашивание антителами к каналу TRPC5; б, ж – окрашивание антителами к пресинаптическому белку синаптофизину; в, з – окрашивание рецепторов к АХ при помощи TMR-α-Б. г, д, и, к: см. подпись к рис. 2. Стрелки вверх – совпадение окрашивания на TRPC5-каналы с синаптофизином и с АХ-рецепторами; стрелки вправо – окрашивание на TRPC5-каналы во внесинаптической области; стрелка влево – структуры типа “светящиеся ребра”; стрелка вниз – окрашивание на TRPC5-каналы на аксоне двигательного нейрона.
Количественное распределение разных подтипов TRPC-каналов в зоне проекции синаптического контакта (зоне 1) и зоне проекции СР мышечных волокон (зоне 2) (рис. 1в). При иммунофлуоресцентном окрашивании различных антигенов сравнение яркостей их флуоресцентных сигналов является не корректным, поэтому мы анализировали процентные доли площади окрашивания определенных зон на различные подтипы TRPC-каналов. В связи с этим, мы применили метод сравнения площадей окрашивания на выявление различных подтипов TRPC-каналов. Такой метод позволяет, по нашему мнению, провести более объективный сравнительный анализ распределения ионных каналов в разных структурах мышцы.
Зона 1. Иммунофлуоресцентное окрашивание препаратов антителами на различные подтипы TRPC-каналов показало, что процентные доли площадей окрашивания в зонах проекции нервно-мышечных контактов (зонах 1) отличаются друг от друга (табл. 1). Если расположить доли площадей окрашивания в порядке убывания, то картина выглядит следующим образом: TRPC5 > TRPC4 > TRPC6 > > TRPC1 > TRPC7 > TRPC3 > TRPC2. Можно видеть, что наибольшая площадь окрашивания наблюдалась в случае TRPC5-каналов, а наименьшая – TRPC2. При этом сравнение между собой двух средних значений долей площадей окрашивания для пары TRPC1 и TRPC6, а также для пары TRPC3 и TRPC7, не выявило достоверных различий (табл. 1).
Таблица 1.
Значения площадей окрашивания на TRPC-каналы для зоны проекции нервно-мышечного контакта (зоны 1) в порядке убывания
| Подтип канала TRPC | Площадь окрашивания (среднее значение ± стандартная ошибка и число измерений n), % | Достоверность отличия двух средних значений сравниваемых подтипов TRPC |
|---|---|---|
| TRPC5 | 64.6 ± 1.8 (n = 55) | |
| TRPC4 | 56.9 ± 2.3 (n = 52) | P < 0.05 (TRPC4 и TRPC5) |
| TRPC6 | 44.6 ± 1.5 (n = 47) | P < 0.05 (TRPC6 и TRPC4) |
| TRPC1 | 42.5 ± 1.3 (n = 56) | P > 0.05 (TRPC1 и TRPC6) |
| TRPC7 | 38.6 ± 1.4 (n = 53) | P < 0.05 (TRPC7 и TRPC1) |
| TRPC3 | 36.8 ± 2.5 (n = 51) | P > 0.05 (TRPC3 и TRPC7) |
| TRPC2 | 26.1 ± 2.2 (n = 53) | P < 0.05 (TRPC2 и TRPC3) |
Зона 2. Во внесинаптических областях мышечных волокон, окрашивание TRPC-каналов в виде структур типа “светящиеся ребра” (зона 2) наблюдали только для подтипов TRPC1, TRPC3, TRPC4 и TRPC5 (рис. 2а, 4а, 7а, 8а), тогда как для подтипов TRPC2, TRPC6 и TRPC7 такие структуры не выявляли (рис. 3а, 5а, 6а). Анализ долей площадей окрашивания в зонах проекции СР мышечных волокон (“светящиеся ребра”) (зона 2) для выявленных подтипов TRPC (1, 3, 4, 5) показал, что наибольшую площадь окрашивания имели каналы TRPC5, а наименьшую – TRPC1 (табл. 2). Если разместить в порядке убывания площади окрашивания для этих четырех подтипов, то получим следующий ряд: TRPC5 > > TRPC3 > TRPC4 > TRPC1 (табл. 2).
Таблица 2.
Значения площадей окрашивания на TRPC-каналы для зоны проекции СР (“светящиеся ребра”) мышечного волокна (зона 2) в порядке убывания
| Подтип канала TRPC | Площадь окрашивания (среднее значение ± стандартная ошибка и число измерений n), % | Достоверность отличия двух средних значений сравниваемых подтипов TRPC |
|---|---|---|
| TRPC5 | 57.0 ± 1.7 (n = 55) | |
| TRPC3 | 52.7 ± 1.3 (n = 51) | P < 0.05 (TRPC3 и TRPC5) |
| TRPC4 | 46.4 ± 2.7 (n = 52) | P < 0.05 (TRPC4 и TRPC3) |
| TRPC1 | 27.9 ± 3.3 (n = 56) | P < 0.05 (TRPC1 и TRPC4) |
ОБСУЖДЕНИЕ
Иммунофлуоресцентное окрашивание выявляет позитивную реакцию на все классифицированные подтипы (1–7), входящие в состав четырех (А, Б, В и Г) подсемейств TRPC-каналов. При этом все подтипы ионных каналов встречаются как в синаптической, так и во внесинаптической зонах. Этот факт говорит о том, что в отличие от АХ-чувствительных рецепторно-канальных комплексов (Волков, 1989; Bailey et al., 2003; Unwin, 2013) и Na+-каналов (Beam et al., 1985; Caldwell et al., 1986; Волков, 1990; Bailey et al., 2003) четкая локализация TRPC-каналов в зоне синаптического контакта отсутствует, что не подтверждает гипотезу о возможном нейротрофическом контроле за распределением каналов данного семейства в мышечном волокне.
Количественная оценка площадей флуоресцентных пятен позволила ранжировать идентифицированные подтипы TRPC-каналов по шкале от большей площади окрашивания к меньшей. В зонах нервно-мышечных контактов предложенные шкалы площадей окрашивания выглядят следующим образом (по убыванию значений): TRPC5–TRPC4–TRPC6–TRPC1–TRPC7–TRPC3–TRPC2. Наибольшее представительство каналов обнаруживается для подсемейства Г (TRPC5–TRPC4), а наименьшее – для подсемейства Б (TRPC2). Есть основание считать, что чем больше площадь флуоресцентного окрашивания препарата в зоне нервно-мышечного контакта, тем больше плотность TRPC-каналов соответствующего подтипа.
Таким образом, шкала ранжирования отражает степень представительства ионных каналов соответствующих подсемейств и подтипов в мембранах мышечных волокон. При окрашивании препаратов на TRPC1, TRPC3, TRP4 и TRPC5 выявляли так называемые “светящиеся ребра”, тогда как при окрашивании на TRPC2, TRPC6 и TRPC7 последние отсутствовали. Если ранжировать “светящиеся ребра” по площадям окрашивания, то можно получить следующую шкалу (по степени убывания): TRPC5–TRPC3–TRPC4–TRPC1.
Известно, что TRPC-каналы могут быть тесно связаны с СР мышечных волокон (Brinkmeier, 2011; Prakriya, Lewis, 2015). Общеизвестно, что в мышечном волокне цистерны СР и Т-трубочки – это регулярно повторяющиеся структуры (Flucher et al., 1994; Al-Qusairi, Laporte, 2011). Можно думать, что “светящиеся ребра” являются проекциями СР мышечных волокон. Имеющиеся данные дают основание предполагать, что каналы подтипов TRPC5, TRPC3, TRPC4 и TRPC1 включены в состав мембран СР, тогда как подобную локализацию для каналов подтипов TRPC2, TRPC6 и TRPC7 выявить не удалось. Необходимо отметить, что для каналов TRPC5 и TRPC7 окрашивание наблюдали и в аксонах двигательных нейронов. Предположительно, идентифицированные изоформы субъединиц этих подтипов каналов могут синтезироваться не только в мышечных волокнах, но также и в перикарионах мотонейронов и далее перемещаться аксоплазматическим транспортом по направлению к нервным терминалям.
Проведенное исследование позволяет сделать следующее заключение. В состав мембран скелетных мышечных волокон мыши входят TRPC-каналы четырех подсемейств, включающих 7 известных классифицированных подтипов. Наибольшее представительство в зоне нервно-мышечного контакта имеют каналы подтипа TRPC5, а наименьшее – TRPC2. Каналы TRPC подтипов 1, 3, 4 и 5 входят в состав мембран СР мышечных волокон, при этом наибольшее представительство в этих структурах имеют каналы подсемейства TRPC5. Каналы TRPC5 и TRPC7 обнаруживаются также и в аксонах двигательных нейронов. Локальная концентрация TRPC-каналов всех подтипов (TRPC1–TRPC7) исключительно в зоне синаптического контакта отсутствует.
Список литературы
Волков Е.М. 1989. Молекулярные механизмы нейрональной регуляции ацетилхолиновой рецепции скелетных мышц. Успехи совр. биол. Т. 108. № 1. С. 80. (Volkov E.M. 1989. Factors in the neurotrophic control of acetylcholine reception in skeletal muscle. Uspekhi Sovremennoj Biologii. V. 20. № 2. P. 27.)
Волков Е.М. 1990. Нейротрофический контроль Na-проницаемости мембраны мышечного волокна. Успехи совр. биол. Т. 109. № 3. С. 339. (Volkov E.M. 1990. Neurotrophic control of Na-permeability of muscle fiber membranes. Uspekhi Sovremennoj Biologii. V. 109. № 3. P. 339.)
Нуруллин Л.Ф., Волков Е.М. 2020. Иммунофлуоресцентная идентификация изоформ субъединицы α1 потенциал-зависимых Ca2+-каналов семейств Cav1, Cav2 и Cav3 в зонах холинергических синапсов соматической мускулатуры дождевого червя Lumbricus terrestris. Цитология. Т. 62. № 2. С. 141. (Nurullin L.F., Volkov E.M. 2020. Immunofluorescent identification of isoforms subunit α1 voltage-gated Ca2+ channels Cav1, Cav2 and Cav3 in cholinergic synapses zones of somatic muscles earthworm Lumbricus terrestris. Tsitologiya. V. 62. № 2. P. 141.)
Albuquerque E.X., McIsaac R.J. 1970. Fast and slow mammalian muscles after denervation. Exp. Neurol. V. 26. P. 183.
Al-Qusairi L., Laporte J. 2011. T-tubule biogenesis and triad formation in skeletal muscle and implication in human diseases. Skelet. Muscle. V. 1. P. 26.
Bailey S.J., Stocksley M.A., Buckel A., Young C., Slater C.R. 2003. Voltage-gated sodium channels and ankyrinG occupy a different postsynaptic domain from acetylcholine receptors from an early stage of neuromuscular junction maturation in rats. J. Neurosci. V. 23. P. 2102.
Beam K.G., Caldwell J.H., Campbell D.T. 1985. Na channels in skeletal muscle concentrated near the neuromuscular junction. Nature. V. 313. P. 588.
Brenner H.R., Sakmann B. 1983. Neurotrophic control of channel properties at neuromuscular synapses of rat muscle. J. Physiol. V. 337. P. 159.
Brinkmeier H. 2011. TRP Channels in skeletal muscle: Gene expression, function and implications for disease. Adv. Exp. Med. Biol. V. 704. P. 749.
Caldwell J.H., Campbell D.T., Beam K.G. 1986. Na channel distribution in vertebrate skeletal muscle. J. Gen. Physiol. V. 87. P. 907.
Caldwell J.H., Milton R.L. 1988. Sodium channel distribution in normal and denervated rodent and snake skeletal muscle. J. Physiol. V. 401. P. 145.
Fambrough D.M. 1979. Control of acetylcholine receptors in skeletal muscle. Physiol. Res. V. 59. P. 165.
Feske S. 2010. CRAC channelopathies. Pflugers Arch. V. 460. P. 417.
Flucher B.E., Andrews S.B., Daniels M.P. 1994. Molecular organization of transverse tubule/sarcoplasmic reticulum junctions during development of excitation-contraction coupling in skeletal muscle. Mol. Biol. Cell. V. 5. P. 1105.
Franco-Obregón A. Jr., Lansman J.B. 1994. Mechanosensitive ion channels in skeletal muscle from normal and dystrophic mice. J. Physiol. V. 481. P. 299.
Guzzini M., Raffa S., Geuna S., Nicolino S., Torrisi M.R., Tos P., Battiston B., Grassi F., Ferretti A. 2008. Denervation-related changes in acetylcholine receptor density and distribution in the rat flexor digitorum sublimis muscle. Ital. J. Anat. Embryol. V. 113. P. 209.
Halaszovich C.R., Zitt C., Jungling E., Luckhoff A. 2000. Inhibition of TRP3 channels by lanthanides. Block from the cytosolic side of the plasma membrane. J. Biol. Chem. V. 275. P. 37423.
Hofmann T., Obukhov A.G., Schaefer M., Harteneck C., Gudermann T., Schultz G. 1999. Direct activation of human TRPC6 and TRPC3 channels by diacylglycerol. Nature. V. 397. P. 259.
Kalwa H., Storch U., Demleitner J., Fiedler S., Mayer T., Kannler M., Fahlbusch M., Barth H., Smrcka A., Hildebrandt F., Gudermann T., Dietrich A. 2015. Phospholipase C epsilon (PLCε) induced TRPC6 activation: a common but redundant mechanism in primary podocytes. J. Cell. Physiol. V. 230. P. 1389.
Krause M., Wernig A. 1985. The distribution of acetylcholine receptors in the normal and denervated neuromuscular junction of the frog. J. Neurocytol. V. 14. P. 765.
Krüger J., Kunert-Keil C., Bisping F., Brinkmeier H. 2008. Transient receptor potential cation channels in normal and dystrophic mdx muscle. Neuromuscul. Disord. V. 18. P. 501.
Kunert-Keil C., Bisping F., Krüger J., Brinkmeier H. 2006. Tissue-specific expression of TRP channel genes in the mouse and its variation in three different mouse strains. BMC Genomics. V. 7. P. 159.
Leinders-Zufall T., Storch U., Bleymehl K., Mederos Y., Schnitzler M., Frank J.A., Konrad D.B., Trauner D., Gudermann T., Zufall F. 2018. PhoDAGs enable optical control of diacylglycerol-sensitive transient receptor potential channels. Cell. Chem. Biol. V. 25. P. 215.
Lupa M.T., Caldwell J.H. 1991. Effect of agrin on the distribution of acetylcholine receptors and sodium channels on adult skeletal muscle fibers in culture. J. Cell. Biol. V. 115. P. 765.
Montell C. 2005. The TRP superfamily of cation channels. Sci. STKE. V. 2005. P. re3. https://doi.org/10.1126/stke.2722005re3
Montell C., Birnbaumer L., Flockerzi V. 2002. The TRP channels, a remarkably functional family. Cell. V. 108. P. 595.
Nilius B., Owsianik G., Voets T., Peters J.A. 2007. Transient receptor potential cation channels in disease. Physiol. Rev. V. 87. P. 165.
Nurullin L.F., Khuzakhmetova V.F., Khaziev E.F., Samigullin D.V., Tsentsevitsky A.N., Skorinkin A.I., Bukharaeva E.A., Vagin O. 2019. Reorganization of septins modulates synaptic transmission at neuromuscular junctions. Neurosci. V. 404. P. 91.
Nurullin L.F., Mukhitov A.R., Tsentsevytsky A.N., Petrova N.V., Samigullin D.V., Malomouzh A.I., Bukharaeva E.A., Nikolsky E.E., Vyskočil F. 2011. Voltage-dependent P/Q-type calcium channels at the frog: Neuromuscular junction. Physiol. Res. V. 60. P. 815.
Okada T., Inoue R., Yamazaki K., Maeda A., Kurosaki T., Yamakuni T., Tanaka I., Shimizu S., Ikenaka K., Imoto K., Mori Y. 1999. Molecular and functional characterization of a novel mouse transient receptor potential protein homologue TRP7. Ca(2+)-permeable cation channel that is constitutively activated and enhanced by stimulation of G protein-coupled receptor. J. Biol. Chem. V. 274. P. 27359.
Okada T., Shimizu S., Wakamori M., Maeda A., Kurosaki T., Takada N., Imoto K., Mori Y. 1998. Molecular cloning and functional characterization of a novel receptor-activated TRP Ca2+ channel from mouse brain. J. Biol. Chem. V. 273. P. 10279.
Owsianik G., D’hoedt D., Voets T., Nilius B. 2006. Structure-function relationship of the TRP channel superfamily. Rev. Physiol. Biochem. Pharmacol. V. 156. P. 61.
Peng G., Shi X., Kadowaki T. 2015. Evolution of TRP channels inferred by their classification in diverse animal species. Mol. Phylogenet. Evol. V. 84. P. 145.
Plant T.D., Schaefer M. 2005. Receptor-operated cation channels formed by TRPC4 and TRPC5. Naunyn Schmiedebergs Arch. Pharmacol. V. 371. P. 266.
Prakriya M., Lewis R.S. 2015. Store-operated calcium channels. Physiol. Rev. V. 95. P. 1383.
Ramsey I.S., Delling M., Clapham D.E. 2006. An introduction to TRP channels. Annu. Rev. Physiol. V. 68. P. 619.
Schaefer M., Plant T.D., Obukhov A.G., Hofmann T., Gudermann T., Schultz G. 2000. Receptor-mediated regulation of the nonselective cation channels TRPC4 and TRPC5. J. Biol. Chem. V. 275. P. 17517.
Soboloff J., Spassova M., Hewavitharana T., He L.P., Luncsford P., Xu W., Venkatachalam K., van Rossum D., Patterson R.L., Gill D.L. 2007. TRPC channels: integrators of multiple cellular signals. Handb. Exp. Pharmacol. V. 179. P. 575.
Stiber J.A., Zhang Z.S., Burch J., Eu J.P., Zhang S., Truskey G.A., Seth M., Yamaguchi N., Meissner G., Shah R., Worley P.F., Williams R.S., Rosenberg P.B. 2008. Mice lacking Homer 1 exhibit a skeletal myopathy characterized by abnormal transient receptor potential channel activity. Mol. Cell. Biol. V. 28. P. 2637.
Unwin N. 2013. Nicotinic acetylcholine receptor and the structural basis of neuromuscular transmission: insights from Torpedo postsynaptic membranes. Q. Rev. Biophys. V. 46. P. 283.
Vannier B., Peyton M., Boulay G., Brown D., Qin N., Jiang M., Zhu X., Birnbaumer L. 1999. Mouse TRP2, the homologue of the human TRPC2 pseudogene, encodes mTRP2, a store depletion-activated capacitative Ca2+ entry channel. Proc. Natl. Acad. Sci. USA. V. 96. P. 2060.
Vazquez G., Wedel B.J., Aziz O., Trebak M., Putney J.W. Jr. 2004. The mammalian TRPC cation channels. Biochim. Biophys. Acta. V. 1742. P. 21.
Zanou N., Shapovalov G., Louis M., Tajeddine N., Gallo C., Van Schoor M., Anguish I., Cao M.L., Schakman O., Dietrich A., Lebacq J., Ruegg U., Roulet E., Birnbaumer L., Gailly P. 2010. Role of TRPC1 channel in skeletal muscle function. Am. J. Physiol. Cell. Physiol. V. 298. P. C149.
Zitt C., Zobel A., Obukhov A.G., Harteneck C., Kalkbrenner F., Lückhoff A., Schultz G. 1996. Cloning and functional expression of a human Ca2+-permeable cation channel activated by calcium store depletion. Neuron. V. 16. P. 1189.
Дополнительные материалы отсутствуют.


