Цитология, 2020, T. 62, № 8, стр. 542-555
Экспрессия и обновление эндоглина на мембране мезенхимных стволовых клеток и клеток эндотелия
А. А. Пиневич 1, 2, *, Н. Л. Вартанян 1, Л. А. Терехина 1, И. Ю. Крутецкая 1, О. А. Шашкова 1, И. В. Смирнов 1, 3, М. П. Самойлович 1, 2
1 Российский научный центр радиологии и хирургических технологий им. акад. А.М. Гранова
197758 Санкт-Петербург, Россия
2 Кафедра цитологии и гистологии Санкт-Петербургского государственного университета
199034 Санкт-Петербург, Россия
3 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
* E-mail: agniapinevich@gmail.com
Поступила в редакцию 23.04.2020
После доработки 23.04.2020
Принята к публикации 27.04.2020
Аннотация
Эндоглин (CD105) – один из главных маркерных антигенов мезенхимных стволовых клеток (МСК) и эндотелиальных клеток. Функции эндоглина в клетках эндотелия подробно исследованы, тогда как значение этого белка в биологии МСК остается мало изученным. В работе проведено сравнительное исследование экспрессии, интернализации и шединга CD105 клетками эндотелия человека линии EA.hy926 и МСК жировой ткани человека, полученными из разных источников. Количество CD105-позитивных клеток во всех культурах МСК и клетках линии EA.hy926 составляло более 97% популяции, однако МСК, выделенные из висцерального жира, отличались от МСК подкожной жировой ткани по показателю, отражающему плотность CD105 на поверхности клеток. Суммарный уровень экспрессии мРНК эндоглина в МСК и эндотелиальных клетках был сходен, в то время как вклад мРНК, определяющей синтез короткой изоформы CD105, был выше в клетках эндотелия. С помощью моноклональных антител (МКАТ), направленных к разным эпитопам эндоглина, были выявлены значительные различия в динамике обмена CD105 на мембране эндотелиальных клеток и МСК. На клетках эндотелия EA.hy926 молекулы CD105, связавшие антитела, подвергались интернализации и оставались в перинуклеарном пространстве. В культурах МСК комплексы CD105 с антителами не подвергались эндоцитозу и длительное время сохранялись на клеточной мембране. Было показано, что МСК, так же, как и клетки эндотелия, обладают шедингом эндоглина, они сбрасывают экстраклеточный фрагмент молекулы в окружающую среду с образованием растворимой формы CD105. Процесс шединга в МСК был значительно менее интенсивным, чем в эндотелиальных клетках. Таким образом, впервые показано, что в МСК, в отличие от эндотелия, эндоглин долго сохраняется на поверхности клеток и не подвергается интернализации после связывания с антителами. Впервые было установлено, что МСК осуществляют шединг эндоглина с образованием его растворимой формы.
Эндоглин (CD105) – это интегральный трансмембранный белок, корецептор белков суперсемейства TGF-β. У человека идентифицировано две изоформы CD105 – длинная (L-CD105) и короткая (S-CD105), которые образуются в результате альтернативного сплайсинга и отличаются строением цитоплазматического домена (Bellón et al., 1993). Растворимая форма эндоглина образуется в результате отщепления экстраклеточного фрагмента молекулы с поверхности клетки вблизи трансмембранного домена под действием фермента матриксной металлопротеиназы 14 (MMP-14) (Hawinkels et al., 2010).
Известно, что не существует универсального маркера, специфичного для мезенхимных стволовых клеток (МСК), при этом CD105 является одним из основных позитивных маркеров этих клеток. При идентификации МСК необходимо подтвердить экспрессию нескольких мембранных молекул, включая CD105, CD29, CD44, CD73 и CD90 (Dominici et al., 2006). Уровень экспрессии CD105 на МСК, выделенных из различных источников, таких как костный мозг, жировая ткань, пуповинная кровь и плацента, может варьировать (Jeon et al., 2016).
Одним из основных источников МСК взрослого человека является жировая ткань (Gronthos et al., 2001; Zuk et al., 2001). По фенотипическим характеристикам и дифференцировочным потенциям CD105-позитивные МСК жировой ткани сходны с МСК костного мозга (Gronthos et al., 2001; Zuk et al., 2001, 2002; Katz et al., 2005; Mitchell et al., 2006). Низкая экспрессия CD105 на МСК ассоциирована со склонностью клеток к адипогенной дифференцировке, тогда как CD105-позитивные клетки предпочтительно дифференцируются в хондроциты (Jiang et al., 2010). Данные о взаимосвязи между экспрессией CD105 и остеогенной дифференцировкой МСК противоречивы: высокий остеогенный потенциал могут демонстрировать и CD105high-клетки (Jiang et al., 2010; Maleki et al., 2014), и CD105low-клетки (Levi et al., 2011). Отмечена связь между уровнем экспрессии CD105 и иммуномодулирующими свойствами МСК: не несущие этого маркера клетки ингибируют пролиферацию CD4-позитивных Т-лимфоцитов более эффективно, чем CD105-позитивные клетки (Anderson et al., 2013).
Помимо того, что CD105 – один из основных маркеров МСК, он, как известно, является пролиферативно-зависимой маркерной молекулой клеток сосудистого эндотелия (Gougos, Letarte, 1988). Эндоглин регулирует дифференцировку эндотелиальных клеток, влияет на их миграционную активность и участвует в формировании ими адгезионных контактов (Sanz-Rodriguez et al., 2004; Bernabeu et al., 2007). Считается, что ответ клеток на ростовые факторы, принадлежащие к семейству TGF-β, модулируется CD105 с помощью двух альтернативных сигнальных путей. Если после связывания TGF-β с рецептором TGF-β II типа активируется путь ALK1/Smad1/5/8, то пролиферация и миграция эндотелиальных клеток увеличиваются. Активация пути ALK5/Smad2/3 имеет противоположный эффект и обуславливает состояние покоя эндотелиальных клеток (Lebrin et al., 2005).
Моноклональные антитела (МКАТ) служат универсальным инструментом для изучения роли мембранных молекул в биологии различных клеток. Антитела против эндоглина в этом отношении занимают особое место, поскольку CD105 экспрессирован на поверхности эндотелиальных клеток, обращенной в просвет кровеносных сосудов. Такая локализация CD105, а также выраженная зависимость экспрессии этого маркера от пролиферации эндотелия, заставляют рассматривать эту молекулу как перспективную мишень для анти-ангиогенной терапии опухолей, а МКАТ против эндоглина – в качестве инструмента такого рода воздействий (Seon et al., 1997; Takahashi et al., 2001).
Цель настоящего исследования состояла в получении информации об экспрессии и обновлении молекул эндоглина на МСК жировой ткани человека в сравнении с эндотелиальными клетками.
МАТЕРИАЛ И МЕТОДИКА
Клетки. Процедура получения первичных линий МСК из жировой ткани была описана ранее (Пиневич и др., 2014). Вкратце: МСК выделяли из подкожной жировой ткани, извлеченной в ходе операций по поводу рака молочной железы (n = 4) и околопочечного жира, удаленного у пациентов с раком почек в ходе нефрэктомии (n = 4). Для получения материала использовали жировую ткань, не затронутую опухолевым процессом. Образцы МСК из подкожной жировой ткани условно здоровых доноров были выделены из липоаспиратов сотрудниками Покровского банка стволовых клеток человека (Санкт-Петербург, Россия). Все образцы были получены при информированном согласии от пациентов и доноров. Процедуры проводили в соответствии с нормативными требованиями научно-исследовательского этического комитета РНЦРХТ им. акaд. А.М. Гранова (Санкт-Петербург, Россия). Клеточные линии были охарактеризованы как МСК по адгезионным свойствам, фенотипу и дифференцировочным потенциям в соответствии с требованиями международного общества клеточной терапии (Dominici et al., 2006). МСК культивировали в вентилируемых пластиковых флаконах площадью 12.5, 25 и 75 см2 (Orange Sci-entific, Бельгия) в среде DMEM/F12 (БиолоТ, Россия), содержащей 10% эмбриональной телячьей сыворотки (Thermo Scientific, США) и 40 мкг/мл гентамицина (БиолоТ, Россия).
Клетки эндотелия человека линии EA.hy926 (полученные в результате гибридизации первичной линии HUVEC и карциномы человека A549) были предоставлены И.С. Фрейдлин (ИЭМ, Санкт-Петербург, Россия) с любезного разрешения автора (Edgell et al., 1983). Клетки EA.hy926 культивировали в вентилируемых пластиковых флаконах площадью 25 и 75 см2 (Orange Scientific, Бельгия) в среде DMEM/F12 (БиолоТ, Россия), содержащей 5% эмбриональной телячьей сыворотки (Thermo Scientific, США), 0.5 мкМ аминоптерина, 16 мкМ тимидина и 100 мкМ гипоксантина (Sigma, США).
Все клетки культивировали при 37°С в стандартных условиях (6% CO2, 20% O2) до образования 80–90%-ного конфлюентного монослоя, после чего пересевали с помощью раствора 0.25%-ного трипсина с версеном (БиолоТ, Россия).
Антитела. Были использованы МКАТ мыши, направленные против разных конформационно-зависимых эпитопов CD105 человека (2С8, 4С9 и 4Е4) и МКАТ мыши 3А7 против цитотоксического белка CagA Helicobacter pylori в качестве изотипического контрольного реагента. Все МКАТ были ранее получены в лаборатории гибридомной технологии РНЦРХТ им. акaд. А.М. Гранова (Смирнов и др., 2015). Вторичные козьи антитела против иммуноглобулинов мыши были приобретены у Invitrogen (США). Конъюгаты всех антител с изотиоцианатом флуоресцеина были приготовлены по стандартной методике (Catty et al., 1989). Для добавления в клеточные культуры МКАТ выделяли методом аффинной хроматографии с использованием белка G (Catty et al., 1989), разводили в фосфатно-солевом буферном растворе и стерилизовали фильтрованием. Меченные фикоэритрином антитела против CD105 человека и антитела мыши против IgG1κ человека (изотипический контроль) были приобретены у BD Biosciences (США).
Выделение РНК и исследование активности генов методом ПЦР в режиме реального времени. Тотальную клеточную РНК выделяли из МСК и клеток линии EA.hy926 с помощью TRIzol Reagent (Life Technologies, США) в соответствии с рекомендациями производителя. Для постановки реакции обратной транскрипции использовали 500 нг РНК. Реакционная смесь включала: 40 единиц M-MuLV обратной транскриптазы, 1 ммоль смеси dNTP, 0.2 мкг Random праймера, 20 единиц ингибитора РНКаз (RiboLock RNAse inhibitor; Сибэнзим, Россия) и деионизованную воду. Реакцию обратной транскрипции для получения кДНК проводили в соответствии с рекомендациями производителя обратной транскриптазы. ПЦР в реальном времени проводили в объеме 25 мкл в 96-луночных планшетах для ПЦР на термоциклере CFX96 Touch (Bio-Rad, США). Реакционная смесь для ПЦР включала в себя праймеры в заранее подобранных концентрациях (200–300 нМ), 0.5 мкл кДНК, 0.8 ммоль смеси dNTP, 4 ммоль Mg-Cl2, 1 ед. Hot Start Taq ДНК-полимеразы, реакционный буфер (Сибэнзим, Россия), 1 мкл SYBR Green (BioDye, Россия) и деионизованную воду. Специфические праймеры были выбраны из Банка праймеров Гарвардской медицинской школы (США) и синтезированы группoй компаний Алкор Био (Россия).
Экспрессию мРНК CD105 оценивали с использованием двух комбинаций праймеров, подобранных таким образом, чтобы амплифицируемый фрагмент (1) находился в общей для двух изоформ CD105 (L-CD105 и S-CD105) части мРНК или (2) включал часть последовательности интрона S-CD105 изоформы белка. Использовали следующие нуклеотидные последовательности праймеров:
для CD105-LS: 5'-CGGGTCTCAAGACCAGGAAG-3' (прямой) и
5'-GAGGAAGGCACCAAAGGTGA-3' (обратный);
для CD105-S: 5'-TCATCAGCCCTGACCTGTCT-3' (прямой) и
5'-GCATGCTCACTGTGGGGG-3' (обратный);
для MMP-14: 5'-CATCTGTGACGGGAACTTTGA-3' (прямой) и
5'-GGCAGTGTTGATGGACGCA-3' (обратный);
для TGF-β1: 5'-GGCCAGATCCTGTCCAAGC-3' (прямой) и
5'-GTGGGTTTCCAACCATTAGCAC-3' (обратный).
После денатурации при 95°С в течение 10 мин проводили 40 циклов амплификации в следующем режиме: плавление при 95°С в течение 30 с, отжиг при 56°С в течение 30 с, синтез при 72°С в течение 30 с. Уровень активности генов представляли в виде разницы (ΔCT) между пороговым циклом исследуемого гена и гена сравнения GAPDH.
Анализ пролиферации клеток. Клетки культивировали в соответствующей ростовой среде в вентилируемых пластиковых флаконах площадью 25 см2 (Orange Scientific, Бельгия). После достижения субконфлюентного монослоя клетки снимали с поверхности культуральных флаконов с помощью 0.25%-ного раствора трипсина с версеном (БиолоТ, Россия). Число клеток во взвеси определяли с помощью кондуктометрического счетчика Z1 Coulter Counter (Beckman Coulter, США). Время удвоения численности популяции (ВУ) рассчитывали по формуле: ВУ = = (dT × lg2)/(lgN – lgN0), где dT – время от посева до снятия культуры, N0 – исходное число клеток (посевная доза), а N – прирост числа клеток.
Проточная цитофлуориметрия. Для анализа экспрессии CD105 клетки снимали с поверхности культуральных флаконов и инкубировали с меченными фикоэритрином антителами против CD105 или соответствующими изотипическими контрольными реагентами (BD Biosciences, США), разведенными в фосфатно-солевом буферном растворе с добавлением 3% эмбриональной телячьей сыворотки (Thermo Scientific, США) и 0.1% азида натрия (Sigma, США) в течение 1 ч при 4°C. Окрашенные клетки отмывали в буфере CellWASH (BD Biosciences, США) и анализировали на проточном цитофлуориметре BD FACSAriaIII с использованием программного обеспечения BD FACSDiva software version 7.0 (BD Biosciences, США).
Чтобы оценить, как долго CD105, связанный с МКАТ, сохраняется на поверхности плазматической мембраны, клетки в логарифмической фазе роста инкубировали в ростовой среде, содержащей 10 мкг/мл немеченых МКАТ против CD105 в течение 1 ч при 37°C. Далее клетки отмывали от антител и либо немедленно анализировали на проточном цитофлуориметре, либо культивировали в ростовой среде, не содержащей антител, в течение 24, 48 или 72 ч при 37°C. Во всех случаях по окончании культивирования клетки инкубировали с вторичными антителами, меченными изотиоцианатом флуоресцеина, в течение 1 ч при 4°C. Для того чтобы оценить, влияют ли МКАТ на уровень экспрессии CD105, клетки после инкубации с немечеными антителами и культивирования по вышеописанной схеме последовательно инкубировали с немечеными МКАТ против CD105 той же специфичности, что и исходная, и с вторичными антителами, меченными изотиоцианатом флуоресцеина, в течение 1 ч при 4°C. Во всех случаях были использованы соответствующие изотипические контроли. Все эксперименты проводили в трех повторностях.
Иммунофлуоресцентная микроскопия. Для выявления поверхностного и внутриклеточного эндоглина клетки культивировали на покровных стеклах в соответствующей ростовой среде, содержащей 10 мкг/мл меченых изотиоцианатом флуоресцеина МКАТ против CD105 или антител изотипического контроля, в течение 30 мин, 1 или 2 ч при 4°C (для выявления CD105 на поверхности мембраны) или при 37°C (для выявления внутриклеточного CD105 после интернализации). После инкубации с антителами клетки отмывали и либо немедленно фиксировали в 4%-ном забуференном параформ-альдегиде в течение 10 мин, либо культивировали в ростовой среде, не содержащей антител, в течение 24, 48 или 72 ч до фиксации.
Чтобы выявить только поверхностную форму CD105, связанную с МКАТ, клетки культивировали в ростовой среде, содержащей 10 мкг/мл немеченых МКАТ против CD105 или антител изотипического контроля в течение 1 ч при 37°C, отмывали от антител и культивировали в ростовой среде по вышеописанной схеме. По окончании культивирования клетки фиксировали, как описано выше, и инкубировали с вторичными антителами, мечеными изотиоцианатом флуоресцеина, в течение 1 ч при комнатной температуре с пермеабилизацией (0.05%-ным сапонином (Sigma, США) в фосфатно-солевом буферном растворе в течение 30 мин) или без пермеабилизации. Ядра докрашивали DAPI (Sigma, США) в течение 10 мин. Препараты визуализировали с помощью микроскопа AxioScope.A1, оборудованного камерой AxioCam MRm, с использованием программного обеспечения AxioVision Rel. 4.8 software (Carl Zeiss AG, Германия).
Измерение концентрации растворимого CD105 с помощью иммунорферментного анализа (ИФА). Клетки культивировали в 96-луночных планшетах (Thermo Fisher Scientific, США) в течение 24 ч до достижения 100%-ного конфлюентного монослоя. После этого ростовую среду заменяли и продолжали культивирование. Пробы ростовой среды собирали через 24, 48, 96 или 144 ч культивирования из трех независимых лунок. Концентрацию CD105 определяли с помощью высокочувствительного двухцентрового варианта ИФА, разработанного в лаборатории (Смирнов и др., 2015; Smirnov et al., 2016). В качестве калибрующего образца использовали рекомбинантный растворимый CD105 (1097-EN-025, R&D Systems, США).
Статистический анализ. Большинство экспериментов было проведено в трех повторностях. Данные представлены в виде средних значений и стандартного отклонения.
Использованные реактивы: среда DMEM/F12 с глутамином, раствор Дульбекко DPBS 1-кратный без Ca2+ и Mg2+, раствор трипсина с версеном (1 : 1), гентамицин (БиолоТ, Россия); эмбриональная телячья сыворотка Hyclone (Thermo Scientific, США); аминоптерин, тимидин, гипоксантин, азид натрия, изотиоцианат флуоресцеина, сапонин, Tween-20, DAPI (Sigma, США); немеченые козьи антитела против иммуноглобулинов мыши (Invitrogen, США); меченые фикоэритрином моноклональные мышиные антитела к CD105 (clone 266), меченые фикоэритрином антитела изотипического контроля (clone MOPC-21), BD FACSFlow™ Sheath Fluid, BD CellWASH (Becton Dickinson, США); TRIzol Reagent (Life Technologies, США); M-MuLV обратной транскриптазы, смесь dNTP, Random-праймера и ингибитора РНКаз (RiboLock RNAse inhibitor), Hot Start Taq ДНК-полимераза, буфер для Hot Start Taq ДНК-полимеразы, раствор MgCl2 (Сибэнзим, Россия); Sybr Green (BioDye, Россия); рекомбинантный растворимый CD105 (1097-EN-025, R&D Systems, США); параформальдегид (ЛенРеактив, Россия).
РЕЗУЛЬТАТЫ
Анализ экспрессии CD105 с помощью проточной цитофлуориметрии. Уровень экспрессии молекул CD105 на поверхности клеток эндотелия линии EA.hy926 и МСК из жировой ткани оценивали методом проточной цитофлуориметрии (рис. 1). Большинство МСК и клеток EA.hy926 несли на поверхности эндоглин, причем не было обнаружено различий в численности клеток CD105+ между МСК и эндотелиальными клетками. Культуры МСК, выделенные из подкожной или висцеральной жировой ткани пациентов и культуры, полученные из подкожной жировой ткани здоровых доноров, содержали одинаковые по численности популяции клеток, экспрессирующих мембранный эндоглин.
Рис. 1.
Экспрессия поверхностного белкового маркера CD105 эндотелиальными клетками EA.hy926 (1), МСК из подкожной жировой ткани здоровых доноров (2), из висцеральной (3) и подкожной (4) жировой ткани пациентов. Проточная цитофлуориметрия. а – Интенсивность флуоресценции популяций клеток CD105+, меченных МКАТ; пик 5 – изотипический контроль. б – Процентное содержание клеток CD105+ в популяциях. Точки соответствуют средним значениям для отдельных образцов.

В качестве второго критерия оценки экспрессии CD105 была выбрана медиана интенсивности флуоресценции клеток (МИФ), измеренная для каждой индивидуальной культуры МСК и клеток линии EA.hy926 (рис. 2). Этот показатель был близок по значению для клеток эндотелия и культур МСК, выделенных из подкожной жировой ткани. При анализе культур МСК, полученных из висцеральной жировой ткани, были получены более высокие значения МИФ, что свидетельствовало о большем количестве молекул CD105 на поверхности этих клеток.
Рис. 2.
Сравнение медиан интенсивности флуоресценции (МИФ) CD105+-эндотелиальных клеток EA.hy926 (1), МСК из подкожной жировой ткани здоровых доноров (2), из висцеральной (3) и подкожной (4) жировой ткани пациентов. Показаны средние значения и 95%-ные доверительные интервалы. ***Различия достоверны при Р < 0.001.

Анализ экспрессии генов CD105 и TGF-β1. Молекулы CD105 на поверхности клеток могут присутствовать в виде одной из двух изоформ – длинной (L-CD105) или короткой (S-CD105), которые образуются в результате альтернативного сплайсинга и играют противоположные роли в сигнальных путях, индуцированных TGF-β. Чтобы выяснить, какие изоформы эндоглина представлены на эндотелиальных клетках и МСК, были использованы праймеры, позволяющие оценить уровень мРНК S-CD105 или суммарной мРНК обеих изоформ CD105 (рис. 3).
Рис. 3.
Экспрессия генов двух изоформ белка CD105 (L-CD105 и S-CD105 суммарно; (а), S-CD105 (б), TGF-β1 (в) и MMP-14 (г) в эндотелиальных клетках EA.hy926 (1), МСК из подкожной жировой ткани здоровых доноров (2), из висцеральной (3) и подкожной (4) жировой ткани пациентов. Показаны средние значения. Уровни активности генов представлены в виде разности (ΔСТ) между пороговым циклом исследуемого гена и геном сравнения GAPDH (ПЦР в режиме реального времени).
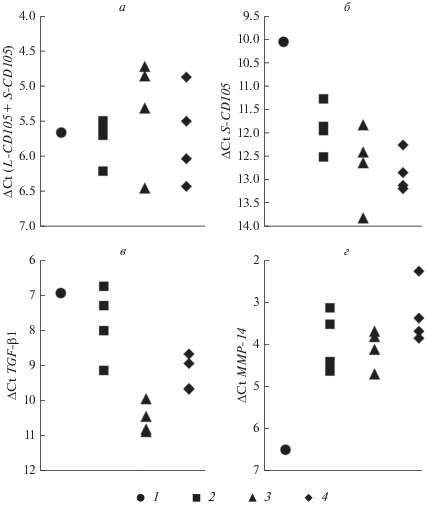
Общий уровень экспрессии гена эндоглина (L‑CD105 + S-CD105) был высоким и в эндотелиальных клетках, и в МСК. При этом в индивидуальных образцах МСК активность гена варьировала (рис. 3а). Вклад мРНК, определяющей синтез короткой изоформы CD105, в клетках EA.hy926 был выше, чем в МСК (рис. 3б), следовательно, культуры МСК характеризовались более высокой экспрессией L‑CD105, чем эндотелиальные клетки. У МСК здоровых доноров обнаружили тенденцию к более высокой экспрессии короткой изоформы эндоглина по сравнению с МСК пациентов.
Уровень экспрессии гена TGF-β1 в эндотелиальных клетках EA.hy926 был сравним с таковым в МСК здоровых доноров и выше, чем в МСК, полученных от пациентов (рис. 3в).
Время удвоения клеточных популяций. Было проведено сравнение скорости роста культур МСК и клеток эндотелия линии EA.hy926 (рис. 4). МСК обладали ограниченным пролиферативным потенциалом. Время удвоения этих культур было наименьшим на 3–6 пассажах культивирования, однако варьировало для индивидуальных образцов. Культура клеток эндотелия EA.hy926 имела значительно более высокую пролиферативную активность, чем любая из культур МСК.
Рис. 4.
Время удвоения эндотелиальных клеток EA.hy926 и МСК. а – Клетки EA.hy926 (1), МСК из подкожной жировой ткани здоровых доноров (2), из висцеральной (3) и подкожной (4) жировой ткани пациентов; для EA.hy926 показаны средние значения, для МСК точки соответствуют отдельным образцам. б – Время удвоения МСК (на примере клеток из подкожной жировой ткани пациентов) при длительном культивировании; вертикальные отрезки – стандартные отклонения от среднего.

Удаление CD105 с мембраны МСК и эндотелиальных клеток. Обмен CD105 на поверхностной мембране клеток является результатом ряда процессов: синтеза эндоглина и встраивания его в мембрану, его интернализации, рециркуляции, а также опосредованного ферментами отщепления экстраклеточного участка CD105. Часть молекул эндоглина в течение некоторого времени может сохраняться на поверхности клеток. Присутствие CD105 на эндотелиальных клетках и МСК исследовали с помощью МКАТ против эндоглина человека, обладающих разной эпитопной специфичностью (рис. 5).
Рис. 5.
Динамика удаления комплексов CD105 с разными по эпитопной специфичности МКАТ (2С8, 4С9, 4Е4) с поверхности эндотелиальных клеток EA.hy926 (а, д), МСК из подкожной жировой ткани здоровых доноров (б, е), из висцеральной (в, ж) и подкожной (г, з) жировой ткани пациентов при культивировании в среде, не содержащей антител. По вертикали: доля клеток, сохраняющих на поверхности иммунные комплексы CD105-МКАТ, % (а–г); отношение МИФ клеток, несущих комплексы CD105-МКАТ (МИФ-1), к МИФ изотипического контроля (МИФ-2) (д–з). Вертикальные отрезки – стандартные отклонения.

Чтобы оценить сохранение молекул эндоглина на поверхностной мембране, клетки инкубировали с немечеными МКАТ в течение 1 ч при 37°C, затем отмывали от несвязавшихся антител. Часть клеток немедленно после этого инкубировали с вторичными антителами, мечеными изотиоцианатом флуоресцеина в течение 1 ч при 4°C и исследовали методом проточной цитофлуориметрии. Другую часть клеток перед дальнейшей обработкой культивировали в среде, не содержащей антител, в течение 24, 48 или 72 ч.
При проведении анализа непосредственно после удаления антител фракция клеток CD105+ составляла более 94% популяции всех индивидуальных культур МСК и эндотелиальных клеток (рис. 5а–г). Результат не зависел от того, какие из эндоглин-специфичных антител были использованы. При культивировании клеток в среде, не содержащей антител, количество иммунных комплексов CD105-МКАТ на мембране снижалось с течением времени, причем динамика этого процесса отличалась для МСК и эндотелиальных клеток. Через 48 ч культивирования лишь 9–46% клеток EA.hy926 несли на поверхности комплексы CD105-МКАТ (рис. 5a), а различия были обусловлены использованными МКАТ.
Культуры МСК сохраняли иммунные комплексы CD105-МКАТ на поверхности мембраны значительно дольше. Динамика снижения количества меченых клеток была разной для индивидуальных образцов. До половины МСК, полученных из висцеральной жировой ткани, сохраняли на поверхности комплексы CD105-МКАТ спустя 72 ч культивирования (рис. 5в). В то же время культуры МСК из подкожной жировой ткани условно здоровых доноров (рис. 5б) и пациентов (рис. 5г) через 72 ч содержали до 69% CD105-позитивных клеток. Доля клеток, сохраняющих иммунные комплексы, была выше, если клетки инкубировали с МКАТ специфичности 2C8 или 4C9. Связывание CD105 с МКАТ другой специфичности (4Е4) во всех экспериментах индуцировало наиболее быстрое освобождение иммунных комплексов с поверхности мембран клеток.
Был поставлен вопрос о том, индуцирует ли связывание CD105 с антителами последующее снижение экспрессии этого маркера на клеточной мембране. Для этого после культивирования по вышеописанной схеме в среде, не содержащей МКАТ, клетки повторно инкубировали в течение 1 ч при 4°C с одноименными немечеными МКАТ, а затем с мечеными вторичными антителами (данные не показаны). Было установлено, что количество клеток CD105+ не менялось на всех сроках культивирования и составляло более 94% для всех исследованных культур. Эндотелиальные клетки и МСК продолжали синтезировать и выставлять на поверхности мембраны вновь синтезированные молекулы эндоглина.
Помимо численности популяции CD105+-клеток, об уровне экспрессии эндоглина МСК и эндотелиальными клетками судили по уровню МИФ. В качестве показателя для каждой временной точки оценивали отношение МИФ клеток CD105+ к МИФ изотипического контроля (рис. 5д–з). Количество иммунных комплексов CD105-МКАТ на поверхности МСК заметно снижалось в течение первых 24 ч культивирования в среде, не содержащей антител, вне зависимости от использованных МКАТ. В течение последующих 48 ч культивирования плотность комплексов CD105-МКАТ незначительно снижалась на поверхности МСК, выделенных из висцеральной жировой ткани и оставалась неизменной на поверхности МСК из подкожной жировой ткани пациентов и здоровых доноров. При этом численность популяций CD105+-клеток продолжала снижаться во всех культурах МСК.
На клетках эндотелия линии EA.hy926 плотность молекул CD105, связанных с антителами, зависела от того, МКАТ какой специфичности (4E4 или 4C9) входили в состав комплекса. Связывание CD105 с 4E4 приводило к быстрому снижению плотности эндоглина на поверхности мембраны, тогда как плотность комплексов CD105-4C9 сохранялась на постоянном уровне в течение 24 ч.
Снижение количества молекул CD105 на поверхности мембраны могло быть следствием либо интернализации клетками иммунных комплексов, либо фермент-опосредованного сбрасывания иммунных комплексов, содержащих эндоглин.
Интернализация CD105 эндотелиальными клетками. Судьба молекул CD105 после связывания с МКАТ на поверхности мембраны была прослежена методом иммунофлуоресцентной микроскопии. Клетки EA.hy926, выращенные на покровных стеклах, инкубировали с меченными изотиоцианатом флуоресцеина МКАТ против CD105, отмывали, и либо сразу просматривали в микроскопе, либо культивировали в течение 24–72 ч в среде, не содержащей антител, перед просмотром (рис. 6).
Рис. 6.
Локализация иммунных комплексов CD105 с МКАТ (4Е4) в эндотелиальных клетках EA.hy926 после инкубации с антителами при разных температуре и длительности. а–е – ФИТЦ-меченные 4Е4: а – 30 мин, 4°C; б – 30 мин, 37°C; в – 2 ч, 37°С; г, д, е – 2 ч при 37°С и последующее культивированиe в среде, не содержащей антител, в течение 24 (г), 48 (д) или 72 (е) ч соответственно. ж, з – Немеченые 4Е4, 2 ч, 37°C и последующее культивирование в среде, не содержащей антител (48 ч) с визуализацией вторичными антителами, меченными ФИТЦ без (ж) или после (з) пермеабилизации; и – после инкубации с антителами изотипического контроля. Ядра докрашены DAPI. Об. 40×.

Динамика элиминации CD105 с поверхности клеток EA.hy926 была одинаковой для всех использованных МКАТ. Через 30 мин инкубации с мечеными МКАТ при 4°C все иммунные комплексы CD105-МКАТ располагались на поверхности клеток без признаков интернализации (рис. 6а). При повышении температуры инкубации до 37°C молекулы CD105, связанные с МКАТ, были обнаружены не только на поверхности мембраны, но и в перинуклеарном пространстве (рис. 6б). Увеличение времени инкубации при 37°C в присутствии МКАТ приводило к увеличению количества комплексов CD105-МКАТ в перинуклеарном пространстве эндотелиальных клеток (рис. 6в). Через 24 ч культивирования клеток EA.hy926 в среде, не содержащей антител, численность клеток, несущих на мембране иммунные комплексы CD105-МКАТ, уменьшалась (рис. 6г). После 48-часового культивирования не удалось обнаружить эндотелиальных клеток, сохранивших на поверхности комплексы CD105-МКАТ, однако эндоглин, меченный МКАТ, присутствовал в перинуклеарном пространстве ряда клеток вплоть до 72 ч культивирования, хотя количество таких клеток со временем снижалось (рис. 6д, е).
Для того, чтобы отличить молекулы CD105, встроенные в поверхностную мембрану клеток, от интернализованного антигена, клетки EA.hy926 инкубировали с немечеными МКАТ против эндоглина при 37°C, отмывали и культивировали в течение 48 ч в среде, не содержащей антител. После этого часть клеток обрабатывали пермеабилизирующим раствором, а остальные сразу же просматривали под микроскопом. Для визуализации комплексов CD105-МКАТ использовали вторичные антитела, меченные изотиоцианатом флуоресцеина. В пермеабилизированных клетках линии EA.hy926 комплексы МКАТ-CD105 были выявлены в перинуклеарном пространстве (рис. 6з), в то время как клетки EA.hy926 с непермеабилизированной мембраной оставались неокрашенными, поскольку все молекулы CD105, связавшие МКАТ, к этому моменту находились внутри клеток (рис. 6ж). Следовательно, в клетках эндотелия линии EA.hy926 молекулы CD105, связавшие МКАТ, интернализовались и сохранялись в цитоплазме до 72 ч.
Интернализация CD105 МСК. Схема экспериментов, выполненных на культурах МСК, была такой же, как для эндотелиальных клеток. Полученные результаты продемонстрированы на примере МСК из подкожной жировой ткани пациентов (рис. 7).
Рис. 7.
Локализация иммунных комплексов CD105 c МКАТ (4Е4) в МСК из подкожной жировой ткани пациентов после инкубации с антителами при разной температуре в течение 2 ч. а–в – ФИТЦ-меченные 4Е4: а – 4°C, б – 37°C, в – 37°C и последующее культивирование в среде, не содержащей антител в течение 72 ч. г, д – Немеченые 4Е4, 37°C и последующее культивирование в среде без антител (72 ч) с визуализацией вторичными антителами, меченными ФИТЦ без (г) или после (д) пермеабилизации соответственно; е – после инкубации с антителами изотипического контроля. Ядра докрашены DAPI. Об. 20×. Видно, что комплексы CD105-МКАТ локализованы на поверхности МСК и не подвергаются интернализации.
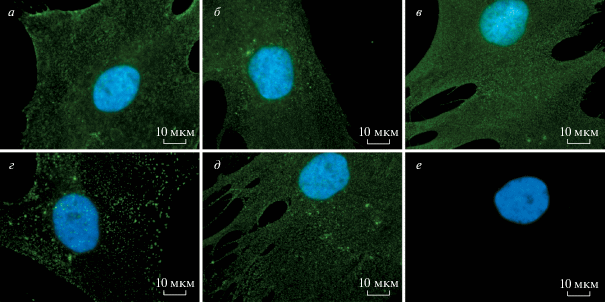
Динамика распределения молекул CD105 после связывания с МКАТ была одинаковой для всех исследованных культур МСК. Через 2 ч после инкубации с мечеными МКАТ при 4°C иммунные комплексы МКАТ-CD105 выявлялись только на поверхности МСК (рис. 7а). Повышение температуры инкубации до 37°C не влияло на полученную картину окрашивания; все иммунные комплексы оставались на поверхности мембраны и не проникали в перинуклеарное пространство (рис. 7б). Для того чтобы определить, как долго молекулы CD105, связанные с МКАТ, остаются на поверхности МСК, клетки культивировали в среде, не содержащей антител (рис. 7в). В течение всего периода культивирования (до 72 ч) комплексы CD105-МКАТ были выявлены только на поверхности МСК, но не в цитоплазме клеток.
Эксперимент с пермеабилизацией МСК, проведенный по аналогии с экспериментом на эндотелиальных клетках, подтвердил, что комплексы эндоглина с МКАТ локализованы только на поверхностной мембране МСК (рис. 7г, 7д). Окрашивание CD105, локализованного на мембране МСК, наблюдали вне зависимости от использованных МКАТ.
Таким образом, молекулы CD105, связанные с МКАТ, сохранялись на поверхности МСК при времени культивирования до 72 ч. Интернализации комплексов CD105-МКАТ не происходило.
Шединг CD105 эндотелиальными клетками и МСК. Известно, что эндотелиальные клетки высвобождают экстраклеточный фрагмент молекулы эндоглина в окружающую среду в результате протеолиза под действием MMP-14. Как было показано выше, МСК, в отличие от эндотелиальных клеток, не интернализуют молекулы CD105, связанные с МКАТ, а сохраняют их на поверхностной мембране в течение длительного времени. До настоящего времени не было известно, способны ли МСК высвобождать экстраклеточный фрагмент CD105 с поверхности мембраны. Было проведено сравнительное исследование накопления растворимой формы эндоглина в культуральной среде эндотелиальных клеток и МСК (рис. 8).
Рис. 8.
Накопление растворимого CD105 в ростовой среде эндотелиальных клеток EA.hy926 (1), МСК из подкожной жировой ткани здоровых доноров (2), из висцеральной (3) и подкожной (4) жировой ткани пациентов, измеренное с помощью двухцентрового ИФА. Вертикальные отрезки – стандартные отклонения.

Впервые было установлено, что МСК, подобно эндотелиальным клеткам, способны накапливать растворимый эндоглин в культуральной среде, причем с течением времени концентрация растворимого CD105 нарастала. Однако концентрация растворимого эндоглина в культуральной среде эндотелиальных клеток была существенно выше и через 6 сут культивирования без замены среды составляла 25 нг/мл с тенденцией к дальнейшему увеличению. Культивирование всех образцов МСК приводило к накоплению не более 4 нг/мл эндоглина в ростовой среде, а при дальнейшем поддержании культур наблюдали тенденцию к замедлению интенсивности шединга. Достоверных различий в динамике накопления CD105 в культуральной среде МСК, полученных из разных источников, отмечено не было.
Для того чтобы исключить повышение концентрации растворимого CD105 в культуральной среде вследствие гибели клеток, оценивали жизнеспособность клеток (данные не приведены) и показали, что количество жизнеспособных эндотелиальных клеток и МСК превышало 90–95%.
Экспрессия гена MMP-14 в эндотелиальных клетках и МСК. Поскольку MMP-14 считается основным ферментом, ответственным за шединг эндоглина в эндотелиальных клетках, исследовали уровень экспрессии гена MMP-14 в эндотелиальных клетках и МСК (рис. 3г). Для всех культур МСК уровень активности MMP-14 оказался выше, чем для эндотелиальных клеток EA.hy926. Несмотря на это, эндотелиальные клетки накапливали значительно больше растворимого эндоглина в культуральной среде, чем МСК.
ОБСУЖДЕНИЕ
Жировая ткань является одним из основных источников МСК. Существует тесная взаимосвязь между МСК, в особенности МСК жировой ткани, и эндотелиальными клетками. Считается, что клетки эндотелия регулируют активность МСК и их способность к дифференцировке (Saleh et al., 2011). Так, развитие капиллярной сети является важным фактором ремоделирования жировой ткани во взрослом организме. Тесный контакт между эндотелиальными клетками и МСК необходим для процесса хоминга последних (Rüster et al., 2006; Jeon et al., 2016). В то же время МСК необходимы для ангиогенеза в поврежденных тканях (Nassiri, Rahbarghazi, 2014). Зрелые адипоциты способны редифференцироваться в эндотелиальные клетки in vitro и in vivo. Этот факт указывает на возможное существование общего эволюционного предшественника адипоцитов и эндотелиальных клеток (Planat-Benard et al., 2004).
МСК и эндотелиальные клетки экспрессируют один и тот же поверхностный маркер, эндоглин (CD105), который является компонентом рецепторного комплекса белков семейства TGF-β. В клетках эндотелия CD105 участвует в пролиферации клеток, их дифференцировке, миграции и в формировании клеточных контактов. Плотность молекул CD105 значительно возрастает на поверхности активированных эндотелиальных клеток, в частности, в местах тканевой регенерации или сосудах растущих опухолей (Brewer et al., 2000; Kassouf et al., 2004; Erdem et al., 2006). В этой связи CD105 рассматривают как маркер опухолевого ангиогенеза и потенциальную мишень для анти-ангиогенной терапии солидных новообразований. Несмотря на многочисленные данные о значимости CD105 для эндотелиальных клеток, мало что известно о его роли в биологии МСК. К настоящему времени показано, что уровень экспрессии CD105 на поверхности МСК тесно связан с их дифференцировкой (Jiang et al., 2010; Levi et al., 2011; Maleki et al., 2014) и иммунорегуляторными свойствами (Anderson et al., 2013).
Одна из задач работы состояла в том, чтобы сравнить экспрессию CD105 на клетках эндотелия линии EA.hy926 и МСК, полученных из разных источников: подкожной и висцеральной жировой ткани пациентов, а также жировой ткани здоровых доноров. Полученные результаты совпали с ранее известными фактами, демонстрирующими, что большинство клеток в культурах МСК и эндотелия несут на мембране эндоглин. Экспрессия гена CD105 была примерно одинаковой во всех исследованных клетках. Однако при дифференцированной оценке сплайсинг-вариантов гена, определяющих продукцию длинной (L-CD105) или короткой (S-CD105) изоформ эндоглина, оказалось, что МСК отличались от эндотелия более высокой экспрессией L-изоформы. Эндотелиальные клетки EA.hy926 экспрессировали обе изоформы CD105.
Ранее было показано, что МСК, полученные из жировой ткани мыши, экспрессируют только L-изоформу CD105 (Anderson et al., 2013). Также известно, что в эндотелиальных клетках при старении происходит усиление экспрессии S-изоформы CD105 (Blanco et al., 2008). Проведенное ранее исследование экспрессии двух сплайсинг-изоформ эндоглина в клетках разного гистогенеза продемонстрировало, что во всех исследованных клеточных линиях преобладала экспрессия длинной изоформы CD105 (Самойлович и др., 2018), что согласуется с данными о связи L-CD105 с адгезивными функциями клеток (Bernabeu et al., 2007). Различия в экспрессии двух изоформ эндоглина между МСК и эндотелиальными клетками могут указывать на то, что функции, выполняемые CD105 в этих клетках, также различны.
Эндоглин является корецептором TGF-β первого и третьего типа (Cheifetz et al., 1992). Мы продемонстрировали, что клетки EA.hy926 обладали более высоким уровнем экспрессии гена TGF-β1 по сравнению с МСК, а время удвоения МСК было значительно ниже, по сравнению с эндотелиальными клетками. Эти данные могут свидетельствовать о том, что сигнальный путь TGF-β не играет ключевой роли в пролиферации МСК.
Значительное сходство культур МСК и эндотелиальных клеток по экспрессии СD105 позволило поставить вопрос о том, насколько различается динамика обмена CD105 на мембранах этих клеток.
Синтезированные клетками молекулы эндоглина встраиваются в плазматическую мембрану, где могут функционировать какое-то время, могут быть интернализованы (при связывании с лигандами или антителами), возвращены на мембрану в результате рециклинга или сброшены в окружающую среду в виде растворимых молекул. Для того чтобы проанализировать эти возможности, были использованы МКАТ против разных эпитопов эндоглина, созданные в нашей лаборатории.
Результаты исследований методом проточной цитометрии и иммунофлуоресцентной микроскопии показали, что в клетках эндотелия линии EA.hy926 эндоглин после связывания с МКАТ подвергался интернализации и был обнаружен в эндосомах в пекринуклеарном пространстве. Небольшая часть CD105 сохранялась на поверхности отдельных клеток эндотелия до 48 ч. Эти результаты согласуются с известными сведениями о метаболизме других по специфичности антител после их связывания с соответствующими мембранными антигенами (Kyriakos et al., 1992; Mattes et al., 1994). Оставшиеся на поверхности клеток эндотелия молекулы CD105 были сброшены с мембраны, в результате чего концентрация растворимого эндоглина в среде культивирования существенно нарастала со временем. Принято считать, что насыщение рецепторов при связывании с антителами происходит в течение 20–30 мин, однако в работе мы использовали период от 30 мин до 2 ч с тем, чтобы по возможности нивелировать различия условий для исследуемых клеточных линий.
Нам не удалось обнаружить в литературе работ, в которых была бы описана интернализация эндоглина МСК. Согласно нашим результатам, большинство МСК, в отличие от эндотелиальных клеток, длительное время удерживали на мембране иммунные комплексы CD105-МКАТ без интернализации. С помощью проточной цитофлуориметрии было показано, что МСК, подобно клеткам эндотелия, после связывания CD105 с МКАТ продолжали синтезировать и встраивать в плазматическую мембрану новые молекулы эндоглина. Впервые нами было установлено, что МСК, как и эндотелиальные клетки, постоянно отщепляют экстраклеточные фрагменты CD105 и сбрасывают их в виде растворимых молекул в окружающую среду. Однако концентрация растворимого CD105 в культуральной среде МСК оказалась существенно ниже, чем для EA.hy926 в те же сроки культивирования.
Основным ферментом, обеспечивающим отщепление экстраклеточного фрагмента эндоглина в эндотелиальных клетках, является MMP-14. Интересно, что уровень экспрессии гена MMP-14 в МСК оказался более высоким, чем в эндотелиальных клетках. Следует отметить, что измерение концентрации CD105 проводили в одинаковых условиях для МСК и эндотелиальных клеток, однако время удвоения клеток линии EA.hy926 было значительно выше. Соответственно, количество клеток линии EA.hy926 на единицу площади культурального флакона было выше, чем МСК. Помимо этого, размер МСК превышал размер эндотелиальных клеток, что предположительно приводило к тому, что накопление растворимой формы эндоглина в ростовой среде эндотелиальных клеток происходило более интенсивно, чем для МСК.
Динамика элиминации молекул CD105 с мембраны МСК была разной для культур клеток, полученных из разных источников, а также при использовании разных по эпитопной специфичности МКАТ. По одним данным МСК, выделенные из подкожной и висцеральной жировой ткани, схожи по экспрессии поверхностных маркеров, в том числе CD105, и дифференцировочным потенциям (Baglioni et al., 2009). Согласно другому исследованию, МСК из подкожной жировой ткани обладают более высокой скоростью роста и адипогенным потенциалом, чем МСК из висцеральной жировой ткани, что может указывать на более глубокие функциональные и метаболические различия между клетками этих типов (Baglioni et al., 2012). Согласно нашим данным, МСК из висцеральной жировой ткани более активно обновляли эндоглин на поверхности плазматической мембраны, чем МСК из подкожной жировой ткани. Динамика обновления CD105, связанного с МКАТ разной эпитопной специфичности, в целом совпадала. Однако связывание МКАТ (4Е4) с CD105 приводило к более быстрому удалению меченого эндоглина с плазматической мембраны и снижению плотности CD105, по сравнению с другими МКАТ (2С8 или 4С9). Этот факт был отмечен и для МСК, и для эндотелиальных клеток, при этом для клеток EA.hy926 он был наиболее выражен в течение первых 24 ч. В целом, результаты сравнительного исследования динамики эндоглина на поверхности МСК и эндотелиальных клеток согласуются с представлениями о том, что судьба комплексов рецепторов и связавших их МКАТ определяется в большей степени характеристиками самих клеточных линий, нежели эпитопной специфичностью антител (Hanna et al., 1996).
Таким образом, полученные данные свидетельствуют о том, что, несмотря на сходный уровень экспрессии эндоглина на поверхности МСК и эндотелиальных клеток, последние обладают значительно более высокой скоростью метаболизма CD105 на плазматической мембране, активно интернализуют эндоглин и сбрасывают его экстраклеточный уча-сток в окружающую среду. В то же время, большинство МСК удерживают эндоглин на поверхности клеток в течение длительного времени, либо сбрасывают его в окружающую среду, но не подвергают CD105 интернализации.
Список литературы
Пиневич А.А., Самойлович М.П., Шашкова О.А., Вартанян Н.Л., Полысалов В.Н., Киселева Л.Н., Карташев А.В., Айзенштадт А.А., Климович В.Б. 2014. Характеристика мезенхимных стромальных клеток при раке молочной железы. Клеточные технологии в биологии и медицине. Т. 2. С. 84. (Pinevich A.A., Samoilovich M.P., Shashkova O.A., Vartanyan N.L., Polysalov V.N., Kiseleva L.N., Kartashev A.V., Aizenshtadt A.A., Klimovich V.B. 2014. Characteristics of mesenchymal stromal cells isolated from patients with breast cancer. Bull. Exp. Biol. Med. V. 157. P. 666.)
Самойлович М.П., Пиневич А.А., Вартанян Н.Л., Смирнов И.В., Крутецкая И.Ю., Столбовая А.Ю., Шашкова О.А., Грязева И.В., Берлина М.А., Смирнова Т.Д., Климович В.Б. 2018. Экспрессия эндоглина культивируемыми нетрансформированными и опухолевыми клетками разного гистогенеза. Цитология. Т. 60. № 6. С. 430. (Samoilovich M.P., Pinevich A.A., Vartanyan N.L., Smirnov I.V., Krutetskaya I.Yu., Stolbovaya A.Yu., Shashkova O.A., Gryazeva I.V., Berlina M.A., Smirnova T.D., Klimovich V.B. 2018. Endoglin expression in non-tumor and tumor cells of different origin. Cell Tiss. Biol. (Tsitologiya). V. 12. P. 437.)
Смирнов И.В., Грязева И.В., Самойлович М.П., Терёхина Л.А., Пиневич А.А., Крылова А.А., Крутецкая И.Ю., Никольский Н.Н., Климович В.Б. 2015. Панель моноклональных антител против эндоглина человека: получение и характеристика. Цитология. Т. 57. № 7. С. 499. (Smirnov I.V., Griazeva I.V., Samoilovich M.P., Terekhina L.A., Pinevich A.A., Krylova A.A., Krutetskaia I.Iu., Nikolsky N.N., Klimovich V.B. 2015. Production and characterization of monoclonal antibodies against human endoglin. Cell Tiss. Biol (Tsitologiya). V. 9. P. 473.)
Anderson P., Carrillo-Gálvez A.B., García-Pérez A., Cobo M., Martin F. 2013. CD105 (endoglin)-negative murine mesenchymal stromal cells define a new multipotent subpopulation with distinct differentiation and immunomodulatory capacities. PLoS One. V. 8. P. e76979. https://doi.org/10.1371/journal.pone.0076979
Baglioni S., Cantini G., Poli G., Francalanci M., Squecco R., Di Franco A., Borgogni E., Frontera S., Nesi G., Liotta F., Lucchese M., Perigli G., Francini F., Forti G., Serio M., Luconi M. 2012. Functional differences in visceral and subcutaneous fat pads originate from differences in the adipose stem cell. PLoS One. V. 7. P. e36569. https://doi.org/10.1371/journal.pone.0036569
Baglioni S., Francalanci M., Squecco R., Lombardi A., Cantini G., Angeli R., Gelmini S., Guasti D., Benvenuti S., Annunziato F., Bani D., Liotta F., Francini F., Perigli G., Serio M., Luconi M. 2009. Characterization of human adult stem-cell populations isolated from visceral and subcutaneous adipose tissue. FASEB J. V. 23. P. 3494.
Bellón T., Corbí A., Lastres P., Calés C., Cebrián M., Vera S., Cheifetz S., Massague J., Letarte M., Bernabéu C. 1993. Identification and expression of two forms of the human transforming growth factor-β-binding protein endoglin with distinct cytoplasmic regions. Eur. J. Immunol. V. 23. P. 2340.
Bernabeu C., Conley B.A., Vary C.P.H. 2007. Novel biochemical pathways of endoglin in vascular cell physiology. J. Cell. Biochem. V. 102. P. 1375.
Blanco F.J., Grande M.T., Langa C., Oujo B., Velasco S., Rodr-iges-Barbero A., Perez-Gomez E., Qintanilla M., López-Novoa J., Bernabue C. 2008. S-endoglin expression is induced in senescent endothelial cells and contributes to vascular pathology. Circ. Res. V. 103. P. 1383.
Brewer C.A., Setterdahl J.J., Li M.J., Johnston J.M., Mann J.L., McAsey M.E. 2000. Endoglin expression as a measure of microvessel density in cervical cancer. Obstet. Gynecol. V. 96. P. 224.
Catty D. 1989. Antibodies: A practical approach. Volume 2. Oxford: Oxford University Press. 259 pp.
Cheifetz S., Bellón T., Calés C., Vera S., Bernabeu C., Massagué J., Letarte M. 1992. Endoglin is a component of the transforming growth factor-beta receptor system in human endothelial cells. J. Biol. Chem. V. 267. P. 19027.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F.C., Krause D.S., Deans R.J., Keating A., Prockop D.J., Horwitz E.M. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. V. 8. P. 315.
Edgell C.J.S., McDonald C.C., Graham J.B. 1983. Permanent cell line expressing human factor VIII-related antigen established by hybridization. Proc. Natl. Acad. USA. V. 80. P. 3734.
Erdem O., Taskiran C., Onan M.A., Erdem M., Guner H., Ata-oglu O. 2006. CD105 expression is an independent predictor of survival in patients with endometrial cancer. Gynecol. Oncol. V. 103. P. 1007.
Gougos A., Letarte M. 1988. Identification of a human endothelial cell antigen with monoclonal antibody 44G4 produced against a pre-B leukemic cell line. J. Immunol. V. 141. P. 1925.
Gronthos S., Franklin D.M., Leddy H.A., Robey P.G., Storms R.W., Gimble J.M. 2001. Surface protein characterization of human adipose tissue-derived stromal cells. J. Cell. Physiol. V. 189. P. 54.
Hanna R., Ong G.L., Mattes M.J. 1996. Processing of antibodies bound to B-cell lymphomas and other hematological m-alignancies. Canc. Res. V. 56. P. 3062.
Hawinkels L.J.A.C., Kuiper P., Wiercinska E., Verspaget H.W., Liu Z., Pardali E., Sier C.F.M., ten Dijke P. 2010. Matrix metalloproteinase-14 (MT1-MMP)-mediated endoglin shedding inhibits tumor angiogenesis. Canc. Res. V. 70. P. 4141.
Jeon Y.J., Kim J., Cho J.H., Chung H.M., Chae J.I. 2016. Comparative analysis of human mesenchymal stem cells derived from bone marrow, placenta, and adipose tissue as sources of cell therapy. J. Cell. Biochem. V. 117. P. 1112.
Jiang T., Liu W., Lv X., Sun H., Zhang L., Liu Y., Zhang W.J., Cao Y., Zhou G. 2010. Potent in vitro chondrogenesis of CD105 enriched human adipose-derived stem cells. Biomaterials. V. 31. P. 3564.
Kassouf W., Ismail H.R.A., Aprikian A.G., Chevalier S. 2004. Whole-mount prostate sections reveal differential endoglin expression in stromal, epithelial, and endothelial cells with the development of prostate cancer. Prostate Canc. Prostatic Dis. V. 7. P. 105.
Katz A.J., Tholpady A., Tholpady S.S., Shang H., Ogle R.C. 2005. Cell surface and transcriptional characterization of human adipose-derived adherent stromal (hADAS) cells. Stem Cells. V. 23. P. 412.
Kyriakos R.J., Shih L.B., Ong G.L., Patel K., Goldenberg D.M., Mattes M.J. 1992. The fate of antibodies bound to the surface of tumor cells in vitro. Canc. Res. V. 52. P. 835–842.
Lebrin F., Deckers M., Bertolino P., ten Dijke P. 2005. TGF-β receptor function in the endothelium. Cardiovasc. Res. V. 65. P. 599–608.
Levi B., Wan D.C., Glotzbach J.P., Hyun J., Januszyk M., Montoro D., Sorkin M., James A.W., Nelson E.R., Li S., Quarto N., Lee M., Gurtner G.C., Longaker M.T. 2011. CD105 protein depletion enhances human adipose-derived stromal cell osteogenesis through reduction of transforming growth factor β1 (TGF-β1) signaling. J. Biol. Chem. V. 286. P. 39497.
Maleki M., Ghanbarvand F., Reza Behvarz M., Ejtemaei M., G-hadirkhomi E. 2014. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int. J. Stem Cells. V. 7. P. 118.
Mattes M.J., Griffiths G.L., Diril H., Goldenberg D.M., Ong G.L., Shih L.B. 1994. Processing of antibody-radioisotope conjugates after binding to the surface of tumor cells. Cancer. V. 73. P. 787.
Mitchell J.B., McIntosh K., Zvonic S., Garrett S., Floyd Z.E., Kloster A., Di Halvorsen Y., Storms R.W., Goh B., Kilroy G., Wu X., Gimble J.M. 2006. Immunophenotype of human ad-ipose-derived cells: temporal changes in stromal-associated and stem cell-associated markers. Stem Cells. V. 24. P. 376.
Nassiri S.M., Rahbarghazi R. 2014. Interactions of mesenchymal stem cells with endothelial cells. Stem Cells Dev. V. 23. P. 319.
Planat-Benard V., Silvestre J.-S., Cousin B., André M., Nibb-elink M., Tamarat R., Clergue M., Manneville C., Saillan-Barreau C., Duriez M., Tedgui A., Levy B., Pénicaud L., Casteilla L. 2004. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. V. 109. P. 656.
Rüster B., Göttig S., Ludwig R.J., Bistrian R., Müller S., Seifried E., Gille J., Henschler R. 2006. Mesenchymal stem cells display coordinated rolling and adhesion behavior on endothelial cells. Blood. V. 108. P. 3938.
Saleh F.A., Whyte M., Genever P.G. 2011. Effects of endothelial cells on human mesenchymal stem cell activity in a three-dimensional in vitro model. Eur. Cell. Mater. V. 22. P. 242.
Sanz-Rodriguez F., Guerrero-Esteo M., Botella L.M., Banville D., Vary C.P.H., Bernabéu C. 2004. Endoglin regulates cytoskeletal organization through binding to ZRP-1, a member of the Lim family of proteins. J. Biol. Chem. V. 279. P. 32 858.
Seon B.K., Matsuno F., Haruta Y., Kondo M., Barcos M. 1997. Long-lasting complete inhibition of human solid tumors in SCID mice by targeting endothelial cells of tumor vasculature with antihuman endoglin immunotoxin. Clin. Canc. Res. V. 3. P. 1031.
Smirnov I.V., Gryazeva I.V., Samoylovich M.P., Terekhina L.A., Pinevich A.A., Shashkova O.A., Krutetskaia I.Y., Sokolov D.I., Selkov S.A., Nikolskiy N.N., Klimovich V.B. 2016. Different pairs of monoclonal antibodies detect va-riable amounts of soluble endoglin in human blood plasma. Immunochem. Immunopathol. V. 2. P. 1–5.
Takahashi N., Haba A., Matsuno F., Seon B.K. 2001. Antiangiogenic therapy of established tumors in human skin/severe combined immunodeficiency mouse chimeras by anti-endoglin (CD105) monoclonal antibodies, and synergy between anti-endoglin antibody and cyclophosphamide. Canc. Res. V. 61. P. 7846.
Zuk P.A., Zhu M., Ashjian P., De Ugarte D.A., Huang J.I., Mi-zuno H., Alfonso Z.C., Fraser J.K., Benhaim P., Hedrick M.H. 2002. Human adipose tissue is a source of multipotent stem cells. Mol. Biol. Cell. V. 13. P. 4279.
Zuk P.A., Zhu M., Mizuno H., Huang J., Futrell J.W., Katz A.J., Benhaim P., Lorenz H.P., Hedrick M.H. 2001. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue Engin. V. 7. P. 211.
Дополнительные материалы отсутствуют.


