Цитология, 2020, T. 62, № 8, стр. 581-590
Иммунофенотипические особенности макрофагов печени и перитонеальной области животных с моделью сахарного диабета 1 типа и их коррекция аминодигидрофталазиндионом натрия in vitro
В. А. Поздина 1, *, И. Г. Данилова 1, М. Т. Абидов 2
1 Институт иммунологии и физиологии Уральского отделения РАН
Екатеринбург, Россия
2 Институт иммунологии и профилактической медицины
1000 Любляна, Словения
* E-mail: varvara.pozdina@gmail.com
Поступила в редакцию 09.04.2020
После доработки 23.04.2020
Принята к публикации 28.04.2020
Аннотация
В работе были исследованы морфологические и функциональные характеристики культуры макрофагов различной локализации, выделенных у интактных животных (ИЖ) и животных с моделью сахарного диабета 1 типа (СД1) в условиях стимуляции их веществом-модулятором макрофагов аминодигидрофталазиндионом натрия (АДФН) in vitro в условиях 24- и 72-часового культивирования. Исследование проводили на культурах макрофагов крысы, полученных из печени и перитонеальной области. Определяли следующие морфометрические показатели: площадь клетки, цитоплазмы и ядер, а также ядерно-цитоплазматическое отношение (ЯЦО). Фенотип макрофагов определяли по экспрессии маркера CD163 (макрофагов типа М2) и CD80 (макрофаги М1). Функциональную активность макрофагов оценивали по уровню цитокинов IL-1a, IL-10 и TNFα. Было установлено, что АДФН меняет морфометрические параметры (уменьшение размеров ядра и клеток, рост ЯЦО) и синтетическую активность клеток (увеличение IL-10 у макрофагов перитонеальной области; IL-1α и TNFα – у макрофагов печени) в первые 24 ч культивирования; через 72 ч действие АДФН приводит к понижению уровней IL-10, TNFα и рост уровня IL-1α во всех исследуемых популяциях клеток. АДФН не влияет на уровень экспрессии маркеров макрофагов М1 и М2.
Макрофаги образуют систему мононуклеарных фагоцитов и представляют собой фенотипически и функционально гетерогенные клеточные популяции, постоянно самообновляющиеся практически во всех органах и тканях (Davies et al., 2013). Помимо обеспечения иммунологического надзора тканевые макрофаги выполняют высокоспециализированные функции, а их фенотип определяется сигналами, которые они получают из широко изменяющегося микроокружения. В ответ на сигналы от инфицированной или поврежденной ткани циркулирующие моноциты покидают кровоток и проникают в ткани, дифференцируясь в макрофаги, где они могут функционировать, чтобы фагоцитировать клеточный дебрис, разрешать воспаление и восстанавливать тканевой гомеостаз, способствуя репарации (регенерации) тканей (Murray, Wynn, 2011). В настоящее время существует большое количество классификаций по типу активности макрофагов, которые сводятся к тому, что клетки классифицируют как классически (М1) или альтернативно (М2) активированные (Ginhoux et al., 2016). Макрофаги типа М1 демонстрируют повышенную фагоцитарную активность и секретируют провоспалительные цитокины. Макрофаги типа М2 выполняют противоположные функции, выделяя противовоспалительные цитокины, факторы ангиогенеза и фиброгенеза, стимулируют прекращение воспалительной реакции и служат заживлению раны, а также участвуют в поддержании тканевого гомеостаза.
Прогрессирующая потеря массы β-клеток поджелудочной железы, приводящая к нарушению гомеостаза глюкозы, является основным фактором, вызывающим развитие СД1 и его многочисленных осложнений. Исторически исследования роли иммунных клеток в микроокружении островков Лангерганса в основном были сосредоточены на аутоиммунном разрушении β-клеток при СД1. Однако несколько недавних исследований продемонстрировали важную роль островковых макрофагов в содействии регенерации β-клеток (George et al., 2015; Lakshmipathi et al., 2016; Xiao et al., 2016).
В патогенезе СД1 макрофаги с фенотипом М1 играют существенную роль, так как они способствуют повреждению островков и потере β-клеток, тогда как пролиферация β-клеток зависит от инфильтрации макрофагов, экспрессирующих маркеры M2, секретирующие TGFβ1 и EGF (Xiao et al., 2014). В наших предыдущих исследованиях в модели аллоксанового диабета (СД1) было показано, что использование модулятора макрофагов аминодигидрофталазиндиона натрия (АДФН) способствует пролиферации β-клеток островков Лангерганса, снижению уровня глюкозы, гликированного гемоглобина, увеличению содержания инсулина в крови (Данилова и др., 2017). Признание роли макрофагов в регенерации β-клеток дает возможность для углубления нашего понимания того, как макрофаги могут влиять на гомеостаз других органов и тканей, не являющихся мишенями при развитии сахарного диабета.
В связи с изложенным в работе была поставлена задача подробно изучить особенности функционирования различных популяций резидентных и циркулирующих макрофагов, выделенных из органов, не являющихся мишенями СД1, животных с моделью СД1. Кроме того, в условиях in vitro оценивали клеточный ответ и изменение морфофункциональных параметров макрофагов, подвергшихся стимуляции АДФН.
МАТЕРИАЛ И МЕТОДИКА
Животные. В работе использовали популяции макрофагов различной локализации – из перитонеальной области и из печени, полученные из самцов крыс Wistar в возрасте 3 мес. и весом 210 ± 5.16 г. Животных, из которых получали макрофаги, делили на две группы: интактные животные и животные с моделью СД1 (СД1). Все эксперименты на животных были одобрены Этическим комитетом Института иммунологии и физиологии УрО РАН (№-d-TM-2016-20) и выполнены в соответствие с принципами, сформулированными в Директиве 2010/63/EC.
Модель СД1. Моделирование СД1 у крыс осуществляли внутрибрюшинным введением аллоксана, разведенного в 0.85%-ном растворе хлорида натрия, в суммарной дозе 300 мг/кг массы тела животного по модифицированной авторской методике (Данилова и др., 2014). Через 30 сут после первого введения аллоксана развивался СД1. Для верификации модели через 30 сут в плазме крови крыс определяли концентрацию глюкозы (19.78 ± 4.8 ммоль/л), а в цельной крови – гликированного гемоглобина (HbA1с) (6.3 ± 0.52%).
Выделение макрофагов перитонеальной области (ПО) и макрофагов печени. Для выделения макрофагов ПО использовали описанную методику (Avijit, Bonnie, 2010) с небольшой модификацией. Животных выводили из эксперимента передозировкой диэтилового эфира. Крысу протирали 70%-ным этанолом и фиксировали на препаровальном столе брюшной полостью вверх. Далее срезали наружную кожу брюшины, вводили 5 мл охлажденной среды RPMI-1640 с помощью шприца 5 мл с иглой длиной 40 мм и диаметром 0.8 мм. Для равномерного распределения среды и воздуха делали массаж брюшины продолжительностью не менее 1 мин. При отсасывании суспензии использовали стерильный шприц 5 мл. Макрофаги печени получали путeм фрагментирования извлеченного органа с небольшим количеством раствора Хэнкса (Ten Hagen et al., 1996). Выделенную печень помещали в чашку Петри в раствор коллагеназы или трипсина на 30 мин в CO2-инкубатор. Затем печень фрагментировали с помощью ножниц в растворе Хэнкса в объеме 10 мл. Полученные суспензии клеток центрифугировали на холоде 5 мин при 1500 g.
Культивирование макрофагов. Клеточный осадок ресуспендировали в полной питательной среде и добавляли по 2 мл в 6-луночные планшеты с покровными стеклами. Для МПО использовали культуральную среду RPMI-1640, а для макрофагов печени – DМЕМ (обе среды от Биолот, Россия). В обоих случаях в среду добавляли эмбриональную телячью сыворотку FBS (Биолот, Санкт-Петербург) (10% от общего объема среды), а также гентамицин в концентрации 40 мкг/мл. Выделение макрофагов основывалось на особенностях их адгезивности (разделение на прилипающую и неприлипающую фракции) (Ogawa et al., 2019). Через 1 ч культивирования клеточной суспензии в полной питательной среде 6-луночные планшеты промывали раствором Хэнкса. Затем в очищенную культуру макрофагов добавляли свежую полную питательную среду и культивировали в течение 24 ч при 37°С в СО2-инкубаторе.
Стимуляция АДФН. Через 24 ч культивирования в полученные культуры макрофагов добавляли АДФН (натриевую соль 5-амино-2,3-дигидрофталазин-1,4-диона) в дозе 10 мкг/мл на 24 и 72 ч. В ряде работ было показано, что это соединение является биологически активным веществом, которое эффективно воздействует на функциональное состояние макрофагов и обладает выраженным противовоспалительным и антиоксидантным действием (Jukić et al., 2011, 2012; Danilova et al., 2017; Данилова и др., 2018). По истечению сроков культивирования в присутствии АДФН супернатант клеток сливали и замораживали для иммуноферментного анализа, покровные стекла в планшетах фиксировали 10%-ным раствором формалина в течение 5 мин.
Оценка экспрессии фенотипических маркеров макрофагов. Для определения фенотипа макрофагов клетки окрашивали иммуноцитохимически на поверхностные маркеры CD80 (MA5-16510) и CD163 (MA5-16658) (ThermoFisher, США). Белок CD80 – поверхностный маркер, играющий важную роль в активации иммунного ответа, является рецептором классически активированных макрофагов (типа М1) (Peach et al., 1995; Kristiansen et al., 2001). Белок CD163 является поверхностным маркером моноцитов (макрофагов) регуляторного М2-фенотипа (Schaer et al., 2006; Шарафутдинова и др., 2014). Степень экспрессии CD80+ и CD163+ макрофагов оценивали по оптической плотности. Обработку изображений производили с помощью оптического микроскопа Leica DM2500 (Leica, Германия), подключенной к ней камеры Leica DFC420 (Leica, Германия) и программного обеспечения LAS Core V4.9 (Leica, Германия).
Морфометрическая характеристика макрофагов. В качестве морфометрических показателей определяли площадь клетки, цитоплазмы и ядра, а также ядерно-цитоплазматическое отношение (ЯЦО). Визуализацию осуществляли с помощью оптического микроскопа Leica DM2500 (Leica, Германия) и подключенной к ней камеры Leica DFC420 (Leica, Германия). Для обработки изображений использовали программу LAS Core V4.9 (Leica, Германия).
Определение функциональной активности макрофагов. Для анализа функциональной активности макрофагов в супернатантах исследуемых образцов оценивали продукцию следующих цитокинов: интерлейкинов (IL) IL-1a, IL-10 и фактора некроза опухоли TNF-α. Выбор цитокинов был обусловлен особенностями их продукции у макрофагов разного фенотипа. Показано, что классически-активированные макрофаги (М1) продуцируют высокие уровни TNF-α и IL-1a, тогда как высокая продукция IL-10 характерна для фенотипа макрофагов М2 (Guillermo, Albert, 2014). Концентрацию цитокинов рассчитывали на основе уравнения, описывающего зависимость оптической плотности от концентрации цитокина в калибровочных образцах. Оптическую плотность измеряли на гибридном фотометре Lazurite Automated Elisa System (Dynex Technologies Inc., США) и с помощью наборов для иммуноферментного анализа на IL-1a, IL-10 и TNF-α крысы (BMS627, BMS629T WO и BMS622 соответственно; Bioscience, Ирландия).
Статистический анализ полученных данных осуществляли с помощью программы STATISTICA.10 и SPSS. Вычисляли среднее арифметическое, ошибку среднего и стандартное отклонение. Определяли достоверность различий между образцами клеток, принадлежащих к одной популяции (ранговый анализ Краскела−Уоллиса, медианный тест). Различия считали достоверными при Р < 0.05.
РЕЗУЛЬТАТЫ
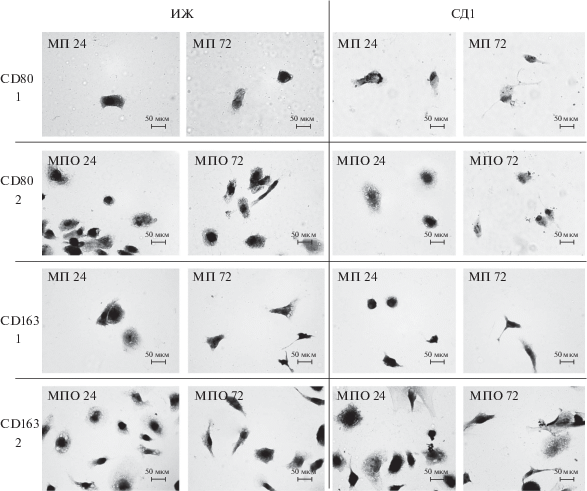
Макрофаги интактных животных. При культивировании макрофагов печени и ПО было отмечено изменение морфологии клеток за 72 ч культивирования (рис. 1, ИЖ). В период 24-часового культивирования среди макрофагов ПО встречается большое количество характерных почти круглых клеток с одним небольшим круглым ядром, смещенным от центра клетки. Макрофаги печени в большинстве своем меньшей величины, вытянутой формы с ядром, смещенным от центра. Через 72 ч культивирования в культуре макрофагов ПО клетки становятся меньше, чаще встречаются клетки неправильной формы, распластанные, с неровными краями, тогда как морфология макрофагов печени меняется в меньшей степени (рис. 1).
Рис. 1.
Иммуноцитохимическая окраска на маркерные белки CD80 и CD163 макрофагов печени (1, МП) и перитонеальной области (2, МПО). Клетки выделяли из интактных животных (ИЖ) и животных с моделью 30-суточного СД1 (СД1) и культивировали в течение 24 и 72 ч. Клетки фиксированы и подкрашены гематоксилином Эрлиха. Увел. об.: 100×.
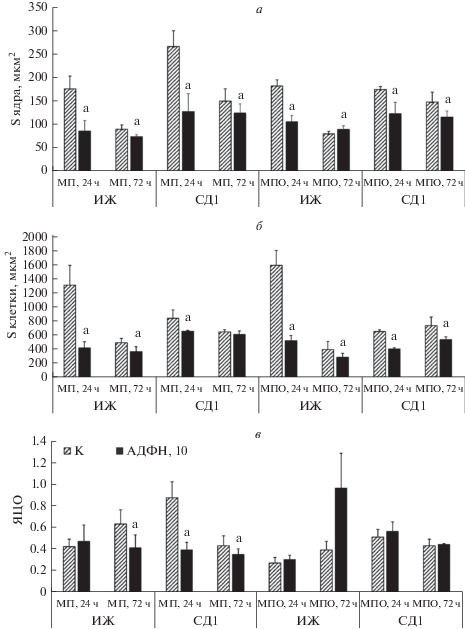
Морфометрический анализ показал, что в обеих культурах в течение 72 ч культивирования уменьшается площадь ядра и всей клетки (табл. 1). Анализ ЯЦО указывает на увеличение этого параметра у макрофагов печени (от 0.42 ± 0.07 до 0.63 ± 0.13) и МПО (от 0.27 ± 0.05 до 0.39 ± 0.08) через 72 ч (табл. 1, рис. 2в).
Таблица 1.
Сравнительная морфометрическая характеристика не стимулированных макрофагов (МФ) печени и перитонеальной области (ПО), выделенных из интактных животных (ИЖ) и животных с моделью 30-суточного СД1, культивированных в течение 24 и 72 ч.
| МФ и животные | Время, ч | Площадь ядра, мкм2 | Площадь клетки, мкм2 | ЯЦО |
|---|---|---|---|---|
| МФ печени, (ИЖ) | 24 | 176.36 ± 27.0 | 1293.35 ± 278.17 | 0.42 ± 0.07 |
| 72 | 89.72 ± 9.56a | 482.46 ± 61.14a | 0.63 ± 0.13a | |
| МФ печени, животные с СД1 |
24 | 266.33 ± 33.8a | 827.57 ± 118.26a | 0.87 ± 0.15a |
| 72 | 150.12 ± 25.85б | 637.05 ± 27.54б | 0.43 ± 0.09б | |
| МФ из ПО, (ИЖ) | 24 | 182.23 ± 12.91 | 1570.42 ± 211.44 | 0.27 ± 0.05 |
| 72 | 79.90 ± 5.58в | 389.10 ± 112.99в | 0.39 ± 0.08в | |
| МФ из ПО, животные с СД1 | 24 | 174.86 ± 5.88 | 641.43 ± 24.38в | 0.51 ± 0.07в |
| 72 | 147.72 ± 21.58г | 722.61 ± 123.22г | 0.43 ± 0.06г |
Рис. 2.
Морфометрические показатели (а–в) популяций макрофагов, выделенных из интактных животных (ИЖ) и животных с моделью 30-суточного СД1 (СД1) и культивированных в отсутствие (К, заштрихованные столбцы) и в присутствии 10 мкг/мл АДФН в течение 24 и 72 ч (черные столбцы). МП и МПО – макрофаги, выделенные из печени и перитонеальной области соответственно. а, б – Площадь (S) ядра и клетки соответственно; в – ядерно-цитоплазматическое отношение (ЯЦО); аотличия от нестимулированных макрофагов достоверны при Р ≤ 0.05.
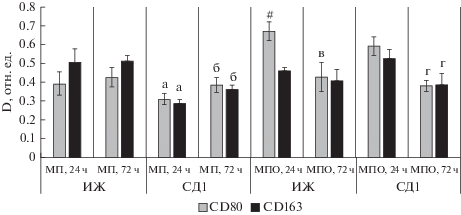
При проведении фенотипического анализа было обнаружено различие уровня экспрессии CD80 между исследуемыми популяциями клеток в период 24-часового культивирования (табл. 2, рис. 3). Макрофаги ПО экспрессируют высокий уровень CD80 в сравнении с популяцией МП. Через 72 ч культивирования клеток у макрофагов ПО уровень экспрессии CD80 понижается. У макрофагов печени маркеры CD80 и CD163 одинаково хорошо экспрессируются в течение обоих сроков культивирования клеток, но экспрессия CD163 незначительно выше, чем экспрессия CD80 (табл. 2, рис. 3).
Таблица 2.
Фенотипическая характеристика макрофагов печени и перитонеальной области, выделенных из интактных животных и животных с моделью 30-суточного СД1 и культивированных в отсутствие (контроль, К) и в присутствии 10 мкг/мл АДФН в течение 24 и 72 ч.
| МФ и животные | Время, ч | Экспрессия маркеров фенотипа М1 и М2 | |||
|---|---|---|---|---|---|
| CD80, усл. ед (М1) | CD163, усл. ед. (М2) | ||||
| К | АДФН | К | АДФН | ||
| МФ печени, ИЖ | 24 | 0.392 ± 0.062 | 0.567 ± 0.18 | 0.507 ± 0.073 | 0.367 ± 0.045 |
| 72 | 0.427 ± 0.051 | 0.392 ± 0.072 | 0.511 ± 0.039 | 0.415 ± 0.021 | |
| МФ печени, СД1 | 24 | 0.309 ± 0.033а | 0.401 ± 0.11 | 0.287 ± 0.023а | 0.320 ± 0.052 |
| 72 | 0.385 ± 0.046б | 0.597 ± 0.2 | 0.364 ± 0.028б | 0.424 ± 0.14 | |
| МФ из ПО, ИЖ | 24 | 0.671 ± 0.054д | 0.523 ± 0.14 | 0.459 ± 0.022 | 0.361 ± 0.082 |
| 72 | 0.428 ± 0.084в | 0.560 ± 0.091 | 0.410 ± 0.061 | 0.347 ± 0.053 | |
| МФ из ПО, СД1 | 24 | 0.592 ± 0.052 | 0.510 ± 0.051 | 0.525 ± 0.053 | 0.471 ± 0.048 |
| 72 | 0.383 ± 0.041г | 0.321 ± 0.022 | 0.389 ± 0.064г | 0.386 ± 0.027 | |
Сокращения те же, что в табл. 1. Отличия достоверны при Р ≤ 0.05: а от МФ печени из ИЖ, 24 ч (К); б от МФ печени, СД1, 24ч (К); в от МФ из ПО, ИЖ, 24 ч (К); г от МФ из ПО, СД1, 24 ч (К); д от CD80 МФ печени, ИЖ, 24 ч (К).
Рис. 3.
Экспрессия маркеров фенотипа М1 (CD80, светлые столбцы) и М2 (CD163, черные столбцы) популяций макрофагов, выделенных из интактных животных (ИЖ) и животных с моделью 30-суточного СД1 (СД1) и культивированных в течение 24 и 72 ч. МП и МПО – макрофаги из печени и перитонеальной области соответственно; отличия от нестимулированных макрофагов достоверны при Р ≤ 0.05: # от CD80 МП, 24 ч, ИЖ; а от МП, 24 ч, ИЖ; б от МП, 72 ч, ИЖ; в от МПО, 24 ч, ИЖ; г от МПО, 24 ч, СД1.
Анализ секреторной активности не выявил отличий продукции провоспалительных цитокинов (IL-1α и TNF-α) и противовоспалительных (IL-10) между исследуемыми культурами клеток за 24 ч культивирования (табл. 3).
Таблица 3.
Секреторная характеристика макрофагов печени и перитонеальной области, выделенных из интактных животных и животных с моделью 30-суточного СД1 и культивированных в отсутствие (контроль, К) и в присутствии 10 мкг/мл АДФН в течение 24 и 72 ч.
| МФ и животные | Время, ч | Синтез цитокинов | |||||
|---|---|---|---|---|---|---|---|
| IL-1α, пкг/мл | IL-10, пкг/мл | TNF-α, пкг/мл | |||||
| К | АДФН | К | АДФН | К | АДФН | ||
| МФ печени, ИЖ | 24 | 616.67 ± 41.66 | 760.00 ± 46.67а | 139.42 ± 51.56 | 205.25 ± 32.47 | 230.91 ± 43.16 | 1003.42 ± 153.34а |
| МФ печени, СД1 | 24 | 750.00 ± 40.96а | 539.44 ± 34.23б | 58.58 ± 4.41а | 116.08 ± 39.06 | 1535.92 ± 64.72а | 475.08 ± 51.24б |
| 72 | 525.00 ± 48.31б | 711.67 ± 43.47в | 116.92 ± 7.41б | 62.75 ± 1.44в | 101.75 ± 21.84а, б | 5.92 ± 3.41в | |
| МФ из ПО, ИЖ | 24 | 563.33 ± 47.18 | 604.44 ± 52.40 | 94.42 ± 18.05 | 202.75 ± 46.70a | 472.58 ± 248.43 | 310.92 ± 26.47 |
| МФ из ПО, СД1 | 24 | 645.56 ± 52.48 | 782.78 ± 43.91а | 177.45 ± 48.37 | 199.42 ± 68.83 | 936.75 ± 223.14а | 2225.92 ± 383.43б |
| 72 | 336.67 ± 62.07а, б | 586.11 ± 36.11в | 281.08 ± 74.80 а | 179.42 ± 34.87 | 571.75 ± 97.13б | 198.42 ± 51.85в | |
Сокращения те же, что в табл. 1. Отличия достоверны при Р ≤ 0.05: а от К, 24 ч, ИЖ; б от К, 24 ч, СД1; в от К, 72 ч, СД1.
Полученные данные позволяют предположить, что исследуемые группы макрофагов обладают разными морфологическими и морфометрическими характеристиками. Анализ экспрессии фенотипических маркеров указывает на преобладание среди макрофагов ПО типа М1, тогда как среди макрофагов печени невозможно выделить преобладающую по фенотипу группу клеток. Полученные данные хорошо согласуются с представлениями взаимосвязи фенотипа макрофагов и органа, откуда были выделены макрофаги, и его выполняемыми функциями (Elchaninov et al., 2019).
Макрофаги животных с моделью 30-суточного СД1. Популяции макрофагов печени ПО, выделенных из животных с моделью СД1, не отличаются по морфологии от аналогичных клеток, выделенных из интактных животных (рис. 1, СД1). Различаются только размеры ядра, клетки и ЯЦО.
В течение 24-часового культивирования площадь ядер макрофагов печени, выделенных из животных с СД1, заметно больше (266.33 ± 33.85 мкм2), чем этот показатель, измеренный у макрофагов, выделенных из интактных животных (176.36 ± 27.0 мкм2) (табл. 1, рис. 2а). У макрофагов ПО, выделенных из животных с моделью СД1, в течение 24-часового культивирования площадь ядра практически не изменяется относительно клеток, выделенных из интактных животных. Этот показатель обеих популяций клеток, выделенных из животных с СД1, за 72 ч культивирования значимо уменьшается в сравнении со значениями, определенными через 24 ч культивирования (табл. 1, рис. 2а). Площадь клетки у всех популяций макрофагов, выделенных из животных с моделью СД1, на всех сроках культивирования меньше, чем у клеток, выделенных из интактных животных (табл. 1, рис. 2б).
У макрофагов печени, выделенных из животных с СД1, в течение 24 ч культивирования показатель ЯЦО выше и составляет 0.87 ± 0.15 относительно 0.42 ± 0.07 клеток, выделенных из интактных животных. Величина ЯЦО у МПО, выделенных из животных с СД1, через 24 ч культивирования также выше (0.51 ± 0.07) относительно этого значения у клеток, выделенных из интактных животных (0.27 ± 0.05). Через 72 ч культивирования в обеих исследуемых популяциях клеток, выделенных из животных СД1, показатель ЯЦО уменьшается, а не увеличивается, как наблюдалось ранее у всех групп макрофагов, выделенных из интактных животных (табл. 1, рис. 2в).
У макрофагов печени, выделенных из животных с СД1, показатели экспрессии CD80 и CD163 на обоих сроках культивирования значительно ниже в сравнении с экспрессией клеток из интактных животных (табл. 2). Через 72 ч культивирования у макрофагов из животных с СД1 экспрессия CD163 повышается относительно этого показателя через 24 ч. У макрофагов ПО, выделенных из животных с СД1, экспрессия CD80 и CD163 через 24 ч культивирования незначительно ниже показателей экспрессии макрофагов из интактных животных. Через 72 ч культивирования у макрофагов ПО экспрессия маркеров снижается (табл. 2, рис. 3).
В супернатантах исследуемых популяций макрофагов, выделенных из животных с СД1, через 24 ч культивирования уровни IL-10, IL-1a и TNF-α оказались повышенными в сравнении с супернатантами клеток, выделенных из интактных животных (табл. 3). У макрофагов печени из животных с СД1 через 72 ч культивирования наблюдается увеличение уровня IL-10 и уменьшение уровней IL-1a и TNF-α. У макрофагов ПО из животных с СД1 через 72 ч культивирования отмечается понижение уровней IL-1a и TNF-α, уровень IL-10 не менялся (табл. 3).
Подводя итог, можно отметить, что популяции макрофагов, выделенных из животных с моделью СД1, существенно отличаются от популяций макрофагов, выделенных из интактных животных, на сроке культивирования 24 ч. Во-первых, есть отличия по размеру ядер, в особенности у макрофагов ПО. Во-вторых, исследуемые популяции макрофагов продемонстрировали повышенную функциональную активность. Об этом свидетельствуют данные как морфометрического анализа (увеличенные площадь ядра и ЯЦО), так и иммуноферментного анализа (повышенные уровни IL-10 и TNFα). В-третьих, различается экспрессия фенотипических маркеров между исследуемыми популяциями клеток. В течение обоих сроков культивирования у макрофагов печени, выделенных из животных с СД1, экспрессия CD80 и CD163 ниже, чем у клеток, выделенных из интактных животных, хотя в период 24–72 ч культивирования она увеличивается, но остается ниже значений клеток интактных животных. У макрофагов ПО, выделенных из животных с СД1, характер изменений с увеличением срока культивирования не меняется в сравнении с клетками из интактных животных, выраженной разницы между уровнями экспрессии CD80 и CD163 нет.
Макрофаги интактных животных, стимулированные in vitro АДФН в дозе 10 мкг/мл. Морфометрический анализ стимулированных АДФН макрофагов позволил выявить следующие закономерности: АДФН действует на все исследуемые популяции макрофагов; наиболее выраженные изменения происходят в течение 24-часового культивирования в присутствии 10 мкг/мл АДФН. За это время площадь ядра исследуемых популяций макрофагов значимо уменьшается относительно не стимулированных (рис. 2а). Площади макрофагов печени и ПО относительно не стимулированных клеток также уменьшаются в течение обоих сроков культивирования в присутствии АДФН (рис. 2б).
В течение 24 ч культивирования с АДФН в обеих исследуемых популяциях клеток наблюдается незначительное повышение ЯЦО относительно не стимулированных клеток. Через 72 ч культивирования с АДФН параметр ЯЦО у макрофагов печени уменьшается, а у макрофагов ПО увеличивается относительно не стимулированных клеток (рис. 2в).
Фенотипический анализ показал, что АДФН в дозе 10 мкг/мл не проявляет своего действия на исследуемые культуры макрофагов. В обоих популяциях клеток уровень экспрессии их маркеров не меняется относительно значений контроля (табл. 2).
Анализ секреторной активности показал, что при 24-часовом культивировании в присутствии 10 мкг/мл АДФН у макрофагов ПО происходит увеличение синтеза IL-10, а у макрофагов печени – увеличение синтеза IL-1α и TNFα относительно не стимулированных клеток (табл. 3).
Культивирование макрофагов, выделенных из интактных животных, в присутствии 10 мкг/мл АДФН приводит к увеличению синтетической активности клеток в течение 24 ч.
Макрофаги животных с моделью СД1, стимулированные in vitro 10 мкг/мл АДФН. Анализ макрофагов, выделенных из животных с СД1 и стимулированных АДФН показал, что наиболее выраженные морфометрические изменения клеток происходили на сроке культивирования в 24 ч. В обеих популяциях макрофагов уменьшаются площади ядер, клеток и ЯЦО, что также говорит об уменьшении синтетической активности клеток (рис. 2а–в).
Фенотипический анализ показал, что АДФН в дозе 10 мкг/мл также не влияет на исследуемые культуры макрофагов (табл. 2).
Анализ уровня цитокинов через 24 ч культивирования в присутствии 10 мкг/мл АДФН указывает на незначительное повышение уровня IL-10 практически во всех популяциях клеток. У макрофагов печени при 24-часовом культивировании с АДФН происходит падение уровней IL-1α и TNFα; при 72-часовом культивировании в присутствии АДФН у них понижаются уровни IL-10, TNFα и возрастает уровень IL-1α. У макрофагов ПО при культивировании с АДФН увеличиваются уровни IL-1α и TNFα через 24 ч, а через 72 ч понижаются уровни IL-10, TNFα и возрастает уровень IL-1α (табл. 3).
ОБСУЖДЕНИЕ
СД 1 является тяжелым прогрессирующим заболеванием, связанным с повышенным апоптозом и гибелью β-клеток островков поджелудочной железы, что приводит к развитию дефицита инсулина, перманентной гипергликемии и некоторых хронических осложнений. Предполагается, что макрофаги поджелудочной железы, возможно фенотипа M1, участвуют в секреции активных форм кислорода, провоспалительных цитокинов и цитотоксических факторов (Gusdon et al., 2006).
Воздействие на макрофаги, вызванное их стимуляцией АДФН, было недавно оценено для стимулирования пролиферации β-клеток. Установлено, что АДФН, воздействуя на макрофаги, прерывает патологический иммунный ответ, продуцируя противовоспалительные цитокины (Danilova et al., 2017).
Последние данные свидетельствуют о том, что макрофаги М2 могут предотвращать возникновение воспалительного ответа при СД1; такая защита, вероятно, опосредована секретируемыми пептидами с пролиферативным противовоспалительным действием (Espinoza-Jiménez et al., 2012). Поскольку макрофаги организма образуют систему мононуклеарных фагоцитов, то логично предположить, что активность макрофагов провоспалительного фенотипа выходит за пределы поджелудочной железы, и активация макрофагов в сторону М1-фенотипа происходит в частности во всех органах и полостях организма при CД1 (Espinoza-Jiménez et al., 2012).
В органах, не мишенях СД1, таких, как в печень, активность макрофагов М1 способствует повреждению и фиброзу печени, который зачастую ускоряет терминальный исход течения болезни (Bilzer et al., 2006; Novo et al., 2006). В частности, в предыдущих исследованиях, связанных с токсическим повреждением печени, было показано, что АДФН способствует ускорению регенераторного процесса (Danilova et al., 2020).
Как установлено в наших экспериментах, макрофаги печени и макрофаги ПО, выделенные из интактных животных, имеют разные морфологические и морфометрические характеристики. В условиях краткосрочного культивирования (24 ч) в популяции макрофагов ПО обнаруживается преобладание макрофагов типа М1, тогда как у макрофагов печени невозможно выделить преобладающую по фенотипу группу клеток. Это связано прежде всего с тем, что макрофаги печени и перитониальной области различны по своему происхождению, что определяет их функциональную активность и фенотип в норме и при различных патологических состояниях (Italiani, Boraschi, 2014; Varol et al., 2015).
В этом исследовании показано, что макрофаги интактных животных, в зависимости от источника их происхождения, имеют неодинаковую чувствительность к активирующим индукторам, а именно к АДФН. Так при совместном культивировании макрофагов ПО с АДФН 10 мкг/мл происходит увеличение синтеза IL-10 относительно не стимулированных клеток. У макрофагов печени на этом сроке культивирования с исследуемой дозой АДФН происходит увеличение синтеза IL-1α и TNFα. В обоих случаях АДФН приводит к увеличению синтетической активности клеток в период 24-часового культивирования.
Было установлено, что популяции макрофагов, выделенных из животных с моделью СД1 по сравнению с макрофагами из интактных животных, синтетически более активны в течение 24 ч культивирования: растет размер ядра и ЯЦО, повышается экспрессия цитокинов IL-10 и TNFα. В наших экспериментах клетки (как макрофаги ПО, так и печени), выделенные из животных с СД1, показали снижение поверхностной экспрессии рецепторов CD80 и CD163, которые определяют характер поляризации макрофагов.
Исследование показало непосредственное влияние АДФН на секреторную активность макрофагов не только интактных животных, но в большей степени на макрофаги, полученные из животных с СД1, поскольку клетки этой группы животных вследствии прогрессирования патологического процесса, априори являются более секреторно-активными. Воздействие АДФН, как и в наших предыдущих исследованиях на различных моделях in vivo, корректирует количество медиаторов воспаления, таких как TNFα, IL-1α до уровней, измеренных у интактных животных (Danilova et al., 2017; Danilova et al., 2020). Воздействие АДФН на макрофаги из животных с СД1 через 24 ч культивирования также приводило к изменению морфометрических параметров (уменьшению размеров ядра и клетки, росту ЯЦО) и синтетической активности клеток (повышению уровня IL-10 практически во всех популяциях клеток). Через 72 ч культивирования уровни IL-10, TNFα понижались, уровень IL-1α возрастал во всех исследуемых популяциях клеток.
Не смотря на выраженное корректирующее действие АДФН на синтез цитокинов, фенотип макрофагов по экспрессии маркеров не подвергся каким-либо изменениям. Наша первая исследовательская гипотеза, о том, что АДФН влияет на экспрессию маркеров фенотипа и меняет ее с М1 (CD80high CD163low) на М2 (CD80low CD163high) не нашла подтверждения. Скорее всего это связано с тем, что в настоящее время в научном сообществе накапливаются все более убедительные доказательства того, что между провоспалительным М1-состоянием (когда имеется и экспрессия маркерных молекул М1 и провоспалительных цитокинов) и М2-состояниям (с экспрессией маркерных молекул и противовоспалительных цитокинов) макрофагов существует множество разных состояний (Kole et al., 2012; Bain et al., 2013). Считается, что при исследовании макрофагов в культуре происходит формирование различных фенотипов макрофагов, при этом получение чистых популяций макрофагов M1 и M2 невозможно, поскольку клетки неизбежно взаимодействуют с ксеногенными белками культуральной среды и полимерным материалом носителя (Perdiguero, Geissmann, 2016).
Проведенное исследование показало и подтвердило морфологическую, морфометрическую, фенотипическую и синтетическую разнородность макрофагов печени и ПО, которая зависит от состояния организма, органа выделения клеток и выполняемой этим органом функции. Нами продемонстрирован ответ клеток на воздействие вещества-модулятора макрофагов АДФН в дозе 10 мкг/мл в условиях культивирования клеток. Также важно отметить, что краткосрочное культивирование клеток (24 ч) наиболее точно отражает цитокиновый профиль клеток и это наблюдение должно учитываться при постановке экспериментов по репрограммированию фенотипа и цитокинового профиля макрофагов.
Список литературы
Данилова И.Г., Гетте И.Ф., Булавинцева Т.С. 2014. Способ моделирования аллоксанового диабета. Патент РФ № 2 534 411. Бюл. № 33. (Danilova I.G., Gette I.F., Bulavintseva T.S. 2014. Method for simulating alloxan diabetes.Russian Patent № 2534411. Bull. № 33.)
Данилова И.Г., Емельянов В.В., Гетте И.Ф., Медведева С.Ю., Булавинцева Т.С., Черешнева М.В., Сидорова Л.П., Черешнев В.А. Соколова К.В. 2018. Цитокиновая регуляция регенераторных процессов в поджелудочной железе при аллоксановом сахарном диабете у крыс и его коррекции соединением ряда 1,3,4-тиадиазина и липоевой кислотой. Мед. иммунол. Т. 20. № 1. С. 35. (Danilova I.G., Emelianov V.V., Gette I.F., Medvedeva S.Yu., Bulavintseva T.S., Chereshneva M.V., Sidorova L.P., Chereshnev V.A., Sokolova K.V. 2018. Cytokine regulation of regenerative processes in pancreatic gland in alloxan-induced diabetic rats, and it correction by 1,3,4-thiadiazine composition and lipoic acid. Med. Immunol. (Russia). V. 20. № 1. P. 35.)
Шарафутдинова Л.А., Горшкова Е.Н., Садртдинова И.И., Хисматуллина З.Р., Башкатов С.А. 2014. Оценка морфологических параметров нейтрофильных гранулоцитов методом атомно-силовой микроскопии после воздействия фуллерена С60. Биомед. № 3. С. 49–53. (Sharafutdinova E.N., Gorshkova I.I., Sadrtinova Z.R., Khismadulina SA. 2014. Evaluation of the morphological parameters of neutrophilic granulocytes by atomic force microscopy after exposure to fullerene C60. Biomed. V. 3. P. 49–53.)
Avijit R., Bonnie N.D. 2010. Isolation of mouse peritoneal cavity cells. J. Visualized Exper. V. 35. P. 1488.
Bain C.C., Scott C.L., Uronen-Hansson H., Gudjonsson S., Jansson O., Grip O., Guilliams M., Malissen B., AgaceW.W., Mowat A.M. 2013. Resident and pro-inflammatory macrophages in the colon represent alternative context-dependent fates of the same Ly6Chi monocyte precursors. Mucosal Immunol. V. 6. P. 498.
Bilzer M., Roggel F., Gerbes A.L. 2006. Role of Kupfer cells in host defense and liver disease. Liver Int. V. 26. P. 1175.
Danilova I.G., Bulavintceva T.S., Gette I.F., Medvedeva S.Y. 2017. Partial recovery from alloxan-induced diabetes by sodium phthalhydrazide in rats. Biomed. Pharmacother. V. 95. https://doi.org/10.1016/j.biopha.2017.07.117
Danilova I.G., Shafigullina Z.A., Gette I.F., Sencov V.G., Medvedeva S.Y., Abidov M.T. 2020. Accelerated liver recovery after acute CCl4 poisoning in rats treated with sodium phthalhydrazide. Int. Immunopharmacol. V. 80. https://doi.org/10.1016/j.intimp.2019.106124
Davies L.C., Jenkins S.J., Allen J.E., Taylor P.R. 2013. Tissue-resident macrophages. Nature Immunol. V. 14. P. 986.
Elchaninov A.V., Fatkhudinov T.K., Vishnyakova P.A., Lokhonina A.V., Sukhikh G.T. 2019. Phenotypical and functional polymorphism of liver resident macrophages. Cells. V. 8. P. 1.
Espinoza-Jiménez A., Peón A.N., Terrazas L.I. 2012. Alternatively activated macrophages in types 1 and 2 diabetes. Mediators Inflamm. V. 2012. https://doi.org/10.1155/2012/815953
George N.M., Boerner B.P., Mir S.U.R., Guinn Z., Sarvetnick N.E. 2015. Exploiting expression of hippo effector, Yap, for expansion of functional islet mass. Mol. Endocrinol. V. 29. P. 1594.
Ginhoux F., Schultze J.L., Murray P.J., Ochando J., Biswas S.K. 2016. New insights into the multidimensional concept of macrophage ontogeny, activation and function. Nature Immunol. V. 17. P. 34.
Guillermo A.D., Albert D. 2014. Macrophage cytokines: involvement in immunity and infectious diseases. Front. Immunol. V. 5. P.1.
Gusdon A.M., Corbett J.A., Mathews C.E. 2006. Type 1 diabetes: Islet inflammation – the contribution of cytokines and beta-cells. Drug Discov. Today: Dis Mech. V. 3. P. 367.
Jukić T., Abidov M., Ihan A. 2011. A tetrahydrophthalazine derivative 'sodium nucleinate" exerts a potent suppressive effect upon LPS-stimulated mononuclear cells in vitro and in vivo. Collegium Antropol. V. 35. P. 1219.
Jukić T., Ihan A., Jukić D. 2012. Tetrahydrophthalazine derivative “sodium nucleinate” exert its anti-inflammatory effects through inhibition of oxidative burst in human monocytes. Collegium Antropol. V. 36. P. 409.
Italiani P., Boraschi D. 2014. From monocytes to M1/M2 macrophages: phenotypical vs. functional differentiation. Front. Immunol. V. 5. P. 1.
Kole A., Kelsall B.L., Valatas V., He J., Rivollier A. 2012. Inflammation switches the di erentiation program of Ly6C hi monocytes from antiinflammatory macrophages to inflammatory dendritic cells in the colon. J. Exp. Med. V. 209. P. 139–155.
Kristiansen M., Graversen J.H., Jacobsen C., Sonne O., Hoffman H.J., Law S.K., Moestrup S.K. 2001. Identification of the haemoglobin scavenger receptor. Nature. V. 409. P. 198.
Lakshmipathi J., Alvarez-Perez J.C., Rosselot C., Casinelli G.P., Stamateris R.E., Rausell-Palamos F. 2016. PKC-ζ is essential for pancreatic beta cell replication during insulin resistance by regulating mTOR and cyclin-D2. Diabetes. V. 65. P. 1283.
Murray P. J., Wynn T. A. 2011. Protective and pathogenic functions of macrophage subsets. Nature Rev. Immunol. V. 11. P. 723.
Novo E., Marra F., Zamara E., Valfrè Di Bonzo L., Caligiuri A., Cannito S., Antonaci C., Colombatto S., Pinzani M., Parola M. 2006. Dose dependent and divergent effects of superoxide anion on cell death, proliferation, and migration of activated human hepatic stellate cells. Gut. V. 55. P. 90.
Ogawa K., Tsurutani M., Hashimoto A., Soeda M. 2019. Simple propagation method for resident macrophages by co-culture and subculture, and their isolation from various organs. BMC Immunol. V. 20. P. 34. https://doi.org/10.1186/s12865-019-0314-z
Peach R.J., Bajorath J., Naemura J., Leytze G., Greene J., Aruffo A., Linsley P.S. 1995. Both extracellular immunoglobin-like domains of CD80 contain residues critical for binding T cell surface receptors CTLA-4 and CD28. J. Biol. Chem. V. 270. P. 21181.
Perdiguero E.G., Geissmann F. 2016. The development and maintenance of resident macrophages. Nat. Immunol. V. 17. P. 2.
Schaer D.J., Schaer C.A., Buehler P.W., Boykins R.A., Schoedon G., Alayash A.I., Schaffner A. 2006. CD163 is the macrophage scavenger receptor for native and chemically modified hemoglobins in the absence of haptoglobin. Blood. V. 107. P. 373.
Ten Hagen, Timo L.M., Wim Van Vianen, and Irma A.J.M. Bakker-Woudenberg. 1996. Isolation and characterization of murine Kupffer cells and splenic macrophages. J. Immunol. V. 193. P. 81.
Varol C., Mildner A., Jung S. 2015. Macrophages: Development and tissue specialization. Annu. Rev. Immunol. V. 33. P. 643.
Xiao X., Fischbach S., Song Z., Gaffar I., Zimmerman R., Wiersch J. 2016. Transient suppression of transforming growth factor beta receptor signaling facilitates human islet transplantation. Endocrinol. V. 157. P. 1348.
Xiao X., Gaffar I., Guo P. 2014. M2 macrophages promote beta-cell proliferation by up-regulation of SMAD7. Proc. Natl. Acad. Sci. USA. V. 111. P. E1211. https://doi.org/10.1073/pnas.1321347111
Дополнительные материалы отсутствуют.


