Цитология, 2020, T. 62, № 9, стр. 623-637
Получение и характеристика линий мезенхимных стволовых клеток, выделенных из разных областей плаценты одного донора
А. М. Кольцова 1, *, В. В. Зенин 1, М. А. Петросян 2, 3, В. И. Турилова 1, Т. К. Яковлева 1, Г. Г. Полянская 1, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 Научно-исследовательский институт акушерства, гинекологии и репродуктологии им. Д.О. Отта
199034 Санкт-Петербург, Россия
3 Национальный медицинский исследовательский центр им. В.А. Алмазова
194156 Санкт-Петербург, Россия
* E-mail: koltsova.am@mail.ru
** E-mail: poljansk@incras.ru
Поступила в редакцию 18.05.2020
После доработки 18.05.2020
Принята к публикации 25.05.2020
Аннотация
Получены и охарактеризованы две новые неиммортализованные клеточные линии, выделенные из разных мест плаценты одного донора: из области, расположенной рядом с пупочным канатиком, и из области, удаленной от него, названные MSC-PL-1 и MSC-PL-2 соответственно. Анализ разных характеристик проводили на раннем (6-ом) и поздних пассажах. В процессе длительного культивирования выявлены существенные межлинейные различия по характеру репликативного старения и по ростовым характеристикам, которые включают эффективность клонирования и пролиферативную активность. Кариотипический анализ показал, что на раннем пассаже обе линии имеют нормальный диплоидный кариотип с незначительным количеством неклональных хромосомных перестроек. На позднем 15-ом пассаже клетки линии MSC-PL-2 также сохраняют нормальный кариотип. При длительном культивировании линии MSC-PL-1 до пассажа 14 обнаружены, помимо неклональных, клональные перестройки, что свидетельствует об аномальном кариотипе этой линии на позднем пассаже. Повторный кариотипический анализ позволил сделать вывод, что одна клональная перестройка - Х, add(X)(p22.3) - является характерной чертой линии MSC-PL-1 при репликативном старении, но ее частота может варьировать при культивировании разных клеточных популяций одной линии. Для обеих линий подтвержден статус МСК. На раннем и поздних пассажах показана высокая доля клеток, несущих поверхностные антигены, характерные для МСК человека: CD44, CD73, CD90, CD105, виментин и HLA-ABC. Выявлена крайне низкая частота клеток с антигенами CD34, CD45 и HLA-DR. Показано, что клетки полученных линий на раннем пассаже обладают способностью дифференцироваться в остеогенном, хондрогенном и адипогенном направлениях. В процессе репликативного старения дифференцировочный потенциал линий существенно снижается. В частности, в клетках линии MSC-Pl-1 исчезает адипогенная дифференцировка, а в линии MSC-Pl-2 - существенно снижается. Наблюдается корреляция между уровнем адипогенной дифференцировки и транскрипционной активности гена glut4, исследованной с помощью ОТ-ПЦР-анализа. ОТ-ПЦР-анализ экспрессии гена nse показал низкую потенцию клеток обеих линий к нейрональной дифференцировке. Эти данные являются косвенным подтверждением важности онтогенетического происхождения линий МСК. Полученные данные позволяют предполагать, что основная причина межлинейных различий состоит в физиологических особенностях той области органа, из которой были получены клетки.
Актуальной задачей клеточной биологии является выделение и сравнительная характеристика мезенхимных стволовых клеток (МСК) человека, выделенных из разных источников. Согласно требованиям Международного общества клеточной терапии, статус МСК разного происхождения определяется рядом общих характеристик. К таким характеристикам относятся: адгезивность к культуральному пластику, активная пролиферация, экспрессия поверхностных маркеров CD105, CD90, CD73, CD44, HLA ABC и отсутствие экспрессии CD34, CD45 и HLA DR, способность к дифференцировке в остеогенном, хондрогенном и адипогенном направлениях (Dominici, 2006; Sensebé et al., 2010).
Сравнительное изучение характеристик МСК человека, являющихся определяющими в поддержании статуса МСК, а также других характеристик, ответственных за важнейшие клеточные процессы, необходимо как для понимания механизмов биологических процессов в клетке, так и для расширения возможностей использования МСК для регенеративной медицины. Важность этих исследований связана с особенностями взаимодействия клеток с их уникальным микроокружением, характерным для конкретной ткани, которое регулирует пролиферацию, выживаемость, миграцию, старение, дифференцировочный потенциал и другие клеточные свойства посредством межклеточных взаимодействий и различных биоактивных молекул (Cox et al., 1972; Hooper, Subak-Sharpe; 1981; Шаровская и др., 2009; Gattazo et al, 2014; Choi et al., 2015; Darnell et al., 2018; Niedernhofer et al., 2018; Нимирицкий и др., 2018).
Микроокружение (или ниша) постоянно находится под влиянием генетических, эпигенетических и внешних факторов. Таким образом, происхождение или источник получения МСК могут определять их функциональные характеристики. Надо подчеркнуть, что в Коллекции культур клеток позвоночных Института цитологии РАН (Санкт-Петербург) получено 14 линий МСК человека разного происхождения. Сравнительный анализ полученных линий свидетельствует, что все они имеют статус МСК. Но между ними обнаружены количественные различия по ростовым характеристикам, по характеру репликативного старения, по дифференцировочному потенциалу и по цитогенетической нестабильности.
Данные других исследований также подтверждают наличие различий в характеристиках МСК из разных источников. Причинами наблюдаемых различий могут быть: 1) эпигенетические факторы, связанные с условиями культивирования или с микроокружением; 2) генетические факторы, связанные, с генетическими различиями между донорами или с генетической предрасположенностью линий МСК, полученных из разных источников, к цитогенетической нестабильности (Полянская, 2018; Полянская, Мусорина, 2018; Brown et al., 2019; Khasawneh et al., 2019; Кольцова и др. 2019; Мусорина и др., 2019; Yang et al., 2019; Abedian et al., 2020).
Многие МСК, полученные из взрослых и эмбриональных тканей, имеют ограниченное применение из-за инвазивного способа их получения, малого количества полученных клеток в связи с невысоким пролиферативным потенциалом или этических проблем (Bongso, Fong, 2013). В связи с этим большое внимание уделяется выделению МСК из внезародышевых органов, которые формируются в первые недели беременности, а получение МСК из этих органов не связано с перечисленными ограничениями. К внезародышевому органу относится, в частности, плацента.
Настоящая работа посвящена получению и анализу МСК из плаценты человека. Известно, что условия выделения клеток при получении новой линии и условия последующего культивирования существенно влияют на клеточные характеристики (Полянская и др., 2019). Кроме того, плацента человека имеет сложный клеточный состав. Поэтому возможны значительные вариации между клеточными линиями, полученными из плаценты. В связи с этим при получении конкретной линии необходимо четко определить область происхождения и метод выделения клеток из этой ткани (Parolini et al., 2008). Учитывая возможное влияние конкретной ниши на характеристики МСК, в данной работе были получены 2 культуры клеток из 2-х областей плаценты: из области, расположенной рядом с пупочным канатиком, и из области, удаленной от него.
В работе поставлены следующие задачи: 1) выделить из 2-х областей плаценты фибробластоподобные клетки; 2) подтвердить статус МСК для обеих полученных линий на раннем пассаже (6); 3) провести сравнительный количественный анализ активности фермента β-галактозидазы, характеризующей процесс репликативного старения при длительном культивировании клеток; 4) охарактеризовать МСК при длительном культивировании по следующим основным показателям: ростовым, цитогенетическим, маркерам недифференцированных эмбриональных стволовых клеток (ЭСК) и поверхностным маркерам, дифференцировочному потенциалу и экспрессии генов (по ОТ-ПЦР-анализу), ответственных, в частности, за адипогенную и нейрональную дифференцировки.
МАТЕРИАЛ И МЕТОДИКА
Выделение клеток. Использовали плаценту здорового донора, полученную в ходе естественных родов. Были взяты два фрагмента ткани плаценты: из области расположенной в непосредственной близости к пупочному канатику и краевой, удаленной от него. Оба фрагмента содержали ткани из хориона и амниотической мембраны. Выделение клеток проводили с помощью ферментативной обработки. Ткань измельчали при помощи одноразового стерильного скальпеля до фрагментов не более 1-2 мм3 и обрабатывали смесью 0.1%-ного раствора коллагеназы 1 и коллагеназы 4 (1 : 1) в течение 30 мин при 37°С при легком покачивании. Для удаления эритроцитов выделенные из ткани клетки обрабатывали ACK Lysing Buffer (Gibco, США). Оставшиеся клетки культивировали в ростовой среде DMEM/F12 (Биолот, Россия), содержащей 10% эмбриональной бычьей сыворотки (HyClone, США) и раствор антибиотиков и антимикотика (Antibiotic Antimycotic Solution, Sigma, Израиль) в концентрации, рекомендованной производителем, при 37°С и 5% СО2 в течение 2 нед. Пересев клеток осуществляли посредством обработки 0.25%-ным раствором трипсин-ЭДТА (Gibco, Великобритания).
На 4-м пассаже при отсутствии явных признаков контаминации бактериями и грибами в ростовую среду переставали добавлять раствор антибиотиков и антимикотика. Клетки длительно культивировали и получали разные характеристики на 6-, 13-, 14-, 15- и 16-м пассажах. Криоконсервировали клетки в кондиционированной среде, содержащей 10% криопротектора диметилсульфоксида (Биолот, Россия). Микробиологический анализ подтвердил отсутствие бактериальной, грибковой и микоплазменной контаминации.
В результате проведенной работы из двух фрагментов одной плаценты были выделены фибробластоподобные клетки, которые при культивировании сформировали 2 линии клеток. Линии названы MSC-PL-1 (из области рядом с пупочным канатиком) и MSC-PL-2 (удаленная от пупочного канатика часть плаценты).
Морфологический анализ. Полученные клеточные линии анализировали с помощью инвертированного микроскопа (NICON, Япония).
Репликативное старение клеток. Оценивали активность фермента β-галактозидазы. Клетки выращивали в чашках Петри (3.5 cм, Nunc, Дания) до образования конфлюента. Затем среду удаляли и окрашивали клетки с помощью набора реактивов (Senescence β-galactosidase staining kit; Cell Signaling, США) согласно инструкции. У клеток, вступающих в фазу репликативного старения, цитоплазма окрашивается в ярко синий цвет. Анализ проводили с помощью инвертированного микроскопа (NICON, Япония) на 6-, 13- и 18-ом пассажах. Долю окрашенных клеток в % определяли при подсчете не менее 1000 клеток в разных полях зрения на одну временную точку.
Эффективность клонирования клеточной линии определяли в чашках Петри в условиях редкого посева - 50 клеток на 1 чашку с плотностью 3-4 кл./см2. Через 14 сут клетки окрашивали 1%-ным водным раствором кристалл-виолета и считали колонии. Эффективность клонирования определяли в % как отношение числа выросших колоний (клонов) к числу посеянных клеток. Учитывали колонии, состоящие из не менее 20 клеток. Анализировали по 8 экспериментов на ранних и поздних пассажах.
Характеристика пролиферативной активности. Оценивали индекс пролиферации - отношение числа клеток в текущий момент к исходному числу посеянных клеток и строили кривые роста клеточных популяций. Для измерения среднего времени удвоения клеточной популяции каждый экспериментальный вариант повторяли 3 раза, ежедневно считали клетки в течение 5-6 сут (120-144 ч). Среднее время одного удвоения клеточной популяции (ao) определяли по формуле (Седова, 2008):
ao = t ln 2/ln(Mt/Mo),
где Mt - число клеток в момент времени t; Mo - начальное число клеток; t - время логарифмической фазы роста клеточной культуры. Анализ проводили на 6-, 13- и 16-м пассажах.
Кариотипический анализ проводили на нескольких пассажах. Клетки линии MSC-PL-1 анализировали дважды: 1) на пассажах 6 и 14; 2) на пассажах 6 и 13. Клетки линии MSC-PL-2 анализировали на пассажах 6 и 15. Для получения препаратов метафазных хромосом за 3 ч до фиксации клеток в среду вводили демеколцин (10 мкг/мл; Sigma, Великобритания), клетки диссоциировали с помощью 0.25%-ного раствора трипсин-ЭДТА (Gibco, Англия) и проводили гипотоническую обработку смесью 0.075 М раствора КСl и 1%-ного раствора цитрата натрия (1 : 1). Клетки фиксировали смесью метанола с ледяной уксусной кислотой (3 : 1) (Реактив, Россия). Для кариотипического анализа проводили дифференциальное G-окрашивание хромосом в соответствии с ранее описанной методикой (Ozkinay, Mitelman, 1979). В клетках MSC-PL-2 анализировали 100 метафаз на каждом пассаже. Количество полиплоидов определяли при подсчете 1000 клеток в каждом варианте.
В клетках MSC-PL-1 в связи с менее активной пролиферацией анализировали меньшее число метафазных пластинок. Так, на пассаже 6 анализ кариотипа проведен в 50 метафазных пластинках. Доля полиплоидных клеток оценена при просмотре 760 метафазных пластинок. Резкое снижение пролиферативной активности к 14-му пассажу позволило кариотипировать только 33 метафазных пластинки. Следует подчеркнуть, что, согласно ранее установленным количественным критериям, долю полиплоидных клеток оценивали только в тех вариантах, где можно было просчитать не менее 500 клеток. В связи с возможностью анализа только небольшого количества метафазных пластинок, был проведен повторный кариотипический анализ клеток линии MSC-PL-1. Клетки для повторного анализа были взяты из той же закладки (заморозки), что и для первого эксперимента. На 6-м пассаже анализировали 100 метафаз. Долю полиплоидов определяли при подсчете 1000 клеток. Кариотипический анализ проведен в 78 клетках. Kариотип линии анализировали с помощью микроскопа Axio Imager.M1 (Carl Zeiss, Германия) с системой автоматического кариотипирования Ikaros 4 karyotyping system (MetaSystems, ФРГ) и описывали в соответствии с Международной системой цитогенетической номенклатуры хромосом человека ISCN (Shaffer et al., 2013).
Иммунофлуоресцентный анализ (ИФА). Присутствие маркеров ранней дифференцировки ЭСК в производные 3-х зародышевых листков оценивали с помощью антител к нестину (тест на эктодерму) (Santa Cruz, США), α-актинину (тест на мезодерму) и α-фетопротеину (тест на энтодерму) (все антитела от Sigma, США). Для определения доли клеток, несущих маркеры недифференцированных ЭСК, использовали антитела против транскрипционных факторов OCT-4, SOX2 и поверхностного маркера SSEA-4 (Santa Cruz, США). Клетки фиксировали 4%-ным раствором параформальдегида в течение 20 мин при комнатной температуре, блокировали 1%-ным раствором бычьего сывороточного альбумина (BSA; Sigma, ФРГ) в течение 1 ч. Пермеабилизацию проводили 0.1%-ным раствором Тритона Х-100 в течение 15 мин при комнатной температуре. Далее все клетки инкубировали с первыми антителами в течение ночи при 4°С. Вторые антитела (Alexa Fluor 488; Life Technologies, США) разводили в соотношении 1 : 500 и инкубировали с ними препараты в течение 1 ч в темноте при комнатной температуре. В качестве отрицательного контроля использовали клетки, окрашенные только вторыми антителами. Визуализацию проводили с помощью микроскопа Olimpus FV3000 (Япония). Анализ проводили на 6-м пассаже.
Для количественной оценки присутствия виментина, используемого для подтверждения статуса МСК, суспензию клеток последовательно фиксировали, пермеабилизовали (как описано выше), далее инкубировали сначала с первыми, а потом со вторыми антителами (Alexa Fluor 488; Life Technologies, США) и анализировали методом проточной цитофлуориметрии.
Анализ поверхностных антигенов с помощью проточной цитофлуориметрии для определения статуса МСК. Экспрессию каждого маркера оценивали по результатам трех экспериментов для клеток, находящихся на 6- и 13-м пассажах для клеток линии MSC-PL-1 и на 6- и 16-м пассажах для клеток линии MSC-PL-2. Иммунофенотипирование проводили с помощью панели конъюгатов CD-маркерных моноклональных антител с флуорохромами. В работе использовали моноклональные антитела против CD34, CD45, HLA-ABC и HLA-DR (Caltac, США), CD44, CD73, CD105 (Beckman Coulter, США), СD90, (BD Pharmingen, США). В качестве негативного контроля использовали очищенные мышиные антитела IgG1/Fitc и IgG1/RFE (DAKO, Дания). Клетки снимали с поверхности чашки с помощью 0.25%-ного раствора трипсина-ЭДТА (Gibco, США) и отмывали от него солевым буферным раствором (РВS), не содержащим ионов Са2+ и Mg2+ (Биолот, Россия). Полученную суспензию клеток (1 млн/мл) в РВS делили на пробы по 10 мкл, добавляли к каждой из них по 2 мкл антител и инкубировали при 4°С в течение 30 мин. Далее пробы доводили до оптимального объема (0.1 мл) с помощью Stain Buffer (BD Pharmingen, США). Пробы анализировали на проточном цитофлуориметре Beckman Coulter (США).
Индукция остеогенной, адипогенной и хондрогенной дифференцировки для определения статуса МСК. Использовали модифицированный метод (Reyes et al., 2001). Клетки (10 000 кл./см2) высевали в остеогенную и адипогенную дифференцировочные среды (HyClone Thermo Scientific HyClone Product, США). Хондрогенную дифференцировку проводили в культуре микромасс в хондрогенной дифференцировочной среде (HyClone Thermo Scientific HyClone Product, США). Индукцию проводили в течение трех недель, меняя среду каждые 3 сут.
Для идентификации хондрогенной дифференцировки из сформированных микромасс готовили мазки на трех предметных стеклах, фиксировали их содержимое 4%-ным раствором параформальдегида в течение 20 мин и далее каждый из мазков окрашивали в течениe 30 мин при комнатной температуре 1%-ным раствором толуидинового синего в 50%-ном изопропаноле, или 0.1%-ным водным раствором сафранина О, или 1%-ным раствором альцианового синего в 3%-ной уксусной кислоте (Sigma, США). Окрашенные мазки промывали дистиллированной водой, высушивали и монтировали под покровное стекло.
Для идентификации остеогенной дифференцировки использовали реакцию Вон Косса. Для этого клетки фиксировали 2 мин в метаноле при -20°С и окрашивали 2%-ым раствором нитрата серебра (Вектон, Россия) в течение 1 ч под лампой мощностью 60 Вт. Окрашенные клетки промывали дистиллированной водой и помещали на 5 мин в 2.5%-ный раствор тиосульфата натрия. Затем клетки снова промывали водой и заливали 70%-ным глицерином.
Для идентификации адипогенной дифференцировки клетки промывали PBS без ионов Ca2+ и Mg2+, фиксировали в метаноле в течение 2 мин при -20°С. Фиксированные клетки промывали 50%-ным этанолом и окрашивали красным масляным (Oil Red O) в течение 10 мин. Далее клетки промывали 50%-ным этанолом, затем дистиллированной водой и заливали 70%-ным глицерином. Наличие адипогенной дифференцировки анализировали дополнительно методом ОТ-ПЦР по экспрессии гена транспортера глюкозы glut4.
Индукции нейрональной дифференцировки. Клетки высевали на чашки Петри и при достижении ими конфлюента ростовую среду меняли на индукционную среду: DMEM (Биолот, Россия), содержащая 10% фетальной бычьей сыворотки (HyClone, США), 1 мкмоль/л ретиноевой кислоты (Sigma-Aldrich, США), по 20 мкг/л ростовых факторов bFGF (Gibco, ThermoFisher, США) и hEGF (Sigma-Aldrich, США). Клетки культивировали в течение 4 сут, а затем анализировали экспрессию гена nse (нейроспецифической элоназы) методом ОТ-ПЦР.
Полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР). Для анализа экспрессии генов glut4 и nse из клеток выделяли тотальную РНК при помощи RiboPure™ RNA Purification Kit (Invitrogen, США) по протоколу, рекомендованному производителем. Все образцы обрабатывали ДНКазой (Fermentas, Thermo Scientific, Литва). Для синтеза кДНК использовали 1 мкг тотальной РНК на пробу, ревертазу RevertAid M-MuLV и случайные олигонуклеотидные последовательности (Fermentas, Thermo Scientific, Литва). Пробы для ПЦР готовили в соответствии с протоколом производителя Taq ДНК-полимеразы (Fermentas, Thermo Scientific, Литва).
Использовали специфические праймеры следующих последовательностей: для nse прямой 5'-AAGGACAAATACGGCAAGGA-3' и обратный 5'-TGGACCAGGCAGCCCAATC-3'; для glut-4 прямой 5'-GGCATGTGTGGCTGTGCCATC-3' и обратный 5'-GGGTTTCACCTCCTGCTCTAA-3'; для β-актина прямой 5'-AATCTGGCACCACACCTTCTACA-3' и обратный 5'-GACGTAGCACAGCTTCTCCTTA-3'. Температура отжига праймеров была адаптирована к оптимальным условиям ПЦР для каждой используемой пары. ПЦР-анализ экспрессии генов проводили на амплификаторе T100 (BioRad, Сингапур). ПЦР-продукт разделяли методом электрофореза в 2%-ном агарозном геле. ОТ-ПЦР-анализ проводили на пассажах 6 и 13 для клеток MSC-PL-1 и на пассажах 6 и 16 для клеток MSC-PL-2.
Результаты обрабатывали статистически с использованием t-критерия Стьюдента. Различия считали достоверными при вероятности нулевой гипотезы Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Морфологический анализ. Из двух фрагментов одной плаценты были выделены фибробластоподобные клетки, которые при культивировании сформировали 2 линии клеток: линия MSC-PL-1 (из области рядом с пупочным канатиком) и линия MSC-PL-2 (удаленная от пупочного канатика часть плаценты). Морфологический анализ этих линий на пассаже 6 показал однородность клеточных популяций, представленных средними по размеру вытянутыми фибробластоподобными клетками (рис. 1).
Рис. 1.
Прижизненные фотографии клеток линий MSC-PL-1 и MSC-PL-2 на раннем (6) и позднем (13 или 16) пассажах. Инвертированный световой микроскоп Nicon Eclipse TS100, Япония. Масштабная линейка: 200 мкм.
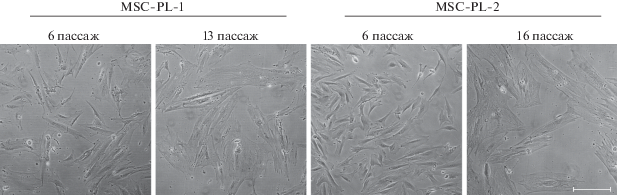
Репликативное старение. Старение клеток MSC-PL-1 и MSC-PL-2 оценивали по активности β-галактозидазы в клеточных популяциях (табл. 1). На пассаже 6 обнаружена сравнительно небольшая доля стареющих клеток, которая свидетельствует о начальной стадии репликативного старения. Далее, к пассажу 13, в клетках MSC-PL-1 наблюдается значительное увеличение доли стареющих клеток, достигающее 85.5%. В отличие от этой линии в клетках MSC-PL-2 усиление активности β-галактозидазы происходит постепенно, и доля стареющих клеток к пассажу 13 значительно меньше по сравнению с клетками MSC-PL-1 и достигает ее уровня только к пассажу 18. Таким образом, наблюдается разный характер репликативного старения в клетках полученных линий, что может быть связано с разной изначальной локализацией выделенных клеток в ткани плаценты (Parolini et al., 2008). Кроме усиления активности β-галактозидазы в клеточных популяциях в процессе культивирования, существенно изменяется и морфология клеток, выражающаяся в увеличении размеров и степени их распластанности, а также в появлении дебриса, что тоже свидетельствует об активном репликативном старении (рис. 1).
Таблица 1.
Доля клеток линий MSC-PL-1 и MSC-PL-2 с выраженной активностью β-галактозидазы в процессе культивирования
| Пассаж | MSC-PL-1 | MSC-PL-2 | ||
|---|---|---|---|---|
| число клеток | доля окрашенных клеток, % | число клеток | доля окрашенных клеток, % | |
| 6 | 1298 | 16.9 ± 1.04 | 1247 | 14.4 ± 1.00 |
| 13 | 1137 | 85.5 ± 1.04 | 1011 | 46.3 ± 1.57 |
| 18 | - | - | 1120 | 91.1 ± 0.85 |
В табл. 1 и 2 даны средние значения и их ошибки при подсчете не менее 1000 клеток в разных полях зрения на одну временную точку (табл. 1) или из 3-4 экспериментов (табл. 2).
Ростовые характеристики. Эффективность клонирования клеток MSC-PL-1 на пассаже 6 составляет 8.0 ± 1.6%. На пассаже 13 клоногенная активность не обнаружена. В клетках MSC-PL-2 на пассажах 6 и 18 отсутствует клоногенная активность, что позволяет считать, что пролиферативный потенциал снижен по сравнению с большинством линий МСК человека. Таким образом, на раннем пассаже, когда доли клеток с низкой активностью β-галактозидазы одинаковы, обнаружены различия по клоногенной активности между линиями, которые нивелируются на поздних пассажах в процессе активного репликативного старения, демонстрируя в обеих линиях отсутствие этой активности. Надо подчеркнуть, что ранее полученные результаты по анализу клоногенной активности в МСК разного происхождения свидетельствуют о ее больших колебаниях между разными линиями (Lo Surdo et al., 2013; Szepesi et al., 2016; Кольцова и др., 2018; Мусорина и др., 2019). Тем не менее, есть данные, свидетельствующие о сходстве показателей эффективности клонирования у близких по происхождению МСК (из пульпы молочного зуба и десны), как на ранних, так и на поздних пассажах (Кольцова и др., 2019).
По-видимому, как показано рядом авторов, эффективность клонирования зависит от первоначальной плотности посева клеток на культуральный сосуд в связи с возможным влиянием метаболических продуктов, секретируемых клетками, а также клеточной миграцией, свойственной МСК. В связи с этим для строгой оценки клоногенной активности необходимо использовать посев единичных клеток с применением 96-луночных плат (Sarugaser et al., 2009; Ali et al., 2015).
Характеристика пролиферативной активности клеток MSC-PL-1 и MSC-PL-2 в процессе длительного культивирования свидетельствуeт об активном делении клеток на пассаже 6 и значительном снижении индекса пролиферации (ИП) к пассажам 13 и 16 (рис. 2). Тем не менее, характер пролиферативной активности различается между линиями. Так, у клеток MSC-PL-1 на пассаже 6 увеличение ИП начинается в первые сутки и существенно увеличивается в течение 96 ч (логарифмическая фаза роста), а далее не изменяется. Среднее время одного удвоения клеточной популяции составляет 59.4 ± 0.72 ч, что значительно больше, чем у ранее полученных нами линий МСК. Совершенно другой характер пролиферативной активности имеют клетки линии MSC-PL-2. На пассаже 6 логарифмическая фаза начиналась на 2 сут и длилась всего 24 ч. Среднее время одного удвоения клеточной популяции составляет 14.5 ± 0.85 ч, что значительно меньше не только по сравнению с линией MSC-PL-1, но и с другими линиями МСК, полученными нами ранее. Таким образом, клетки линии MSC-PL-2, выделенной из района плаценты, отдаленного от пупочного канатика, делятся значительно быстрее, чем клетки линии MSC-PL-1, выделенной из района пупочного канатика. Обе линии существенно отличаются от ранее полученных нами линий по времени удвоения клеточной популяции на раннем пассаже (Полянская, 2018).
Рис. 2.
Кривые роста клеток MSC-PL-1 (1, 2) и MSC-PL-2 (3, 4) на разных пассажах: 6 (кривые 1, 3), 13 (кривая 2) и 16 (кривая 4).
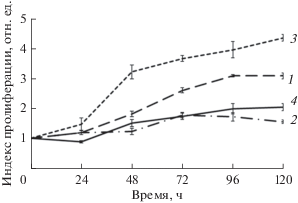
В процессе длительного культивирования, сопровождающегося активным репликативным старением, наблюдается изменение характера пролиферативной активности. Так, у клеток MSC-PL-1 на пассаже 13 увеличение ИП начинается в 1-е сут, затем имеет место неравномерный рост, завершающийся через 72 ч, далее величина ИП не изменяется. Среднее время одного удвоения клеточной популяции составляет 89.0 ± 8.6 ч, что значительно больше, чем у клеточной популяции этой линии на раннем пассаже (P < 0.05). Уменьшение пролиферативной активности также наблюдается в процессе репликативного старения и клеток MSC-PL-2. Начиная с 48 ч, наблюдается постепенный медленный рост, прекращающийся через 96 ч. Логарифмическая фаза составляет 24 ч. Среднее время одного удвоения клеточной популяции составляет 44.1 ± 7.8 ч, что значительно больше, чем у клеточной популяции этой линии на раннем пассаже (P < 0.05). Обращает на себя внимание, что несмотря на удлинение времени удвоения клеточной популяции в процессе репликативного старения в обеих линиях, степень этого удлинения существенно различается между линиями. Так, в клетках MSC-PL-1, оно увеличивается в 1.5 раза, а в линии MSC-PL-2 - в 3 раза.
Таким образом, по характеру пролиферативной активности так же, как и по характеру репликативного старения, клетки двух полученных линий радикально различаются между собой, несмотря на происхождение от одного донора. По-видимому, изначально разная локализация клеточных популяций этих линий в одной плаценте может приводить к существенным различиям ряда клеточных характеристик.
Таким образом, наша работа показывает, что в процессе длительного культивирования клеток полученных линий наступает репликативное старение, которое характеризуется исчезновением клоногенной активности, снижением ИП (рис. 2), значительным увеличением размеров клеток и их распластанности, появлением дебриса (рис. 1), увеличением доли клеток с выраженной активностью β-галактозидазы (табл. 1). В целом, полученные результаты подтверждают ограниченный срок жизни клеток обеих линий, характерный для неиммортализованных клеточных популяций (Hayflick, 1965; Matsumura et al., 1979; Bonab et al., 2006).
Кариотипический анализ. Анализ 50 метафазных пластинок в клетках линии MSC-PL-1 на пассаже 6 показал, что имеет место нормальный кариотип человека: 46, XX (98.0 ± 2.0%) (рис. 3а). В одной клетке обнаружена комплексная перестройка хромосом 8 и 16 (рис. 3а). Доля полиплоидных клеток в популяции при просмотре 760 метафаз составляет 3.4 ± 0.6%. Кариотипический анализ, проведенный на пассаже 14, свидетельствует о существенных изменениях (рис. 3б). Резкое снижение пролиферативной активности к пассажу 14 позволило кариотипировать только 33 клетки. Международное общество клеточной терапии и Рабочая группа по клеточным продуктам рекомендуют исключать клеточные культуры, имеющие 10% и более клональных хромосомных нарушений при анализе минимум 20 клеток методом дифференциального G-окрашивания хромосом (Meisner, Johnson, 2008; Barkholt et al., 2013).
Рис. 3.
Кариотип клеточной линии MSC-PL-1 на пассажах 6 (а), 14 (б, в). а - нормальный кариотип, 46, XX; б - структурный вариант кариотипа 46, X, add(X)(?::p22.3→qter); в - структурный вариант кариотипа 46, XX, der(12)(12pter→12q24.3::?5q31→5qter). На врезке показана комплексная перестройка хромосом 8 и 16, обнаруженная в одной клетке на пассаже 6: образование кольцевой хромосомы (r), маркерной хромосомы (mar) и неидентифицированного фрагмента; стрелками указаны структурно перестроенные хромосомы.
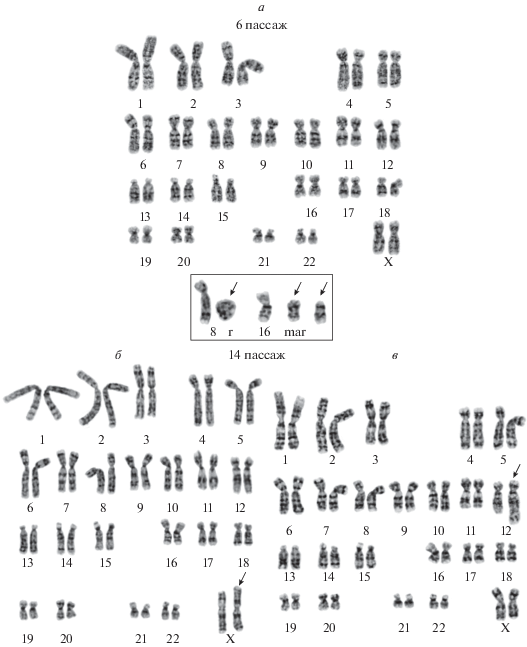
Несмотря на то, что большинство клеток имеют в кариотипе 46 хромосом, нормальный кариотип (46, ХХ) обнаружен только в 3-х из 33-х (9.1 ± 5.0%) просмотренных клеток. В остальных 30 клетках (90.9 ± 5.0%) выявлены два структурных варианта кариотипа (СВК), причем каждый из них характеризовался появлением дополнительного хромосомного материала. В одном СВК (63.6 ± 8.8%) дополнительный материал был обнаружен на коротком плече хромосомы Х, add(X)(p22.3) (рис. 3б), в другом (27.3 ± 8.1%) — на длинном плече хромосомы 12, der(12)t(?5;12)(?q31;q24.3) (рис. 3в). Таким образом, длительное культивирование клеток MSC-PL-1 при активном репликативном старении приводит к существенным кариотипическим изменениям. Подчеркнем, что, несмотря на высокую частоту встречаемости указанной клональной перестройки, она не является адаптивно выгодной, т. к. клеточная популяция теряет пролиферативную активность. Тем не менее, учитывая небольшое количество проанализированных клеток, было решено повторно провести длительное культивирование, чтобы подтвердить или опровергнуть устойчивый характер клональной перестройки Х, add(X)(p22.3), затрагивающей большую часть клеточной популяции. Результаты получены на пассажах 6 и 13.
Клетки MSC-PL-1 для повторного анализа взяты из той же закладки (заморозки), что и для предыдущего эксперимента. Повторный анализ кариотипа на пассаже 6 проведен на 100 метафазных пластинках. Число клеток с нормальным кариотипом 46, ХХ составляло 97.0 ± 1.7%. В трех клетках обнаружены разные неклональные перестройки хромосом: в одной — транслокация хромосом 2 и 13, t(2;13)(p13;q12), в другой — делеция короткого плеча хромосомы 3, del(3)(p14), в третьей — делеция длинного плеча хромосомы 4, del(4)(q22) (данные не представлены). Доля полиплоидных клеток на пассаже 6 составила 13.5 ± 1.1%. Анализ 78 клеток MSC-PL-1 на пассаже 13 показал значительно большую частоту клеток с нормальным кариотипом линии по сравнению с предыдущим исследованием (82.05 ± 4.30%). Тем не менее, повторно выявлен СВК с перестройкой хромосомы Х, add(X)(p22.3) (16.7 ± 4.2%), что существенно выше разрешенного предела для клональных перестроек в нормальном кариотипе. СВК с перестройкой хромосомы 12, der(12)t(?5;12)(?q31;q24.3) не наблюдался, но в одной клетке обнаружена перестройка хромосом 5 и 12 с образованием двух аномальных хромосом add(5)(q11.2) и add(12)(q15) (данные не представлены).
Таким образом, обнаруженная клональная перестройка является характерной чертой кариотипа линии MSC-PL-1 при репликативном старении. Но при этом частота этой перестройки может варьировать при культивировании разных клеточных популяций одной линии. Подобный результат был получен ранее при анализе кариотипа вновь полученной линии МСК, выделенной из десны человека. Но в том случае частоты появления одной клональной перестройки в обеих популяциях были близки (Кольцова и др., 2019).
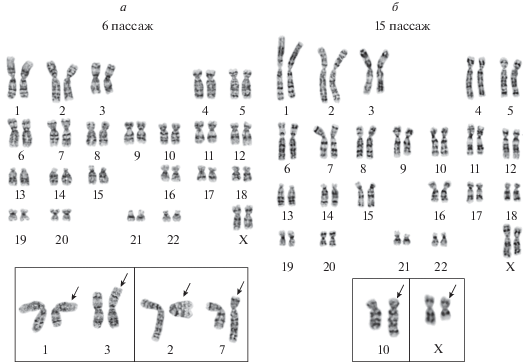
Совершенно другая картина наблюдается в клеточной линии MSC-PL-2. Анализ 100 метафазных пластинок в клетках линии MSC-PL-2 на пассажах 6 и 15 показал, что в обоих случаях с одинаковой частотой встречается нормальный кариотип человека - 46, XX (98.0 ± 1.4%) (рис. 4а, б). Обнаружены на обоих сроках культивирования случайные (неклональные) структурные хромосомные перестройки. Так, на пассаже 6 в двух клетках обнаружены сбалансированные транслокации: транслокация хромосом 1 и 3, t(1;3)(p10;p10) в одной клетке и транслокация хромосом 2 и 7, t(2;7)(q11.2;q11.1) в другой (рис. 4а). На пассаже 15 также сохранился нормальный кариотип (98.0 ± 1.4%). В двух клетках выявлены структурные перестройки хромосом Х и 10, add(X)(q21), в одной клетке и хромосомы 10, add(10)(q26), в другой (рис. 4б). Доля полиплоидных клеток в популяции на пассаже 6 при просмотре 1000 метафаз составляет 4.0 ± 0.6%, на пассаже 15 - 6.7 ± 0.8%, что свидетельствует об отсутствии различий по этому параметру на раннем и позднем пассажах. Предыдущие данные свидетельствуют о наличие цитогенетической нестабильности в процессе длительного культивирования в некоторых линиях МСК (Redaelli et al., 2012; Kim et al., 2015; Кольцова и др., 2018, 2019; Мусорина и др., 2019).
Рис. 4.
Кариотип клеточной линии MSC-PL-2 на пассажах 6 (а) и 15 (б). Нормальный кариотип, 46, XX. На врезках (а, б) — структурно перестроенные хромосомы (стрелки), обнаруженные в отдельных клетках: пассаж 6 ((а) — der(1;3)(1pter→1p10::3p10→3pter) и der(1;3)(1qter→1q10::3q10→3qter); der(2)(2pter→2q11.2::7q11.1→7qter) и der(7)(7pter→7q11.1::2q11.2→2qter); пассаж 15 (б) — add(X)(pter→q21::?); add(10)(pter→q26::?).
Различия между двумя вновь полученными линиями состоят в том, что они получены от одного здорового донора, но из разных областей плаценты: MSC-PL-1 - из области, расположенной рядом с пупочным канатиком, а MSC-PL-2 - из области, удаленной от него. Остальные условия выделения и культивирования клеток были идентичны. Можно с большой долей вероятности выдвинуть два предположения, объясняющие межлинейные различия, полученные и рассмотренные в настоящей работе. Первая и основная причина состоит в разных физиологических условиях, зависящих от изначального места локализации выделяемых клеток. Согласно второй (с учетом особенностей плаценты, как сложного внезародышегого органа), межлинейные различия можно объяснить степенью созревания областей плаценты в процессе беременности. Так, в обзорной статье (Parolini et al., 2008) говорится о снижении пролиферативной активности в 3-ем триместре беременности в МСК по сравнению с ранними триместрами, т.е. возможно старение клеточных популяций in vivo. Поэтому подчеркнем, что для получения клеточных линий мы использовали фрагменты плаценты, полученной в процессе родов.
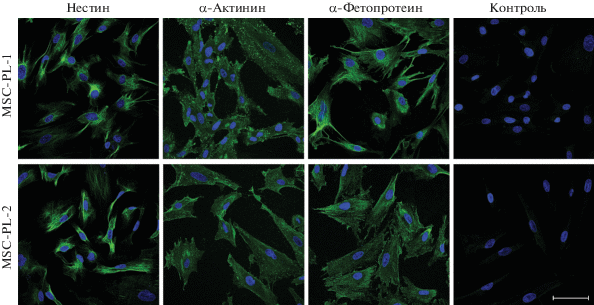
Результаты иммунофлуоресцентного анализа. Присутствие маркеров ранней дифференцировки ЭСК в производные трех зародышевых листков в клетках MSC-PL-1 и MSC-PL-2 показано на рис. 5. Идентифицированы следующие маркеры: нестин (маркер эктодермы), альфа-актинин (маркер мезодермы), альфа-фетопротеин (маркер энтодермы). Эти результаты совпадают с предыдущими данными, полученными разными методами, о наличии маркеров ранней дифференцировки ЭСК в МСК разного происхождения. Возможно, что с присутствием маркеров ранней дифференцировки ЭСК связана дифференцировочная пластичность МСК (Riekstina et al., 2009; Huang et al., 2010; Antonucci et al., 2011; Mamidi et al., 2011; Wu et al., 2013; Мусорина и др., 2019). Существенно отметить, что на пассаже 6 отсутствуют клетки, несущие маркеры недифференцированных ЭСК: SSEA-4 и OCT-4 по данным иммунофлуоресцентного анализа, а также маркер SOX2 по данным проточной цитофлуориметрии (данные не представлены).
Рис. 5.
Флуоресценция маркеров ранней дифференцировки эмбриональных стволовых клеток человека линий MSC-PL-1 и MSC-PL-2 на пассаже 6. Окраска соответствующими моноклональными антителами. Показаны маркеры эктодермы (нестина), мезодермы (альфа-актинина) и энтодермы (альфа-фетопротеина). Масштабная линейка: 50 мкм.
Анализ поверхностных антигенов для определения статуса МСК. Поверхностные антигены МСК полученных линий анализировали с помощью проточной цитофлуориметрии и подтвердили наличие у них статуса МСК (табл. 2). Для популяций обеих линий характерна большая доля клеток, несущих характерные для МСК антигены CD44, CD73, CD90, CD105, виментин и HLA-ABC и небольшая часть клеток с антигенами CD34, CD45 и HLA-DR. Тем не менее, обнаружены различия (как внутрилинейные, так и межлинейные) по доле клеток, несущих ряд маркеров, в процессе репликативного старения. Отметим, что в обеих линиях для всех маркеров доля клеток, несущих антигены, необходимые для подтверждения статуса МСК (CD44, CD73, CD90, CD105, виментин и HLA-ABC) достаточно высока. А доля клеток с маркерами, которые должны отсутствовать в МСК (CD34, CD45 и HLA-DR), достаточно низкая (табл. 2).
Таблица 2.
Доля клеток (%) линий MSC-PL-1 и MSC-PL-2, несущих разные поверхностные маркеры
| Маркер | MSC-PL-1 | MSC-PL-2 | ||
|---|---|---|---|---|
| пассаж 6 | пассаж 13 | пассаж 6 | пассаж 16 | |
| CD44 | 98.81 ± 1.12 | 99.71 ± 0.06 | 99.89 ± 0.07 | 98.97 ± 0.34 |
| CD73 | 98.70 ± 1.16 | 99.53 ± 0.09 | 99.43 ± 0.19 | 97.19 ± 0.33 |
| CD90 | 90.00 ± 6.84а | 62.28 ± 2.32а | 53.05 ± 6.56 | 48.19 ± 0.62 |
| CD105 | 99.90 ± 0.06 | 98.64 ± 0.52 | 99.94 ± 0.01 | 95.54 ± 0.94 |
| Виментин | 57.12 ± 2.61 | 50.16 ± 4.56 | 18.66 ± 2.27 | 20.00 ± 1.84 |
| CD34 | 0.30 ± 0.14 а | 1.60 ± 0.38 а | 0.85 ± 0.16 | 1.14 ± 0.24 |
| CD45 | 3.60 ± 0.79 | 3.29 ± 0.73 | 4.76 ± 1.79 | 1.55 ± 0.26 |
| HLA-ABC | 96.99 ± 0.38 | 87.98 ± 5.25 | 99.76 ± 0.10 | 97.22 ± 0.52 |
| HLA-DR | 0.39 ± 0.01а | 1.17 ± 0.16а | 0.87 ± 0.31 | 1.54 ± 0.24 |
Наиболее заметные различия, но не нарушающие статус МСК, состоят в следующем: снижение доли клеток, несущих маркер CD90 на пассаже 13 по сравнению с пассажем 6 (Р < 0.05) в клетках линии MSC-PL-1, а также заметно меньшая доля клеток, несущих маркер виментин, в клетках линии MSC-PL-2 на ранних и поздних пассажах по сравнению с линией MSC-PL-1.
Таким образом, согласно требованиям Международного общества клеточной терапии (Domonici et al., 2006; Sensebé et al., 2010), для обеих линий подтвержден статус МСК. Надо отметить, что высокая доля клеток, несущих маркеры CD44, CD73, CD90, CD105, как правило, достаточно устойчива и сходна как в разных линиях, так и в процессе длительного культивирования одной линии. Тем не менее, в ряде работ авторы отмечают количественные колебания клеток с маркерами CD90 и CD105 между линиями, полученными из разных источников, при культивировании в разных условиях, в процессе репликативного старения, а также в линиях с кариотипической нестабильностью. Эти результаты рассмотрены в обзорной статье (Полянская, 2018). Надо подчеркнуть, что функционально CD90 и CD105 связаны с важнейшими клеточными процессами, такими как межклеточные взаимодействия, миграция, клеточная пролиферация и дифференцировка (Maleki et al., 2014). В настоящее время сложно объяснить причину этих колебаний. Возможно, не существует одной причины, а есть комплекс факторов, влияющих на проявление этих маркеров. Пока только можно отметить, что эти два поверхностных антигена подвержены большим количественным колебаниям, чем остальные маркеры.
Индукция остеогенной, адипогенной и хондрогенной дифференцировки для определения статуса МСК. Анализ дифференцировочного потенциала клеток линий MSC-PL-1 и MSC-PL-2 на пассаже 6 выявила их способность формировать жировую, хрящевую и костную ткань (рис. 6), что подтверждает статус МСК (Dominici et al., 2006; Sensebé et al., 2010). Культивирование клеток в адипогенной среде способствовало образованию кластеров адипоцитов, показанных с помощью окрашивания красителем масляным красным (Oil Red O). Культивирование клеток в остеогенной среде способствовало формированию минеральных комплексов, идентифицированных с помощью реакции Vоn Kossa, выявляющей нерастворимые соли кальция в межклеточном пространстве. Культивирование клеток в хондрогенной среде привело к образованию сульфатированных гликозаминогликанов, протеогликанов и кислых гликозаминогликанов, которые выявлены с помощью окрашивания специфическими красителями, подтверждающими наличие хондрогенной дифференцировки.
Рис. 6.
Дифференцировка клеток линий MSC-PL-1 и MSC-PL-2 в адипогенном, остеогенном и хондрогенном направлении на раннем (6) и позднем (13 или 16) пассажах при длительном культивировании. Показано окрашивание жировых включений масляным красным (адипогенез), реакция Vоn Kossa, выявляющая нерастворимые соли кальция в межклеточном пространстве (остогенез) и окрашивание толуидиновым синим сульфатированных гликозаминогликанов, сафранином О протеогликанов или альциановым синим кислых гликозаминогликанов (хондрогенез) на разных пассажах. Масштабная линейка: 100 мкм.
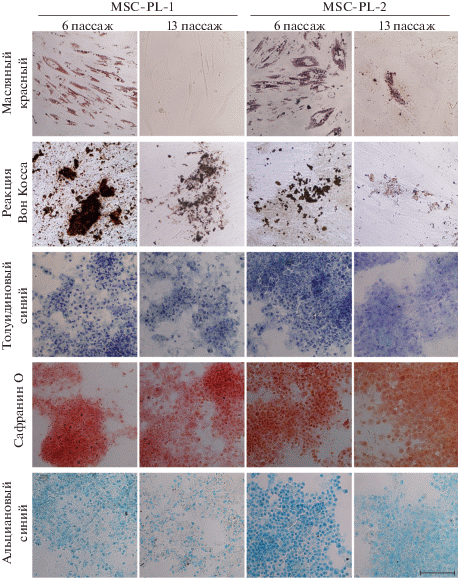
Дифференцировочный потенциал исследуемых линий в процессе репликативного старения существенно изменяется. Принципиальные различия между ранними и поздними пассажами наблюдаются в процессе адипогенной и остеогенной дифференцировок. Так, в клетках MSC-PL-1 на пассаже 13 отсутствует адипогенная и снижена остеогенная дифференцировка. В клетках MSC-PL-2 на пассаже 16 имеют место обе эти дифференцировки, но потенциал этих дифференцировок значительно слабее, чем на пассаже 6 (рис. 6).
В связи с полученными результатами необходимо отметить, что в настоящее время накапливаются данные о значительных колебаниях уровня потенциала трех стандартных направлений дифференцировки МСК человека. Так, показаны существенные колебания, вплоть до отсутствия конкретной дифференцировки, при изменении условий культивирования, разном возрасте доноров, разных источниках выделения МСК, а также в процессе репликативного старения. Причем, причиной колебаний дифференцировочного потенциала могут быть изменения, происходящие как на уровне транскрипции определенных генов, так и на уровне трансляции (Park et al., 2005; Bonab et al., 2006; Zhang et al., 2006; Lo Surdo et al., 2013; Крылова и др., 2015; Bianchi et al., 2017; Кольцова и др., 2018, 2019; Мусорина и др., 2019; Monterubbianesi et al., 2019).
Результаты ОТ-ПЦР. Одним из генов, участвующих в адипогенной дифференцировке, является glut4 - ген транспортера глюкозы. Был проведен анализ экспрессии гена glut4 на разных пассажах исследуемых линий (рис. 7а). В клетках линии MSC-PL-1 на пассаже 6 транскрипция гена glut4 присутствует в контроле и усиливается при индукции адипогенной дифференцировки. В процессе репликативного старения, к пассажу 13, экспрессия полностью исчезает и в контроле и при индукции. В клетках MSC-PL-2 на пассаже 6 данные по экспрессии glut4 идентичны данным, полученным на клетках MSC-PL-1. К пассажу 16 сохраняется возможность к индукции адипогенной дифференцировки, проявляющейся в транскрипционной активности этого гена, хотя и с меньшей интенсивностью.
Рис. 7.
Экспреcсии гена glut4 (транспортера глюкозы - маркера адипогенной дифференцировки, а) и гена nse (нейроспецифической элоназы - маркера нейрональной дифференцировки, б) в клетках MSC-PL-1 и MSC-PL-2 при еe индукции. Метод ОТ-ПЦР. Контроль - экспрессия гена в недифференцированных клетках; β-актин - контрольный ген общего метаболизма; слева - маркеры мол. массы (пары оснований).
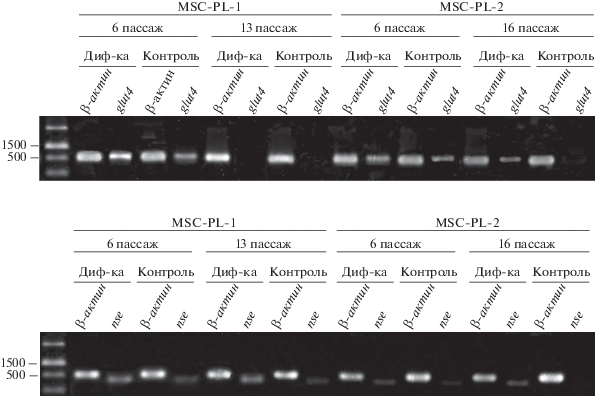
Наблюдаемая корреляция между прекращением транскрипции гена glut4 на стадии активного репликативного старения и отсутствием адипогеной дифференцировки в клетках MSC-PL-1 может свидетельствовать о наличие причинно-следственной связи между этими явлениями. Корреляция между уровнем адипогенной дифференцировки и транскрипционной активностью glut4 отмечена и для клеток MSC-PL-2, в которых наблюдается ослабление адипогенного дифференцировочного потенциала на пассаже 16 (рис. 6) и ослабление транскрипции гена glut4 (рис. 7а) относительно пассажа 6. Подобный результат был показан нами при анализе адипогенного потенциала в клетках MSC-DP, полученных из пульпы молочного зуба (Кольцова и др., 2018). Надо подчеркнуть, что корреляция между транскрипционной активностью гена glut4 и способностью клеток формировать адипоциты с характерными для них включениями жировых капель, проявляется не всегда. Так, в клетках линии MSC-GING, полученной из десны взрослого донора, показано наличие транскрипционной активности гена glut4, но отсутствие формирования жировых капель (Кольцова и др., 2019). Таким образом, результаты, полученные в предыдущих исследованиях и в настоящей работе, могут свидетельствовать о разных причинах, вызывающих изменения дифференцировочного потенциала МСК человека (Кольцова и др., 2018, 2019).
Интересно было исследовать потенциал нейрональной дифференцировки клеточных линий, полученных из плаценты. Ранее была показана экспрессия гена nse, участвующего в нейрональной дифференцировке, в линиях клеток MSC-DP и MSC-GING, которые по своему онтогенетическому происхождению относятся к эктодермальному зародышевому листку, чем и объясняется их повышенный потенциал к нейрональной дифференцировке (Кольцова и др., 2018, 2019). Плацента имеет сложное онтогенетическое происхождение. Результаты, полученные с помощью ОT-ПЦР-анализа (рис. 7б), свидетельствуют либо об очень слабой экспрессии гена nse в клетках MSC-PL-1 на пассаже 6 и в процессе репликативного старения, либо об отсутствии экспрессии этого гена в процессе длительного культивирования в клетках MSC-PL-2.
Эти данные могут явиться косвенным подтверждением важности онтогенетического происхождения определенной линии МСК. Слабые различия между клетками линий MSC-PL-1 и MSC-PL-2 могут отражать конкретное место локализации клеток ткани плаценты, из которых они получены.
Список литературы
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2018. Получение и характеристика линии мезенхимных стволовых клеток, выделенных из пульпы молочного зуба человека. Цитология. Т. 60. № 12. С. 955. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2018. The derivation and characterization of mesenchymal stem cell line, isolated from human pulp of a deciduous tooth. Tsitologiia. V. 60. P. 955.)
Кольцова А.М., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2019. Получение и характеристика линии мезенхимных стволовых клеток, выделенной из десны человека. Цитология. Т. 61. № 8. С. 658. (Koltsova A.M., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2020. Isolation and characterization of mesenchymal stem cells from human gingiva. Cell Tiss. Biol. (Tsitologiya). V. 61. P. 658.)
Крылова Т.А., Мусорина А.С., Зенин В.В., Полянская Г.Г. 2015. Характеристика клеточных сфероидов, полученных из линий мезенхимных стволовых клеток, выделенных из костного мозга и зачатка конечности раннего эмбриона человека. Цитология. Т. 57. № 7. С. 480. (Krylova T.A, Musorina A.S., Zenin V.V., and. Poljanskaya G.G. 2015. Cellular spheroids obtained from mesenchymal stem cells derived from bone marrow and limb muscle of early human embryo. Cell Tiss. Biol. (Tsitologiya). V. 9. P. 431.)
Мусорина А.С., Зенин В.В., Турилова В.И., Яковлева Т.К., Полянская Г.Г. 2019. Характеристика неиммортализованной линии мезенхимных стволовых клеток, выделенных из эпикардиальной жировой ткани человека. Цитология. Т. 61. № 4. С. 272. (Musorina A.S., Zenin V.V., Turilova V.I., Yakovleva T.K., Poljanskaya G.G. 2019. Х Characterization of a nonimmortalized mesenchymal stem cell line isolated from human epicardial adipose tissue. Cell Tiss. Biol.(Tsitologiya). V. 13. P. 247).
Нимирицкий П.П., Сагарадзе Г.Д., Ефименко А.Ю., Макаревич П.И., Ткачук В.А. 2018. Ниша стволовой клетки. Цитология. 60. № 8. P. 575. (Nimiritsky P.P., Sagaradze G.D., Efimenko A.Yu., Makarevich P.I., Tkachuk V.A. 2018. The stem cell niche. Tsitologiya. V. 60. P. 955).
Полянская Г.Г. 2018. Сравнительный анализ характеристик линий мезенхимных стволовых клеток человека, полученных в коллекции культур клеток позвоночных (обзор). Сб. “Клеточные культуры”, вып. 34. С. 3. (Poljanskaya G.G. 2018. Comparative analysis of the lines of human mesenchymal stem cells derived in the collection of cell cultures of vertebrates (review). Collection “Cell cultures”, issue 34. P. 3).
Полянская Г.Г., Ефремова Т.Н., Кольцова А.М., Мусорина А.С., Шарлаимова Н.С., Яковлева Т.К. 2019. Методическое пособие по работе с клеточными культурами человека и животных. Спб. Изд-во Политехнического ун-та, 114 с. (Poljanskaya G.G., Efremova T.N., Koltsova A.M. Musorina A.S., Sharlaimova N.S., Yakovleva T.K. 2019. Methodical handbook for working with cell cultures of humans and animals. SPb, Polytechnic Univ. Publishing House. P. 114).
Полянская Г.Г., Мусорина А.С. 2018. Коллекция культур клеток позвоночных: создание, деятельность, каталог. СПб, Изд-во Политехнического ун-та, С. 184. (Poljanskaya G.G., Musorina A.S. 2018. Collection of vertebrate cell cultures: creation, activity, catalogue. SPb, Polytechnic Univ. Publishing House. P. 184) .
Седова Г.П. 2008. Количественные аспекты злокачественного роста. Математическая морфология. Электронный математический и медико-биологический журн. Т. 7. № 2. URL: http://www.smolensk.ru/user/ sgma/ mmorph/n-18-html/cont.htm (Sedova G.P. 2008. Quantitative aspects of malignant body height. Mathematical morphology. Electronic Math. Medicobiol. J. V. 7(2). URL: http://www.smolensk.ru/user/sgma/mmorph/n-18-html/cont.htm
Шаровская Ю.Ю., Лагарькова М.А., Киселев С.Л., Чайлахян Л.М. 2009. Исследование диффузионной связи через щелевые контакты в эмбриональных стволовых клетках человека в процессе спонтанной дифференцировки. ДАН. Т. 427. № 3. С. 407. (Sharovskaya Y.Y, Lagarkova M.A, Kiselev S.L, Chailakhyan L.M. 2009. Gap junctional intercellular communication in human embryonic stem cells during spontaneous differentiation. Dokl. Biol. Sci. V. 427. P. 407).
Abedian Z, Jenabian N, Moghadamnia A.A., Zabihi E., Pourbagher R., Hossein-Nataj H. 2020. A comparative study on immunophenotypic characterization and osteogenic differentiation of human mesenchymal stromal cells derived from periodontal ligament and gingiva. J. Periodontol. https://doi.org/10.1002/JPER.19-0535
Ali H., Al-Yatama M.K., Abu-Farha M., Behbehani K., Al Madhoun A. 2015. Multi-lineage differentiation of human umbilical cord Wharton’s Jelly Mesenchymal Stromal Cells mediates changes in the expression profile of stemness markers. PLoS One. 10: e0122465. https://doi.org/10.1371/journal.pone.0122465
Antonucci I., Stuppia L., Kaneko Y., Yu S., Tajiri N., Bae E.C., Chheda S.H., Weinbren N.L., Borlongan C.V. 2011. Amniotic fluid as rich source of mesenchymal stromal cells for transplantation therapy. Cell Transplant. V. 20. P. 789.
Barkholt L., Flory E., Jekerle V., Lucas-Samuel S., Ahnert P., Bisset L., Büscher D., Fibbe W., Foussat A., Kwa M., Lantz O., Mačiulaitis R., Palomäki T., Schneider C.K., Sensebé L., Tachdjian G., Tarte K., Tosca L., Salmikangas P. 2013. Risk of tumorigenicity in mesenchymal stromal cell-based therapies-bridging scientific observations and regulatory viewpoints. Cytother. V. 15. P. 753.
Bianchi M. V., Awaja F., Altankov G. 2017. Dynamic adhesive environment alters the differentiation potential of young and ageing mesenchymal stem cells. Mater. Sci. Eng. C. Mater. Biol. Appl. V. 78. P. 467.
Bonab M.M., Alimoghaddam K., Talebian F., Ghaffari S.H., Ghavamzadeh A., Nikbin B. 2006. Aging of mesenchymal stem cell in vitro. BMC Cell Biol. V. 7.
Bongso A., Fong C.Y. 2013. The therapeutic potential, challenges and future clinical directions of stem cells from the Wharton’s jelly of the human umbilical cord. Stem Cell. Rev. V. 9. P. 226.
Brown C., McKee C., Bakshi S., Walker K., Hakman E., Halassy S., Svinarich D., Dodds R., Govind C.K., Chaudhry G.R. 2019. Mesenchymal stem cells: Cell therapy and Regeneration potential. J. Tissue Eng. Regen. Med. https://doi.org/10.1002/term.2914
Choi J.S., Lee B.J., Park H.Y., Song J.S., Shin S.C., Lee J.C., Wang S.G., Jung J.S. 2015. Effects of donor age, long-term passage culture, and cryopreservation on tonsil-derived mesenchymal stem cells. Cell Physiol. Biochem. V. 36. P. 85.
Cox R.P., Krauss M.R., Balis M.E., Dancis J. 1972. Communication between normal and enzyme-deficient cells in tissue culture. Exp. Cell. Res. V. 74. P. 251.
Darnell M., O’Neil A., Mao A., Gu L., Rubin L.L., Mooney D.J. 2018. Material microenvironmental properties couple to induce distinct transcriptional programs in mammalian stem cells. Proc. Natl. Acad. Sci. USA. V. 115. P. E8368.
Dominici M., Le Blanc K., Mueller I., Slaper-Cortenbach I., Marini F., Krause D., Deans R., Keating A., Prockop Dj., Horwitz E. 2006. Minimal criteria for defining multipotent mesenchymal stromal cells. Int. Soc. Cell. Ther. position statement. Cytother. V. 8. P. 315.
Gattazzo F., Urciuolo A., Bonaldo P. 2014. Extracellular matrix: a dynamic microenvironment for stem cell niche. Biochim. Biophys. Acta. V. 1840. P. 2506.
Hayflick L. 1965. The limited in vitro lifetime of human diploid cell strains. Exp. Cell Res. V. 37. P. 614.
Hooper M.L., Subak-Sharpe J.H. 1981. Metabolic cooperation between cells. Int. Rev. Cytol. V. 69. P. 45.
Huang H.I., Chen S.K., Ling Q.D., Chien C.C., Liu H.T., Chan S.H. 2010. Multilineage differentiation potential of fibroblast-like stromal cells derived from human skin. Tiss. Eng. (A). V. 16. P. 1491.
Khasawneh R.B., Al Sharie A.H., Abu-El-Rub E., Serhan A.O., Obeidat H.N. 2019. Addressing the impact of different fetal bovine serum percentages on mesenchymal stem cells biological performance. Mol. Biol. Rep. https://doi.org/10.1007/s11033-019-04898-1
Kim J.A., Im K.O., Park S.N., Kwon J.S., Kim S.Y., Oh K., Lee D.S., Kim M.K., Kim S.W., Jang M., Lee G., Oh Y.M., Lee S.D., Lee D.S. 2015. Cytogenetic heterogeneity and their serial dynamic changes during acquisition of cytogenetic aberrations in cultured mesenchymal stem cells. Mutat. Res. V. 777. P. 60.
Lo Surdo J.L., Millis B.A., Bauer S.R. 2013. Automated microscopy as a quantitative method to measure differences in adipogenic differentiation in preparations of human mesenchymal stromal cells. Cytotherapy. V. 15. P. 1527.
Maleki M., Ghanbarvand F., Reza Behvarz M., Ejtemaei M., Ghadirkhomi E. 2014. Comparison of mesenchymal stem cell markers in multiple human adult stem cells. Int. J. Stem Cells. V. 7. P. 118.
Mamidi M.K., Pal R., Mori N.A., Arumugam G., Thrichelvam S.T., Noor P.J., Abdullah H.M., Gupta P.K., Das A.K., Zakaria Z., Bhonde R. 2011. Co-culture of mesenchymal-like stromal cells derived from human foreskin permits long term propagation and differentiation of human embryonic stem cells. J. Cell. Biochem. V. 112. P. 1353.
Matsumura T., Zerrudo Z., Hayflick L. 1979. Senescent human diploid cells in culture: survival, DNA synthesis and morphology. J. Gerontol. V. 34. P. 328.
Meisner L.F., Johnson J.A. 2008. Protocols for cytogenetics studies of human embryonic stem cells. Methods. V. 45. P. 133.
Monterubbianesi R., Bencun M., Pagella P., Woloszyk A., Orsini G., Mitsiadis T.A. 2019. A comparative in vitro study of the osteogenic and adipogenic potential of human dental pulp stem cells, gingival fibroblasts and foreskin fibroblasts. Sci. Rep. V. 9. P. 1761.
Niedernhofer L.J., Gurkar A.U., Wang Y., Vijg J., Hoeijmakers J.H.J., Robbins P.D. 2018. Nuclear Genomic Instability and Aging. Ann. Rev. Biochem. V. 87. P. 295.
Ozkinay C., Mitelman F. 1979. A simple trypsin-Giemsa technique producing simultaneous G- and C-banding in human chromosomes. Hereditas. V. 90. P. 1.
Park J.S., Kim H.Y., Kim H.W., Chae G.N., Oh H.T., Park J.Y., Shim H., Seo M., Shin E.Y., Kim E.G., Park S.C., Kwak S.J. 2005. Increased caveolin-1, a cause for the declined adipogenic potential of senescent human mesenchymal stem cells. Mech. Ageing Dev. V. 126. P. 551.
Parolini O., Alviano F., Bagnara G.P., Bilic G., Buhring H.J., Evangelista M., Hennerbichler S., Liu B., Magatti M., Mao N., Miki T., Marongiu F., Nakajima H., Nicaido T., Portmann-Lanz C.B. et al. 2008. Concise review: isolation and characterization of cells from human term placenta: outcome of the first international Workshop on Placenta derived stem cells. Stem Cells. V. 26. P. 300.
Redaelli S., Bentivegna A., Foudah D., Miloso M., Redondo J., Riva G., Baronchelli S., Dalprà L., Tredici G. 2012. From cytogenomic to epigenomic profiles: monitoring the biologic behavior of in vitro cultured human bone marrow mesenchymal stem cells. Stem Cell Res. Ther. V. 3. P. 47.
Reyes M., Lund T., Lenvik T., Aguiar D., Koodie L., Verfaillie C.M. 2001. Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells. Blood. V. 98. P. 2615.
Riekstina U., Cakstina I., Parfejevs V., Hoogduijn M., Jankovskis G., Muiznieks I., Muceniece R., Ancans J. 2009. Embryonic stem cell marker expression pattern in human mesenchymal stem cells derived from bone marrow, adipose tissue, heart and dermis. Stem Cell Rev. V. 5. P. 378.
Sarugaser R., Hanoun L., Keating A., Stanford W.L., Davies J.E. 2009. Human mesenchymal stem cells self-renew and differentiate according to a deterministic hierarchy. PLoS One. 4:e6498. https://doi.org/10.1371/journal.pone.0006498
Sensebé L., Krampera M., Schrezenmeier H., Bourin P., Giordano R. 2010. Mesenchymal stem cells for clinical application. Vox Sang. V. 98. P. 93.
Shaffer I.G., Slovak M.L., Campbell L.J. (Eds.). 2013. An international system for human cytogenetic nomenclature. Basel: S. Karger. 140 p.
Szepesi Á., Matula Z., Szigeti A., Várady G., Szalma J., Szabó G., Uher F., Sarkadi B. Német K. 2016. In vitro characterization of human mesenchymal stem cells isolated from different tissues with a potential to promote complex bone regeneration. Stem Cells Int. https://doi.org/10.1155/2016/3595941
Wu R., Gu B., Zhao X., Tan Z., Chen L., Zhu J., Zhang M. 2013. Derivation of multipotent nestin(+)/CD271(-)/STRO-1(-) mesenchymal-like precursors from human embryonic stem cells in chemically defined conditions. Hum. Cell. V. 26. P. 19.
Yang C., Chen Y., Zhong L., You M., Yan Z., Luo M., Zhang B., Yang B., Chen Q. 2019. Homogeneity and heterogeneity of biological characteristics in mesenchymal stem cells from human umbilical cords and exfoliated deciduous teeth. Biochem. Cell Biol. https://doi.org/10.1139/bcb-2019-0253
Zhang W., Walboomers X.F., Shi S., Fan M., Jansen J.A. 2006. Multilineage differentiation potential of stem cells derived from human dental pulp after cryopreservation. Tissue Eng. V. 12. P. 2813.
Дополнительные материалы отсутствуют.


