Цитология, 2020, T. 62, № 9, стр. 679-684
Клеточные элементы собственной пластинки слизистой оболочки мочевого пузыря в экспериментальных моделях интерстициального цистита (синдрома болезненного мочевого пузыря)
Р. Ф. Шолан *
Республиканский лечебно-диагностический центр
AZ1122 г. Баку, Азербайджан
* E-mail: ittihaf@yahoo.com
Поступила в редакцию 01.06.2020
После доработки 11.06.2020
Принята к публикации 13.06.2020
Аннотация
Важным компонентом слизистой оболочки мочевого пузыря является собственная пластинка, но ее роль в функции мочевого пузыря окончательно не установлена. Целью работы являлось изучение электронно-микроскопического строения собственной пластинки слизистой оболочки мочевого пузыря в экспериментальных моделях интерстициального цистита (синдрома болезненного мочевого пузыря). Для создания экспериментальной модели использовали самок белых новозеландских кроликов массой 1500-2000 г (n = 15), которым вводили в стенку мочевого пузыря мочу, взятую из мочевого пузыря животного; контрольным животным (n = 7) в стенку мочевого пузыря вводили 0.9%-ный раствор NaCl. На 7-е сут проводили цистэктомию и последующее исследование организации стенки мочевого пузыря на ультраструктурном уровне. В образцах животных экспериментальной группы обнаруживали разрыхления тканей различной степени, отдельные разнонаправленные коллагеновые волокна в окружении мелкогранулярных преципитатов плазменных белков, комплекс патоморфологических изменений в структурных элементах собственной пластинки и эпителия слизистой оболочки мочевого пузыря, периваскулярную инфильтрацию клетками воспаления и выраженный отек собственной пластинки. В составе последней выявляли макрофаги, лимфоциты, нейтрофилы и отдельные эозинофилы, множество плазматических клеток. Полученные данные позволяют заключить, что в стенке мочевого пузыря экспериментальной группы в течение 7 сут развился острый воспалительный процесс с морфологическими признаками реакций как врожденного, так и приобретенного иммунитета.
Интерстициальный цистит (синдром болезненного мочевого пузыря; ИЦ/СБМП) считается заболеванием уротелия слизистой оболочки мочевого пузыря и сопровождается множественныеми нарушениями его физиологии (Andersson, McCloskey, 2014; Kanai et al., 2014; Jhang, Kuo, 2016; Neuhaus et al., 2017). Уротелий и уротелиальные клетки играют важную роль в процессах нормального функционирования мочевого пузыря, включая поддержание его целостности. Являясь высокоэффективным барьером с постоянной проницаемостью, уротелий препятствует проникновению в кровь токсичных веществ мочи, что при ИЦ/СБМП является основным фактором возникновения боли в мочевом пузыре (Слесаревская и др., 2017; Зайцев и др., 2018).
Первостепенное значение для понимания механизмов нормальных и патологических функций мочевого пузыря имеют данные о клеточном составе его слизистой оболочки. Полагают, что клетки, входящие в стенку мочевого пузыря, гетерогенны по своей функциональной значимости (Neuhaus et al., 2017). Хотя уротелию уделяется большое внимание, не менее важным компонентом слизистой оболочки мочевого пузыря является собственная пластинка - Lamina propria (Andersson, McCloskey, 2014; Gabella, 2019). В собственной пластинке, толщина которой в растянутом мочевом пузыре составляет около 50 мкм, присутствуют клетки разных типов, в том числе фибробласты, адипоциты, интерстициальные клетки, афферентные и эфферентные нервные окончания. Предполагается, что собственная пластинка является емкостным слоем мочевого пузыря, определяющим его податливость и возможности увеличения объема (Andersson, McCloskey, 2014; Gabella, 2019). Однако, роль собственной пластинки и ее компонентов в функционировании мочевого пузыря окончательно не установлена. В связи с этим сохраняется актуальность как экспериментальных, так и клинических исследований в данном направлении с использованием гистологического анализа и электронной микроскопии.
Целью исследования было изучение ультраструктурной организации собственной пластинки слизистой оболочки мочевого пузыря в экспериментальных моделях ИЦ/СБМП.
МАТЕРИАЛ И МЕТОДИКА
В работе использовали 22 самки белых новозеландских кроликов массой 1500-2000 г. Животные были разделены на 2 группы. Животным из 1-й группы (n = 15) в стенку мочевого пузыря вводили мочу, взятую из мочевого пузыря животного, животным из 2-й (контрольной) группы (n = 7) в стенку мочевого пузыря вводили 0.9%-ный раствор NaCl.
Кроликам выполняли надлобковый разрез, затем шприцом с иглой 30‑го калибра брали мочу из мочевого пузыря и вводили под слизистый слой мочевого пузыря в объеме 0.5 мл (Sand, 2006; Bayrak et al., 2012). Спустя 7 сут животных умерщвляли с помощью пентобарбитала (дозировка 200 мг/кг), делали трансабдоминальный разрез по средней линии и выполняли цистэктомию. Фрагменты стенки мочевого пузыря были взяты как вблизи места инъекции мочи, так и на противоположной стороне мочевого пузыря. При проведении исследования были соблюдены все применимые международные принципы использования лабораторных животных.
Взятые образцы фиксировали в течение 15 мин в смеси 2.5%-ного раствора глютаральдегида, 2.5%-ного раствора параформальдегида и 0.1%-ного раствора пикриновой кислоты на фосфатном буфере (рН 7.4). На ночь образцы помещали в новую порцию фиксатора. Постфиксацию проводили в растворе 1%-ной четырехокиси осмия и 1.5%-ного феррицианида калия на 0.1 М фосфатном буфере (рН 7.4) в течение 2 ч. После процедуры обезвоживания были приготовлены аралдит-эпоновые блоки, из которых были изготовлены ультратонкие срезы толщиной 50-70 нм с помощью ультрамикротома Leica EM UC7 (Германия). Ультратонкие срезы контрастировали 2%-ным насыщенным водным раствором уранил ацетата, затем - 0.6%-ным раствором цитрата свинца (Serva, Германия) на 0.1 M растворе NaOH. Просмотр ультратонких срезов проводили на электронном микроскопе JEM-1400 (Япония) при ускоряющем напряжении 80-100 кВ. Для получения цифровых изображений использовали боковую цифровую камеру Veleta и программное обеспечение ITEM (Япония, Германия).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Этиология ИЦ/СБМП все еще остается неясной и может включать множество причин. С целью прояснения этого вопроса и лучшего понимания патогенеза ИЦ/СБМП создаются экспериментальные модели данной патологии. Для анализа функций мочевого пузыря, как правило, используются модели, основанные на действии вредных внутрипузырных или системных стимулов на здоровых животных (Birder, Andersson, 2018). Для изучения различных факторов, которые могут иметь отношение к ИЦ/СБМП, обычно используют, по меньшей мере, три различных типа моделей на животных: модели, ориентированные на мочевой пузырь, модели со сложными механизмами и модели психологических и физических стрессоров (естественных заболеваний) (Birder, Andersson, 2018). В настоящем исследовании мы использовали модель ИЦ/СБМП, которая воспроизводит просачивание компонентов мочи через поврежденный уротелий в пластинку мочевого пузыря (Teichman, Moldwin, 2007), что стимулирует воспаление и обусловливает боли в мочевом пузыре.
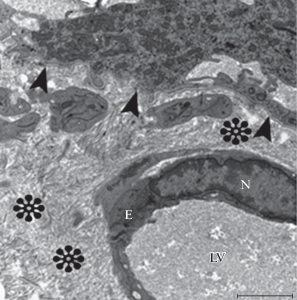
В образцах животных, которым вводили мочу под слизистую основу мочевого пузыря, начиная c собственной пластинки эпителиального покрытия, в расположении пучков коллагеновых волокон наблюдали разрыхления различной степени. По мере приближения к мышечному слою среди отдельных разнонаправленных коллагеновых волокон обнаруживались области мелкогранулярных преципитатов плазменных белков, что является признаком резкого нарушения проницаемости кровеносных сосудов при экспериментальном цистите (рис. 1).
Рис. 1.
Фрагмент собственной пластинки слизистой оболочки мочевого пузыря на 7‑е сут после введения мочи в подслизистую оболочку. Головки стрелок - базальная мембрана, звездочка - место расположения отечной жидкости, E - эндотелиальная клетка, LV - просвет сосуда, N - ядро. Масштабный отрезок - 2 мкм.
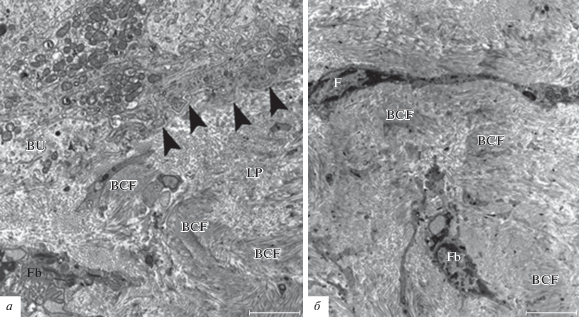
В контрольных образцах на ультраструктурном уровне собственная пластинка слизистой оболочки кролика состоит из плотной неоформленной соединительной ткани с пучками разнонаправленных коллагеновых волокон (рис. 2а, б). Вблизи коллагеновых волокон находятся фибробласты, отвечающие за синтез коллагена и внеклеточного матрикса, которые имеют сплюснутую, веретенообразную форму (рис. 2б). Также выявляются неактивные фибробласты (фиброциты), которые характеризуются небольшим объемом цитоплазмы и уплощенными гетерохроматическими ядрами.
Рис. 2.
Ультраструктурная организация клеток собственной пластинки слизистой оболочки мочевого пузыря на 7‑е сут после введения 0.9%-ного NaCl в стенку мочевого пузыря (контроль). Головки стрелок - базальная мембрана, BU - базальный эпителиоцит, LP - собственная пластинка, BCF - пучки коллагеновых волокон, F - фиброцит, Fb - фибробласт. Масштабная линейка: 2 мкм.
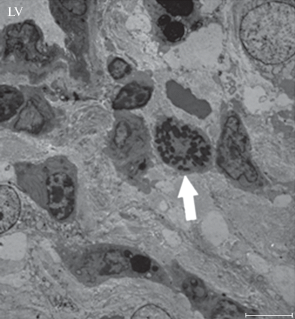
При введении мочи под слизистую основу мочевого пузыря комплекс патоморфологических изменений структурных элементов наблюдали как в собственной пластинке, так и в эпителиальном покрытии слизистой оболочки мочевого пузыря. Обращала на себя внимание периваскулярная инфильтрация клетками воспаления и выраженный отек собственной пластинки слизистой оболочки мочевого пузыря. Наличие в просвете венулярных сосудов в одном поле зрения трех нейтрофилов, одного лимфоцита и многочисленных активированных тромбоцитов (рис. 3) можно расценивать как признак продолжающего воспалительного процесса.
Рис. 3.
Клетки воспаления и отек собственной пластин-ки слизистой оболочки мочевого пузыря у кроликов на 7-е сут после введения мочи в подслизистую оболочку. Звездочка - нейтрофил, треугольник - лимфоцит. Масштабная линейка: 5 мкм.
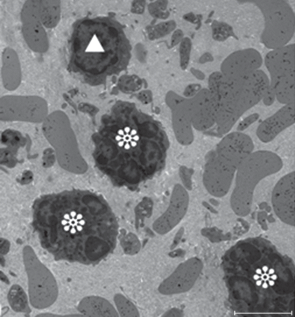
Как можно видеть на рис. 4, в составе собственной пластинки мочевого пузыря вокруг кровеносного сосуда (расположен в верхнем левом углу рисунка) среди активированных фибробластов, пучков коллагеновых волокон и неокрашенных участков, соответствующих месту расположения отечной жидкости, наряду с мононуклеарными клетками (макрофагами, лимфоцитами) присутствуют и полиморфоядерные клетки (нейтрофилы и отдельные эозинофилы).
Рис. 4.
Измененные фибробласты собственной пластинки слизистой оболочки мочевого пузыря кролика на 7‑е сут после введения мочи в подслизистую оболочку. LV - просвет сосуда, стрелка - эозинофил. Масштабная линейка: 5 мкм.
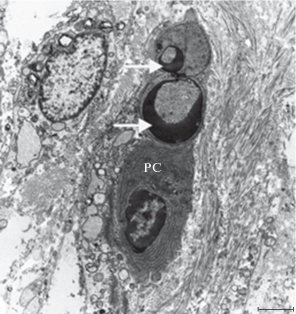
Особо следует отметить наличие многочисленных плазматических клеток, имеющих тесные контакты с макрофагами, фибробластами и лимфоцитами (рис. 5). Наличие в ядрах лимфоцитов в составе собственной пластинки периферически расположенных областей сверхконденсированного гетерохроматина указывает на их апоптотическое состояние (рис 5, стрелки).
Рис. 5.
Плазматические клетки в собственной пластинке слизистой оболочки мочевого пузыря кролика на 7‑е сут после введения мочи в подслизистую оболочку. Стрелка - гетерохроматин, PC - плазматические клетки. Масштабная линейка: 5 мкм.
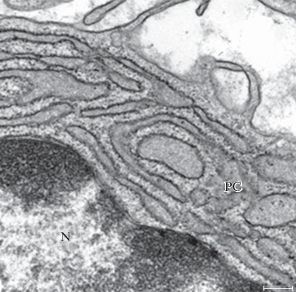
Наличие многочисленных цистерн гранулярного эндоплазматического ретикулума, в просвете которых имеется многочисленное мелкогранулярное содержимое (рис. 6), позволяет предположить, что при введении мочи в собственную пластинку мочевого пузыря имеющиеся здесь плазматические клетки находятся в активном состоянии и продуцируют антитела.
Рис. 6.
Ультраструктурные изменения эндоплазматического ретикулума плазматической клетки в собственной пластинке слизистой оболочки мочевого пузыря кролика на 7‑е сут после введения мочи в подслизистую оболочку. PC - плазматические клетки; N - ядро. Масштабная линейка: 200 нм.
Известно, что уникальная дифференциация клеток уротелия обеспечивает нормальное функционирование стенки мочевого пузыря как барьера проницаемости для мочи и крови у здоровых людей (Lee et al., 2014). Собственная пластинка представляет собой один из трех слоев слизистой оболочки и образована плотной соединительной тканью, которую также называют плотной волокнистой тканью из-за относительно высокого содержания коллагеновых волокон. Нужно отметить, что коллагеновые волокна обладают хорошей прочностью при растяжении и поэтому важны для нормального функционирования мочевого пузыря при его наполнении (Gabella, 2019). В образцах животных из 1-й (экспериментальной) группы коллагеновые волокна были представлены “густо волокнистыми” структурами, морфология которых позволяет предполагать изменение их способности к растяжению. Таким образом, непосредственное воздействие метаболитов мочи проявилось в разрыхлении коллагеновых волокон.
В экспериментальной группе с ИЦ/СБМП отечная жидкость, проникающая в основном через фенестры в периферических частях эндотелиальных клеток капилляров и посткапиллярных венул собственной пластинки слизистой оболочки, нарушает целостность отдельных частей базальной пластинки и распространяется между базальными и промежуточными клеточными слоями эпителиального покрытия мочевого пузыря. У животных с ИЦ/СБМП между отдельными поверхностными уротелиальными клетками обнаруживались узкие щелевидные пространства, которые прослеживались до полости мочевого пузыря. Даже при больших увеличениях электронного микроскопа (от 80 000 до 100 000) ни в апикальных, ни в близлежащих частях латеральных поверхностей поверхностных уротелиоцитов не обнаруживалось точек слипания плазмолеммы - основного признака плотных контактов, которые считаются единственным морфологическим признаком гемато-уринарного барьера (blood-urine barrier).
Основной клеткой в собственной пластинке слизистой оболочки полости мочевого пузыря является фибробласт, который отвечает за выработку и обмен как волокон, так и основного вещества и, таким образом, играет ключевую роль в поддержании целостности тканей. На ультраструктурном уровне фибробласты обладают характеристиками активных синтетических клеток, включая многочисленные митохондрии, обширный гранулярный эндоплазматический ретикулум (который часто растягивается своим содержимым). Их длинные отростки имеют тенденцию располагаться параллельно пучкам коллагеновых волокон (El-Bassouny et al., 2014; Kim, 2018; Gabella, 2019), и, согласно нашим результатам, данная тенденция сохраняется в образцах кроликов экспериментальной группы.
Механические, тепловые или химические сигналы в моче могут активировать клетки уротелия. Под уротелием расположена обширная сосудистая сеть, которая, вероятно, является источником медиаторов, способных влиять на выживание клеток и передачу сигналов (Winder et al., 2014; Захарова и др., 2018).
В целом, слизистая оболочка мочевого пузыря, несомненно, играет ключевую роль в сложной коммуникации слизистой оболочки при ИЦ/СБМП. Изменения организации слизистой оболочки в целом и ее собственной пластинки, выявляемые на ультраструктурном уровне после введения мочи под слизистую оболочку мочевого пузыря, у белых новозеландских кроликов указывают на развитие острого воспалительного процесса, который продолжается не менее 7 сут после действия повреждающего фактора. Наличие в составе воспалительного инфильтрата, наряду с нейтрофилами и макрофагами, лимфоцитов и плазматических клеток можно рассматривать как морфологические признаки, свидетельствующие о вовлечении в воспалительный процесс механизмов как врожденного, так и приобретенного иммунитета. Для дальнейшего определения функциональной значимости субпопуляций клеток собственной пластинки и их межклеточных взаимодействий необходимы дальнейшие исследования на ультраструктурном уровне.
Список литературы
Зайцев А.В., Шаров М.Н., Арефьева О.А., Пушкарь Д.Ю. 2018. Синдром болезненного мочевого пузыря/интерстициальный цистит: факторы прогноза клинического течения заболевания. Вестник урологии. Т. 6. № 3. С. 26. (Zaitsev A.V., Sharov M.N., Arefieva O.A., Pushkar D.Yu. 2018. Interstitial Cystitis/Bladder Pain Syndrome: factors predicting the clinical course of the disease. Urology Herald. (Vestnik urologii). V. 6. № 3. P. 26). https://doi.org/10.21886/2308-6424-2018-6-3-26-35
Захарова И.Н., Османов И.М., Касьянова А.Н., Мумладзе Э.Б., Мачнева Е.Б., Лупан И.Н. 2018. Протективные факторы слизистой оболочки мочевого пузыря - ключ к новым подходам к терапии инфекции мочевых путей. Рос. вестн. перинатол. и педиатрии. Т. 63. № 2. С. 16. (Zaharova I.N., Osmanov I.M., Kas’janova A.N., Mumladze J.B., Machneva E.B., Lupan I.N. 2018. Protective factors of the mucous membrane of the bladder are the key to new approaches to the treatment of urinary tract infections. Russ. Bull. Perinatol. and Pediatrics. V. 63. № 2. P. 16.)
Слесаревская М.Н., Игнашов Ю.А., Кузьмин И.В. 2017. Современные подходы к диагностике синдрома болезненного мочевого пузыря. Урологические ведомости. Т. 7. № 2. С. 25. (Slesarevskaya M.N., Ignashov Yu.A., Kuzmin I.V. 2017. Current approaches to the diagnostic of bladder pain syndrome. Urological statements. V. 7. № 2. P. 25). https://doi.org/10.17816/uroved7225-30
Andersson K.E., McCloskey K.D. 2014. Lamina propria: the functional center of the bladder? Neurourol. Urodyn. V. 33. P. 9. https://doi.org/10.1002/nau.22465
Bayrak O., Seckiner I., Solakhan M., Karakok M., Erturhan S.M., Yagci F. 2012. Effects of intravesical dexpanthenol use on lipid peroxidation and bladder histology in a chemical cystitis animal model. Urology. V. 79. P. 1023. https://doi.org/10.1016/j.urology.2012.01.025
Birder L., Andersson K.-E. 2018. Animal modelling of interstitial cystitis/bladder pain syndrome. Int. Neurourol. J. V. 22. Suppl. 1. P. S3. https://doi.org/10.5213/inj.1835062.531
El-Bassouny D.R., Abdel L., Hoda A. 2014. Ultrastructural study of the mucosal layer of the adult albino rat ureter. The Egyptian Journal of Histology. V. 37. № 2. P. 316. https://doi.org/10.1097/01.EHX.0000446583.73701.52
Gabella G. 2019. Lamina propria: The connective tissue of rat urinary bladder mucosa. Neuroulogy and Urodynamics. V. 38. № 8. P. 2093. https://doi.org/10.1002/nau.24085
Jhang J.-F., Kuo H.-C. 2016. Pathomechanism of interstitial cystitis/bladder pain syndrome and mapping the heterogeneity of disease. Int. Neurourol. J. V. 20. Suppl. 2. P. S95. https://doi.org/10.5213/inj.1632712.356
Kanai A., Fry C., Hanna-Mitchell A., Birder L., Zabbarova I., Bijos D., Ikeda Y. 2014. Do we understand any more about bladder interstitial cells? ICI-RS 2013. Neurourol. Urodyn. V. 33. P. 573. https://doi.org/10.1002/nau.22591
Kim D.S. 2018. Potential mechanisms underlying the increased excitability of the bladder afferent pathways in interstitial cystitis/bladder pain syndrome. Urogenit. Tract Infect. V. 13. № 2. P. 26. https://doi.org/10.14777/uti.2018.13.2.26
Lee G., Romih R., Zupančič D. 2014. Cystitis: From urothelial cell biology to clinical applications. BioMed. Res. Int. V. 2014 : 473536. https://doi.org/10.1155/2014/473536
Neuhaus J., Schröppel B., Dass M., Zimmermann H., Wolburg H., Fallier-Becker P., Gevaert T., Burkhardt C.J., Do H.M., Stolzenburg J.U. 2018. 3D-electron microscopic characterization of interstitial cells in the human bladder upper lamina propria. Neurourol. Urodyn. V. 379. P. 89. https://doi.org/10.1002/nau.23270
Sand P.K. 2006. Proposed pathogenesis of painful bladder syndrome/interstitial cystitis. J. Reprod. Med. V. 51. Suppl. 3. P. 234.
eichman J.M., Moldwin R. 2007. The role of the bladder surface in interstitial cystitis/painful bladder syndrome. Can. J. Urol. V. 14. P. 35 997
Winder M., Tobin G., Zupancic D., Romih R. 2014. Signalling molecules in the urothelium. Biomed. Res. Int. V. 2014: 297295. https://doi.org/10.1155/2014/297295
Дополнительные материалы отсутствуют.


