Цитология, 2020, T. 62, № 9, стр. 654-661
Транскрипционный фактор HIF1 негативно регулирует содержание глюкозо-6-фосфатдегидрогеназы в клетках HEK293T
О. В. Ветровой 1, 2, *, П. П. Нимирицкий 3, Е. И. Тюлькова 1, Е. А. Рыбникова 1
1 Институт физиологии им. И.П. Павлова РАН
199034 Санкт-Петербург, Россия
2 Кафедра биохимии, Биологический факультет, Санкт-Петербургский государственный университет
199034 Санкт-Петербург, Россия
3 Институт регенеративной медицины, Медицинский научно-образовательного центр,
Московский государственный университет им. М.В. Ломоносова
119192 Москва, Россия
* E-mail: vov210292@yandex.ru
Поступила в редакцию 18.05.2020
После доработки 29.05.2020
Принята к публикации 01.06.2020
Аннотация
Выявление новых мишеней регуляции индуцируемого гипоксией транскрипционного фактора HIF1 является актуальной задачей клеточной и молекулярной биологии. С использованием индуктора накопления HIF1 хлорида кобальта (CoCl2) и блокатора его трансляции топотекана проверяли ранее описанный на мозге крысы феномен супрессии ключевого фермента пентозофосфатного пути глюкозо-6-фосфатдегидрогеназы (Г6ФДГ) транскрипционным фактором HIF1. На первичной культуре фибробластов кожи крысы были определены нетоксические дозы CoCl2 (50 и 100 мкМ) и топотекана (0.2 и 1 мкМ). На линии клеток эмбриональной почки человека HEK293T (Human Embryonic Kidney 293T) исследовали взаимосвязь между накоплением HIF1α и содержанием Г6ФДГ методами вестерн блоттинг и дот-иммуноферментного анализа. Для проверки взаимосвязи между зависящим от дозы CoCl2 и топотекана изменением содержания HIF1α и HIF1-зависимой экспрессии клетки HEK293T трансфицировали вектором, содержащим ген люциферазы под контролем HIF1-зависимого промотора (HRE), и определяли ее активность хемилюминесцентным методом. Было установлено, что CoCl2 дозозависимо повышает содержание HIF1α и увеличивает люциферазную активность, способствуя уменьшению количества Г6ФДГ. Топотекан, напротив, снижает накопление HIF1α, что сопровождается уменьшением активности люциферазы и нормализацией содержания Г6ФДГ. Результаты подтверждают наличие супрессирующего действия транскрипционного фактора HIF1 на содержание первого фермента пентозофосфатного пути в клетках человека.
Индуцируемый гипоксией фактор-1 (HIF1) является одним из ключевых регуляторов адаптации к гипоксическим условиям. HIF1 – транскрипционный фактор, представляющий собой гетеродимер белков HIF1α и HIF1β, имеющих ДНК связывающий домен, центральный PAS (Per-ARNT-Sim) домен, обеспечивающий гетеродимеризацию, а также N- и С-терминальные трансактиваторные домены, опосредующие запуск транскрипции (Semenza, 2001; Dengler et al., 2014). HIF1α накапливается в условиях гипоксии, тогда как HIF1β экспрессируется конститутивно. В присутствии кислорода HIF1α гидроксилируется пролилгидроксилазой, убиквитинилируется и подвергается протеасомной деградации (Смирнова и др., 2012). В условиях гипоксии в связи с отсутствием окислителя пролилгидроксилаза не функционирует, вследствие чего убиквитинлигаза VHL (Von Hippel–Lindau) не распознает HIF1α, что приводит к его накоплению, димеризации с HIF1β и транслокации в ядро. В ядре гетеродимер HIF1 связывается с гипоксия-респонсивными элементами (HRE) промоторов, активируя транскрипцию генов-мишеней, в том числе фактора роста эндотелия сосудов (VEGF), транспортера глюкозы-1 (GLUT1), ферментов гликолиза, лактатдегидрогеназы, цитокина эритропоэтина и многих других генов, необходимых для обеспечения комплексной программы адаптации к хронической гипоксии (Chavez et al., 2000; Semenza, 2001; Kim et al., 2006; Guo et al., 2008; Dengler et al., 2014; Sheldon et al., 2014; Lukyanova, Kirova, 2015). В настоящее время очевидно, что пути регуляции работы HIF1 намного сложней и разнообразней. В частности, помимо пролилгидроксилазного есть еще аспарагингидроксилазный путь ингибирования транскрипционной активности HIF1 (Giaccia et al., 2003; Kaspe et al., 2006).
Несмотря на очевидность исключительной значимости HIF1 в обеспечении адаптации клеток к отклонению уровня кислорода от оптимального, также накапливаются данные и о неблагоприятных эффектах этого белка в тех случаях, когда HIF1-зависимая адаптивная программа включается в неподходящих условиях (Meijer et al., 2012). В частности, рядом исследователей постинсультной патологии было показано, что транскрипционный фактор HIF1, продолжая реализовать свою программу в условиях реоксигенации, оказывает ряд повреждающих эффектов на мозг, таких как нарушение целостности гемато-энцефалического барьера (Sun et al., 2017), отек мозга и гибель клеток (Chen et al., 2009).
Как известно, для обеспечения эффективной работы систем антиоксидантной защиты и поддержания окислительно-восстановительного статуса клетки необходим НАДФН, а в мозге его ключевым источником является пентозофосфатный путь метаболизма глюкозы (Fernandez-Fernandez et al., 2012). В предыдущих исследованиях с использованием модели повреждающей гипоксии на крысах нами было показано, что отсроченное повреждение мозга в период реоксигенации опосредуется HIF1-зависимым уменьшением количества мРНК, белковой формы и активности глюкозо-6-фосфатдегидрогеназы (Г6ФДГ), фермента, лимитирующего скорость пентозофосфатного пути метаболизма глюкозы (Vetrovoy et al., 2020). Настоящее исследование in vitro с использованием первичной культуры фибробластов кожи крысы и иммортализованной линии клеток эмбриональной почки человека HEK293T посвящено проверке гипотезы об отсутствии тканевой специфичности данного механизма и его функционирования в клетках человека.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные культуры и линии. В работе использовали клетки перевиваемой иммортализованной ли-нии клеток эмбриональной почки человека HEK-293T, полученные из коллекции “Линии клеток человека и животных” банка-депозитария живых систем МГУ им. М.В. Ломоносова “Ноев Ковчег” (ID коллекции MSU_HEK293), а также первичную культуру фибробластов кожи крысы.
Выделение дермальных фибробластов крысы. Для выделения фибробластов кожи в стерильных условиях ламинарного бокса кожный лоскут измельчали ножницами на кусочки площадью не более 0.25 см2, после чего материал помещали в стерильную пробирку, содержащую смесь ферментов коллагеназы I типа (300 ед/мл, Worthington, США) и диспазы (30 ед./мл, Corning, США) и инкубировали в течение 60 мин при 37°С при периодическом интенсивном встряхивании. После завершения инкубации к полученной смеси добавляли равный объем полной среды роста DMEM (Gibco, США) с 10% фетальной сыворотки (Fetal Bovine Serum; Gibco, США) для инактивации ферментов, после чего центрифугировали при 200 g в течение 10 мин. Супернатант удаляли. Осадок ресуспендировали в полной среде роста и переносили в чашку Петри подходящего диаметра. На следующий день среду роста меняли на свежую. Клетки культивировали в условиях CO2 инкубатора при 37°С и 5% СО2 в полной среде роста.
Культивирование клеточных культур и линий. Все клетки культивировали в условиях CO2 инкубатора при 37°С и 5% СО2 в пластиковых чашках Петри в полной среде роста DMEM (Gibco, США) с 10% фетальной сыворотки (Fetal Bovine Serum; Gibco, США). При достижении 80–90% конфлюэнтности монослоя клетки пассировали. Для открепления клеток с культурального пластика ростовую среду удаляли, после чего промывали раствором Версена. Затем раствор Версена отбирали и добавляли 0.05%-ный раствор трипсина-ЭДТА (Gibco, США) и инкубировали в СО2-инкубаторе в течение 3–5 мин. При приобретении клетками округлой формы и откреплении их от пластика, клетки суспендировали, полученную суспензию переносили в стерильную пробирку и центрифугировали при 200 g 5 мин. Супернатант удаляли, осадок ресуспендировали в полной среде роста и рассаживали в соотношении 1 : 4.
Моделирование индукции и супрессии накопления фактора HIF1. Предварительное определение нетоксических концентраций CoCl2 (активатора накопления транскрипционного фактора HIF1) и топотекана (блокатора накопления HIF1) проводили на клетках первичной культуры фибробластов. CoCl2 добавляли в полную среду роста в концентрациях 0, 25, 50, 100, 200, 400 мкМ вместе с топотеканом или без него. Топотекан добавляли в полную среду роста в концентрациях 0, 0.2, 1, 5 мкМ вместе с CoCl2 или без него. Клетки первичной культуры фибробластов, культивируемые в таких условиях в течение 24 ч, фотографировали с помощью инвертированного микроскопа Leica DMi8 (Leica, Германия), оснащенного объективом HC PL FLUOTAR 10×/0.32 PH1 (Leica, Германия) и камерой Leica DFC 7000 T (Leica, Германия), с использованием фазового контрастирования для регистрации общей морфологии культуры клеток. По сохранности морфологии делали вывод о допустимом (нетоксичном) диапазоне концентраций.
Выбранные по результатам предварительного эксперимента на клетках первичной культуры фибробластов нетоксические концентрации CoCl2 (0, 50, 100 мкМ) и топотекана (0, 0.2, 1 мкМ) были также проверены на токсичность на культуре клеток HEK293T. Клетки HEK293T культивировали в течение 12 ч, после чего также фотографировали с помощью инвертированного микроскопа (фазовый контраст). Эти же концентрации CoCl2 и топотекана были использованы для анализа HIF1-зависимой экспрессии и определения содержания HIF1α и Г6ФДГ.
Репортерные плазмидные векторы для оценки HIF1-зависимой экспрессии. Для определения HIF1-зависимой экспрессии использовали плазмидные векторы из набора Dual Luciferase Reporter Assay System (Promega, США), созданные на основе вектора для экспрессии в эукариотических клетках pGL3. В качестве репортерного вектора для оценки HIF1-зависимой экспрессии использовали вектор, включающий кодирующую последовательность гена люциферазы светлячка Photinus pyralis с сайтом связывания HIF1 в виде 6-ти повторов гипоксия-чувствительного элемента (HRE) в промоторной области (конструкция pHRE-LUСPP). Для контроля трансфекции и нормализации использовали векторы с генами GFP и люциферазы морского полипа Renilla reniformis под контролем конститутивного CMV-промотора (конструкция pCMV-GFP и pCMV-LUCRR).
Трансфекция HEK293T кальций-фосфатным методом. Трансфекцию клеток HEK293T проводили на 6-луночном планшете при достижении ими 80–90% конфлюэнтного монослоя. Для этого 2 мкг смеси плазмидной ДНК (2 мкг pCMV-GFP в точках контроля трансфекции или 1.9 мкг pHRE-LUСPP и 0.1 мкг pCMV-LUCRR в экспериментальных точках) смешивали с раствором 0.3 М CaCl2 и по каплям добавляли к двукратному буферу HBS (pH 7.1), состоящему из 280 мМ NaCl, 50 мМ HEPES, 1.5 мМ Na2HPO4. После этого полученную смесь инкубировали 1 мин и по каплям добавляли к среде роста. Через 16 ч клетки отмывали, помещали в свежую полную среду роста, затем для контроля качества трансфекции по сигналу GFP фотографировали с помощью системы визуализации клеток FLoid™ Cell Imaging Station, (Thermo Scientific, США) с использованием флуоресцентной микроскопии. Далее производили моделирование индукции накопления фактора HIF1 в течение 12 ч, как описано выше.
Определение активности люцифераз с использованием специфических субстратов. Для определения активности люцифераз в лизатах клеток HEK293T, трансфицированных репортерными конструкциями, использовали набор Dual Luciferase Reporter Detection (Promega, США), все процедуры проводили согласно инструкции производителя. При этом в лизатах клеток сначала измеряли активность люциферазы светлячка, которая пропорциональна транкскрипционной активности HIF1, а затем – активность люциферазы Renilla reniformis, продукция которой была конституивной и зависела от количества клеток. Оба сигнала регистрировали на люминесцентном ридере Wallac EnVision 2104 (Perkin Elmer, Германия) в течение 3–10 с после начала реакции со временем экспозиции от 2 до 5 с в зависимости от интенсивности сигнала. Полученные данные использовали для оценки активности HIF1, нормированной на число клеток. Данное измерение проводили для контроля наличия взаимосвязи между изменением количества HIF1α под действием CoCl2 и топотекана и активностью HIF1 в качестве транскрипционного фактора. Поэтому оно выполнено в 2 технических повторностях, и результат не может быть обработан статистически.
Определение содержания белков HIF1α и Г6ФДГ методами вестерн блоттинг и дот-иммуноферментного анализа. Клетки линии HEK293T были высажены на 24-луночный планшет и после достижения ими конфлюэнтного состояния подвергнуты моделированию гипоксической индукции накопления фактора HIF1α в течение 12 ч. После этого культуры были лизированы в буфере Laemmli.
Белки детектировали методом вестерн блоттинг: разделяли методом электрофореза в полиакриламидном геле по Laemmli и осуществляли электроперенос на нитроцеллюлозную мембрану (Bio-Rad, США). Далее, после блокировки в течение 1 ч в 5%-ном молоке, мембраны инкубировали с кроличьими антителами против HIF1α (1 : 1000, ab2185, Abcam, США), Г6ФДГ (1 : 2000, ab993, Abcam, США) и β-актина (1 : 2000, a9044, Sigma Ald., США) в течение ночи при 4°C. Мембраны отмывали в TBST буфере и инкубировали с противокроличьими HRP-антителами (1 : 10 000, a16096, Thermo Scientific, США) в течение 1.5 часов при комнатной температуре. Визуализацию белков интереса осуществляли с применением Clarity Max ECL хемилюминесцентного набора (Bio-Rad, США), используя систему документирования ChemiDoc MP Imaging System (Bio-Rad, США). Количественный анализ белков интереса проводили с использованием программы ImageJ (NIH, Bethesda, MD, США) нормируя данные на β-actin. Для каждого типа проб количество биологических повторностей равно 3.
Также количественный анализ белков интереса осуществляли методом дот-иммуноферментного анализа (дот-ИФА): раскапывали пробы по 1 мкл в двух параллелях на нитроцеллюлозную мембрану, высушивали и осуществляли иммунодетекцию по вышеописанному протоколу. Визуализацию белков интереса осуществляли с применением NovaRed набора (Vector-Labs, США). Количественный анализ белков интереса проводили с использованием программы ImageJ (NIH, Bethesda, MD, США) нормируя данные на общий белок, измеренный с использованием красителя Amido Black (Sigma Ald., США). Для проб клеток, содержавшихся в 100 мкМ CoCl2 без топотекана и с топотеканом в концентрациях 0.2 и 1 мкМ количество биологических повторностей равно 5. Для остальных типов проб количество биологических повторностей равно 4.
Статистическая обработка результатов. Результаты обрабатывали с помощью пакетов анализа данных STATISTICA 7.0 Stat Soft, Inc и Microsoft Excel’2003. Оценку статистической значимости проводили с использованием непараметрического теста Манн−Уитни (Mann−Whitney U-test). Различия между группами считали достоверными при p ≤ 0.05. В качестве post-hoc процедуры использовали Данн тест (Dunn’s test) для множественных выборок при уровне значимости α = 0.05.
Все результаты представлены в виде среднего арифметического ± SEM (standard error of the mean).
РЕЗУЛЬТАТЫ
С целью определения оптимальных нетоксических концентраций CoCl2, являющегося активатором накопления HIF1α, и блокатора трансляции HIF1α топотекана был проведен предварительный эксперимент на культуре фибробластов крысы. На рис. 1 представлены микрофотографии, демонстрирующие отсутствие токсического эффекта CoCl2 в диапазоне концентраций от 0 до 100 мкМ при воздействии на протяжении 24 ч. Топотекан не оказывал повреждающего эффекта на фибробласты в данном временном диапазоне при концентрациях от 0 до 1 мкМ.
Рис. 1.
Фибробласты крысы, культивируемые 24 ч в присутствии индуктора HIF1, CoCl2 (0, 25, 50, 100, 200, 400 мкМ) и блокатора HIF1, топотекана (0, 0.2, 1, 5 мкМ). Фазовый контраст, об. 10×. Красными рамками выделены концентрации фармакологических агентов, используемые в экспериментах на клетках HEK293T.

На основании этих результатов при переходе на клетки человека HEK293T были выбраны концентрации CoCl2 0, 50 и 100 мкМ и топотекана 0, 0.2 и 1 мкМ. На рис. 2 представлены микрофотографии, подтверждающие отсутствие токсического эффекта выбранных концентраций CoCl2 и топотекана при воздействии на клетки HEK293T на протяжении 12 ч.
Рис. 2.
Клетки HEK293T, культивируемые 12 ч в присутствии индуктора HIF1, CoCl2 (0, 50, 100 мкМ) и блокатора HIF1, топотекана (0, 0.2, 1 мкМ). Фазовый контраст, об. 10×.

Для оценки HIF1-зависимой экспрессии произвели трансфекцию клеток HEK293T люциферазным вектором под HIF1-зависимым промотором (эффективность трансфекции проверена с использованием плазмиды, содержащей ген GFP (рис. 3б)). Интенсивность HIF1-зависимой экспрессии в этой модели в присутствии CoCl2 и топотекана, визуализированная хемилюминесцентным методом, представлена на рис. 3а. Было выявлено, что CoCl2 в концентрации 50 мкМ вызывает увеличение люциферазной активности до 180% от контроля, а CoCl2 в концентрации 100 мкМ – до 190%. В отсутствии CoCl2 топотекан в концентрации 0.2 мкМ не оказывал влияния на HIF1-зависимую экспрессию (96% от контроля), однако в присутствии CoCl2 в концентрациях 50 мкМ и 100 мкМ ослаблял ее до 105 и 150% от контроля соответственно. Топотекан в концентрации 1 мкМ, снижал экспрессию с HIF1-зависимого промотора как в отсутствии (60% от контроля), так и в присутствии CoCl2 (60 и 50% от контроля для CoCl2 в концентрации 50 и 100 мкМ соответственно).
Рис. 3.
Результаты эксперимента на культурах клеток HEK293T, трансфицированных плазмидой, содержащей ген люциферазы под контролем HIF1-зависимого промотора (pHRE-LUСPP) и нормировочной люциферазы морского полипа Renilla reniformis под контролем конститутивного CMV-промотора (pCMV-LUCRR). а – Влияние индуктора HIF1, CoCl2 (0, 50, 100 мкМ) и блокатора HIF1, топотекана (0, 0.2, 1 мкМ) на HIF1-зависимою экспрессию. Результаты выражены в усл. ед. интенсивности хемилюминесценции (ХЛ; LUСPP/LUCRR). б – Микрофотографии культуры клеток HEK293T, трансфицированных плазмидой, содержащей pHRE-LUСPP и pCMV-LUCRR, либо плазмидой, содержащей ген GFP (pCMV-GFP) для контроля эффективности трансфекции. Флуоресцентная микроскопия, об.: 10×.
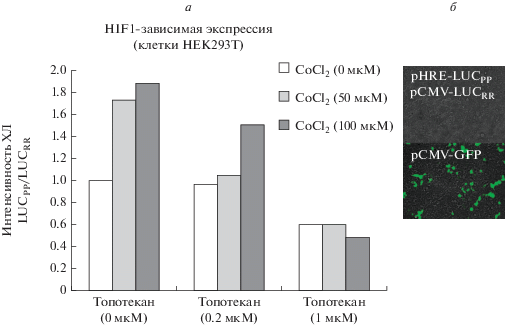
Таким образом, мы получили ряд проб, отличающихся между собой по эффективности HIF1-зависимой экспрессии, как в сторону увеличения, так и в сторону уменьшения.
При анализе содержания регулируемой кислородом субъединицы данного фактора (HIF1α) методами вестерн блоттинг (рис. 4а, б) и дот-ИФА (рис. 4г, д) было получено подтверждение причины выявленных ранее изменений экспрессии с HIF1-зависимого промотора. На рис. 4 (б, д) представлены результаты количественного анализа, указывающие на тот факт, что накопление белка HIF1α находится в прямой зависимости от дозы CoCl2 и в обратной зависимости от дозы топотекана.
Рис. 4.
Содержание белков HIF1α (а, б, г, д) и Г6ФДГ (а, в, г, е) по результатам вестерн блоттинга (а–в) и дот-иммуноферментного анализа (г–е) в клетках HEK293T в присутствии индуктора HIF1, CoCl2 (0, 50, 100 мкМ) и блокатора HIF1, топотекана (0, 0.2, 1 мкМ). ж – графическое представление результата исследования: HIF1 является негативным регулятором экспрессии Г6ФДГ. *Статистически достоверные отличия от группы Топотекан (0 мкМ), CoCl2 (0 мкМ) (р ≤ 0.05, a = 0.05), # – статистически достоверные отличия от группы Топотекан (0 мкМ), CoCl2 (50 мкМ) (р ≤ 0.05, a = 0.05), $ – статистически достоверные отличия от группы Топотекан (0.2 мкМ), CoCl2 (0 мкМ) (р ≤ 0.05, a = 0.05).
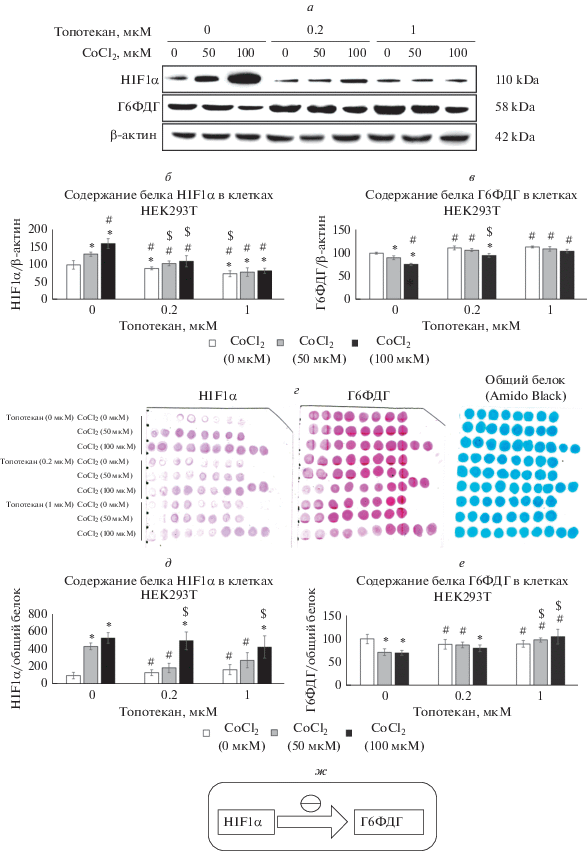
Исследование содержания Г6ФДГ методами вестерн блоттинг (рис. 4а, в) и дот-ИФА (рис. 4г, е) показало, что содержание этого белка находится в обратной зависимости от содержания и HIF1 и эффективности HIF1-зависимой экспрессии. Так, в условиях максимального количества HIF1α, в присутствии CoCl2 в концентрации 100 мкМ и в отсутствии топотекана, количество Г6ФДГ было минимально и составляло 75% (рис. 4в) и 70% (рис. 4е) от контроля при детекции методами вестерн блоттинг и дот-ИФА соответственно. В отсутствии CoCl2 топотекан в концентрациях 0.2 и 1 мкМ не влиял на количество Г6ФДГ. Уменьшение количества Г6ФДГ при добавлении CoCl2 в концентрации 50 мкМ эффективно предотвращалось топотеканом в концентрации 0.2 и 1 мкМ. Топотекан в концентрации 1 мкМ (но не 0.2 мкМ) предотвращал уменьшение количества Г6ФДГ в присутствии 100 мкМ CoCl2.
ОБСУЖДЕНИЕ
Пентозофосфатный путь метаболизма глюкозы, являясь основным источником восстановленного НАДФ, выполняет роль ключевого регулятора антиоксидантных систем и обеспечения нормального окислительно-восстановительного статуса клеток (Fernandez-Fernandez et al., 2012), а также путей детоксикации ксенобиотиков (Spencer, Stanton, 2017). Снижение эффективности пентозофосфатного пути опосредует широкий спектр неблагоприятных состояний (Tang, 2019), таких как нарушение работы оксидаз со смешанной функцией (Stincone et al., 2014), снижение эффективности синтеза стероидных гормонов (Dhur et al., 1989), уменьшение скорости восстановления тиоредоксинов и глутатиона (Fernandez-Fernandez et al., 2012), что отражается как в дефекте отдельных функций клетки, так и в нарушении интегративной регуляции всего организма. Ранее нами было показано, что патогенез постгипоксической реоксигенации в мозге крыс во многом определяется снижением эффективности пентозофосфатного пути. В то же время ингибирование транскрипционного фактора HIF1 предотвращало нарушение работы этого пути метаболизма, что сопровождалось предотвращением состояния окислительного стресса и апоптотических процессов (Vetrovoy et al., 2020).
В настоящем исследовании нами было показано, что негативная регуляция экспрессии ключевого фермента пентозофосфатного пути метаболизма глюкозы Г6ФДГ транскрипционным фактором HIF1 (рис. 4ж) является механизмом, характерным не только для нейрональных клеток крысы, но и, как минимум, для клеток почки человека. Подобное перепрограммирование метаболизма ввиду роли пентозофосфатного пути, как источника НАДФН, в процессах антиоксидантной защиты и анаболизме, является важной гомеостатической реакцией при адаптации к продолжительной тканевой гипоксии, когда существует необходимость увеличения эффективности катаболизма. Однако в условиях отсутствия кислородного дефицита, таких как различные железодефицитные состояния (Dhur et al., 1989) или при быстрой реоксигенации после ишемии (Vetrovoy et al., 2020), например, при краткосрочной тяжелой гипоксии, постинсультных состояниях, супрессия пентозофосфатного пути может оказаться серьезным патогенетическим фактором. Соответственно возможность его фармакологической (Hwang et al., 2018) или немедикаментозной (Ветровой и др., 2017; Vetrovoy et al., 2019) активации так же, как и применение заместительной терапии (Li et al., 2015), представляет собой потенциальную терапевтическую стратегию для коррекции подобных нарушений метаболизма.
Список литературы
Ветровой О.В., Рыбникова Е.А., Самойлов М.О. 2017. Церебральные механизмы гипоксического/ишемического прекондиционирования. Биохимия. Т. 82. № 3. С. 542. (Vetrovoy O.V., Rybnikova E.F., Samoilov M.O. 2017. Cerebral mechanisms of hypoxic/ischemic postconditioning. Biochemistry (Moscow). V. 82. № 3. P. 392. )https://doi.org/10.1134/S000629791703018X
Смирнова Н.А., Хушпульян Д.М., Спир Р.Е., Гайсина И.Н., Ратан Р.Р., Газарян И.Г. 2012. Каталитический механизм и субстратная специфичность HIF пролилгидроксилаз. Биохимия. Т. 77. № 10. С. 1337. (Smirnova N.A., Hushpulian D.M., Speer R.E., Gaisina I.N., Ratan R.R., Gazaryan I.G. 2012. Catalytic mechanism and substrate specificity of HIF prolyl hydroxylases. Biochemistry (Moscow). V. 77. P. 1108. )https://doi.org/10.1134/S0006297912100033
Chavez J., Agani F., Pichiule P., LaManna J. 2000. Expression of hypoxia-inducible factor-1alpha in the brain of rats during chronic hypoxia. J. Appl. Physiol. V. 89. P. 1937. https://doi.org/10.1152/jappl.2000.89.5.1937
Chen C., Hu Q., Yan J., Yang X., Shi X., Lei J., Chen L., Huang H., Han J., Zhang J., Zhou C. 2009. Early inhibition of HIF-1alpha with small interfering RNA reduces ischemic-reperfused brain injury in rats. Neurobiol. Dis. V. 33. P. 509. https://doi.org/10.1016/j.nbd.2008.12.010
Dengler V., Galbraith M., Espinosa J. 2014. Transcriptional regulation by hypoxia inducible factors. Crit. Rev. Biochem. Mol. Biol. V. 49. P. 1. https://doi.org/10.3109/10409238.2013.838205
Dhur A., Galan P., Hercberg S. 1989. Effects of different degrees of iron deficiency on cytochrome P450 complex and pentose phosphate pathway dehydrogenases in the rat. J. Nutr. V. 119. P. 40. https://doi.org/10.1093/jn/119.1.40
Fernandez-Fernandez S., Almeida A., Bolaños J. 2012. Antioxidant and bioenergetic coupling between neurons and astrocytes. Biochem. J. V. 443. P. 3. https://doi.org/10.1042/BJ20111943
Hwang S., Mruk K., Rahighi S., Raub A.G., Chen C.H., Dorn L.E., Mochly-Rosen D. 2018. Correcting glucose-6-phosphate dehydrogenase deficiency with a small-molecule activator. Nat. Commun. V. 9. P. 1. https://doi.org/10.1038/s41467-018-06447-z
Giaccia A., Siim B., Johnson R. 2003. HIF-1 as a target for drug development. Nat. Rev. Drug Discovery. V. 10. P. 803. https://doi.org/10.1038/nrd1199
Guo S., Bragina O., Xu Y., Cao Z., Chen H., Zhou B., Morgan M., Lin Y., Jiang B., Liu K., Shi H. 2008. Glucose up-regulates HIF-1 alpha expression in primary cortical neurons in response to hypoxia through maintaining cellular redox status. J. Neurochem. V. 105. P. 1849. https://doi.org/10.1111/j.1471-4159.2008.05287.x
Kaspe L., Fukuyama T., Biesen M., Boussouar F., Tong C., de Pauw A., Murray P., van Deursen J., Brindle P. 2006. Conditional knockout mice reveal distinct functions for the global transcriptional coactivators CBP and p300 in T-cell development. Mol. Cell. Biol. V. 26. P. 789. https://doi.org/10.1128/MCB.26.3.789-809.2006
Kim J., Tchernyshyov I., Semenza G., Dang, C. 2006. HIF-1-mediated expression of pyruvate dehydrogenase kinase: a metabolic switch required for cellular adaptation to hypoxia. Cell Metab. V. 3. P. 177. https://doi.org/10.1016/j.cmet.2006.02.002
Li M., Zhou Z.P., Sun M., Cao L., Chen J., Qin Y.Y., Qin Z.H. 2015. Reduced nicotinamide adenine dinucleotide phosphate, a pentose phosphate pathway product, might be a novel drug candidate for ischemic stroke. Stroke. V. 47. P. 187. https://doi.org/10.1161/STROKEAHA.115.009687
Lukyanova L., Kirova Y. 2015. Mitochondria-controlled signaling mechanisms of brain protection in hypoxia. Front. Neurosci. V. 9. P. 320. https://doi.org/10.3389/fnins.2015.00320
Meijer T., Kaanders J., Span P., Bussink J. 2012. Targeting hypoxia, HIF-1, and tumor glucose metabolism to improve radiotherapy efficacy. Clin. Cancer Res. V. 18. P. 5585. https://doi.org/10.1158/1078-0432.CCR-12-0858
Semenza G. 2001. Hypoxia-inducible factor 1: oxygen homeostasis and disease pathophysiology. Trends Mol. Med. V. 7. P. 345. https://doi.org/10.1016/s1471-4914(01)02090-1
Sheldon R., Lee C., Jiang X., Knox R., Ferriero D. 2014 Hypoxic preconditioning protection is eliminated in HIF-1α knockout mice subjected to neonatal hypoxia-ischemia. Pediatr. Res. V. 76. P. 46. https://doi.org/10.1038/pr.2014.53
Spencer N.Y., Stanton R.C. 2017. Glucose 6-phosphate dehydrogenase and the kidney. Curr. Opin. Nephrol. Hypertens. V. 26. P. 43. https://doi.org/10.1097/MNH.0000000000000294
Stincone A., Prigione A., Cramer T., Wamelink M.M., Campbell K., Cheung E., Ralser M. 2014. The return of metabolism: biochemistry and physiology of the pentose phosphate pathway. Biol. Rev. Cambridge Philos. Soc. V. 90. P. 927. https://doi.org/10.1111/brv.12140
Sun Y., Chen X., Zhang X., Shen X., Wang M., Wang X., Liu W., Liu C., Liu J., Liu W., Jin X. 2017. β2-adrenergic receptor-mediated HIF-1α upregulation mediates blood brain barrier damage in acute cerebral ischemia. Front. Mol. Neurosci. V. 10. P. 257. https://doi.org/10.3389/fnmol.2017.00257
Tang B.L. 2019. Neuroprotection by glucose-6-phosphate dehydrogenase and the pentose phosphate pathway. J. Cell. Biochem. V. 20. P. 14285. https://doi.org/10.1002/jcb.29004
Vetrovoy O., Sarieva K., Galkina O., Eschenko N., Lyanguzov A., Gluschenko T., Tyulkova E., Rybnikova E. 2019. Neuroprotective mechanism of hypoxic post-conditioning involves HIF1-associated regulation of the pentose phosphate pathway in rat brain. Neurochem. Res. V. 44. P. 1425. https://doi.org/10.1007/s11064-018-2681-x
Vetrovoy O., Sarieva K., Lomert E., Nimiritsky P., Eschenko N., Galkina O., Lyanguzov A., Tyulkova E., Rybnikova E. 2020. Pharmacological HIF1 inhibition eliminates downregulation of the pentose phosphate pathway and prevents neuronal apoptosis in rat hippocampus caused by severe hypoxia. J. Mol. Neurosci. V. 70. P. 635. https://doi.org/10.1007/s12031-019-01469-8
Дополнительные материалы отсутствуют.


