Цитология, 2021, T. 63, № 1, стр. 43-52
Роль мембранных везикул Serratia grimesii при взаимодействии бактерий с клетками CACO-2
Е. С. Божокина 1, *, Ю. М. Берсон 2, **
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
2 ООО “Гротекс”
195279 Санкт-Петербург, Россия
* E-mail: bozhokina@yahoo.com
** E-mail: juletschka.ber@gmail.com
Поступила в редакцию 16.09.2020
После доработки 27.10.2020
Принята к публикации 28.10.2020
Аннотация
Условно-патогенные бактерии Serratia grimesii способны проникать в клетки эукариот, однако механизмы их инвазивной активности неизвестны. Ранее мы показали, что S. grimesii in vitro секретируют мембранные везикулы, которые проникают в культивируемые клетки эукариот и усиливают инвазию S. grimesii в эти клетки (Bozhokina et al., 2020). Поэтому целью настоящей работы является исследование роли мембранных везикул S. grimesii в процессе взаимодействия бактерий с клеткой-хозяином. Результаты проведенных экспериментов показали, что воздействие холодового шока или окислительного стресса, вызванного перекисью водорода, увеличивает секрецию мембранных везикул бактериями S. grimesii, а выделенные везикулы усиливают инвазию бактерий в клетки СaCo-2. Кроме того, мембранные везикулы S. grimesii индуцируют иммунный ответ клеток СaCo-2, а также обладают по отношению к этим клеткам цитотоксической активностью, определяемой по уровню высвобождения из клеток лактатдегидрогеназы. В присутствии везикул, полученных в условиях стресса, бактерии активнее адгезировали и проникали в клетки CaCo-2. Кроме того, впервые продемонстрировано участие рецептора клеточной поверхности Е-кадгерина в инвазии мембранных везикул S. grimesii в клетки CaCo-2. Полученные результаты позволяют предположить, что везикуло-опосредованная доставка факторов вирулентности к клеткам эукариот может вносить существенный вклад в патогенез, вызванный инфекцией S. grimesii.
Многие грамотрицательные бактерии способны секретировать мембранные везикулы, представляющие собой сферические пузырьки наружной мембраны бактерий размером от 20 до 400 нм, которые содержат биологически активные белки, нуклеиновые кислоты, а также различные бактериальные метаболиты (Brown et al., 2015; Schwechheimer, Kuehn, 2015; Bryant et al., 2017; Toyofuku et al., 2019). Предполагается, что мембранные везикулы бактерий являются ключевыми участниками в межбактериальных взаимодействиях, а также во взаимодействии бактерий с клетками эукариот. Этому способствуют разнообразные роли мембранных везикул, такие как поглощение питательных веществ, перенос генов, образование биопленок, антимикробная защита, доставка токсинов и факторов вирулентности при заражении клетки-хозяина (Kulp, Kuehn, 2010).
Бактериальная ДНК, выделенная из везикул, обнаруживается в моче (Yoo et al., 2016; Park et al., 2017), а также в таких стерильных отделах организма, как сердечный миокард (Svennerholm et al., 2017). Это предполагает, что бактериальные везикулы могут проникать в органы, значительно удаленные от места первичного бактериального контакта (Stentz et al., 2018). Показано, что везикулы могут взаимодействовать с различными клетками млекопитающих, включая клетки эпителия кишечника (Bielaszewska et al., 2013; Stentz et al., 2014; O’Donoghue et al., 2017), клетки легочного эпителия (Bauman, Kuehn, 2009), эндотелиальные клетки (Kim et al., 2013) и клетки иммунной системы (Hickey et al., 2015; Deo et al., 2018). Тем не менее, молекулярные механизмы проникновения мембранных везикул, а также дальнейшая судьба их содержимого в цитоплазме эукариотической клетки остаются мало изученными (Margolis, Sadovsky, 2019).
Исторически исследования мембранных везикул были сосредоточены на изучении везикул, продуцируемых патогенными грамотрицательными бактериями, и роли этих структур в транспортировке токсинов и факторов вирулентности в клетку-хозяина (Kunsmann et al., 2015; Rasti et al., 2018). Недавно появились исследования, показывающие наличие мембранных везикул условно-патогенных и пробиотических бактерий, которые могут благоприятно влиять на клетки хозяина, поддерживая их гомеостаз путем воздействия на сигнальные пути эпителиальных и иммунных клеток. Например, было показано, что мембранные везикулы Escherichia coli штамма Nissle 1917 помогают поддерживать целостность кишечного барьера за счет усиления экспрессии белков оклудина-1 и клаудина-14, усиливающих межклеточные контакты (Alvarez et al., 2016), а также путем увеличения производства противомикробных пептидов и противовоспалительных цитокинов (Fabrega et al., 2017; Alvarez et al., 2019). С другой стороны, показано, что выделенные мембранные везикулы S. grimesii содержат актин-специфическую протеазу гримелизин, которую везикулы могут переносить в цитоплазму эукариотической клетки и способствовать заражению этих клеток инвазирующими бактериями (Bozhokina et al., 2020).
Хотя все эти данные указывают на способность мембранных везикул бактерий влиять на жизнедеятельность клеток эукариот, процессы образования везикул и их проникновения в клетки эукариот остаются недостаточно изученными. Ранее мы показали, что условно-патогенные бактерии S. grimesii образуют везикулы, которые не только способны проникать в эукариотические клетки, но и усиливают инвазию “материнских” бактерий в эти клетки (Bozhokina et al., 2020). В экспериментах этой работы количество выделенных мембранных везикул увеличивали с помощью холодового шока (4°С), которому были подвергнуты бактерии S. grimesii (Bozhokina et al., 2020).
Задачей настоящей работы было изучение влияния мембранных везикул S. grimesii, полученных в условиях холодового шока или окислительного стресса, на свойства эукариотических клеток in vitro и взаимодействие бактерий с клеткой-хозяином.
Результаты нашей работы показали, что мембранные везикулы S. grimesii индуцируют иммунный ответ клеток эукариот, а также обладают цитотоксической активностью по отношению к этим клеткам. Присутствие везикул усиливало адгезию S. grimesii к клеткам аденокарциномы кишечного эпителия Ca-Co-2 и проникновение бактерий в эти клетки. Кроме того, впервые продемонстрировано участие рецептора клеточной поверхности Е-кадгерина в инвазии мембранных везикул S. grimesii в клетки CaCo-2. Полученные результаты указывают на то, что мембранные везикулы могут вносить существенный вклад в патогенез, вызванный инфекцией S. grimesii.
МАТЕРИАЛ И МЕТОДИКА
Клетки, бактерии, среды, условия культивирования. Клетки аденокарциномы толстой кишки человека линии СаCо-2 были получены из Коллекции культур клеток позвоночных Института цитологии РАН (КККП ИНЦ РАН, С.-Петербург). Клетки Ca-Co-2 культивировали в среде DMEM/F12 (Gibco, США), содержащей 10% эмбриональной бычьей сыворотки (HyClone, США) при 37°C и 5% CO2. Клетки снимали 0.25%-ным раствором трипсин-ЭДТА (Gibco, Великобритания) и переносили в 24-луночные планшеты для тканевых культур (Corning Glass Works, Corning, Нидерланды). Для иммунофлуоресцентного анализа монослой клеток СаCо-2 дважды промывали фосфатно-солевым буферным раствором PBS (Биолот, Россия) и культивировали в среде DMEM/F12 (Gibco, США), не содержащей антибиотиков и сыворотки.
Бактерии S. grimesii были получены из Немецкой коллекции микроорганизмов и клеточных культур (DSMZ, Берлин, Германия). Бактерии выращивали в среде LB (Gibco, Великобритания) при 37°C в колбах с аэрацией в течение 24 ч до достижения оптической плотности, равной 0.1 при 600 нм (OD600). Для экспериментов с холодовым шоком бактерии культивировали при 37°C, а затем (перед выделением мембранных везикул) помещали на водяную баню со льдом на 1 ч. Для экспериментов с окислительным стрессом бактерии культивировали как указано выше, а затем в среду добавляли пероксид водорода до конечной концентрации 250 мкМ (Биолот, Россия) на 1 ч, после чего выделяли мембранные везикулы.
Выделение мембранных везикул. Бактерии, выращенные в течение 24 ч в среде LB (Gibco, Великобритания) при 37°C в колбах с аэрацией, центрифугировали при 10 000 g в течение 30 мин и полученный супернатант фильтровали через мембрану с диаметром пор 0.22 мкм (Millipore, Великобритания). Фильтрат концентрировали, используя центробежный фильтр Ultra-4 с номинальной отсечкой 10 кДа (Millipore, Великобритания). Концентрированный фильтрат подвергали ультрацентрифугированию при 40 000 g в течение 1 ч при 4°C с использованием ротора Type 45 Ti (Beckman Instruments, США). Осадки, содержащие мембранные везикулы, суспендировали в PBS (Биолот, Россия). Суспензию мембранных везикул проверяли на стерильность, высевая на чашки с LB-агаром (Gibco, Великобритания). Количество мембранных везикул выравнивали по концентрации белка в растворе мембранных везикул, определенного по методу Лоури (Lowry et al., 1951).
Количественная оценка адгезии и инвазии бактерий после обработки клеток мембранными везикулами. Влияние мембранных везикул на инвазию бактерий S. grimesii определяли с помощью метода количественной оценки адгезии и инвазии по описанной методике (Wu et al., 2014) с небольшими модификациями. Клетки CaCo-2 культивировали в среде DMEM/F12 (Gibco, США) без сыворотки в присутствии разного количества везикул в течение 1 ч, затем среду отбирали и клетки промывали 3 раза буфером PBS (Биолот, Россия), контроль отмывки везикул проводили с помощью микроскопа ZOI (Biorad, США). Среду DMEM/F12 заменяли на свежую без сыворотки и клетки заражали бактериями S. grimesii из расчета 25 бактерий на 1 клетку. Клетки в присутствии бактерий культивировали при 37°C и 5% CO2 в течение 2 ч. Затем клетки промывали 1 мл раствора трипсина с ЭДТА (Биолот, Россия), добавляли среду DMEM/F12 с гентамицином (100 мкг/мл) и культивировали 1 ч, чтобы уничтожить внеклеточные бактерии. После этого клетки лизировали в 4.5%-ном растворе дезоксихолата натрия в течение 10 мин. Лизат обьемом 100 мкл быстро титровали холодной средой LB (Gibco, Великобритания) до нужной концентрации и высевали по 100 мкл на чашки с LB-агаром (Gibco, Великобритания) для подсчета количества колониеобразующих единиц (КОЕ). Ту же процедуру использовали для анализа бактериальной адгезии, но исключали обработку клеток средой с гентамицином. Результаты представляют собой среднее значение КОЕ, которое соответствует количеству образовавшихся колоний, из трех независимых экспериментов. Результаты выражали средним значением и среднестатистическим отклонением. Различия считали значимыми при вероятности гипотезы p < 0.05.
Иммунофлуоресцентная окраска мембранных везикул и рецептора клеточной поверхности Е-кадгерина. Клетки CaCo-2 инкубировали с мембранными везикулами, предварительно окрашенными красителем DiLO (Thermo Fisher Scientific, Великобритания), согласно инструкции производителя в течение 1 ч. Затем клетки промывали буфером PBS и фиксировали в 4%-ном растворе параформальдегида (Sigma-Aldrich, США) в течение 20 мин при комнатной температуре и блокировали 1%-ным раствором бычьего сывороточного альбумина (BSA; Sigma, ФРГ) в течение 1 ч. Пермеабилизацию клеточной мембраны проводили 0.1%-ным раствором Тритона Х-100 в течение 15 мин при комнатной температуре. Далее образцы инкубировали с антителами к Е-кадгерину (Santa Cruz, США) в течение ночи при 4°С. Вторые антитела (AlexaFluor 488; Life Technologies, США) разводили в соотношении 1 : 500 и инкубировали с ними препараты 1 ч в темноте при комнатной температуре. В качестве отрицательного контроля использовали клетки, окрашенные только вторыми антителами. Визуализацию проводили с помощью микроскопа Olympus FV3000 (Olympus, Япония), используя программное обеспечение ImageJ.
Определение уровня воспалительных цитокинов в клетках СаCо-2 после их инкубации с мембранными везикулами S. grimesii. Уровень секреции интерлейкинов IL-6 и IL-8 оценивали с использованием набора для сэндвич-ИФА в соответствии с инструкциями производителя (Human IL-6, IL-8 Pre-Coated ELISA Kit; Peprotech, Великобритания). Клетки СаCо-2 инкубировали в течение 24 ч с мембранными везикулами в концентрации 2, 50 или 100 мкг/мл. Определение уровней цитокинов IL-6 и IL-8 проводили с использованием 96-луночных планшет-ридеров Dynex MRX II (Dynex, США), предварительно покрытых моноклональными антителами, специфичными к IL-6 или IL-8. Поглощение измеряли при длине волны 405 нм, в качестве детектирующих антител использовали биотинилированные поликлональные антитела, специфичные к IL-6 или IL-8, и анализировали с помощью программного обеспечения Revelation (Dynex, США).
Оценка цитотоксичности мембранных везикул. Цитотоксичность мембранных везикул S. grimesii по отношению к клеткам оценивали с помощью нерадиоактивного анализа цитотоксичности CytoTox 96 (Promega, Великобритания). За 7 сут до инфицирования клетки CaCo-2 засевали в 24-луночные планшеты, выращивали до образования 70%-ного монослоя и культивировали при 37°C в течение 24 ч среде DMEM/F12 (Gibco, США) без сыворотки с мембранными везикулами S. grimesii (в концентрации 2, 50 или 100 мкг/мл). Цитотоксичность мембранных везикул определяли в супернатантах клеток по уровню высвобождения в среду лактатдегидрогеназы (LDH). Необработанные клетки являлись отрицательным контролем цитотоксичности (0%). Полный лизис клеток после обработки 1%-ым Тритоном Х-100 представлял собой положительный контроль (цитотоксичность 100%).
Полимеразная цепная реакция (ПЦР) в режиме реального времени с обратной транскрипцией (ОТ-ПЦР). Для анализа экспрессии гена e-cadherin из клеток выделяли тотальную РНК при помощи набора RiboPure™ RNA Purification Kit (Invitrogen, США) по протоколу, рекомендованному производителем. Все образцы обрабатывали ДНКазой (Fermentas, Thermo Scientific, Литва). Для синтеза кДНК использовали 1 мкг тотальной РНК на пробу, ревертазу RevertAid M-MuLV и случайные олигонуклеотидные последовательности (Fermentas, Thermo Scientific, Литва). Пробы для ПЦР готовили в соответствии с протоколом производителя Taq ДНК-полимеразы (Fermentas, Thermo Scientific, Литва). Использовали специфические праймеры следующих последовательностей: для e-cadherin прямой 5'-CTGAGAACGAGGANAACG-3' и обратный 5'-TTCACATCCAGCACATCC-3'; для β-актина прямой 5'-AATCTGGCACCACACCTTCTACA-3' и обратный 5'-GACG-TAGCACAGCTTCTCCTTA-3'. Температура отжига праймеров была адаптирована к оптимальным условиям ПЦР для каждой используемой пары. ПЦР-анализ экспрессии генов проводили на амплификаторе CFX96 (BioRad, Сингапур).
Статистическая обработки результатов. Использовали t-критерий Стьюдента. Различия считали достоверными при вероятности гипотезы p < 0.05.
РЕЗУЛЬТАТЫ
Синтез мембранных везикул бактериями S. grimesii в условиях стресса
Ранее мы показали, что бактерии S. grimesii увеличивают производство мембранных везикул при физиологическом стрессе (Bozhokina et al., 2020). Температура является основным регулятором экспрессии генов у бактерий, и производство мембранных везикул бактериями происходило как при низких, так и при более высоких температурах (Yonezawa et al., 2011). Имея это в виду, мы проверили, влияют ли изменения температуры на количество мембранных везикул S. grimesii. Бактерии S. grimesii культивировали либо при 32°С, либо при 37°С и оценивали количество везикул по концентрации белка в очищенной фракции везикул (рис. 1). Оказалось, что при 37°С накопление белка значительно выше, чем при 32°С, что предполагает более активное производство везикул при 37°С, т.е. при температуре, которая является температурным оптимумом для S. grimesii (рис. 1).
Рис. 1.
Зависимость количества мембранных везикул бактерий Serratia grimesii от температуры и стрессовых факторов. Измеряли общее содержание белка мембранных везикул, выделенных из S. grimesii, культивируемых при 32 или 37°C. Концентрации белка мембранных везикул (МВ) были нормализованы к относительной концентрации бактериальной культуры, которую определяли по оптической плотности при длине волны 600 нм. Холодовой шок (ХШ) моделировали помещением бактерий на лед на 30 мин, окислительный – 250 мкМ перексида водорода (ПВ) в течение 1 ч. Контроль – количество мембранных везикул от бактерий, выращенных при температурном оптимуме (37°C) с качанием. Эксперименты повторяли дважды; показаны средние значения и стандартные отклонения; различия достоверны по сравнению с контролем (*) при р < 0.05.
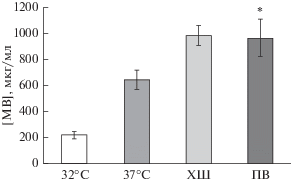
Кроме того, известно, что в условиях стресса происходит активация бактериальных сигнальных путей (Macdonald, Kuehn, 2013), и это также может увеличить образование мембранных везикул. Мы исследовали влияние холодового шока, хорошо зарекомендовавшего себя индуктора стресса у грамотрицательных бактерий (Phadtare, 2004), на синтез мембранных везикул бактериями S. grimesii. Холодовой шок вызывали выдерживанием бактерий, выращенных при 37°С, в течение получаса на льду с качанием. Количественная оценка белков мембранных везикул после холодового шока продемонстрировала значительное увеличение секреции везикул по сравнению с контрольными бактериями, выращенными при 37°С (рис. 1).
Для того чтобы определить, являются ли условия стресса физиологически значимыми для стимулирования производства везикул S. grimesii, мы определили количество мембранных везикул после добавления в ростовую среду бактерий пероксида водорода. Эта добавка имитирует резкое увеличение в среде активных форм кислорода, которые могли бы продуцироваться нейтрофилами в процессе инфекции in vivo для противодействия бактериальной инфекции в организме хозяина. Действительно, при добавлении в бактериальную среду 250 мкМ пероксида водорода на 1 ч количество везикул также возрастало (рис. 1).
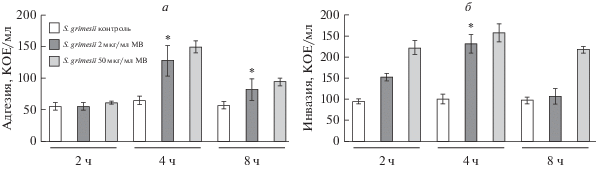
Влияние мембранных везикул на инвазию S. grimesii в клетки CaCo-2. Так как бактерии S. grimesii секретируют везикулы во внеклеточную среду, мы проверили, как инкубация клеток с мембранными везикулами влияет на адгезию и инвазию бактерий. После инкубации клеток CaCo-2 с мембранными везикулами (2 или 50 мкг/мл) в течение 30 мин среду меняли на свежую и добавляли бактерии S. grimesii (множественность заражения 25 : 1). Добавление мембранных везикул не оказало существенного влияния на бактериальную адгезию через 2 ч (рис. 2а). Однако на более поздних сроках – через 4 и 8 ч после добавления бактерий, адгезия усиливалась в 2.5 раза (рис. 2а). Однако количество внутриклеточных (инвазировавших) бактерий после преинкубации клеток с мембранными везикулами увеличивалось на всех временных точках. Количество внутриклеточных бактерий увеличивалось также в зависимости от концентрации везикул до 2.5 раз (рис. 2б).
Рис. 2.
Влияние мембранных везикул (МВ) на адгезию и инвазию бактерий S. grimesii в клетки CaCo-2. Клетки инкубировали в среде с МВ в течение 30 мин. Бактериальную адгезию (а) и инвазию (б) оценивали по количеству прикрепившиеся и проникших в клетки S. grimesii. Количество бактерий оценивали по числу колониеобразующих элементов (КОЕ/мл) после высева на твердые среды. Число прикрепившихся бактерий после инкубирования клеток в среде с МВ увеличивается через 4 и 8 ч адгезии. Контроль – необработанные везикулами клетки CaCo-2. Эксперименты повторяли трижды; показаны средние значения и стандартные отклонения; различия достоверны по сравнению с контрольными (*) при р < 0.05.
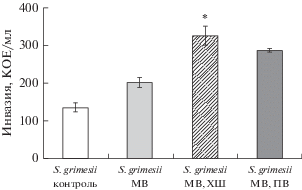
Стоит отметить, что предварительная обработка клеток везикулами, полученными в условиях стресса (холодовой шок или добавление пероксида водорода) приводила к более значительной инвазии бактерий в клетки, что может говорить о наличии в таких везикулах большего количества бактериальных факторов вирулентности (рис. 3).
Рис. 3.
Инвазия S. grimesii в клетки CaCo-2, предварительно обработанные мембранными везикулами (МВ), полученными в условиях стресса. МВ из бактерий выделяли после холодового шока (ХШ) в течение 30 мин на льду, или окислительного стресса добавлением 250 мкМ пероксида водорода (ПВ). Контроль – инвазия CaCo-2, без предварительной обработки бактерий МВ. Эксперименты повторяли трижды; показаны средние значения и стандартные отклонения; различия с контролем достоверны (*) при р < 0.05.
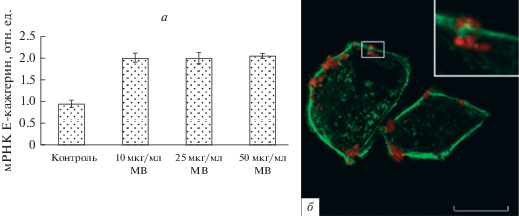
Оказалось, также, что предварительная обработка клеток CaCo-2 мембранными везикулам увеличила экспрессию гена рецептора клеточной поверхности Е-кадгерина (рис. 4а), а также колокализацию везикул с E-кадгерином на поверхности клеток (рис. 4б). После окраски красителем DiLO к клеткам CaCo-2 добавляли мембранные везикулы в концентрации 50 мкг/мл на 1 ч. Затем клетки фиксировали и окрашивали антителами к Е-кадгерину. На врезке (рис. 4б) видны прикрепившиеся к поверхности клеток везикулы (красный сигнал) и места контакта везикул с E-кадгерином (зеленый сигнал), что указывает на участие этого рецептора в интернализации везикул в клетки-хозяина.
Рис. 4.
Совместная иммунофлуоресцентная окраска мембранных везикул (МВ) бактерий S. grimesii и рецептора клеточной поверхности Е-кадгерина клеток CaCo-2. Клетки CaCo-2 инкубировали в среде с 10, 25 и 50 мкг/мл МВ в течение 1 ч, затем оценивали экспрессию рецептора клеточной поверхности Е-кадгерина методом ОТ-ПЦР (а); контроль – клетки CaCo-2 в среде без МВ. б – Показана иммунофлуорисценция рецептора Е-кадгерина (зеленый цвет) при инкубации клеток CaCo-2 в среде с МВ (красный цвет) бактерий S. grimesii; на врезке с увеличенным изображением участка видны прикрепившиеся к поверхности клеток везикулы и места контакта везикул с E-кадгерином. Масштабный отрезок – 25 мкм.
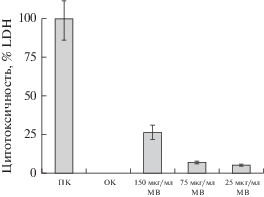
Цитотоксическое действие мембранных везикул S. grimesii, полученных в условиях оптимума роста и при условиях стресса на клетки CaCo-2. Цитотоксическое действие мембранных везикул на клетки Ca-Co-2 оценивали количественно по высвобождению фермента LDH из цитозоля клеток, как меры их повреждения. Мембранные везикулы в количестве 25, 75 или 150 мкг/мл добавляли к клеткам CaCo-2 на 24 ч. Цитотоксический эффект мембранных везикул увеличивался пропорционально концентрации добавленных к клеткам везикул (рис. 5).
Рис. 5.
Цитотоксичность мембранных везикул (МВ) в разной концентрации), выделенных из бактерий S. grimesii, на клетки CaCo-2. По горизонтали: ПК – положительный контроль (лизис клеток в 1%-ном растворе Тритона Х-100, 100%-ная цитотоксичность), ОК – отрицательный контроль (культуральная среда без МВ). Цитотоксическое действие на клетки CaCo-2 определяли по росту содержания лактатдегидрогеназы (LDH) в среде клеток по мере их повреждения.
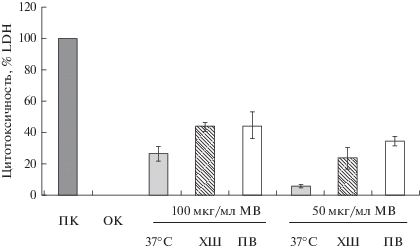
Суспензию мембранных везикул, полученных в условиях стресса, в концентрации 50 и 100 мкг/мл инкубировали с клетками CaCo-2 в течение 24 ч. Цитотоксический эффект мембранных везикул был пропорционален концентрации добавленных к клеткам везикул (рис. 6). Кроме того, мы показали, что цитотоксический эффект был выше в 1.5 раза при обработке везикулами, полученными после воздействия температурного (холодового) шока, а также был выше в 2.5 раза после воздействия окислительного стресса (обработки пероксидом водорода). В качестве отрицательного контроля на цитотоксичность, клетки инкубировали в среде без везикул, для положительного контроля использовали обработку клеток раствором Triton X-100.
Рис. 6.
Цитотоксический эффект мембранных везикул (МВ), выделенных из бактерий S. grimesii, в условиях стресса. По горизонтали: ПК – положительный контроль (лизис клеток в 1%-ном растворе Тритона Х-100, 100%-ная цитотоксичность), ОК – отрицательный контроль (культуральная среда без мембранных везикул); 37°C – оптимальные условия роста бактерий; ХШ – холодовой шок; ПВ – добавление в среду культивирования бактерий пероксида водорода (250 мМ). Цитотоксическое воздействие на клетки CaCo-2 определяли по содержанию в среде клеток фермента LDH.
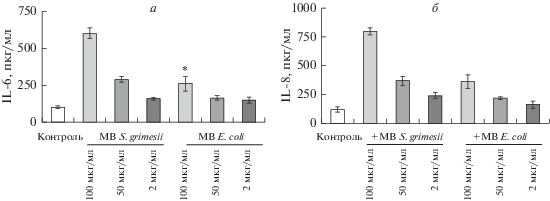
Влияние мембранных везикул S. grimesii на синтез провоспалительных цитокинов IL-6 и IL-8 в клетках CaCo-2. По данным иммунноферментного анализа (ИФА), после инкубации клеток CaCo-2 с мембранными везикулами в концентрации 2, 50 или 100 мкг/мл в течение 24 ч уровень секретируемых IL-6 и IL-8 увеличивался в 4.8 и в 6.4 раза соответственно (рис. 7а, б). В ответ на обработку клеток везикулами (при совместном культивировании клеток с везикулами в максимальной концентрации) наблюдали секрецию цитокинов IL-6 и IL-8 в самых высоких концентрациях. Секреция цитокинов уменьшалась пропорционально концентрации мембранных везикул, предварительно добавленных к клеткам. Максимальная секреция цитокинов достигалась при концентрации мембранных везикул 100 мкг/мл, а увеличение секреции всего в 1.6 раз достигалась при концентрации везикул 2 мкг/мл. Было также показано, что ответы клеток на обработку везикулами непатогенного штамма E. coli ССМ были значительно меньше при аналогичных концентрациях, чем при обработке везикулами бактерий S. grimesii (рис. 7 а, б). Это можно объяснить тем, что в везикулах S. grimesii, в отличие от везикул штамма E. coli ССМ, содержится протеаза гримелизин (Bozhokina et al., 2020), поэтому такая разница в эффектах может быть связана с наличием в мембранных везикулах этого фермента.
Рис. 7.
Индукция IL-6 (а) и IL-8 (б) в клетках CaCo-2 в ответ на обработку мембранными везикулами (МВ) бактерий S. grimesii и Escherichia coli. Клетки инкубировали в среде с МВ в различной концентрации в течение 24 ч. Содержание IL-6 и IL-8, секретируемых клетками CaCo-2 в среду после обработки клеток МВ бактерий, определяли методом ИФА; контроль – клетки без предварительной обработки МВ. Различия с контролем достоверны (*) при р < 0.05.
ОБСУЖДЕНИЕ
В настоящее время мембранные везикулы бактерий считаются одним из ключевых участников бактериальной вирулентности (Kulp, Kuehn, 2010). Везикулы играют важную роль в таких взаимодействиях клетки-хозяина и патогена, как транспортировка и высвобождение факторов вирулентности многих патогенных и условно-патогенных бактерий (Ellis, Kuehn, 2010). Ранее мы обнаружили, что условно-патогенные бактерии S. grimesii продуцируют мембранные везикулы, содержащие актин-специфическую протеазу гримелизин, которая является одним из факторов вирулентности этих бактерий (Bozhokina et al., 2020). Эти результаты указывает на то, что S. grimesii могут использовать мембранные везикулы в качестве системы доставки целевых бактериальных белков в процессе интернализации бактерий. Однако в литературе недостаточно данных о наличии у бактерий штамма S. grimesii специфических бактериальных систем секреции, которые способствуют проникновению этих условно-патогенных бактерий в клетки эукариот. В то же время, известно, что образование мембранных везикул является ответом бактерий на неблагоприятные условия окружающей среды (MacDonald, Kuehn, 2013).
Температуру окружающей среды обычно рассматривают как общий фактор стресса, который встречается во время инфекции. Используя изменение температуры (холодовой шок), мы показали, что количество везикул, выделенных бактериями, подвергшимися инкубации при 4°C, значительно превышало количество везикул, выращенных при 32 или 37°C (Bozhokina et al., 2020). Аналогичное увеличение количества секретируемых везикул происходило в результате окислительного стресса – еще одного вида стресса, с которым патоген может встретиться в процессе развития инфекции. Оказалось, что окислительный стресс, а именно инкубация бактерий S. grimesii в присутствии пероксида водорода, приводила к значительному, почти в 3.5 раза, увеличению продукции везикул. Активные формы кислорода, такие как пероксид водорода, вырабатываются клетками врожденного иммунитета и высвобождаются при контакте с инфекционным агентом. Реактивный кислород является мощным защитным механизмом клетки, а бактерии не обладают единым механизмом уклонения от активных форм кислорода. Возможно, повышенная продукция мембранных везикул является как раз таким защитным механизмом для бактерий S. grimesii.
Увеличение количества везикул S. grimesii при воздействии стресса согласуется с данными о везикулах других грамотрицательных бактерий (Deatherage et al., 2009). При этом изменение количества мембранных везикул, синтезируемых бактериями S. grimesii, предполагает, что может происходить дифференцированная сортировка внутренних белков везикул, как, например, это происходит с мембранными везикулами бактерий P. gingivalis (Haurat et al., 2011).
В настоящее время было идентифицировано множество факторов вирулентности бактерий, ассоциированных с мембранными везикулами. Было показано, что мембранные везикулы доставляют в клетки эукариот бактериальные факторы вирулентности таких кишечных патогенов, как энторопатогенная Escherichia coli и Helicobacter pylori (Ellis, Kuehn, 2010). Мы показали, что при помощи везикул S. grimesii в значительном количестве переносит металлопротеазу гримелизин (Bozhokina et al., 2020). Кроме того, аналогично данным для мембранных везикул патогенных бактерий (Lindmark et al., 2009), мембранные везикулы S. grimesii обладают цитотоксичным эффектом по отношению к клеткам CaCo-2.
Цитотоксичность мембранных везикул измеряли по наличию в среде клеток внеклеточного фермента LDH после их совместной 24-часовой инкубации, и уровень цитотоксичности менялся пропорционально концентрации добавленных к клеткам везикул. Такое действие на клетки CaCo-2 может предполагать роль других цитотоксических факторов S. grimesii в дополнение к гримелизину, например, других бактериальных протеаз, которые могут повреждать клеточные мембраны. Для проверки этого предположения требуются дальнейшие исследования, чтобы установить, является ли снижение целостности мембраны клетки-хозяина результатом действия мембранных везикул на клеточный цикл, или цитотоксичность достигается фактическим лизисом клеток-хозяина. Тем не менее, можно предположить, что везикулы S. grimesii могут модулировать изменения мембран клеток линии CaCo-2 человека, и тем самым влиять на проникновение бактерий.
Известно, что бактериальные мембранные везикулы могут активировать сигнальные пути врожденного и приобретенного иммунного ответа в клетках хозяина (Ellis, Kuehn, 2010). Факторы вирулентности, ассоциированные с мембранными везикулами, могут модулировать иммунный ответ хозяина, стимулируя иммунное (воспалительное) повреждение или уничтожение патогена (Ellis, Kuehn, 2010). Провоспалительный ответ на действие мембранных везикул наблюдали для некоторых видов бактерий, включая H. pylori (Ismail et al., 2003) и P. aeruginosa (Bauman, Kuehn 2006).
Мы также показали, что в ответ на инфицирование мембранными везикулами клетки CaCo-2 продуцируют провоспалительные цитокины IL-6 и IL-8. Эти результаты являются первым свидетельством того, что мембранные везикулы S. grimesii действуют как инициаторы иммунного ответа хозяина. По нашим предварительным данным, предобработка мембранных везикул протеиназой K не снижает способности везикул индуцировать IL-8. Так как протеиназа К разрушает белки, связанные с поверхностью везикул, но не белки, находящиеся в их внутреннем просвете (Bomberger, et al. 2009), эти данные указывают на то, что факторы вирулентности S. grimesii, участвующие в индукции интерлейкинов клетки-хозяина, являются внутренними компонентами мембранных везикул.
Ранее мы показали, что клетки эукариот чувствительны к инвазии S. grimesii (Bozhokina et al., 2011). Результаты настоящей работы свидетельствуют о том, что эффективность бактериальной инвазии увеличивается в присутствии мембранных везикул, секретируемых бактериями S. grimesii. Секреция везикул значительно усиливается в условиях стресса, холодового шока, а также при инкубации бактерий в присутствии перекиси водорода.
Результаты нашей работы впервые показали, что предварительная обработка клеток CaCo-2 мембранными везикулами S. grimesii приводит к значительному усилению инвазии бактерий в эти клетки. Цитотоксичность везикул для клеток согласуется с этими данными. Таким образом, полученные результаты продемонстрировали роль мембранных везикул, как средства доставки факторов вирулентности S. grimesii и выявили влияние везикул на клетки человека, включая цитотоксичность и индукцию врожденного иммунного ответа, связанную с секрецией интерлейкинов IL-6 и IL-8.
Список литературы
Alvarez C.S., Badia J., Bosch M., Gimenez R., Baldoma L. 2016. Outer membrane vesicles and soluble factors released by probiotic Escherichia coli Nissle 1917 and commensal ECOR63 enhance barrier function by regulating expression of tight junction proteins in intestinal epithelial cells. Front. Microbiol. V. 7. P. 1981. https://doi.org/10.3389/fmicb.2016.01981
Alvarez C.S., Gimenez R., Canas M.A., Vera R., Diaz-Garrido N., Badia J., Baldoma L. 2019. Extracellular vesicles and soluble factors secreted by Escherichia coli Nissle 1917 and ECOR63 protect against enteropathogenic E. coli-induced intestinal epithelial barrier dysfunction. BMC Microbiol. V. 19. P. 166. https://doi.org/10.1186/s12866-019-1534-3
Bauman S.J., Kuehn M.J. 2006. Purification of outer membrane vesicles from Pseudomonas aeruginosa and their activation of an IL-8 response. Microbes Infect. V. 8. P. 2400.
Bauman S.J., Kuehn M.J. 2009. Pseudomonas aeruginosa vesicles associate with and are internalized by human lung epithelial cells. BMC Microbiol. V. 9. P. 26. https://doi.org/10.1186/1471-2180-9-26
Bozhokina E., Kever L., Khaitlina S. 2020. The Serratia grimesii outer membrane vesicles-associated grimelysin triggers bacterial invasion of eukaryotic cells. Cell Biol. Int. V. 44. P. 2275. https://doi.org/10.1002/cbin.11435
Bozhokina E.S., Tsaplina O.A., Efremova T.N., Kever L.V., Demidyuk I.V., Kostrov S.V., Adam T, Komissarchik Y.Y., Khaitlina S.Y. 2011. Bacterial invasion of eukaryotic cells can be mediated by actin-hydrolysing metalloproteases grimelysin and protealysin. Cell Biol Int. V. 35. P. 111. https://doi.org /https://doi.org/10.1042/CBI20100314
Bielaszewska M., Ruter C., Kunsmann L., Greune L., Bauwens A., Zhang W., Kuczius T., Kim K.S., Mellmann A., Schmidt A.M., Karch H. 2013. Enterohemorrhagic Escherichia coli hemolysin employs outer membrane vesicles to target mitochondria and cause endothelial and epithelial apoptosis. PLoS Pathog. V. 9. P. 12. https://doi.org/10.1371/journal.ppat.1003797
Bomberger J.M., MacEachran D.P., Coutermarsh B.A., Ye S., O’Tool G.A., Stanton B.A. 2009. Long-distance delivery of bacterial virulence factors by Pseudomonas aeruginosa outer membrane vesicles. PLoS Pathog. V. 5. P. e1000382. https://doi.org/10.1371/journal.ppat.1000382
Brown L., Wolf J.M., Prados-Rosales R., Casadevall A. 2015. Through the wall: extracellular vesicles in Gram-positive bacteria, mycobacteria and fungi. Nat. Rev. Microbiol. V. 13. P. 620.
Bryant W. A., Stentz R., Le Gall G., Sternberg M.J.E., Carding S.R., Wilhelm T. 2017. In silico analysis of the small molecule content of outer membrane vesicles produced by Bacteroides thetaiotaomicron indicates an extensive metabolic link between microbe and host. Front. Microbiol. V. 8. P. 2440.
Collins B.S. 2011. Gram-negative outer membrane vesicles in vaccine development. Discov. Med V. 12. P. 7.
Deatherage B.L., Cookson B.T. 2012. Membrane vesicle release in bacteria, eukaryotes, and archaea: a conserved yet underappreciated aspect of microbial life. Infect. Immun. V. 80. P. 1948.
Deatherage B.L., Lara J.C., Bersbaken T., Barrett S.L.R., Lara S., Cookson B.T. 2009. Biogenesis of bacterial membrane vesicles. Mol. Microbiol. V. 72. P. 1395.
Deo P., Chow S.H., Hay I.D., Kleifeld O., Costin A., Elgass K.D., Jiang J.H., Ramm G., Gabriel K., Dougan G., Lithgow T., Heinz E., Naderer T. 2018. Outer membrane vesicles from Neisseria gonorrhoeae target PorB to mitochondria and induce apoptosis. PLoS Pathog. V. 14. P. e1006945. https://doi.org/10.1371/journal.ppat.1006945
Ellis T.N., Kuehn M.J. 2010. Virulence and immunomodulatory roles of bacterial outer membrane vesicles. Microbiol. Mol. Biol. Rev. V. 74. P. 81.
Fabrega M.J., Rodriguez-Nogales A., Garrido-Mesa J., Algier F., Badia J., Gimenez R., Galvez J., Baldoma L. 2017. Intestinal anti-inflammatory effects of outer membrane vesicles from Escherichia coli Nissle 1917 in DSS-experimental colitis in mice. Front. Microbiol. V. 8. P. 1274. https://doi.org/10.3389/fmicb.2017.01274
Haurat M.F, Aduse-Opoku J., Rangarajan M., Dorobantu L., Gray M.R., Curtis M.A., Feldman M.F. 2011. Selective sorting of cargo proteins into bacterial membrane vesicles. J. Biol. Chem. V. 286. P. 1269.
Hickey C.A., Kuhn, K.A., Donermeyer D.L., Porter N.T., Jin C., Cameron E.A., Jung H., Kaiko G.E., Wegorzewska M., Malvin N.P., Glowacki R.W.P., Hansson G.C., Allen P.M., Martens E.C., Stappenbeck T.S. 2015. Colitogenic Bacteroides thetaiotaomicron antigens access host immune cells in a sulfatase-Dependent manner via outer membrane vesicles. Cell Host Microbe. V. 17. P. 672.
Hooper L.V., Stappenbeck T.S., Hong C.V., Gordon J.I. 2003. Angiogenins: a new class of microbicidal proteins involved in innate immunity. Nat. Immunol. V. 4. P. 269.
Ismail S., Hampton M.B., Keenan J.I. 2003. Helicobacter pylori outer membrane vesicles modulate proliferation and interleukin-8 production by gastric epithelial cells. Infect. Immun. V. 71. P. 5670.
Kim J.H., Yoon Y.J., Lee J., Choi E.J., Yi N., Park K.S., Park J., Lotvall j., Kim Y.K., Gho Y.S. 2013. Outer membrane vesicles derived from Escherichia coli up-regulate expression of endothelial cell adhesion molecules in vitro and in vivo. PLoS One. V. 8. P. e59276. https://doi.org/10.1371/journal.pone.0059276
Kulp A., Kuehn M.J. 2010. Biological functions and biogenesis of secreted bacterial outer membrane vesicles. Annu. Rev. Microbiol. V. 64. P. 163.
Kunsmann L., Ruter C., Bauwens A., Greune L., Gluder M., Kemper B., Fruth A., Wai S.N., He X., Lloubes R., Schmidt M.A., Dobrint U., Mellmann A., Karch H., Bielaszewska M. 2015. Virulence from vesicles: novel mechanisms of host cell injury by Escherichia coli O104:H4 outbreak strain. Sci. Rep. https://doi.org/10.1038/ srep13252
Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.H. 1951. Protein measurement with the Folin phenol reagent. J. Biochem. Chem. V. 193. P. 265.
Lindmark B., Rompikuntal P.K., Vaitkevicius K., Song T., Mizunoe Y., Uhlin B.E., Guerry P., Wai S.N. 2009. Outer membrane vesicle-mediated release of cytolethal distending toxin (CDT) from Campylobacter jejuni. BMC Microbiol. V. 9. P. 220. https://doi.org/10.1186/1471-2180-9-220
Macdonald I.A., Kuehn M.J. 2013. Stress-induced outer membrane vesicle production by Pseudomonas aeruginosa. J. Bacteriol. V. 195. P. 2971.
Manning A.J., Kuehn M.J. 2011. Contribution of bacterial outer membrane vesicles to innate bacterial defense. BMC Microbiol. V. 11. P. 1.
Margolis L., Sadovsky Y. 2019. The biology of extracellular vesicles: The known unknowns. PLoS Biol. V. 17. P. e3000363. https://doi.org/10.1371/journal.pbio.3000363
Necchi V., Candusso M.E., Tava F., Luinetti O., Ventura U., Fiocca R., Ricci V., Solcia E. 2007. Intracellular, intercellular, and stromal invasion of gastric mucosa, preneoplastic lesions, and cancer by Helicobacter pylori. Gastroenterol. V. 132. P. 1009.
O’Donoghue E.J., Krachler A.M. 2016. Mechanisms of outer membrane vesicle entry into host cells. Cell. Microbiol. V. 18. P. 1508.
O’Donoghue E.J., Sirisaengtaksin N., Browning D.F., Bielska E., Hadis M., Alderwick L., Jabbari S., Krachler A.M. 2017. Lipopolysaccharide structure impacts the entry kinetics of bacterial outer membrane vesicles into host cells. PLoS Pathog. V. 13. P. 1006760. https://doi.org/10.1371/journal.ppat.1006760
Park J.Y., Choi J., Lee Y., Lee J.E., Lee E.H., Kwon H.J., Yang J., Jeong B.R., Kim Y.K., Han P.L. 2017. Metagenome analysis of bodily microbiota in a mouse model of Alzheimer disease using bacteria-derived membrane vesicles in blood. Exp. Neurobiol. V. 26. P. 369.
Phadtare S. 2004. Recent developments in bacterial cold-shock response. Curr. Issues. Mol. Biol. V. 6. P. 125.
Rasti E.S., Schappert M.L., Brown A.C. 2018. Association of Vibrio cholerae 569B outer membrane vesicles with host cells occurs in a GM1-independent manner. Cell. Microbiol. V. 20. P. e12828. https://doi.org/10.1111/cmi.12828
Schwechheimer C., Kuehn M.J. 2015. Outer-membrane vesicles from Gram-negative bacteria: biogenesis and functions. Nat. Rev. Microbiol. V. 13. P. 605.
Schwechheimer C., Kulp A., Kuehn M.J. 2014. Modulation of bacterial outer membrane vesicle production by envelope structure and content. BMC Microbiol. V.14. P. 1
Stentz R., Carvalho A.L., Jones E.J., Carding S.R. 2018. Fantastic voyage: The journey of intestinal microbiota-derived microvesicles through the body. Biochem. Soc. Trans. V. 46. P. 1021.
Stentz R., Osborne S., Horn N., Li A.W., Hautefort I., Bongaerts R., Rouyer M., Bailey P., Shears S.B., Hemmings A.M., Brearley C.A., Carding S.R. 2014. A bacterial homolog of a eukaryotic inositol phosphate signaling enzyme mediates cross-kingdom dialog in the mammalian gut. Cell Rep. V. 6. P. 646. https://doi.org/10.1016/j.celrep.2014.01.021
Svennerholm K., Park K.S., Wikstrom J., Lasser C., Crescitelli R., Shelke G.V., Jang S.C., Suzuki S., Banderia E., Olofsson C.S., Lotvall J. 2017. Escherichia coli outer membrane vesicles can contribute to sepsis induced cardiac dysfunction. Sci. Rep. V. 7. P. 17434. https://doi.org/10.1038/s41598-017-16363-9
Toyofuku M., Nomura N., Eberl L. 2019. Types and origins of bacterial membrane vesicles. Nat. Rev. Microbiol. V. 17. P. 13.
Wu J., Pugh R., Laughlin R.C., Andrews-Polymenis H., McClelland M., Bäumler A.J., Adams L.G. 2014. High-throughput assay to phenotype Salmonella enterica Typhimurium association, invasion, and replication in mac- rophages. J. Vis. Exp. V. 90. P. e51759.
Yonezawa H., Osaki T., Woo T., Kurata S., Zaman C., Hojo F., Hanawa T., Kato S., Kamiya S. 2011. Analysis of outer membrane vesicle protein involved in biofilm formation of Helicobacter pylori. Anaerobe. V. 17. P. 388.
Yoo J.Y., Rho M., You Y.A., Kwon E.J., Kim M.H., Kym S., Jee Y.K., Kim Y.K. Kim Y.J. 2016. 16S rRNA gene-based metagenomic analysis reveals differences in bacteria-derived extracellular vesicles in the urine of pregnant and non-pregnant women. Exp. Mol. Med. V. 48. P. e208. https://doi.org/10.1038/emm.2015.110
Дополнительные материалы отсутствуют.


