Цитология, 2021, T. 63, № 1, стр. 74-79
Применение лазерной интерференционной микроскопии для оценки функционального состояния эритроцитов
А. В. Дерюгина 1, М. Н. Иващенко 2, *, А. А. Белов 2, П. С. Игнатьев 3, В. Б. Метелин 4
1 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
2 Нижегородская государственная сельскохозяйственная академия
603107 Нижний Новгород, Россия
3 Производственное объединение “Уральский оптико-механический завод им. Э.С. Яламова”
620100 Екатеринбург, Россия
4 Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского
129110 Москва, Россия
* E-mail: kafedra2577@mail.ru
Поступила в редакцию 24.07.2020
После доработки 11.10.2020
Принята к публикации 12.10.2020
Аннотация
Проведена оценка потенциальных возможностей лазерной интерференционной микроскопии при неинвазивном исследовании динамики показателей морфофункционального состояния эритроцитов периферической крови, подвергнутых в условиях in vitro воздействию адреналина (10–9 г/мл), кортизола (5 × 10–7 г/мл), бета-адреноблокатора пропранолола (10–9 г/мл) и глутарового альдегида (0.1%). Параллельно в эритроцитах определяли концентрацию малонового диальдегида, аденозинтрифосфорной кислоты и 2,3-дифосфоглицерата. Полученные результаты продемонстрировали зависимость оптико-геометрических характеристик эритроцитов от особенностей их структурно-функциональной организации. Усиление метаболической активности клеток на фоне снижения окислительного потенциала при воздействии на эритроциты кортизола и пропранолола сопровождалось уменьшением фазовой высоты эритроцитов на 18 и 29% (p < 0.05) и уменьшением фазового диаметра на 3 и 5% соответственно (p < 0.05). Снижение метаболической активности на фоне усиления окислительного стресса при воздействии на красные клетки крови адреналина и глутарового альдегида вызывало увеличение либо фазовой высоты, либо фазового диаметра клеток. Полученные результаты демонстрируют, что лазерная интерференционная микроскопия позволяет в режиме реального времени проводить метаболическую оценку состояния живых эритроцитов, что повышает информативность и объективизирует данные о морфологических особенностях и функциональных возможностях клеток.
Лазерная интерференционная микроскопия считается высокоинформативным методом неинвазивного исследования состояния биологических объектов. Высокое пространственное разрешение, количественный характер получаемой информации и отсутствие необходимости применения дорогостоящих красителей позволяют использовать этот метод в качестве универсального инструмента для исследования структурно-функциональных особенностей живой клетки (Popescu, Park, 2015; Vasilenko et al., 2015).
Показано, что при измерениях с помощью лазерного интерференционного микроскопа оптически однородных, хорошо отражающих свет объектов, достигается разрешение порядка 0.1 нм по вертикали и 15–100 нм – в плоскости объекта, что значительно превышает классический предел световых микроскопов (Tychinsky, Tikhonov, 2010). Кроме того, важное преимущество интерференционной микроскопии заключается в том, что регистрируемая величина оптической разности хода лучей в интерферометре позволяет получать количественную информацию об объемном распределении показателя преломления объекта, отражающего не только его морфологические особенности, но и функциональное состояние (Jiang, Yin, 2016; Cherkezyan et al., 2017).
Однако отсутствие эффективного и универсального подхода к интерпретации результатов измерения физических параметров света, рассеянного объектом, приводит к недопустимому сужению круга исследуемых объектов и числа анализируемых параметров (Болотова и др., 2017; Василенко и др., 2018).
Изучение динамики морфологической структуры и функционального состояния эритроцитов всегда вызывало повышенный интерес, обусловленный участием этих клеток в разнообразных процессах поддержания гомеостаза всего организма. Поэтому получение новых данных об изменении поверхностной архитектоники, размеров, конфигурации и конформационной перестройки внутриклеточного гемоглобина может иметь фундаментальное и практическое значение для диагностики состояния нормы и патологии в медицине и биологии (Воробьева и др., 2018; Farag, Alagawany, 2018; Дерюгина и др., 2019).
В связи с этим цель нашего исследования – выявления возможностей лазерной интерференционной микроскопии для получения новой количественной информации о метаболических процессах в эритроцитах, подвергнутых в условиях in vitro направленному воздействию различных модифицирующих агентов.
МАТЕРИАЛ И МЕТОДИКА
Исследовали 30 образцов венозной крови практически здоровых доноров-добровольцев – лиц обоего пола в возрасте от 21 до 49 лет. Кровь отбирали из кубитальной вены в вакуумные пробирки, содержащие гепарин (20–50 Ед. на 1 мл крови).
Микроскопию эритроцитов проводили на лазерном интерференционном микроскопе МИМ-340 (Россия, Екатеринбург), использовали лазер с длиной волны 650 нм и объектив с увеличением 30×. Для захвата изображений применяли видеокамеру VS-415U (НПК Videoscan, Россия) с разрешением 782 × 582 пикселей.
Основой аппаратно-программного комплекса МИМ-340 служит классическая схема интерфереометра Линника, которая подразумевает разделение одного плоскопараллельного пучка когерентного источника света на два идентичных. Первый проходит через объект исследования, второй является опорным и движется по другому оптическому пути. После объединения двух лучей формируется интерференционная картина, которая фиксируется на матрице видеокамеры. Фаза световых волн, прошедших через исследуемую клетку, меняется от интегральных характеристик клеточного вещества, таких как химический состав, концентрация и конформационное состояние молекул. Это отражается в распределении фазовой толщины, закодированной в цифровом виде в топограмме, которая является проекцией суммарного вклада клеточного вещества в сдвиг фазы световой волны, проходящей через каждый участок препарата, соответствующий одному пикселю. В топограммах клеток анализировали значения фазовой толщины Δh и диаметра эритроцита D, как представлено на рис. 1.
Рис. 1.
Фазовое изображение (топограмма) (а) и профиль фазовой толщины (б) нормального эритроцита (дискоцита).
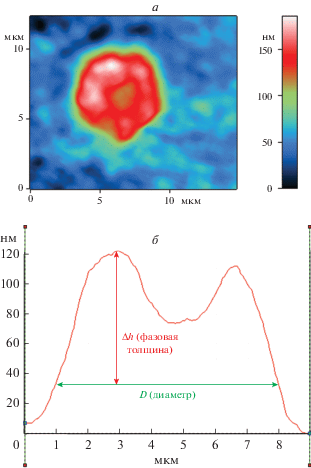
Для объективной оценки метода получали изображения 10 участков с монослойным расположением клеток и рассчитывали морфометрические показатели, используя не менее 100 эритроцитов каждого образца.
В условиях in vitro эритроциты инкубировали с соединениями, меняющими их метаболический потенциал: с адреналином (1 × 10–9 г/мл, серия 1) и кортизолом (5 × 10–7 г/мл, серия 2) – основными стресс-реализующими гормонами; глутаровым альдегидом (0.1%-ный раствор, серия 3) – фиксатором белковых структур мембран эритроцитов и пропранололом (1 × 10–9 г/мл, серия 4) – неселективным адреноблокатором β-адренорецепторов. Время воздействия препаратов составило 30 мин, за исключением адреналина (15 мин). В каждой серии было по 12 проб.
Функциональные показатели красных клеток крови определяли по содержанию малонового диальдегида (МДА), аденозинтрифосфорной кислоты (АТФ) и 2,3-дифосфоглицерата (2,3-ДФГ) в эритроцитах.
Концентрацию МДА определяли с помощью реакции с тиобарбитуровой кислотой по образованию окрашенного триметинового комплекса с максимумом поглощения при 532 нм (Крылов и др., 2015). Для расчета концентрации использовали коэффициент молярной экстинции: E = 1.56 × 10–5 М–1 см–1.
Содержание главных фосфоорганических соединений 2,3-ДФГ и АТФ эритроцитов исследовали неэнзиматическим методом, определяя неорганический фосфор (Фн) в гидролизатах эритроцитов фотоэлектроколориметрически. Отмытые эритроциты (1 мл) гемолизировали холодной дистиллированной водой (2 мл) в течение 20 мин, белки осаждали 12% трихлоруксусной кислотой (ТХУ) (2 объема), а осадок отделяли центрифугированием при 3000 об./мин в течение 15 мин с последующим фильтрованием надосадочной жидкости через бумажный фильтр. ТХУ фильтрат гемолизированных эритроцитов использовали для определения АТФ и 2,3-ДФГ. При определении АТФ к 1 мл ТХУ фильтрата добавили 1 мл 2 н НС1 и проводили гидролиз в кипящей водяной бане 7 мин с последующим охлаждением и нейтрализацией равным объемом 2 н NaOН. Определяли Фн, в состав которого входил Фн, отщепившийся от АТФ после гидролиза, и Фн до гидролиза. Для определения 2,3-ДФГ из ТХУ фильтрата гемолизированных эритроцитов удаляли нуклеотиды (АТФ, АДФ, АМФ) путем адсорбции на активированном угле с последующим центрифугированием. В супернатанте (0.5 мл) определяли Фн-1 (пробирка 1). Часть ТХУ фильтрата (0.5 мл) подвергали озолению, добавляя 0.5 мл 5% раствора нитрата магния, кипятили и после охлаждения содержимое пробирки растворяли в 0.5 мл 0.36 M КН2Р04. В 0.5 мл супернатанта измеряли Фн-2 (пробирка 2). Определяли Фн в каждой пробирке, регистрируя плотность окраски на фотометре фотоэлектрическом КФК-3 (длина волны 660 нм). Концентрацию Фн определяли по калибровочной кривой, используя стандартный раствор КН2РO4. Расчет концентрации 2,3-ДФГ проводили по формуле (Фн-1 × 100 – Фн × 10)/2. (Виноградова и др., 1980; Бояринов и др., 2016).
Данные, полученные в ходе исследования, были статистически обработаны с расчетом средней величины и ошибки средней. Достоверность различий оценивали по t-критерию Стьюдента при уровне значимости p < 0.05. Статистический анализ полученных результатов выполняли с использованием программы Microsoft Exel и пакета прикладных программ Statistika версия 6.0.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В рамках настоящего исследования проведены измерения интегрального показателя преломления эритроцитов, подвергнутых направленному воздействию модифицирующих агентов.
Анализ оптико-геометрических параметров показал, что фазовая высота эритроцитов, инкубированных с кортизолом (5 × 10–7 г/мл), пропранололом (1 × 10–9 г/мл) и глутаровым альдегидом (0.1%) снижалась относительно контроля на 18, 29 и 19% соответственно (p < 0.05). В то же время после инкубации с адреналином (1 × 10–9 г/мл) наблюдали рост фазовой высоты эритроцитов на 3% (p < 0.05).
Фазовый диаметр эритроцитов относительно значений контрольной группы увеличивался после инкубации клеток с глутаровым альдегидом (0.1%) на 8% (p < 0.05), а после действия кортизола (5 × 10–7 г/мл), адреналина (1 × 10–9 г/мл) или пропранолола (1 × × 10–9 г/мл), напротив, снижался на 3, 2 и 5% соответственно (p < 0.05) (табл. 1).
Таблица 1.
Действие разных агентов in vitro на оптико-геометрические показатели эритроцитов
| Агент | Фазовый диаметр эритроцитов, мкм (М ± m) |
Фазовая высота эритроцитов, нм (М ± m) |
|---|---|---|
| − (Контроль) | 4.75 ± 0.03 | 256.8 ± 4.66 |
| Адреналин | 4.68 ± 0.03а | 265.0 ± 4.62а |
| Глутаровый альдегид | 5.12 ± 0.06а | 207.9 ± 2.87а |
| Пропранолол | 4.51 ± 0.05а | 182.8 ± 2.76а |
| Кортизол | 4.63 ± 0.03а | 211.3 ± 6.09а |
При оценке показателей метаболизма эритроцитов установлено, что после воздействия модифицирующих агентов концентрация маркерного субстрата кислородного обеспечения – 2,3-ДФГ – во всех случаях значительно снижалась.
Влияние используемых соединений на энергетический потенциал красных клеток крови было подтверждено изменением содержания АТФ под их воздействием. Выявлено статистически значимое повышение содержания АТФ в эритроцитах после их инкубации с кортизолом (5 × 10–7 г/мл) на 9%, пропранололом (1 × 10–9 г/мл) на 5% и статистически значимое снижение – под воздействием адреналина (1 × 10–9 г/мл) на 35% и глутарового альдегида (0.1%) на 8%.
Концентрация МДА в эритроцитах, характеризующего интенсивность перекисного окисления липидов, значимо снижалась на 45% при действии кортизола (5 × 10–7 г/мл), на 47% при действии пропранолола (1 × 10–9 г/мл) и увеличивалась при действии адреналина (1 × 10–9 г/мл) и глутарового альдегида (0.1%) на 27 и 17% соответственно (табл. 2).
Таблица 2.
Концентрация 2,3-ДФГ, АТФ и МДА в эритроцитах с модификацией структуры
| Агент | 2,3-ДФГ, мкмоль/л | АТФ, мкмоль/л |
МДА, нмоль/мл |
|---|---|---|---|
| − (Контроль) | 3.28 ± 0.55 | 1.82 ± 0.33 | 0.90 ± 0.06 |
| Кортизол | 2.11 ± 0.35а | 1.99 ± 0.27а | 0.50 ± 0.10а |
| Адреналин | 2.38 ± 0.26а | 1.19 ± 0.17а | 1.15 ± 0.08а |
| Пропранолол | 2.30 ± 0.34а | 1.92 ± 0.44а | 0.48 ± 0.10а |
| Глутаровый альдегид | 2.49 ± 0.53а | 1.67 ± 0.40а | 1.05 ± 0.08а |
Можно предположить, что усиление метаболической активности клеток на фоне снижения окислительного потенциала при воздействии на эритроциты стрессового гормона кортизола и неселективного адреноблокатора β-адренорецепторов пропранолола обеспечивает мембраностабилизирующий эффект, фосфорилирование интегральных и периферических белков эритроцитарной мембраны, вызывающих изменение морфологии эритроцитов, которое, вероятно, направлено на повышение эффективности прохождения эритроцитами микрокапилляров и улучшение реологии крови (Takakuwa, 2000; Nunomura et al., 2006).
Снижение метаболической активности на фоне усиления окислительного стресса при воздействии на красные клетки крови стресс-гормона адреналина и глутарового альдегида вызывает увеличение либо фазовой высоты, либо фазового диаметра, что ухудшает пластичность эритроцитов и их прохождение через микрокапилляры.
По нашему мнению, увеличение фазовой высоты эритроцитов при действии адреналина может быть следствием окислительного стресса, развивающегося на фоне метаболического истощения клеток. Снижение содержания АТФ в эритроцитах ведет к ряду нарушений, в частности, к блокированию работы ионных насосов, изменению ионного баланса и снижению способности клеток к деформации (Zarkovic et al., 2013).
Увеличение фазового диаметра эритроцитов после действия глутарового альдегида может объясняться его влиянием на подмембранный цитоскелет клеток. При этом увеличение уровня МДА в эритроцитах способствует образованию сшивок между фосфолипидами и белками мембраны, что приводит к изменению ионной проницаемости мембран, снижению активности гликолиза (Bura, Сimen, 2008) и как следствие к изменению оптико-геометрических показателей эритроцитов.
Из полученных результатов следует вывод о зависимости фазово-интерференционных изображений эритроцитов от функционального состояния клеток. Применение лазерной интерференционной микроскопии позволяет исследовать метаболическое состояние эритроцитов, что дает возможность анализировать физиологический статус клеток и раскрывает широкие возможности использования этого метода в медицине. Метод может оказаться эффективным при определении состояния нормы или патологии, а также для оценки адекватности лечебной коррекции выявленных нарушений. Получение с помощью лазерной интерференционной микроскопии качественно новой информации, недоступной при традиционных подходах, будет способствовать пониманию некоторых вопросов, касающихся структуры и функции эритроцитов, закономерностей поведения клетки в условиях нормального функционирования, их возможных нарушений при различных патологических состояниях, а также при направленном воздействии физическими, химическими или биологическими факторами.
Список литературы
Болотова А.А., Звержховский В.Д., Вышенская Т.В., Кретушев А.В., Евдокимов А.А. 2017. Информативность фазовых изображений биологических клеток. В кн.: Информатика и технологии. Инновационные технологии в промышленности и информатике (“МНТК ФТИ-2017”). М.: МИРЭА. № 23. С. 616. (Bolotova A.A., Zverzhkhovskij V.D., Vyshenskaya T.V., Kretushev A.V., Evdokimov A.A. 2017. Information content of phase images of biological cells. In: Computer science and technology. Innovative technologies in industry and informatics ("ISTC FTI-2017”). Collection of proceedings. M.: MIREA. № 23. P. 616.)
Бояринов Г.А., Дерюгина А.В., Яковлева Е.И., Зайцев Р.Р., Шумилова А.В., Бугрова М.Л., Бояринова Л.В., Филиппенко Е.С., Соловьева О.Д. 2016. Фармакологическая коррекция микроциркуляции крыс, перенесших черепно-мозговую травму. Цитология. Т. 58. № 8. С. 610. (Boyarinov G.A., Deryugina A.V., YAkovleva E.I., Zajcev R.R., SHumilova A.V., Bugrova M.L., Boyarinova L.V., Filippenko E.S., Solov’eva O.D. 2016. Pharmacological correction of microcirculation in rats with traumatic brain injury. Tsitologiya. V. 58. № 8. P. 610.).
Василенко И.А., Метелин В.Б., Игнатьев П.С., Кардашова З.З., Лифенко Р.А. 2018. Диалог с клеткой: диагностическая real-time технология на основе лазерной интерферометрии. Альманах клинической медицины. Т. 46. № 8. С. 748. (Vasilenko I.A., Metelin V.B., Ignat’ev P.S., Kardashova Z.Z., Lifenko R.A. 2018. Dialogue with the cell: real-time diagnostic technology based on laser interferometry. Almanac Clin. Med. V. 46. № 8. P. 748.)
Виноградова И.Л., Багрянцева С.Ю., Дервиз Г.В. 1980. Метод одновременного определения 2,3-ДФГ и АТФ в эритроцитах. Лабораторное дело. № 7. С. 424. (Vinogradova I.L., Bagryanceva S.YU., Derviz G.V. 1980. Method for simultaneous determination of 2,3-DPH and ATP in red blood cells. Laboratornoe Delo. № 7. P. 424.)
Воробьева Н.В., Котова О.В., Уколова Г.Б., Зацепин В.И., Хабибулина Т.В., Бекетов И.Н. 2018. Физиологическая реакция микрореологических свойств эритроцитов у лиц второго зрелого возраста с низкой физической активностью на начало регулярных физических нагрузок. Вестник биомед. социол. Т. 3. № 2. С. 100. (Vorob’eva N.V., Kotova O.V., Ukolova G.B., Zacepin V.I., Habibulina T.V., Beketov I.N. 2018. Physiological response of microrheological properties of red blood cells in second-age adults with low physical activity at the beginning of regular physical activity. Bulletin Biomed. Sociol. V. 3. № 2. P. 100.)
Дерюгина А.В., Иващенко М.Н., Игнатьев П.С., Лодяной М.С., Самоделкин А.Г. 2019. Изменение фазового портрета и электрофоретической подвижности эритроцитов при различных видах заболеваний. Современные технологии в медицине. Т. 11. № 2. С. 63. (Deryugina A.V., Ivashchenko M.N., Ignat’ev P.S., Lodyanoj M.S., Samodelkin A.G. 2019. Alterations in the phase portrait and electrophoretic mobility of erythrocytes in various diseases. Sovremennye Tehnologii v Medicine. V. 11. № 2. P. 63.)
Крылов В.Н., Дерюгина А.В., Плескова С.Н., Калинин В.А. 2015. Апоптозный характер гемолиза эритроцитов, индуцированный малыми дозами ионизирующей радиации. Биофизика. Т. 60. № 1. С. 102. (Krylov V.N., Deryugina A.V., Pleskova S.N., Kalinin V.A. 2015. The apoptotic nature of the hemolysis of erythrocytes induced by low doses of ionizing radiation. Biophysics. V. 60. № 1. P. 102.)
Burak Cimen M.Y. 2008. Free radical metabolism in human erythrocytes. Clinica Chimica Acta. V. 390. P. 1.
Farag M.R., Alagawany M. 2018. Erythrocytes as a biological model for screening of xenobiotics toxicity. Chem. Biol. Interact. V. 279. P. 73.
Jiang W., Yin Z. 2016. Seeing the invisible in differential interference contrast microscopy images. Med. Image Anal. V. 34. P. 65.
Nunomura W., Takakuwa Y. 2006. Regulation of protein 4.1R interactions with membrane proteins by Ca2+ and calmodulin. Front. Biosci. V. 11. P. 1522.
Popescu G., Park Y. 2015. Quantitative phase imaging inbiomedicine. J. Biomed. Opt. V. 20. P. 111201.
Takakuwa Y. 2000. Protein 4.1. a multifunctional protein of the erythrocyte membrane skeleton: Structure and functions in erythrocytes and nonerythroid cells. Int. J. Hematol. V. 72. P. 298.
Tychinsky V.P., Tikhonov A.N. 2010. Interference microscopy in cell biophysics. 1. Principles and methodological aspects of coherent phase microscopy. Cell Biochem. Biophys. V. 58. P. 107.
Vasilenko I., Metelin V., Nasyrov M., Kuznetsov A., Sukhenko E., Belyakov V. 2015. Quantitative phase imaging of cellular and subcellular structures for non-invasive screening diagnostics of socially significant diseases. J. Biomed. Optics. V. 3. P. 231.
Zarkovic N., Cipak A., Jaganjac M., Borovic S. 2013. Pathophysiological relevance of aldehydic protein modifications. J. Proteomics. V. 92. P. 239.
Дополнительные материалы отсутствуют.


