Цитология, 2021, T. 63, № 1, стр. 63-73
Влияние криоконсервации на стабильность кариотипа трансформированных фибробластов легкого китайского хомячка in vitro
Т. М. Гринчук 1, *, М. А. Шилина 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: grintat@bk.ru
Поступила в редакцию 02.09.2020
После доработки 02.10.2020
Принята к публикации 02.10.2020
Аннотация
Вопрос о влиянии криозаморозки на стабильность генома клеток разного генотипического статуса остается открытым. В настоящей работе представлены результаты изучения влияния криозаморозки разной длительности на стабильность кариотипа фибробластов китайского хомячка линии СHL V-79 RJK, характеризующихся повышенной кариотипической стабильностью в стандартных условиях культивирования. Установлено, что реакция генома клеток СHL V-79 RJK на криозаморозку в зависимости от ее продолжительности далеко не однозначна. После длительного (10 лет) пребывания в жидком азоте при температуре –196°С, в отличие от краткосрочной криозаморозки (3, 6 мес.) клетки демонстрируют тенденцию к разнотипной дестабилизации структуры кариотипа, а именно: к анеуполиплоидизации, увеличению пула хромосом, вовлекаемых в перестройки, к нарушению степени конденсации отдельных хромосом, к повышенному слипанию негомологичных хромосом (эктопическая конъюгация). Полученные данные говорят в пользу того, что многолетнее пребывание клеток в условиях глубокой заморозки может нарушить механизм клеточного деления и повлечь за собой дестабилизацию клеточного генома.
Разработка методов криоконсервации берет свое начало с первой половины ХХ в. Ее родоначальником считается английский ученый Эрнест Джон, который открыл криопротекторные свойства глицерина. Со временем метод криоконсервации был взят на вооружение и стал широко использоваться в разных областях биологии и медицины.
К настоящему времени накоплены данные о том, что скорость и температура криозаморозки, типы криопротекторов, используемые в процессе криоконсервации, реактивы, скорость и температура разморозки могут повлиять на физиологический и генетический статус клеток. Так, криоконсервация/декриоконсервация эмбриональных клеток человека вызывала их апоптоз и дифференцировку c последующей потерей их плюрипотентности и низкую выживаемость после разморозки (Pera et al., 2000; Reubinoff et al., 2000; Ji et al., 2004; Heng et at., 2005).
Подборке условий криохранения посвящено множество работ. На данный момент большинство протоколов криозаморозки клеток оптимизированы и большинство исследователей в своей работе используют стандартные протоколы. Однако проблеме влияния самой процедуры криоконсервации и длительного хранения на клеточный геном по сей день уделено мало внимания.
Современные методы криоконсервации делятся на две группы (He, 2011): медленное замораживание и сверхбыстрое замораживание (витрификация). Наиболее распространеная медленная криконсервация позволяет замораживать клетки при низком содержании криопротекторов. Скорость медленного замораживания (при добавлении 1.5 М криопротекторов) для большинства клеток составляет 1°C/мин (Zhang et al., 2011), что обеспечивает большее выживание клеток. Повреждения клеток, вызываемые воздействием криопротекторов, вне- и внутриклеточным образованием льда, а также осмотической дегидратацией клеток под действием давления, неизбежны даже после оптимизации условий процессов замораживания–оттаивания. В этой связи возникновение разнотипных стрессовых ситуаций при криоконсервировании клеток in vitro вызывает беспокойство о физиологической и генетической их стабильности после криоконсервации. Использование в исследовательских, биоинженерных, медицинских и коммерческих целях различных по происхождению клеточных линий требует их генетической стабильности. В основе стабильности генома лежит точность прохождения в процессе клеточного цикла определенной последовательности событий, направленных на воспроизведение генетического материала в дочерних клетках. Нарушения на уровне репликации, репарации, сегрегации хромосом, удвоения центриолей, формирования веретена деления ведут к генетическим дефектам потомства (Diaferia et al., 2008; Tan et al., 2019).
Возникающие изменения могут носить как спонтанный характер, так, и индуцированный, вызванный теми или иными факторами. Спонтанные изменения в своем большинстве относятся к числу неклональных (случайных) и встречаются с низкой частотой. Повторяющиеся в пределах популяции специфические изменения идентифицируются как селективные (Rangel et al., 2017).
Известно, что основные типы кариотипической нестабильности связаны с полиплоидизацией кариотипа и изменением структуры хромосом. Изменение геномной архитектоники, сопряженной с изменением профиля генной экспрессии, может стать причиной генетических заболеваний, озлокачествления клеток и ускоренного клеточного старения (Wang et al., 2005; Tang et al., 2012).
Имеющиеся на данный момент сведения о влиянии криозаморозки на клеточный геном являются далеко не полными и разноречивыми (deLima Prata et al., 2012). С одной стороны, широко распространено мнение о том, что криоконсервация, в частности краткосрочная (от нескольких дней до нескольких недель), не влияет и даже поддерживает фенотипическую и генотипическую стабильность клеток (deLima Prata et al., 2012; Polchow et al., 2012; Imaizumi et al., 2014). С другой стороны, существуют работы, указывающие на то, что после криозаморозки фенотип клеток может измениться (Duarte et al., 2012). При этом могут претерпеть модификационные изменения важнейшие клеточные элементы – мембраны, лизосомы, митохондрии, генетический аппарат (Полянская и др., 1990). На клеточных линиях грызунов (как трансформированных, так и не трансформированных) показано, что после декриоконсервации возможен обратимый усиленный внеплановый синтез ДНК, существенно превосходящий исходный уровень (Семенова, 1988).
В связи с тем, что вопрос о влиянии криозаморозки на стабильность генома клеток разного генотипического статуса остается не ясным, в настоящей статье представлены результаты изучения влияния криозаморозки на стабильность кариотипа. Объектом настоящего исследования были выбраны трансформированные фибробласты легкого китайского хомячка (линия CHL V-79 RJK), характеризующиеся повышенной кариотипической стабильностью.
Целью настоящей работы было проследить динамику кариотипических изменений клеток линии CHL V-79 RJK в связи с неоднократным применением в процессе культивирования процедуры криозаморозки и криохранения разной продолжительности.
МАТЕРИАЛ И МЕТОДИКА
Клеточный материал. В настоящей работе были использованы клетки фибробластов легкого китайского хомячка постоянной трансформированной линии CHL V-79 RJK. Клеточная культура CHL V-79 RJK была предоставлена для работы доктором Ф. Раддлом (Йельский Университет, США).
Культивировали клетки в стандартных условиях (5% СО2, 37°С) с использованием культуральной среды ДМЕМ/F12 (Gibco, США) с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США), 1% пенициллина–стрептомицина (Gibco, США). Клетки пересевали с помощью 0.05%-ного раствора трипсина и EDTA (Gibco, США) в соотношении 1 : 4–1 : 6. Для культивирования использовали флаконы Т25 и Т75 (Fisher Scientific, США).
Криоконсервация. Клетки, открепленные с помощью 0.05%-ного раствора трипсина и EDTA, помещали в пробирку, к ним добавляли культуральную среду и центрифугировали со скоростью 1500 об./мин в течение 5 мин. Супернатант удаляли, осадок разбивали и ресуспензировали в растворе 90%-ной бычьей эмбриональной сыворотки, содержащей 10% DMSO (Sigma, США). Ресуспензированные клетки переносили в криовиалы (Nunc, США) и замораживали со скоростью 1°С/мин, с последующим хранением в жидком азоте (–196°С). При разморозке ампулу с клетками быстро нагревали в водяной бане при 37°С. Клетки переносили в центрифужную пробирку, добавляли теплую ростовую среду и центрифугировали при 1750 об./мин в течение 5 мин. Отмытые от DMSO клетки помещали в культуральные флаконы.
Кариотипирование. В клеточную культуру для накопления клеток в стадии метафазы добавляли колхицин (Merk, США) в конечной концентрации 3.6 мкг/мл на 1 ч. Затем среду с колхицином удаляли, клетки ферментативно, с помощью 0.05%-ного трипсина, открепляли от пластика, собирали в центрифужные пробирки, суспензию центрифугировали (1000 об./мин), супернатант удаляли, осадок ресуспензировали, проводили обработку клеток 0.56%-ным раствором КСl (Реахим, Россия) в течение 15–20 мин. После удаления гипотонического раствора клетки фиксировали на холоде смесью метанола с ледяной уксусной кислотой (3 : 1) (3 смены фиксатора, общее время фиксации 1.5 ч). Фиксированный материал раскапывали на охлажденные влажные предметные стекла. Препараты в течение 1 нед. высушивали при комнатной температуре, после чего метафазные пластинки окрашивали на G-диски красителем Гимза (BDH, Англия) в PBS после их предварительной трипсинизации (0.25%-ный трипсин (Биолот)). Метафазные пластинки анализировали под световым микроскопом Ampleval (Zeiss, Германия) при увеличениях объектива 20× и 100×. Хромосомы идентифицировали в соответствии со стандартной номенклатурой (Ray, Mohandas, 1975).
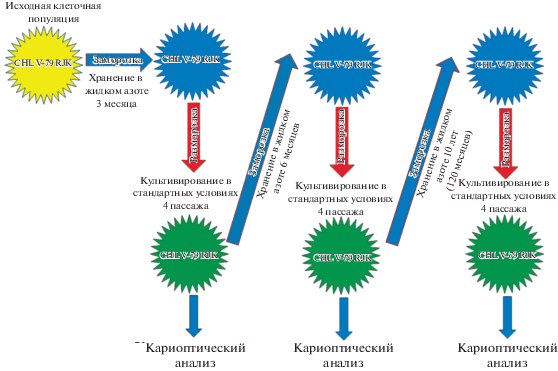
Схема эксперимента представлена на рис. 1. Исходную клеточную популяцию подвергли криозаморозке с хранением в жидком азоте в течении 3 мес., после чего клетки были разморожены и их культивировали в течении 4 пассажей в стандартных условиях. На четвертом пассаже часть клеток была подвергнута кариотипическому анализу, а часть – криозаморозке. В новой заморозке было увеличено время пребывания клеток в жидком азоте в 2 раза, до 6 мес. Через 6 мес. клетки разморозили и культивировали, как и в первый раз, 4 пассажа. На четвертом пассаже часть клеток была подвергнута кариотипическому анализу, а часть – криозаморозке. Длительность 3-го периода хранения клеток в азоте была значительно больше, чем в первые две заморозки, клетки хранили в течении 10 лет (120 мес.). После этого клетки разморозили и прокультивировали до 4-ого пассажа. На четвертом пассаже после разморозки клетки были подвергнуты кариотипическому анализу.
РЕЗУЛЬТАТЫ
Кариотип клеток CHL V-79 RJK является анеуплоидным и представлен 4 неперестроенными хромосомами, типичными для клеток китайского хомячка в норме (две копии хромосомы 2, хромосомы 3 и 8 – по одной копии) и 15 уникальными перестроенными хромосомами (Z1–Z15), являющихся маркерами линии (рис. 2а). Модальный класс числа хромосом в клетках выражен и представлен 17–19 хромосомами. Стабильность структуры хромосомы Z2, равно как и ее присутствие в кариотипическом наборе не постоянно. Самые короткие хромосомы Z14 и Z15 в единичных случаях отсутствуют, либо представлены двумя копиями. В проанализированной популяции только одна клетка имела кариотипическое нарушение, связанное с наличием делеции в длинном плече хромосомы Z3 (рис. 2б, табл. 1). Анеуполиплоидные клеточные варианты отсутствовали.
Рис. 2.
Кариотип клеток китайского хомячка линии CHL V-79 RJK до первой процедуры криозаморозки/разморозки. а – Стандартный кариотип. N = 18. Хромосомы 2, 3, 8 не перестроены; Z1–Z15 – маркеры линии. Хромосома Z15 – отсутствует. б – Кариотип с перестройкой. N = 18. Z4 delq – делеция длинного (q) плеча хромосомы Z4, отсутствие хромосомы Z2.
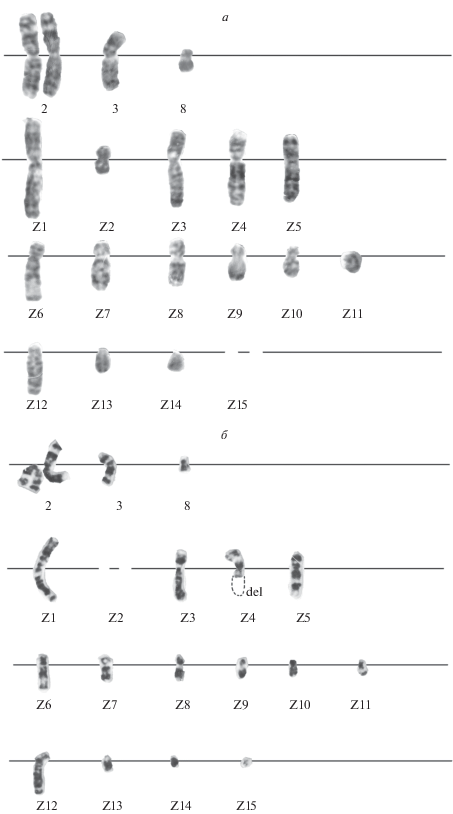
Таблица 1.
Кариотипические особенности клеток линии CHL V-79 RJK после криохранения различной продолжительности
| Кариотипические отклонения в клетках CHL V-79 RJK (контроль) | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро №, пп |
Хромосомы | ||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | delq | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 2 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 3 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | – | n | n |
| 4 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 5 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | 2n |
| 6 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 7 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 8 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 9 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | – | n | n |
| 10 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 11 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 12 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 13 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 14 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | – | n | n |
| 15 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 16 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| Кариотипические отклонения в клетках CHL V-79 RJK через 3 мес. хранения в жидком азоте | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро №, пп |
Хромосомы | ||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 2 | n | 2n | n | n | n | n | n | n | n | n | n | – | n | n | n | n | n |
| 3 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 4 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 5 | n | 2n | n | n | n | n | n | n | – | n | n | n | n | n | n | n | n |
| 6 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 7 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | 2n |
| 8 | n | 2n | n | n | n | n | n | n | delqter | n | n | n | n | n | n | 2n | 2n |
| 9 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 10 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 11 | n | 2n | n | n | n | n | n | n | n | n | n | – | n | n | n | n | n |
| 12 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 13 | n | 2n | p+q | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 14 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 15 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 16 | n | 2n | n | n | n | n | n | n | n | pdel | n | n | n | n | n | n | n |
| Кариотипические отклонения в клетках CHL V-79 RJK через 6 мес. хранения в жидком азоте | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро №, пп |
Хромосомы | ||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 2 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 3 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 4 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | – | n | n |
| 5 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 6 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 7 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 8 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 9 | 2n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 10 | n | 2n | n | n | n | n | n | n | n | n + (delqter) | n | n | n | n | n | n | n |
| 11 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | 2n | 2n |
| 12 | n | 2n | delqter | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 13 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 14 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 15 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 16 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 17 | delp | 2n | n | n | n | n | n | n | n | n | n | n | – | n | n | n | n |
| Кариотипические отклонения в клетках CHL V-79 RJK через 10 лет хранения в жидком азоте | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ядро №, пп |
Хромосомы | ||||||||||||||||
| Z1 | 2 | Z3 | Z4 | Z12 | Z6 | Z5 | 3 | Z7 | Z8 | Z9 | Z10 | Z11 | Z13 | 8 | Z14 | Z15 | |
| 1 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 2 | n | 2n | n | n | n | n | n | n | n | n | n | n | – | n | n | n | n |
| 3 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 4 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 5 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 6 | n | 2n | p + q | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 7 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | – | n | n |
| 8 | n | 2n | n | – | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 9 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 10 | n | 2n | delpter | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 11 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | 2n |
| 12 | n | 2n | n + (p + q) | n | n | n | n | n | n | – | n | n | n | n | n | n | n |
| 13 | n | 2n | brqter | n + delq | n | n | n | n | n | 2n | n | n | n | n | n | n | n |
| 14 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 15 | n | 2n | n | n | n | n | n | n | – | n | n | n | n | n | n | n | n |
| 16 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 17 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 18 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 19 | 2n | 4n | 2n + delqter | n | 2n | 2n | 2n | 2n | 2n | n + trZ3ter | n | 2n | n | n | 2n | n | n |
| 20 | n | 2n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 21 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 22 | 2n | 3n+delq | brqter | n | n | n | n | n | n | n | 2n | n | 2n | n | n | n | n |
| 23 | n | 2n | n | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 24 | n | 2n | brqter | n | n | n | n | n | n | n | n | n | n | n | n | n | n |
| 25 | 2n | 2n | 3n | 2n | 2n | 2n | 2n | 2n | 2n | 2n | 2n | n | 2n | 2n | 2n | 2n | 2n |
| 26 | n + delqter | 3n+ trZ1qter | 2n | 2n | 2n | 2n | n + delpter | 2n | 2n | 2n | 2n | n | – | 2n | 2n | 2n | 2n |
Обозначения: n – нормальная хромосома; 2n – две копии нормальной хромосомы; (–) – отсутствие хромосомы; delp – делеция p-плеча; delq – делеция q-плеча; p + q – прицентромерная поломка с сохранением материала; n + (p + q) – 1 нормальная копия и 1 копия с прицентромерной поломкой; delqter – терминальная поломка в q-плече; delpter – терминальная поломка в p-плече; n + delqter – 1 нормальная копия плюс 1 копия с терминальной делецией q-плеча; tr – межхромосомная транслокация; brqter – терминальная поломка в q-плече с сохранением материала.
Работа по изучению влияния криозаморозки разной продолжительности на стабильность кариотипа клеток CHLV-79 RJK состояла из 2-х этапов: 1) анализа структуры кариотипа данных клеток после заморозки/разморозки с краткосрочным (3 и 6 мес.) хранением их в жидком азоте; 2) изучения влияния на клеточный геном многолетнего (10 лет) хранения клеток в жидком азоте при температуре –196°С.
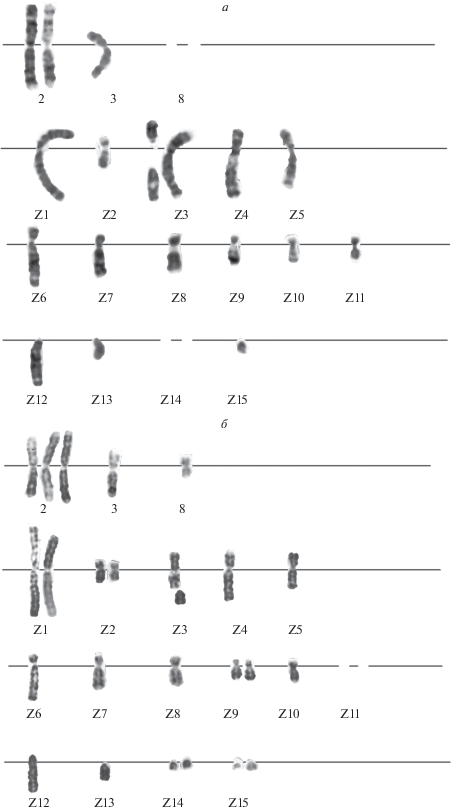
Кариотипический анализ клеток после первой краткосрочной заморозки (3 мес. в жидком азоте) выявил в структуре кариотипа единичные структурные нарушения хромосом, а именно хромосом Z3, Z7 и Z8. В одной из клеток наблюдалось отсутствие хромосомы (Z10) (рис. 3, табл. 1). Каждая из выявленных перестроек в проанализированной популяции встретилась однократно.
Рис. 3.
Кариотип клеток CHL V-79 RJK после первой процедуры криозаморозки/разморозки с краткосрочным (3 мес.) хранением в жидком азоте. Терминальная делеция q-плеча хромосомы Z7 и отсутствие хромосомы Z2. N = 20.

Кариотипический анализ клеток после второй заморозки (6 мес. в жидком азоте) также не выявил закономерных изменений в структуре кариотипа. В перестройки оказались вовлечены четыре хромосомы, а именно: хромосомы Z1, Z3, Z4 и Z8 (рис. 4, табл. 1). Выявленные изменения также были связаны с хромосомными поломками.
Рис. 4.
Кариотип клеток CHL V-79 RJK после второй процедуры криозаморозки/разморозки с краткосрочным (6 мес.) хранением в жидком азоте. Делеция короткого (p) плеча хромосомы Z1, отсутствие хромосом Z2, Z15. N = 17.
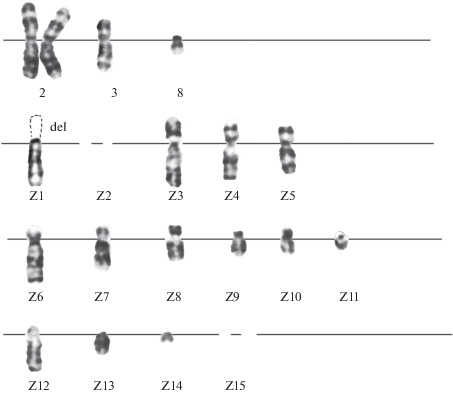
Вторая часть работы была связана с изучением кариотипической стабильности клеток после их длительного хранения в жидком азоте (120 мес. в жидком азоте). После длительного пребывания в жидком азоте спектр кариотипических изменений расширился. Некоторые из них носили неслучайный характер. В поломки было вовлечено 5 хромосом набора – 2, Z1, Z3, Z4 и Z8. Z5 (рис. 5а). Поломки разной локализации в хромосоме Z3 присутствовали в 23% проанализированных клеток. Кроме структурных изменений, наблюдали изменения в числе хромосомных копий. Наряду со стандартным набором хромосом, в кариотипе присутствовали клетки с удвоенным числом копий отдельных хромосом набора и анеуполиплоидные клетки (табл. 1). Анеуполиплоидные клетки характеризовались повышенной структурной нестабильностью (поломки хромосом, межхромосомные транслокации, эктопическая конъюгация между негомологичными хромосомами, разная степень конденсации гомологов) (рис. 5б). В пределах кариотипического набора в перестройки могли быть вовлечены несколько хромосом набора.
Рис. 5.
Кариотип клеток CHL V-79 RJK после длительной (10 лет) криозаморозки. а – Две копии хромосомы Z3 (в одной из копий – прицентромерная поломка с сохранением р и q), отсутствие хромосом 8 и Z14. N = 18. б – Дополнительные копии хромосом 2, Z1, Z2, Z9, Z14, Z15; поломка в терминальной часть q-плеча с сохранением хромосомного материала в Z3, терминальная делеция в одной из копий Z2; разная конденсация гомологов хромосом 2 и Z1; отсутствие хромосомы Z11. N = 24.
Обобщая полученные данные, можно говорить о том, что многолетнетняя криоконсервация, в отличие от краткосрочной, привела к разнотипной дестабилизации структуры кариотипа.
ОБСУЖДЕНИЕ
Результаты настоящей работы, направленной на изучение влияния криоконсервации на клеточный геном показали, что использованные в качестве модельной системы трансформированные клетки CHL V-79 RJK при относительно непродолжительном хранении в жидком азоте (3 и 6 мес.) сохраняли стабильный кариотип. Выявляемые изменения носили случайный характер. Длительное (10 лет) пребывание клеток в условиях криозаморозки привело к их анеуполиплоидизации, увеличению пула хромосом, вовлекаемых в перестройки, к усилению частоты встречаемости поломок в одной из хромосом набора (хромосома Z3), появлению таких изменений, как нарушение конденсации хромосом и хромосомные слипания (эктопическая конъюгация). Неоднократное выявление в определенной хромосоме набора (Z3) поломок разной локализации, позволило оценить повышенную ломкость данной хромосомы как неслучайную, вызванную длительным пребыванием клеток в условиях сверхнизкой температуры. В популяциях, претерпевших кратковременные криозаморозки, данная перестройка в силу своей уникальности рассматривалась как случайная. Полученные данные подтвердили постулат Хенга с соавторами о важности случайных хромосомных перестроек в трансформации генома, так как при определенных условиях они могут стать закономерными (Heng et al., 2013). На примере раковых клеток Хенг с соавторами показали, что клетки, встав на путь кариотипической нестабильности, проходят две стадии. Первая стадия – неклональная, связана с накоплением в популяции случайных кариотипических изменений, которые могут быть в любой момент нивелированы. Вторая стадия – клональная, когда определенные аберрации приобретают преимущество и клетки характеризуются модифицированным кариотипом. В нашем случае мы столкнулись с изменениями, вызванными повышенной генетической нестабильностью определенной хромосомы кариотипического набора. Важно, что возникшая нестабильность была сопряжена с длительным экзогенным воздействием фактора пониженной температуры. Возможно, в дальнейшем аберрантность хромосомы Z3 может приобрести селективное преимущество уже клоногенного характера. Полученные в настоящей работе данные, являются примером того, что в результате многолетнего пребывания клеток CHL V-79 RJK в условиях глубокой заморозки они перешли из одного генетического статуса в другой – культура из относительно генетически стабильной превратилась в нестабильную. Известно, что возникшая кариотипическая нестабильность может повлечь за собой последующую нестабильность, проявляющуюся у потомков. Прогнозируя дальнейшую судьбу проанализированных в настоящей работе клеток, можно предположить, что случайные изменения в других хромосомах набора (2, Z1, Z4, Z7 и Z8) со временем могут также перейти в разряд неслучайных, если не будут нивелированы отбором.
Другим важным элементом дестабилизации клеточного генома клеток CHL V-79 RJK, выявленным нами после многолетней криозаморозки является возникновение нарушений, связанных с увеличением числа копий (либо с утратой хромосомы из кариотипического набора) отдельных хромосом набора и/или появлением анеуполиплоидных вариантов. Считается, что это связано с нарушением механизма клеточного деления, вызванным разрушением микротрубочек веретена деления. На настоящий момент сбой в программе клеточного деления рассматривается как один из механизмов дестабилизации клеточного генома, направленный на переход клеток из нормального состояния в злокачественное (Zhu et al., 2012; Passerini et al., 2016). Мак-Гранохан с соавторами (McGranahan et al., 2012) на клетках человека показали, что присутствие в кариотипе даже одной дополнительной хромосомной копии вызывает нестабильность генома, нарушая репликацию ДНК. Динамика непрерывных последовательных изменений в структуре генома, нарастающих во времени как “снежный ком” может приводить к существенной реорганизации клеточного генома, обозначаемой как кариотипический хаос. К числу признаков “кариотипического хаоса”, наряду с хромосомными/хроматидными разрывами относят разную степень конденсации хромосом и межхромосомные слипания (Rangel et al., 2017). Именно эти нарушения мы наблюдали в клетках CHL V-79 RJK, претерпевших многолетнюю криозаморозку. Полученные данные говорят об усилении степени трансформации проанализированных в настоящей работе клеток.
Обобщая полученные данные в совокупности с литературными, можно говорить о том, что реакция клеточного генома на глубокую заморозку в зависимости от ее продолжительности во времени далеко не однозначна. Временной интервал пребывания клеток в жидком азоте является определяющим в сохранении генетического статуса клеток. Скорее всего, для каждой клеточной линии он индивидуален. Полученные в настоящей работе данные позволяют говорить о том, что многолетнее пребывание клеток в условиях глубокой заморозки может повлечь за собой дестабилизацию клеточного генома.
Таким образом, результаты настоящей работы позволяют сделать вывод, что использование в клинических, биоинженерных и прочих прикладных целях клеточного материала, претерпевшего длительную криозаморозку требует тщательной предварительной отработки всех процедур, связанных с данным методом, а также системного физиологического, цитогенетического и молекулярного контроля клеток до и после заморозки, что позволит минимизировать возможные генетические риски в связи с их практическим использованием.
Список литературы
Семенова Е.Г. 1988. Внеплановый синтез ДНК в культивируемых клетках после криоконсервации. Криобиология. № 1. С. 17. (Semenova E.G. 1988. Unscheduled DNA synthesis in cultured cells after cryoconservation. Cryobiology. № 1. P. 17.)
Полянская Г.Г., Семенова Е.Г., Шубин Н.А. 1990. Влияние криоконсервации на цитогенетические характеристики клеточной сублинии фибробластов кожи индийского мунджука. Цитология. Т. 32. № 3. С. 256. (Polyanskaya G.G., Semenova E.G., Shubin N.A. 1990. Cytological variations in the Indian muntjac skin fibroblast cell line as a result of cryoconservation. Tsytologya. V. 32. No 3. P. 256.)
de Lima Prata K., de Santis G.C., Orellana M.D., Palma P.V., Brassesco M.S., Covas D.T. 2012. Cryopreservation of umbilical cord mesenchymal cells in xenofree conditions. Cytotherapy. V. 14. P. 694.
Diaferia G.R., Dessi S.S., Deblasio P., Biunno I. 2008. Is stem cell chromosomes stability affected by cryopreservation conditions? Cytotechnology. V. 58. P. 11.
Duarte D.M., Cornélio D.A., Corado C., Medeiros V.K., de Araujo L.A., Cavalvanti G.B.J., de Medeiros S.R. 2012. Chromosomal characterization of cryopreserved mesenchymal stem cells from the human subendothelium umbilical cord vein. Regen. Med. V. 7. P. 147.
He X. 2011. Thermostability of biological systems: fundamentals, challenges, and quantification. Open Biomed. Eng. J. V. 5. P. 47.
Heng B.C., Kuleshova L.L., Bested S.M., Liu H., Cao T. 2005. The cryopreservation of human embryonic stem cells. Biotechnol. Appl. Biochem. V. 41. P. 97.
Heng H.H., Liu G., Stevens J.B., Abdallah B.Y., Horne S.D., Ye K.J., Bremer S.W., Chowdhury S.K., Ye C.J. 2013. Karyotype heterogeneity and unclassified chromosomal abnormalities. Cytogenet. Genome Res. V. 139. P. 144.
Imaizumi K., Nishishita N., Muramatsu M., Yamamoto T., Takenaka C., Kawamata S., Kobayashi K., Nishikawa S., Akuta T. 2014. A simple and highly effective method for slow-freezing human pluripotent stem cells using dimethyl sulfoxide, hydroxyethyl starch and ethylene glycol. PLoS One. V. 9.e88696. https://doi.org/10.1371/journal.pone.0088696
Ji L., de Pablo J.J., Palecek S.P. 2004. Cryopreservation of adherent human embryonic stem cells. Biotechnol. Bioeng. V. 88. P. 299.
McGranahan N., Burrell R.A., Endesfelder D., Novelli M.R., Swanton C. 2012. Cancer chromosomal instability: therapeutic and diagnostic challenges. EMBO Rep. V. 13. P. 528.
Passerini V., Ozeri-Galai E., de Pagter M.S., Donnelly N., Schmalbrock S., Kloosterman W.P., Kerem B., Storchová Z. 2016. The presence of extra chromosomes leads to genomic instability. Nat. Commun. V. 7. 10754. https://doi.org/10.1038/ncomms10754
Pera M.F., Reubinoff B., Trounson A. 2000. Human embryonic stem cells. J. Cell Sci. V. 113. P. 5.
Polchow B., Kebbel K., Schmiedeknecht G., Reichardt A., Henrich W., Hetzer R., Lueders C. 2012. Cryopreservation of human vascular umbilical cord cells under good manufacturing practice conditions for future cell banks. J. Transl. Med. V. 10. P. 98.
Rangel N., Forero-Castro M., Rondón-Lagos M. 2017. New insights in the cytogenetic practice: Karyotypic chaos, non-clonal chromosomal alterations and chromosomal instability in human cancer and therapyr. Genes (Basel). V. 8. P. 155.
Ray M., Mohandas T. 1975. Proposed banding nomenclature for the Chinese hamster chromosomes (Cricetulus gruseus). Cytogenet. Cell Genet. V. 16. P. 83.
Reubinoff B.E., Pera M.F., Fong C.Y., Trounson A., Bongso A. 2000. Embryonic stem cell lines from human blastocysts: somatic differentiation in vitro. Nat. Biotechnol. V. 18. P. 399.
Tan Z., Chan Y.J.A., Chua Y.J.K., Rutledge S.D., Pavelka N., Cimini D., Rancati G. 2019. Environmental stresses induce karyotypic instability in colorectal cancer cells. Mol. Biol. Cell. V. 30. P. 42.
Tang D.Q., Wang Q., Burkhardt B.R., Litherland S.A., Atkinson M.A., Yang L.J. 2012. In vitro generation of functional insulin-producing cells from human bone marrow-derived stem cells, but long-term culture running risk of malignant transformation. Am. J. Stem Cells. V. 1. P. 114.
Wang B., Zhang Z., Yin Z., Feng C., Wang Q. 2012. Novel and potential application of cryopreservation to plant genetic transformation. Biotechn. Adv. V. 30. P. 604.
Zhang X.H., Catalano P.N., Gurkan U.A., Khimji I., Demirci U. 2011. Emerging technologies in medical applications of minimum volume vitrification. Nanomedicine. V. 6. P. 1115. https://doi.org/10.2217/nnm.11.71
Zhu J., Pavelka N., Bradford W.D., Rancati G., Li R. 2012. Karyotypic determinants of chromosome instability in aneuploid budding yeast. PLoS Genet. V. 8. T. 5. P.e1002719. https://doi.org/10.1371/journal.pgen.1002719
Дополнительные материалы отсутствуют.