Цитология, 2021, T. 63, № 1, стр. 3-16
Талин: структурно-функциональные связи
В. П. Иванова *
Институт эволюционной физиологии и биохимии им. И.М. Сеченова РАН
194223 Санкт-Петербург, Россия
* E-mail: valet@iephb.ru
Поступила в редакцию 02.10.2020
После доработки 14.10.2020
Принята к публикации 15.10.2020
Аннотация
Взаимодействие внеклеточного матрикса (ВКМ) с цитоскелетом клетки осуществляют интегриновые рецепторы. После связывания интегринов с ВКМ в адгезионные структуры, формирующиеся в клетке, вовлекаются молекулы талина, которые участвуют как в регуляции активности интегриновых рецепторов, так и в связывании этих рецепторов с актиновым цитоскелетом. Талин является адаптерным белком, который содержит головной домен, представляющий собой атипический FERM-домен, и палочковидный домен, состоящий из спирализованных пучков, построенных из 4-х или 5-ти α-спиралей. Особенности укладки α-спиралей в пучках определяют их устойчивость к воздействию сил натяжения и способность к растяжению. В представленном обзоре сделан акцент на выявлении связи между структурной организацией талина и распределением функций между головным и палочковидным доменами. Пространственная ориентация субдоменов (F0, F1, F2, F3) в головном домене обеспечивает доступность сайтов связывания в этих субдоменах для эффекторных молекул и быструю трансформацию самого домена при активации талина. Линейное расположение спирализованных пучков (R1–R13) в палочковидном домене с преобладанием 4-х спиральных пучков в N-конце домена и 5-ти спиральных пучков на его C-конце определяют: 1) эффективное межпучковое взаимодействие при образовании неактивной (автоингибированной) формы димера талина и 2) возможность изменения степени спирализации отдельных пучков под действием физических стимулов, в результате чего происходит демаскирование мест связывания с различными белками, скрытыми в спирализованных пучках палочковидного домена талина. Это означает, что N-концевая часть молекулы талина (головной домен) трансформирует одни биохимические сигналы в другие, а C-концевая часть молекулы (палочковидный домен) преобразует физические стимулы в биохимические или физиологические сигналы, регулирующие клеточный ответ. В обзоре рассматриваются и некоторые особенности взаимодействия талина с различными соединениями на молекулярном уровне.
Главенствующее положение в формировании клеточных адгезионных структур занимают интегриновые рецепторы, обеспечивающие взаимосвязь между внеклеточными и внутриклеточными молекулами (Zaidel-Bar et al., 2007; Theocharis et al., 2016). Клеточно-матриксная адгезия, опосредованная интегринами, лежит в основе протекания многих клеточных процессов, включая изменение клеточной формы, миграцию, рост, дифференциацию и апоптоз (Berrier, Yamada, 2007; Theocharis et al., 2016).
Интегрины представляют собой трансмембранные гетеродимерные рецепторы, состоящие из двух нековалентно связанных α- и β-субъединиц. В настоящее время известно 18 α- и 8 β-субъединиц, которые ассоциируют, формируя 24 различных вида интегриновых рецепторов, обладающих разной специфичностью (Takada et al., 2007; Barczyk et al., 2010; Pan et al., 2016). Каждая субъединица содержит крупный внеклеточный трансмембранный домен и короткий цитоплазматический домен (Campbell, Humphries, 2011). Внеклеточный домен α- и β-субъединиц обеспечивает связывание интегринов с лигандами – белками внеклеточного матрикса (ВКМ) и поверхностными клеточными белками. Цитоплазматический домен обеих субъединиц взаимодействует с актиновым цитоскелетом клетки, а также с интегрин-ассоциированными и сигнальными белками (Legate, Fässler, 2009; Morse et al., 2014).
Большинство клеточных процессов, определяемых актиновыми филаментами, зависят от множества актин-связывающих белков и их регуляторов (Wolfenson et al., 2013). Одними из первых, после взаимодействия интегриновых рецепторов с компонентами ВКМ, в формирующиеся адгезионные структуры клетки вовлекаются молекулы талина, участвуя как в регуляции активности интегриновых рецепторов, так и осуществляя связь этих рецепторов с актиновым цитоскелетом клетки (Changede et al., 2015). Талин, являясь адаптерным белком, может контактировать также с другими адаптерными и регуляторными белками, формируя первичную платформу (базис) для построения клеточной адгезионной структуры (Critchley, Gingras, 2008; Das et al., 2014).
Цель представленного обзора состояла в анализе современных данных об особенностях строения и функционирования талина, а также о способах его активации и формах участия талина в структурировании адгезионных структур и проведении внутриклеточного и межклеточного сигнала. При этом основное внимание акцентировано на анализе структурно-функциональных связей талина.
ОСОБЕННОСТИ ДОМЕННОЙ ОРГАНИЗАЦИИ ТАЛИНА
Молекула талина (2541 аминокислотных остатков) состоит из глобулярного N-концевого головного домена и крупного палочковидного С-концевого домена (рис. 1). Талин содержит два сайта связывания с интегринами, три сайта связывания с актином и 11 VBS (дополнительного компонента фокальных адгезий с актин-связывающей активностью), а также сайты связывания с другими структурными и регуляторными молекулами (табл. 1). В представленном обзоре описываются свойства талина 1 – доминирующей у позвоночных животных изоформы талина. (Более подробную информацию об изоформах талина см.: Gough, Goult, 2018).
Рис. 1.
Доменная и субдоменная организация молекулы талина. Талин состоит из N-концевого головного домена (субдомены F0, F1, F2, F3) и палочковидного (спирализованные пучки R1–R13). Между головным и палочковидным доменами расположен неструктурированный участок. D – субдомен димеризации. α-Спирали, содержащие сайты связывания с винкулином, выделены синим цветом. По: Yao et al., 2016, публикуется с любезного разрешения авторов.
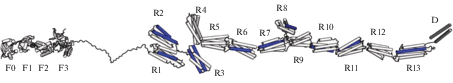
Таблица 1.
Сайты связывания с различными лигандами в субдоменах молекулы талина
| Лиганды талина | Субдомены талина | Источник литературы |
|---|---|---|
| Aктин | F2−F3 (ABS1) | Lee et al., 2004 |
| R4−R8 (ABS2) | Hemmings et al., 1996 | |
| R13−D (ABS3) | Gingras et al., 2008 | |
| β-интегрины | F3 (IBS1) | Calderwood et al., 2002 |
| R11 (IBS2) | Tremuth et al., 2004 | |
| Белок Gα13 | F3 | Schiemer et al., 2016 |
| Моезин | R11−R13−D | Beaty et al., 2014 |
| Паксиллин | F2−F3 | Gao et al., 2017 |
| α-синемин | R7−R8 | Sun et al., 2008; Gingras et al., 2010 |
| DLC1 | R8 | Zacharchenko et al., 2016 |
| FAK | F3 | Lawson et al., 2012 |
| KANK1−2 | R7 | Bouchet et al., 2016; Sun et al., 2016 |
| PIP2 | F2, F3 | Chinthalapudi et al., 2018 |
| PIPK1γ | F3 | Di Paolo et al., 2002 |
| Rap1 | F0 | Zhu et al., 2017 |
| RIAM | F3, R2, R3, R8, R11 | Goult et al., 2013b; Chang et al., 2014; Yang et al., 2014 |
| TIAM1 | F3 | Wang et al., 2012 |
Головной домен (около 400 аминокислотных остатков) талина включает 4 субдомена: F0 (85 аминокислот), а также F1, F2 и F3, образующие атипичный FERM (four-point-one-protein/ezrin/radixin/moesin) домен (остатки с 86 по 400) (табл. 2) (Goult et al., 2010). В отличие от белков, содержащих типичный FERM-домен, в молекуле талина субдомены F0–F3 в головном домене расположены линейно (Elliott et al., 2010). Субдомены F1, F2 и F3 могут контактировать с плазматической мембраной клетки. Субдомен F3 содержит сайт связывания (IBS1) с последовательностью, содержащей фрагмент NPxY (остатки 744–747), расположенной в цитоплазматической области β-субъединицы интегринового рецептора (Calderwood et al., 2002). Кроме того, субдомены F2 и F3 головного домена образуют сайт связывания с F-актином (ABS1) (остатки 202–435) (Lee et al., 2004). Предполагается, что указанные субдомены талина связываются с субдоменом 4 мономерной единицы F-актина и ингибируют элонгацию актиновых филаментов (Ciobanasu et al., 2018). Головной домен талина соединен с палочковидным неструктурированным линкерным участком последовательности (остатки с 401 по 481).
Таблица 2.
Расположение субдоменов в первичной последовательности молекулы талина
| Субдомены талина | Позиция субдомена в последовательности талинаа |
|---|---|
| F0 | 1–85 |
| F1 | 86–202 |
| F2 | 203–309 |
| F3 | 310–402 |
| R1 | 482–655 |
| R2 | 656–786 |
| R3 | 787–911 |
| R4 | 913–1044 |
| R5 | 1045–1205 |
| R6 | 1206–1357 |
| R7 | 1358–1653 |
| R8 | 1461–1580 |
| R9 | 1654–1822 |
| R10 | 1823–1973 |
| R11 | 1974–2140 |
| R12 | 2141–2294 |
| R13 | 2300–2482 |
| D | 2494–2541 |
Палочковидный домен талина (около 2000 аминокислотных остатков) построен из 62 повторяющихся α-спиральных участков (H1–H62), которые структурированы в 13 спирализованных пучков (R1–R13), состоящих из четырeх (R2–R4, R8) или пяти (все, кроме H62) α-спиралей (рис. 1, табл. 2) (Klapholz, Brown, 2017). У 4-х спиральных пучков R2–R4 N- и C-концевые последовательности расположены на одной стороне пучка. Наличие 4-х спиральных пучков (R2–R4) обусловливает более компактную организацию N-концевой части палочковидного домена. В отличие от четырехспиральных пучков, пятиспиральные пучки содержат протяженную петлю, которая при укладке пучка ориентирует расположение 1-ой спирали напротив 3-ей и 4-ой спиралей. Подобная укладка α-спиралей приводит к тому, что N- и C-концы последовательности располагаются с противоположных сторон пятиспирального пучка. Именно указанная пространственная укладка α-спиралей в пучке способствует линейной организации С-концевого участка (R5–R13, кроме R8) палочковидного домена, которая, в свою очередь, является необходимым структурным элементом для возможного приложения механических сил. Установлено, что для растягивания четырехспирального пучка требуется меньше силы, чем для раскрытия пятиспирального (Yan et al., 2015). Т.е. четырехспиральные пучки менее устойчивы к воздействию сил натяжения и первыми теряют свернутую пространственную структуру.
В палочковидном домене талина расположен 2-ой сайт связывания с интегринами (IBS2) (Xing et al., 2001; Tremuth et al., 2004), который локализован внутри спирализованного пучка R11. По разным источникам, размеры IBS2 варьируют и соответствуют остаткам 1984–2113 (Tremuth et al., 2004), 1974–2139 (Gingras et al., 2009), 2077–2099 (Moes et al., 2007) и 2080–2099 (Rodius et al., 2008). При взаимодействии с интегринами имеет место ассоциация 50-ой α‑спирали пучка R11 палочковидного домена талина с α‑спиралью цитоплазматического сегмента 716–734 (KLLITIHDR–KEFAKFEEER) β-субъединицы интегринов, расположенной проксимально от мембраны (Rodius et al., 2008). При этом положительно заряженные остатки Lys2085 и Lys2089 в IBS2 талина связываются с отрицательно заряженными остатками Glu726 и Glu733 в β-субъединице интегринов (Rodius et al., 2008). Установлено, что IBS2 участвует в процессах кластеризации интегриновых рецепторов в незрелых адгезиях (Changede et al., 2015).
Два актин-связывающих сайта находятся в области субдоменов R4−R8 (остатки 957–1327) (ABS2) (Hemmings et al., 1996; Atherton et al., 2015; Kumar et al., 2016) и субдоменов R13−D (остатки 2340–2541) (ABS3) (McCann, Craig, 1997; Gingras et al., 2008). Установлено, что димер талина через ABS3 связывается с 3 мономерами актиновых филаментов (Gingras et al., 2008). Существует представление, что связывание актина с ABS3 приводит к начальному развертыванию субдомена R3, которое определяет последующее развертывание молекулы талина. По сравнению с R1 и R2, субдомен R3 характеризуется наименьшей стабильностью из-за наличия в его структуре 4-х остатков треонина (Thr809, Thr833, Thr867, Thr901), которые локализованы в гидрофобном коре этого субдомена (Yao et al., 2014). В результате развертывания R3 происходит высвобождение ABS2, расположенного в центральной зоне палочковидного домена талина, для взаимодействия с F-актином, что способствует стабилизации фокальных адгезий и генерации силы натяжения (Atherton et al., 2015; Kumar et al., 2016). Установлено, что активность ABS регулируется соседними субдоменами. Так, 57-я α-спираль ингибирует связывание актина через ABS3 (58–62 α-спирали) (Gingras et al., 2008). А субдомены R3 и R9, фланкирующие последовательность ABS2, ингибируют его активность (Atherton et al., 2015). При этом указанный ингибирующий эффект отменяется в результате конформационных изменений молекулы талина.
Существует определенное разграничение в функционировании ABS2 и ABS3. Так, ABS3 регулирует распределение клеточных адгезий в клетке (периферическое или центральное), а ABS2 выполняет функцию механосенсора, обеспечивающего передачу силового сигнала и изменение физико-химических свойств субстрата (Kumar et al., 2016). Кроме того, связывание молекулы талина с F-актином через разные сайты взаимодействия может регулировать направленность силы натяжения. Так, в случае связывания актиновых филаментов с ABS2 может происходить растягивание спирализованных пучков R1–R8, а при связывании с ABS3 ─ всего палочковидного домена (Goult et al., 2018). Однако каким образом сайты взаимодействия с актином регулируют ремоделирование актина, неизвестно. Недавно установлено участие ABS3 в поляризации и миграции клеток (Rahikainen et al., 2019).
Палочковидный домен талина содержит 11 сайтов связывания с головным доменом винкулина (табл. 3) (Bass et al., 2002; Gingras et al., 2005). VBS в свернутой форме молекулы талина скрыты внутри спирализованных пучков (состоящих из 4-х или 5-ти α-спиралей) (Gingras et al., 2005; Patel et al., 2006).
Таблица 3.
Распределение сайтов связывания с винкулином в палочковидном домене талина
| Локализация сайтов связывания в последовательности талинаа | Порядковый номер α-спирали |
Спирализованный пучок | |
|---|---|---|---|
| из 4-х α-спиралей | из 5-ти α-спиралей | ||
| 604–633 | 4 | R1 | |
| 664–688 | 6 | R2 | |
| 765–789 | 9 | R2 | |
| 820–844 | 11 | R3 | |
| 852–876 | 12 | R3 | |
| 1330–1354 | 27 | R6 | |
| 1520–1544 | 33 | R8 | |
| 1628–1652 | 36 | R7 | |
| 1945–1969 | 46 | R10 | |
| 2077–2101 | 50 | R11 | |
| 2345–2369 | 58 | R13 | |
Вслед за этими участками расположен субдомен димеризации (D), участвующий в образовании антипараллельного гомодимера талина (рис. 1) (Goult et al., 2013a).
АКТИВАЦИЯ ТАЛИНА. СТРУКТУРООБРАЗУЮЩАЯ РОЛЬ ТАЛИНА В ФОРМИРОВАНИИ ФОКАЛЬНЫХ АДГЕЗИЙ
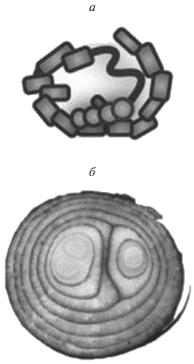
В неактивном состоянии димер талина локализуется в цитоплазме и имеет компактную пространственную форму (рис. 2) (Goksoy et al., 2008; Goult et al., 2013a; Dedden et al., 2019). Предполагается, что неактивная форма димера талина представляет собой антипараллельную свернутую по кругу структуру палочковидных доменов вокруг общего центра, в котором располагаются головные домены каждого из мономеров молекулы (модель “double donut”) (Goult et al., 2013a). Стабилизация неактивной формы талина осуществляется взаимодействиями между субдоменами F3 и R9 (Goult et al., 2009; Song et al., 2012), F2–F3 и R1–R2 (Banno et al., 2012), а также R3–R4 и R9–R10–R11–R12 (Goult et al., 2013a). Верхний слой компактной структуры димера стабилизируется контактами между участками палочковидного домена R3–R4 и R9–R10–R11–R12. Самая сильная связь формируется между субдоменами F3 головного домена с субдоменом R9 палочковидного домена талина. При этом Tyr377 субдомена F3 фиксируется в гидрофобном кармане на одном конце 5-спирального пучка R9. Одновременно кластер основных аминокислотных остатков основной петли субдомена F3, состоящий из Lys316, Lys318, Lys320, Lys322 и Lys324, взаимодействует с кластером отрицательно заряженных аминокислотных остатков Asp1676, Asp1763, Glu1770, Glu1798, Glu1805, локализованных в середине 4-ой α-спирали R9 (Goksoy et al., 2008; Goult et al., 2009). Позднее было показано, что кроме 4-ой α-спирали в процессе автоингибирования молекулы талина может участвовать и 5-я α-спираль R9 (Zhang et al., 2016). Остальные взаимодействия, участвующие в стабилизации свернутой формы димера талина, относятся к слабым связям.
Рис. 2.
Неактивная компактная форма талина. а – Свернутый мономер талина; б – глобула димера талина, в центре располагаются головные домены мономеров, вокруг которых свернуты палочковидные домены. Более подробно см. в тексте. Приводится частично по: Gough, Goult, 2018.
В настоящее время существуют разные точки зрения относительно способов активации молекулы талина (Lee et al., 2009; Kopp et al., 2010). Сторонники одной точки зрения считают, что главенствующее значение в активации и транслокации к мембране талина играет малая ГТФаза Rap1 и ее эффектор RI-AM (Rap1-GTP-interacting adapter molecule – адаптерная молекула, взаимодействующая с ГТФазой Rap1) (Han et al., 2006). Молекула RIAM может взаимодействовать с головным и палочковидным доменами талина. RIAM, связываясь с субдоменом F3 головного домена, вытесняет субдомен R9 палочковидного домена из зоны формирования свернутой неактивной формы талина (Yang et al., 2014). Кроме того, молекула RIAM через сайт связывания с талином 1 (TBS1) (остатки 1–30) связывается с определенными участками, локализованными в субдоменах R2–R3 (остатки 655−911), R8 (остатки 1461–1580) и R11 (остатки 1974–2140) палочковидного домена талина (Lee et al., 2009; Goult et al., 2013b; Chang et al., 2014). Интересно, что RIAM может связываться с субдоменами R2 и R3 талина, которые находятся в исходной спирализованной конформации (Goult et al., 2013b). Взаимодействие RIAM с субдоменами палочковидного домена приводит к транслокации талина к мембране клетки, где он активирует интегриновые рецепторы (Yang et al., 2014).
Существуют данные, подтверждающие роль Г-ТФазы Rap1 в рекрутизации талина к плазматической мембране (Zhu et al., 2017). Мембраносвязывающая способность головного домена талина через положительно заряженную поверхность субдоменов F1, F2 и F3 усиливалась при связывании Rap1 с мембраной. Установлено, что Rap1 посредством α1-спирали и участка переключения 1 (switch1) (остатки Gln25, Val21, Val29, Asp33) связывается с α2-спиралью субдомена F0 головного домена талина (Glu38, Pro37, Ile36, Arg35), усиливая тем самым взаимодействие с мембраной (Zhu et al., 2017).
Активацию талина может регулировать не только RIAM. У тромбоцитов в этом процессе может участвовать гетеротримерный G-белок (Gα13), который, как известно, регулирует процессы гемостаза и тромбоза. Показано, что активация молекулы талина происходит в результате взаимодействия пептидного фрагмента VGGQRSERKRWFECFDS, локализованного в зоне переключения 2 (switch region 2) G-белка, с фрагментом 310–328 субдомена F3 головного домена талина (Schiemer et al., 2016). Передача сигнала посредством взаимодействия Gα13 c молекулой талина регулирует адгезионные процессы тромбоцитов. Предполагается, что зоны взаимодействия Gα13 и RIAM с субдоменом F3 талина перекрываются. Это означает, что связывание Gα13 с талином ингибирует или уменьшает эффективность связывания молекулы RIAM с талином и наоборот.
Другая точка зрения состоит в том, что активация молекулы талина является мембранозависимым процессом и обусловлена связыванием субдоменов F2 и F3 головного домена с участками внутреннего листка липидного бислоя плазматической мембраны, обогащенными минорным фосфолипидом фосфатидилинозитол-4,5-бифосфатом (PtdIns(4,5)P2 или PIP2) (Kopp et al., 2010; Song et al., 2012). Согласно последним данным, это взаимодействие обеспечивается остатками Lys272 субдомена F2, а также Lys316, Lys324, Glu342 и Lys343 субдомена F3 (Chinthalapudi et al., 2018). При этом 4'-фосфатная группа PIP2 взаимодействует с головным доменом по остаткам Lys272, Glu342 и Lys343, а 5'-фосфатная группа связывается с Glu342 и Lys316. Два аминокислотных остатка Lys316 и Lys324 субдомена F3, как упоминалось выше, используются также при формировании неактивной формы молекулы талина. Т.е. имеет место перекрывание зон взаимодействия субдоменов F3 с различными лигандами (палочковидным доменом талина, аннулярными липидами).
После контакта головного домена талина с мембраной и последующего связывания талина с F-актином под действием сил натяжения происходит частичная деспирализация трехмерной структуры палочковидного домена талина, которая приводит к демаскированию определенных мест связывания с различными белками, включая винкулин, скрытых до этого в спирализованных пучках палочковидного домена талина (Yao et al., 2014).
Имеющиеся в настоящее время данные о способах активации талина в клетке могут свидетельствовать о вариабельности этого процесса. В зависимости от типа клеток, физико-химических свойств ВКМ и условий микроокружения клетки в целом может использоваться тот или иной способ активации талина.
Постепенное раскрытие третичной структуры палочковидного домена талина определяет иерархию активации сайтов взаимодействия с различными молекулами (Hytönen, Vogel, 2008). Некоторые сайты (IBS1, IBS2 и ABS3) доступны для взаимодействия в молекуле талина с частично развернутой конформацией, но с сохранением третичной структуры у всех спирализованных пучков (Ascario, Tajkhorshid, 2014). Под действием силы натяжения происходит разворачивание спирализованных пучков с сохранением структуры α-спиралей, которое приводит к доступности VBS, ранее скрытых в свернутой структуре палочковидного домена талина (del Rio et al., 2009; Margadant et al., 2011; Yao et al., 2014; Wang et al., 2019). В зависимости от места приложения механической силы (латерально или через N- и C-концы пучка) возможна различная последовательность раскрытия спиралей и, следовательно, доступность VBS может варьировать (Roberts, Critchley, 2009). При увеличении механической силы увеличивается число доступных для взаимодействия VBS, соответственно, возрастает количество молекул винкулина, связанных с молекулой талина (Hytönen, Vogel, 2008). Более того, показано, что связывание молекул винкулина с димером талина, пространственная структура которого находится в процессе развертывания, является кооперативным процессом (Hu et al., 2016). Т.е. молекула винкулина, связываясь и стабилизируя развернутую структуру талина, ускоряет связывание дополнительных молекул винкулина с талином.
В настоящее время молекулярный механизм взаимодействия всех VBS полностью не изучен. Например, известно, что детерминанта VBS-1, локализованная в 4-ой α-спирали пятиспирального пучка R1 (остатки 482–655) палочковидного домена талина, содержит 5 гидрофобных остатков (Leu608, Ala612, Leu615, Val619 и Leu623). Последние формируют локальную гидрофобную зону на поверхности пяти оборотов 4-ой α-спирали. Указанная панель аминокислотных остатков осуществляет гидрофобное взаимодействие с бороздой, расположенной в головном домене винкулина, при этом образуется эквивалент пятиспирального пучка совместно с имеющимися N-концевыми 4-мя спиралями (α1–α4) головного домена винкулина (Papagrigoriou et al., 2004). Образование комплекса между VBS1 талина и винкулином требует разворачивания пятиспирального пучка R1. Другими словами, за счет дестабилизации структуры талина образуется новая трехмерная структура для связывания с другим белком. Можно предположить, что подобный механизм актуален и для других VBS.
Связывание молекул винкулина с развернутой структурой талина способствует как взаимодействию с актиновыми филаментами, так и укрупнению фокальных адгезий (Humphries et al., 2007). В целом, стабилизация вытянутой конформации молекулы талина через связывание с головным доменом винкулина обеспечивает усиление взаимодействия между интегринами и цитоскелетом (Yao et al., 2014; Yan et al., 2015).
Следует отметить, что талин можно отнести к механочувствительному адаптеру, который посредством конформационных изменений спирализованных пучков палочковидного домена, индуцированных сокращением актиновых филаментов, ассоциированных с фокальными адгезиями, может регулировать вовлечение молекул винкулина в фокальные адгезии и взаимодействие с другими белками через структурные изменения (Lee et al., 2007; del Rio et al., 2009; Yan et al., 2015; Goult et al., 2018).
ЗНАЧЕНИЕ ТАЛИНА В РЕГУЛИРОВАНИИ АКТИВНОСТИ ИНТЕГРИНОВ И ПРОВЕДЕНИИ ВНУТРИКЛЕТОЧНОГО И МЕЖКЛЕТОЧНОГО СИГНАЛА
Не менее важным является участие талина в процессах активации интегриновых рецепторов в ходе передачи сигнала из клетки (inside−out). Особая роль в этом процессе принадлежит головному домену талина, который характеризуется асимметрией распределения положительно заряженных аминокислот на поверхности субдоменов F2 и F3. Установлено, что положительно заряженная зона на поверхности субдомена F2 (Lys256, Lys272, Lys274, Arg277) (Anthis et al., 2009; Chinthalapudi et al., 2018) и субдомена F3 (Lys322 (Wegener et al., 2007) и Lys324 (Saltel et al., 2009) или Lys316, Lys324, Lys343 (Chinthalapudi et al., 2018)) взаимодействует с анионными липидами клеточных мембран, включая PIP2 (Ye et al., 2016), что обеспечивает изменение пространственной ориентации субдоменов F0–F3 головного домена талина.
В частности, удалось показать, что в результате этих процессов происходит переход от линейного расположения указанных субдоменов в V-образную конфигурацию с углом 60° между F0–F1 и F2–F3 (Kalli et al., 2013). Подобная конформация, с одной стороны, оптимизирует контакты талина с отрицательно заряженными микродоменами липидного бислоя клеточной мембраны, с другой стороны, усиливает взаимодействие с интегриновыми рецепторами, увеличивая число водородных связей между субдоменом F3 и цитоплазматическим участком β-субъединицы интегринов (Saltel et al., 2009). Скорее всего, связывание субдомена талина F2 с мембранными участками, содержащими PIP2, способствует необходимой ориентации головного домена талина для продуктивного взаимодействия субдомена F3 с α-спиральным сегментом (остатки 716–734) цитоплазматического домена β-субъединицы интегриновых рецепторов, который локализован проксимально относительно мембраны (Anthis et al., 2009; Saltel et al., 2009; Ascario, Tajkhorshid, 2014). Ведущая роль во взаимодействии интегринов отводится отрицательно заряженным аминокислотным остаткам. По разным источникам, это может быть группа, состоящая из Asp723, Glu726, Glu733 (Saltel et al., 2009) или из Glu726 и Glu733 (Rodius et al., 2008). Установленный контакт F3 защищает β-субъединицу от реассоциации с α‑субъединицей рецепторов.
Кроме субдомена F2 установлено участие субдоменов F0 и F1 в пространственной подстройке субдомена F3 для оптимального взаимодействия талина с β-субъединицей интегринов (Bouaouina et al., 2008). По мнению некоторых исследователей, особенности пространственной укладки субдомена F1 талина играют существенную роль в активации интегринов (Goult et al., 2010). Субдомен F1 головного домена содержит большую петлю, которая при контакте с мембраной может формировать спираль, в которой основные аминокислотные остатки сгруппированы на одной стороне спирали, что обеспечивает наилучшие условия для взаимодействия с отрицательно заряженными фосфолипидами мембраны. Кроме того, в ходе спирализации петли субдомена F1 происходит уменьшение ее длины, что приводит к сближению субдоменов F0 и F1 с плазматической мембраной. В конечном итоге, взаимодействие субдомена F3 талина с цитоплазматическим доменом β‑субъединицы рецептора вносит свой вклад в ускорение сборки фокальных адгезий и увеличение их количества (Kopp et al., 2010).
Для активации интегринов, помимо связывания талина с отрицательно заряженными липидами мембран, необходимо также взаимодействие субдомена F3 головного домена талина в зоне локализации IBS1 с фрагментом WxxxxNPxY (остатки 739–747 для β3) цитоплазматического домена β-субъединицы интегринов (Calderwood, 2004; Legate, Fässler, 2009). Предполагается, что Trp739 интегрина связывается с карманоподобной структурой, образованной остатками Arg358, Ala360 и Tyr377, которые расположены в 5-ом тяже β-структуры субдомена F3 талина. Одновременно фрагмент NPxY β-субъединицы рецептора взаимодействует со спиралью H1 субдомена F3 талина на участке Ala389, Gln390, Ala393 и Ile398. А остаток Phe727 β-субъединицы интегрина входит в петлю между тяжами 1–2 субдомена F3 талина, в состав которой входят остатки Lys318, Met319 и Lys320 (Garcia-Alvarez et al., 2003; Wegener et al., 2007; Mehrbod et al., 2013).
Присоединение талина приводит к разрушению зон ассоциации α-спиралей в трансмембранных доменах α- и β-субъединиц, обусловливающих низко-аффинное состояние интегринов (Luo et al., 2004). В частности нарушается взаимодействие глицин-содержащих сегментов Gly972xxxGly976 (в α-субъединице) и Gly708 (в β-субъединице), а также участков с гидрофобными аминокислотами Phe992–Phe993 (в α-субъединице) и Trp715 (в β-субъединице). Нарушение тесного контакта в этих участках трансмембранных доменов интегринов приводит к разрушению электростатического взаимодействия между Arg995 и Asp723 в α- и β-субъединицах соответственно (Vinogradova et al., 2002; Lau et al., 2009). Скорее всего, Lys324 талина вытесняет Arg995 α-субъединицы из солевого мостика между α- и β-субъединицами, ингибирующего активность интегриновых рецепторов. В результате этих процессов изменяется пространственная ориентация трансмембранного домена β-субъединицы, и α- и β-субъединицы расходятся в плоскости мембраны, что приводит к активации внеклеточного домена и усилению аффинности интегриновых рецепторов к ВКМ (Luo et al., 2004; Wegener et al., 2007; Anthis et al., 2009; Shattil et al., 2010; Kim et al., 2012). Другими словами, Asp723 β-субъединицы интегринов может участвовать в регуляции как инактивации рецепторов через взаимодействие с Arg995 α-субъединицы в отсутствии талина, так и активации рецепторов посредством взаимодействия с Lys324 талина (Saltel et al., 2009).
Кроме регулирования аффинности интегриновых рецепторов талин может влиять на формирование кластеров из этих рецепторов (Bunch, 2010). Возможно талин, образуя комплекс с лиганд-связанным рецептором, может вовлекать соседние интегриновые рецепторы, находящиеся в неактивном состоянии, в формирующиеся адгезионные структуры, способствуя кластеризации рецепторов и образованию фокальных адгезий (Saltel et al., 2009; Goult et al., 2018).
Талин не только осуществляет связь между интегриновыми рецепторами и цитоскелетом клетки, но и участвует в проведении сигнала через другие белки, используя структурные элементы, как головного, так и палочковидного доменов (табл. 1). Так, связывание субдомена F3 головного домена талина с С-концевым участком фосфатидилинозитол-4фосфат-5киназы I типа (PIPK1γ) в зоне гептапептидного фрагмента WVYSPLH (Di Paolo et al., 2002) обеспечивает транслокацию комплекса талина с киназой к плазматической мембране, где фермент осуществляет локальный синтез PIP2 на необходимом уровне.
Связывание фрагмента PIPK1γ 636–652 (P-TDERSWVYSPLHYSAR) с субдоменом F3 талина происходит в зоне расположения β-листа, образованного тремя тяжами (β5–β6–β7), и примыкающей к нему α-спирали (H5) (De Pereda et al., 2005). Участок киназы 642–644 (WVY) располагается у тяжа β5, создавая дополнительную структуру. Остаток Trp642 направлен в глубокий карман, образованный остатками β-тяжей талина: Tyr377 (β7), Asp369 (β6) и Arg358 (β5). Val643 киназы взаимодействует с Trp359 талина в гидрофобном коре β-структуры. На внешней стороне комплекса остаток киназы Tyr644 связывается с Arg358 субдомена F3 талина. Участок киназы 645–648 (SPLH) направлен в противоположную сторону, при этом His648 взаимодействует с петлей между тяжами β6 и β7 талина.
Кроме того, субдомен F3 талина может взаимодействовать с С-концевым фрагментом 965–1012 нерецепторной тирозиновой киназы FAK, способствуя вовлечению FAK в фокальные контакты и ее активации (Chen et al., 1995). Вместе с тем имеются данные о том, что FAK способствует рекрутированию талина в незрелые адгезии независимо от связывания талина с интегринами во время клеточной миграции. При этом прямое взаимодействие F3 талина происходит на участке 1011–1042 тирозиновой киназы (Lawson et al., 2012).
Обнаружено прямое связывание головного домена талина в области субдоменов F2–F3 с белком цитоскелета паксиллином. Последний усиливает связывание талина с интегриновыми рецепторами и их активацию в тромбоцитах (Gao et al., 2017). Однако места связывания талина в аминокислотной последовательности паксиллина до настоящего времени не идентифицированы.
Белок TIAM1 (T-cell lymphoma invasion and metastasis1), индуцирующий Т-клеточную лимфому и относящийся к регуляторам факторов обмена гуаниновых нуклеотидов, через прямое связывание с субдоменом талина F3 (остатки 305–400) участвует в регуляции динамических изменений адгезионных структур у мигрирующих клеток, определяя степень их поляризации (Wang et al., 2012).
Палочковидный домен талина может взаимодействовать с опухолевым супрессорным белком DLC1 (deleted in liver cancer1), что обеспечивает вовлечение последнего в фокальные адгезии. Установлено, что центральный участок DLC1 (остатки 448–500) связывается с пучком R8 палочковидного домена талина. Минимальный сайт связывания супрессора с талином представляет собой LD-содержащий участок 469–476 (LDDILYHV) (Li et al., 2011). Амфипатическая LD-спираль DLC1 укладывается между двумя соседними спиралями α2 и α3 на поверхности 4-спирального пучка R8 палочковидного домена талина, образуя 5-спиральный комплекс (Zacharchenko et al., 2016). Установлено, что при формировании этого комплекса конформация пучка R8 не изменяется.
Белки, содержащие анкириновые повторы KANK-1 и 2 (kidney ankyrin repeat-containing protein) и участвующие в регуляции полимеризации актина в мигрирующих клетках посредством ингибирования Rho-ГТФазной активности (Kakinuma et al., 2009), через взаимодействие с талином рекрутируются в фокальные адгезии (Bouchet et al., 2016; Sun et al., 2016). α-Спираль LD-содержащего N-концевого фрагмента (остатки 30–68) KANK-1 и 2 связывается с консервативной поверхностью 5-спирального пучка R7 талина. Сайт связывания располагается в гидрофобной борозде пучка R7 талина между спиралями 29 и 36. Консервативные аминокислотные остатки Trp1630 и Tyr1389 удерживают спирали в отдалении друг от друга, а Gly1404, благодаря отсутствию бокового радикала, создает пространственный карман между этими спиралями, тем самым обеспечивая формирование сайта связывания. Добавление спирали лиганда к спирализованному пучку является способом взаимодействия палочковидного домена талина без изменения степени спирализации пучков.
Талин может участвовать при определенных внешних стимулах в инвазии опухолевых клеток, регулируя процесс созревания инвадоподий. При этом активируется связывание талина с моезином (адаптерным белком, связывающим плазматическую мембрану и кортикальный актиновый цитоскелет (Ponuwei, 2016)). Установлено, что С-концевые спирализованные пучки R11–R13 и субдомен димеризации D палочковидного домена талина связываются с N-концевым FERM-доменом моезина (Beaty et al., 2014). При этом место связывания моезина в талине перекрывается как с IBS2 (R11), так и с ABS3 (R13−D) (Hemmings et al., 1996; Gingras et al., 2008). В свою очередь, связывание талина с моезином приводит к рекрутированию в инвадоподии опухолевых клеток Na+/H+-обменника (NHE-1), локального регулятора внутриклеточного pH (Beaty et al., 2014), который так же, как и талин, обеспечивает созревание инвадоподий, определяющих инвазивные характеристики клеток. Связано это с тем, что изменения значений pH в клетке обусловливают протонирование или депротонирование боковых радикалов аминокислотных остатков во взаимодействующих белках, регулируя тем самым степень межбелковых связей в белковых комплексах инвадоподий и, в конечном итоге, способность опухолевых клеток к метастазированию.
Наконец, палочковидный домен талина в зоне локализации пучков R7–R8 (остатки 1359–1659) может осуществлять связывание с белком промежуточных филаментов – α-синемином на С-концевом участке 1153–1464 (SNTIII), состоящем из семи тандемных повторов (по 39 аминокислот), каждый из которых включает последовательность S/T-X-R-H/Q (Sun et al., 2008; Gingras et al., 2010). Образующаяся связь обеспечивает механическую интеграцию промежуточных филаментов с актин-содержащим цитоскелетом в мышечных клетках.
На основе проведенного анализа структурной организации талина и способов взаимодействия с различными компонентами адгезионных структур и мембранных комплексов можно заключить, что головной домен талина определяет его связывание с клеточной мембраной и регулирует процессы сигнальной трансдукции, а палочковидный домен специализируется на формировании платформы для построения адгезионных структур.
ЗАКЛЮЧЕНИЕ
Суммируя все вышеизложенное, можно выделить следующие особенности структурно-функциональной организации талина. Обращает на себя внимание разделение функциональной нагрузки между головным и палочковидным доменами молекулы талина. В головном домене сосредоточены сайты активации или связывания с различными белками: рецепторами (интегринами), ферментами (киназами, малыми ГТФазами) и их эффекторами (RIAM), структурными белками (актином) и др., а также анионными липидами клеточных мембран. Главная функция палочковидного домена состоит в трансформации физического стимула (механические силы, силы натяжения) в биохимический или физиологический ответ через активацию (демаскирование) сайтов связывания с определенными адаптерными белками (например, с молекулами винкулина), белками цитоскелета (актином) или рецепторами (интегринами).
Отмеченное распределение функций между доменами талина определяется структурной организацией талина. Пространственная локализация 4-х субдоменов (F0, F1, F2 и F3) в головном домене наилучшим образом обеспечивает доступность сайтов связывания в этих субдоменах для эффекторных молекул. Кроме того, линейное расположение субдоменов в пространстве обеспечивает энергетически выгодный способ конформационной подстройки этих субдоменов, определяющий в итоге конечный биологический эффект, например, при взаимодействии с анионными липидами или структурными (регуляторными) белками. Следует также отметить, что компактная укладка глобулы головного домена при необходимости способствует быстрой конформационной трансформации домена, которая приводит к активации тех или иных сайтов связывания лигандов, необходимых для проведения сигнала.
Трехмерная структура палочковидного домена является эволюционным приспособлением для выполнения механико-адаптерных функций. Как отмечалось выше, в состав палочковидного домена входят спирализованные пучки, состоящие из 4-х или 5-ти α-спиралей. Четырехспиральные пучки сосредоточены в N-концевой части домена (кроме R8) и сгруппированы довольно компактно, а 5-спиральные пучки локализованы в C-концевой части домена (кроме R1) и распределены линейно. Связано это с различиями в способах укладки α-спиралей в пространстве у 4- и 5-спиральных пучков. Как уже отмечалось, N- и C-концевые последовательности в 4-спиральных пучках расположены на одной стороне пучка, а в 5-спиральных пучках – с противоположных сторон пучка. Именно особенностями пространственной укладки α-спиралей определяется устойчивость пучка к воздействию сил натяжения, что имеет существенное значение при трансформации клеточного сигнала.
Столь заметное пространственное разграничение 4- и 5-спиральных пучков, во-первых, способствует эффективному межпучковому взаимодействию при образовании неактивной формы димера талина, а во-вторых, обеспечивает возможность под действием физических стимулов изменять степень спирализации определенных пучков. В результате указанных процессов степень доступности различным белкам сайтов связывания, которые были скрыты в спирализованных пучках неактивной формы талина, может варьировать с изменением внешних факторов. Такой тип структурной организации дает возможность регулировать не только активное (неактивное) состояние молекулы димера талина, но и уровень вовлечения других адаптерных молекул при формировании адгезионных клеточных структур.
Связывание палочковидного домена талина с другими белками может осуществляться и другим способом – без изменения степени спирализации пучков этого домена. Например, белки DLC1 и KANK связываются с палочковидным доменом талина посредством добавления дополнительной спирали. В этом случае α-спираль молекулы лиганда, содержащая LD-последовательность, укладывается у одной из сторон палочковидного домена талина, формируя 5-ти или 6-спиральный комплекс по месту связывания. Таким образом, палочковидный домен талина в зависимости от структурных и функциональных характеристик молекулы лиганда может использовать тот или иной способ взаимодействия спирализованных пучков талина, изменяя или нет степень их спирализации.
В последнее время большое внимание уделяется изучению механизмов взаимодействия талина с другими соединениями на молекулярном уровне. В частности, установлено формирование в субдоменах (доменах) талина положительно заряженных платформ, которые электростатически взаимодействуют либо с анионными липидами, формирующими микродомены в клеточной мембране, либо с участками аминокислотной последовательности талина или белков-партнеров, содержащими компактные зоны из отрицательно заряженных аминокислот. Необходимо отметить, что взаимодействующие платформы заряженных аминокислотных остатков могут располагаться не только линейно в первичной структуре талина, но и концентрироваться на одной из сторон сформированных α-спиральных структур молекулы. В ряде случаев имеет место формирование внутрибелковых или межбелковых гидрофобных взаимодействий, но чаще всего они действуют совместно с электростатическими связями. При этом смешанные платформы аминокислот могут быть распределены как в α-спиралях, так и в β-структурах молекулы талина.
И, наконец, следует выделить основную особенность структурно-функциональной организации талина, которая состоит в детерминированности функций головного и палочковидного доменов. Если N-концевая часть молекулы талина (головной домен) трансформирует одни биохимические сигналы в другие, то C-концевая часть молекулы (палочковидный домен) главным образом преобразует физические стимулы в биохимические или физиологические сигналы, которые активируют или ингибируют определенный клеточный ответ, актуальный или неактуальный в данных условиях.
Список литературы
Anthis N.J., Wegener K.L., Feng Y., Kim C., Goult B.T., Lowe E.D., Vakonakis I., Bate N., Critchley D.R., Ginsberg M.H., Campbell I.D. 2009. The structure of an integrin/talin complex reveals the basis of inside-out signal transduction. EMBO J. V. 28. P. 3623.
Ascario M.J., Tajkhorshid E. 2014. Membrane-induced structural rearrangement and identification of a novel membrane anchor in talin F2F3. Biophys. J. V. 107. P. 2059.
Atherton P., Stutchbury B., Wang D.Y., Jethwa D., Tsang R., Meiler-Rodriguez E., Wang P., Bate N., Zent R., Barsukov I.L., Goult B.T., Critchley D.R., Ballestrem C. 2015. Vinculin controls talin engagement with the actomyosin machinery. Nat. Commun. V. 6. P. 10038. https://doi.org/10.1038/ncomms10038
Banno A., Goult B.T., Lee H., Bate N., Critchley D.R., Ginsberg M.H. 2012. Subcellular localization of talin is regula-ted by inter-domain interactions. J. Biol. Chem. V. 287. P. 13 799.
Barczyk M., Carracedo S., Gullberg D. 2010. Integrins. Cell Tissue Res. V. 339. P. 269.
Bass M.D., Patel B., Barsukov I.G., Fillingham I.J., Mason R., Smith R.J., Bagshaw C.R., Critchley D.R. 2002. Further characterization of the interaction between the cytoskeletal proteins talin and vinculin. Biochem. J. V. 362. P. 761.
Beaty B.T., Wang Y., Bravo-Cordero J.J., Sharma V.P., Miskolci V., Hodgson L., Condeelis J. 2014. Talin regulates moesin-NHE-1 recruitment to invadopodia and promotes mammary tumor metastasis. J. Cell Biol. V. 205. P. 737.
Berrier A.L., Yamada K.M. 2007. Cell-matrix adhesion. J. Cell Physiol. V. 213. P. 565.
Bouaouina M., Lad Y., Calderwood D.A. 2008. The N-terminal domains of talin cooperate with the phosphotyrosine binding-like domain to activate β1 and β3 integrins. J. Biol. Chem. V. 283. P. 6118.
Bouchet B.P., Gough R.E., Ammon Y.C., van der Willige D., Post H., Jacquemet G., Altelaar A.F.M., Heck A.J.R., Goult B.T., Akhmanova A. 2016. Talin-KANK1 interaction controls the recruitment of cortical microtubule stabilizing complexes to focal adhesions. eLIFE. V. 5. e18124. https://doi.org/10.7554/eLife.18124
Bunch T.A. 2010. Integrin αIIbβ3 activation in Chinese hamster ovary cells and platelets increases clustering rather than affinity. J. Biol. Chem. V. 285. P. 1841.
Calderwood D.A. 2004. Talin controls integrin activation. Biochem. Soc. Trans. V. 32. P. 434.
Calderwood D.A., Yan B., de Pereda J.M., Garcia-Alvarez B., Fujioka Y., Liddington R.C., Ginsberg M.H. 2002. The phosphotyrosine binding-like domain of talin activates integrins. J. Biol. Chem. V. 277. P. 21749.
Campbell I.D., Humphries M.J. 2011. Integrin structure, activation and interactions. Cold Spring Harb. Perspect. Biol. V. 3. a004994. https://doi.org/10.1101/cshperspect.a004994
Chang Y.C., Zhang H., Franco-Barraza J., Brennan M.L., Patel T., Cukierman E., Wu J. 2014. Structural and mechanistic insights into the recruitment of talin by RIAM in integrin signaling. Structure. V. 22. P. 1810.
Changede R., Xu X., Margadant F., Sheetz M.P. 2015. Nascent integrin adhesions form on all matrix rigidities after integrin activation. Dev. Cell. V. 35. P. 614.
Chen H.C., Appeddu P.A., Parsons J.T., Hildebrand J.D., Schaller M.D., Guan J.L. 1995. Interaction of focal adhesion kinase with cytoskeletal protein talin. J. Biol. Chem. V. 270. P. 16 995.
Chinthalapudi K., Rangarajan E.S., Izard T. 2018. The interaction of talin with the cell membrane is essential for integrin activation and focal adhesion formation. Proc. Natl. Acad. Sci. USA. V. 115. P. 10 339.
Ciobanasu C., Wang H., Henriot V., Mathieu C., Fente A., Csillag S., Vigouroux C., Faivre B., Clainche C. 2018. Integrin-bound talin head inhibits actin filament barbed-end elongation. J. Biol. Chem. V. 293. P. 2586.
Critchley D.R., Gingras A.R. 2008. Talin at a glance. J. Cell Sci. V. 121. P. 1345.
Das M., Ithychanda S.S., Qin J., Plow E.F. 2014. Mechanisms of talin-dependent integrin signaling and crosstalk. Biochim. Biophys. Acta. V. 1838. P. 579.
Dedden D., Schumacher S., Kelley C.F., Zacharias M., Biertümpfel C., Fässler R., Mizuno N. 2019. The architecture of talin1 reveals an autoinhibition mechanism. Cell. V. 179. P. 120.
De Pereda J.M., Wegener K.L., Santelli E., Bate N., Ginsberg M.H., Critchley D.R., Campbell I.D., Liddington R.C. 2005. Structural basis for phosphatidylinositol phosphate kinase type Iγ binding to talin at focal adhesions. J. Biol. Chem. V. 280. P. 8381.
del Rio A., Perez-Jimenez R., Liu R., Roca-Cusachs P., Fernandez J.M., Sheetz M.P. 2009. Stretching single talin rod molecules activates vinculin binding. Science. V. 323. P. 638.
Di Paolo G., Pellegrini L., Letinie K., Cestra G., Zoncu R., Voro-nov S., Chang S., Guo J., Wenk M.R., De Camilli P. 2002. Recruitment and regulation of phosphatidylinositol phosphate kinase type Iγ by the FERM domain of talin. Nature. V. 420. P. 85.
Elliott P.R., Goult B.T., Kopp P.M., Bate N., Grossmann J.G., Roberts G.C.K., Critchley D.R., Barsukov I.L. 2010. The structure of the talin head reveals a novel extended conformation of the FERM domain. Structure. V. 18. P. 1289.
Gao J., Huang M., Lai J., Mao K., Sun P., Cao Z., Hu Y., Zhang Y., Schulte M.L., Jin C., Wang J., White G.C., Xu Z., Ma Y.Q. 2017. Kindlin supports platelet integrin αIIbβ3 activation by interacting with paxillin. J. Cell Sci. V. 130. P. 3764.
Garcia-Alvarez B., de Pereda J.M., Calderwood D.A., Ulmer T.S., Critchley D.R., Campbell I.D., Ginsberg M.H., Liddington R.C. 2003. Structural determinants of integrin recognition by talin. Mol. Cell. V. 11. P. 49.
Gingras A.R., Bate N., Goult B.T., Hazelwood L., Canestrelli I., Grossmann I.G., Liu H., Putz N.S.M., Roberts G.C.K., Volkmann N., Hanein D., Barsukov I.L., Critchley D.R. 2008. The structure of the C-terminal actin-binding domain of talin. EMBO J. V. 27. P. 458.
Gingras A.R., Bate N., Goult B.T., Patel B., Kopp P.M., Emsley J., Barsukov I.L., Roberts G.C.K., Critchley D.R. 2010. Central region of talin has a unique fold that binds vinculin and actin. J. Biol. Chem. V. 285. P. 29577.
Gingras A.R., Wolfgang H.Z., Bobkov A.A., Joyce M.G., Fasci D., Himmel M., Rothemund S., Ritter A., Grossmann J.G., Patel B., Bate N., Goult B.T., Emsley J., Barsukov I.L., Roberts G.C.K., Liddington R.C., Ginsberg M.H., Critchley D.R. 2009. Structural determinants of integrin binding to the talin rod. J. Biol. Chem. V. 284. P. 8866.
Gingras A.R., Ziegler W.H., Frank R., Barsukov I.L., Roberts G.C.K., Critchley D.R., Emsley J. 2005. Mapping and consensus sequence identification for multiple vinculin binding sites within the talin rod. J. Biol. Chem. V. 280. P. 37217.
Goksoy E., Ma Y.Q., Wang X., Kong X., Perera D., Plow E.F., Qin J. 2008. Structural basis for the autoinhibition of talin in re-gulating integrin activation. Mol. Cell. V. 31. P. 124.
Gough R.E., Goult B.T. 2018. The tail of two talins – two isoforms to fine-tune integrin signalling. FEBS Lett. V. 592. P. 2108.
Goult B.T., Bate N., Anthis N.J., Wegener K.L., Gingras A.R., Patel B., Barsukov I.L., Campbell I.D., Roberts G.C.K., Critchley D.R. 2009. The structure of an interdomain complex that regulates talin activity. J. Biol. Chem. V. 284. P. 15097.
Goult B.T., Bouaouina M., Elliott P.R., Bate N., Patel B., Gingras A.R., Grossmann J.G., Roberts G.C.K., Calderwood D.A., Critchley D.R., Barsukov I.L. 2010. Structure of a double ubiquitin-like domain in the talin head: a role in integrin activation. EMBO J. V. 29. P. 1069.
Goult B.T., Xu X.P., Gingras A.R., Swift M., Patel B., Bate N., Kopp P.M., Barsukov I.L., Critchley D.R., Volkmann N., Hanein D. 2013a. Structural studies on full-length talin1 reveal a compact auto-inhibited dimer: implications for talin activation. J. Struct. Biol. V. 184. P. 21.
Goult B.T., Yan J., Schwartz M.A. 2018. Talin as a mechanosensitive signaling hub. J. Cell Biol. V. 217. P. 3276.
Goult B.T., Zacharchenko T., Bate N., Tsang R., Hey F., Gingras A.R., Elliott P.R., Roberts G.C.K., Ballestream C., Critchley D.R., Barsukov I.L. 2013b. RIAM and vinculin binding to talin are mutually exclusive and regulate adhesion assembly and turnover. J. Biol. Chem. V. 288. P. 8238.
Han J., Lim C.J., Watanabe N., Soriani A., Ratnikov B., Calderwood D.A., Puzon-McLaughlin W., Lafuente E.M., Boussiotis V.A., Shattil S.J., Ginsberg M.H. 2006. Reconstructing and deconstructing agonist-induced activation of integrin αIIbβ3. Curr. Biol. V. 16. P. 1796.
Hemmings L., Rees D.J.G., Ohanian V., Bolton S.J., Gilmore A.P., Patel B., Priddle H., Trevithick J.E., Hynes R.O., Critchley D.R. 1996. Talin contains three actin-binding sites each of which is adjacent to a vinculin-binding sites. J. Cell Sci. V. 109. P. 2715.
Hu X., Jing C., Xu X., Nakasawa N., Cornish V.W., Margadant F.M., Sheetz M.P. 2016. Cooperative vinculin binding to talin mapped by time-resolved super resolution microscopy. Nano Lett. V. 16. P. 4062.
Humphries J.D., Wang P., Streuli C., Geiger B., Humphries M.J., Ballestream C. 2007. Vinculin controls focal adhesion formation by direct interactions with talin and actin. J. Cell Biol. V. 179. P. 1043.
Hytönen V.P., Vogel V. 2008. How force might activate talin’s vinculin binding sites: SMD reveals a structural mechanism. PLoS Comput. Biol. V. 4. e24. https://doi.org/10.1371/journal.pcbi.0040024
Kakinuma N., Zhu Y., Wang Y., Roy B.C., Kiyama R. 2009. Kank proteins: structure, functions and diseases. Cell. Mol. Life Sci. V. 66. P. 2651.
Kalli A.C., Campbell I.D., Sansom M.S.P. 2013. Conformational changes in talin on binding to anionic phospholipid membranes facilitate signaling by integrin transmembrane helices. PLoS Comput. Biol. V. 9. a1003316. https://doi.org/10.1371/journal.pcbi.1003316
Kim C., Ye F., Hu X., Ginsberg M.H. 2012. Talin activates integrin by altering the topology of the β transmembrane domain. J. Cell Biol. V. 187. P. 605.
Klapholz B., Brown N.H. 2017. Talin – the master of integrin adhesions. J. Cell Sci. V. 130. P. 2435.
Kopp P.M., Bate N., Hansen T.M., Brindle N.P.J., Praekelt U., Debrand E., Caleman S., Mazzeo D., Goult B.T., Gingras A.R., Pritchard C.A., Critchley D.R., Monkley S.J. 2010. Studies on the morphology and spreading of human endothelial cells define key inter- and intramolecular interactions for talin1. Eur. J. Cell Biol. V. 89. P. 661.
Kumar A., Ouyang M, van den Dries K., McGhee E.J., Tanaka K., Anderson M.D., Groisman A., Goult B.T., Anderson K.I., Schwartz M.A. 2016. Talin tension sensor reveals novel features of focal adhesion force transmission and mechanosensitivity. J. Cell Biol. V. 213. P. 371.
Lau T.L., Kim C., Ginsberg M.H., Ulmer T.S. 2009. The structure of the integrin αIIbβ3 transmembrane complex explains integrin transmembrane signalling. EMBO J. V. 28. P. 1351.
Lawson C., Lim S.T., Uryu S., Chen X.L., Calderwood D.A., Schlaepfer D.D. 2012. FAK promotes recruitment of talin to nascent adhesions to control cell motility. J. Cell Biol. V. 196. P. 223.
Lee H.S., Bellin R.M., Walker D.L., Patel B., Powers P., Liu H., Garcia-Alvarez B., de Pereda J.M., Liddington R.C., Volkmann N., Hanein D., Critchley D.R., Robson R.M. 2004. Characterization of an actin-binding site within the talin FERM domain. J. Mol. Biol. V. 343. P. 771.
Lee H.S., Lim C.J., Puzon-McLaughlin W., Shattil S.J., Ginsberg M.H. 2009. RIAM activates integrins by linking talin to Ras GTPase membrane-targeting sequences. J. Biol. Chem. V. 284. P. 5119.
Lee S.E., Kamm R.D., Mofrad M.R. 2007. Force-induced activation of talin and its possible role in focal adhesion me-chanotransduction. J. Biomech. V. 40. P. 2096.
Legate K.R., Fässler R. 2009. Mechanisms that regulate adaptor binding to β-integrin cytoplasmic tails. J. Cell Sci. V. 122. P. 187.
Li G., Du X., Vass W.C., Papageorge A.G., Lowy D.R., Qian X. 2011. Full activity of the deleted in liver cancer 1 (DLC1) tumor suppressor depends on an LD-like motif that binds talin and focal adhesion kinase (FAK). Proc. Natl. Acad. Sci. USA. V. 108. P. 17129.
Luo B.H., Springer T.A., Takagi J. 2004. A specific interface between integrin transmembrane helices and affinity for ligand. PLoS Biol. V. 2. e153. https://doi.org/10.1371/journal.pbio.0020153
Margadant F., Chew L.L., Hu X., Yu H., Bate N., Zhang X., Sheetz M. 2011. Mechanotransduction in vivo by repeated talin stretch-relaxation events depends upon vinculin. PLoS Biol. V. 9. e1001223. https://doi.org/10.1371/journal.pbio.1001223
McCann R.O., Craig S.W. 1997. The I/LWEQ module: a conserved sequence that signifies F-actin binding in functionally diverse proteins from yeast to mammals. Proc. Natl. Acad. Sci. USA. V. 94. P. 5679.
Mehrbod M., Trisno S., Mofrad M.R.K. 2013. On the activation of integrin αIIbβ3: outside-in and inside-out pathways. Biophys. J. V. 105. P. 1304.
Moes M., Rodius S., Coleman S.J., Monkley S.J., Goormaghtigh E., Tremuth L., Kox C., van der Holst P.P., Critchley D.R., Kieffer N. 2007. The integrin binding site2 (IBS2) in the talin rod domain is essential for linking integrin beta subunits to the cytoskeleton. J. Biol. Chem. V. 282. P. 17280.
Morse E.M., Brahme N.N., Calderwood D.A. 2014. Integrin cytoplasmic tail interactions. Biochemistry. V. 53. P. 810.
Pan L., Zhao Y., Yuan Z., Qin G. 2016. Research advances on structure and biological functions of integrins. SpringerPlus. V. 5. 1094. https://doi.org/10.1186/s40064-016-2502-0
Papagrigoriou E., Gingras A.R., Barsukov I.L., Bate N., Fillingham I.J., Patel B., Frank R., Ziegler W.H., Roberts G.C.K., Critchley D.R., Emsley J. 2004. Activation of a vinculin-binding site in the talin rod involves rearrangement of a five-helix bundle. EMBO J. V. 23. P. 2942.
Patel B., Gingras A.R., Bobkov A.A., Fujimoto L.M., Zhang M., Liddington R.C., Mazzeo D., Emsley J., Roberts G.C.K., Barsukov I.L., Critchley D.R. 2006. The activity of the vinculin binding sites in talin is influenced by the stability of the helical bundles that make up the talin rod. J. Biol. Chem. V. 281. P. 7458.
Ponuwei G.A. 2016. A glimpse of the ERM proteins. J. Biomed. Sci. V. 23. 35. https://doi.org/10.1186/s12929-016-0246-3
Rahikainen R., Öhman T., Turkki P., Varjosalo M., Hytönen V.P. 2019. Talin-mediated force transmission and talin rod domain unfolding independently regulate adhesion signaling. J. Cell Sci. V. 132. jcs226514. https://doi.org/10.1242/jcs.226514
Roberts G.C.K., Critchley D.R. 2009. Structural and biophysical properties of the integrin-associated cytoskeletal protein talin. Biophys. Rev. V. 1. P. 61.
Rodius S., Chaloin O., Moes M., Schaffner-Reckinger E., Landriew I., Lippens G., Lin M., Zhang J., Kieffer N. 2008. The talin rod IBS2 α-helix interacts with the β3 integrin cytoplasmic tail membrane-proximal helix by establishing charge complementary salt bridges. J. Biol. Chem. V. 283. P. 24212.
Saltel F., Mortier E., Hytönen V.P., Jacquier M.C., Zimmerman P., Vogel V., Liu W., Wehrle-Heller B. 2009. New PI(4,5)P2- and membrane proximal integrin-binding motifs in the talin head control β3-integrin clustering. J. Cell Biol. V. 187. P. 715.
Schiemer J., Bohm A., Lin L., Merrill-Skoloff G., Flaumenhaft R., Huang J.S., Le Breton G.C., Chishti A.H. 2016. Gα13 switch region 2 relieves talin autoinhibition to activate αIIbβ3 integrin. J. Biol. Chem. V. 291. P. 26 598.
Shattil S.J., Kim C., Ginsberg M.H. 2010. The final steps of integrin activations: the end game. Nat. Rev. Mol. Cell Biol. V. 11. P. 288.
Song X., Yang J., Hirbawi J., Ye S., Perera H.D., Goksoy E., Dwivedi P., Plow E.F., Zhang R., Qin J. 2012. A novel membrane-dependent on/off switch mechanism talin FERM domain at sites of cell adhesion. Cell Res. V. 22. P. 1533.
Sun N., Critchley D.R., Paulin D., Li Z., Robson R.M. 2008. Identification of a repeated domain within mammalian a-synemin that interacts directly with talin. Exp. Cell Res. V. 314. P. 1839.
Sun Z., Tseng H.Y., Tan S., Senger F., Kursawa L., Dedden D., Mizuno N., Wasik A.A., Thery M., Dunn A.R., Fässler R. 2016. Kank2 activates talin, reduces force transduction across integrins and induces central adhesion formation. Nat. Cell Biol. V. 18. P. 941.
Takada Y., Ye X., Simon S. 2007. The integrins. Genome Biol. V. 8. P. 215.1.
Theocharis A.D., Skandalis S.S., Gialeli C., Karamanos N.K. 2016. Extracellular matrix structure. Adv. Drug Delivery Rev. V. 97. P. 4.
Tremuth L., Kreis S., Melchior C., Hoebeke J., Rondé P., Plancon S., Takeda K., Kieffer N. 2004. A fluorescence cell biology approach to map the second integrin-binding site of talin to a 130-amino acid sequence within the rod domain. J. Biol. Chem. V. 279. P. 22 258.
Vinogradova O., Velyvis A., Velyviene A., Hu B., Haas T.A., Plow E.F., Qin J. 2002. A structural mechanism of integrin αIIbβ3 “inside-out” activation as regulated by its cytoplasmic face. Cell. V. 110. P. 587.
Wang S., Watanabe T., Matsuzawa K., Katsumi A., Kakeno M., Matsui T., Ye F., Sato K., Murase K., Sugiyama I., Kimura K., Mizoguchi A., Ginsberg M.H., Collard J.G., Kaibuchi K. 2012. Tiam 1 interaction with the PAR complex promotes talin-mediated Rac1 activation during polarized cell migration. J. Cell Biol. V. 199. P. 331.
Wang Y., Yan J., Goult B.T. 2019. Force-dependent binding constants. Biochemistry. V. 58. P. 4696.
Wegener K.L., Partridge A.W., Han J., Pickford A.R., Liddington R.C., Ginsberg M.H., Campbell I.D. 2007. Structural basis of integrin activation by talin. Cell. V. 128. P. 171.
Wolfenson H., Lavelin I., Geiger B. 2013. Dynamic regulation of the structure and functions of integrin adhesions. Dev. Cell. V. 24. P. 447.
Xing B., Jedsadayanmata A., Lams S.C.T. 2001. Localization of an integrin binding site to the C terminus of talin. J. Biol. Chem. V. 276. P. 44373.
Yan J., Yao M., Goult B.T., Sheetz M.P. 2015. Talin dependent mechanosensitivity of cell focal adhesions. Cell. Mol. Bioeng. V. 8. P. 151.
Yang J., Zhu L., Zhang H., Hirbawi J., Fukuda K., Dwivedi P., Liu J., Byzova T., Plow E.F., Wu J., Qin J. 2014. Conformational activation of talin by RIAM triggers integrin-mediated cell adhesion. Nat. Commun. V. 5. P. 5880. https://doi.org/10.1038/ncomms6880
Yao M., Goult B.T., Chen H., Cong P., Sheetz M.P., Yan J. 2014. Mechanical activation of vinculin binding to talin locks talin in an unfolded conformation. Sci. Rep. V. 4. P. 4610. https://doi.org/10.1038/srep04610
Yao M., Goult B.T., Klapholz B., Hu X., Toseland C.P., Guo Y., Cong P., Sheetz M.P., Yan J. 2016. The mechanical response of talin. Nat. Commun. V. 7. P. 11966. https://doi.org/10.1038/ncomms11966
Ye X., McLean M.A., Sligar S.G. 2016. Conformational equilibrium of talin is regulated by anionic lipids. Biochim. Biophys. Acta. V. 1858. P. 1833.
Zacharchenko T., Qian X., Goult B.T., Jethwa D., Almeida T.B., Ballestrem C., Critchley D.R., Lowy D.R., Barsukov I.L. 2016. LD motif recognition by talin: structure of the talin-DLC1 complex. Structure. V. 24. P. 1130.
Zaidel-Bar R., Itzkovitz S., Ma’ayan A., Iyengar R., Geiger B. 2007. Functional atlas of the integrin adhesome. Nat. Cell Biol. V. 9. P. 858.
Zhang H., Chang Y.C., Huang Q., Brennan M.L., Wu J. 2016. Structural and functional analysis of a talin triple-domain module suggests an alternative talin autoinhibitory confi-guration. Structure. V. 24. P. 721.
Zhu L., Yang J., Bromberger T., Holly A., Lu F., Liu H., Sun K., Klapproth S., Hirbawi J., Byzova T.V., Plow E.F., Moser M., Qin J. 2017. Structure of Rap1b bound to talin reveals a pathway for triggering integrin activation. Nat. Commun. V. 8. P. 1744. https://doi.org/10.1038/s41467-017-01822-8
Дополнительные материалы отсутствуют.
Инструменты
Цитология


