Цитология, 2021, T. 63, № 1, стр. 30-42
Мембранная биоэнергетика и разделение труда в системах электрически связанных клеток
Т. В. Потапова *
Научно-исследовательский институт физико-химической биологии им. А.Н. Белозерского
Московского государственного университета им. М.В. Ломоносова
119899 Москва, Россия
* E-mail: potapova@belozersky.msu.ru
Поступила в редакцию 31.08.2020
После доработки 10.09.2020
Принята к публикации 11.09.2020
Аннотация
С позиций современной мембранной биоэнергетики возможно разделение в пространстве мембранных белков, обеспечивающих запасание и использование энергии, аккумулированной в форме мембранного потенциала (МП). Наличие в многоклеточных системах электрической связи через проницаемые контакты (ПК) создает возможность транспорта энергии через ПК и на этой основе разделения труда между соседними клетками. Происходящие при этом процессы и явления проявляются в изменениях электрических характеристик отдельных клеток и ПК и могут быть количественно проанализированы с помощью описания клеток и клеточных систем как эквивалентных электрических кабелей. В настоящем обзоре приводятся данные многолетних исследований с участием автора передачи энергии через ПК в эволюционно различных многоклеточных системах: трихомах нитчатых цианобактерий, гифах мицелиальных грибов и монослойных культурах клеток животных. Более детально рассмотрена, как удобная экспериментальная модель, гифа Neurospora crassa. На основе сопоставления собственных данных с большим объемом данных из литературы рассмотрена гипотеза о возможном участии в самоорганизации внутриклеточных структур на верхушке растущей гифы N. crassa локальных электрических полей, которые создаются при разделении между клетками функций генерации МП и использования его энергии. Представления об особенностях электрических процессов и явлений, сопровождающих транспорт энергии через ПК, могут быть полезны при анализе многих важных вопросов, связанных с рассмотрением механизмов реализации генетических “инструкций” в конкретных жизненных процессах.
В рамках представлений современной мембранной биоэнергетики (Скулачев и др., 1977, 2010; Skulachev, 1988) разность электрохимических потенциалов ионов Н+ на сопрягающей мембране (ΔµH+) представляет собой наряду с АТФ конвертируемую и транспортабельную форму энергии в клетке, которая обеспечивает различные типы жизненной активности, такие как химическая, осмотическая и механическая работа и производство тепла. Транспорт энергии в форме ΔµH+ вдоль сопрягающих мембран объединяет тысячи генераторов ΔµH+ в единую энергосистему.
Транспорт ионов через плазматическую мембрану у всех живых клеток от прокариотов до эукариотов – необходимая составная часть поддержания ионно-осмотического гомеостаза, передачи информации, энергетического обеспечения клеточного метаболизма, снабжения клеток субстратами и удаления продуктов жизнедеятельности (Mitchell, 1962, 1966; Crane, 1977; Harold 1986; Slayman, 1987; Skulachev, 1988). В стационарном состоянии все ионные потоки взаимосогласованы между собой и с энергетическим статусом клетки. Транспорт ионов, необходимых для выполнения клеткой определенных функций, осуществляют разнообразные внутримембранные белки, которые являются либо первичными ионными насосами, как, например, непосредственно потребляющая энергию АТФ протонная ATФаза грибной клетки (Slayman, 1987), либо вторичными транспортерами, например, те, которые у грибов осуществляют в симпорте с протоном перенос сахаров, аминокислот и ионов (Slayman, Slayman, 1974; Sanders et al., 1983; Blatt, Slayman, 1987; Rodriquez-Navarro et al., 1986). Активная работа подобных транспортных белков создает значительные ионные потоки через плазматическую мембрану (примерно 106–107 ионов на клетку за 1 с) и часто сопровождается более или менее значительными электрическими токами: от пикоампер до десятков наноампер на клетку (De Loof, 1985; Harold 1986; Slayman, 1987).
Различные транспортные белки, как в пределах одной клетки, так и в соседних клетках, могут быть неоднородно распределены или неоднородно активированы, что может привести к появлению более или менее значительных локальных электрических полей. Примером такого рода могут служить локальные электрические токи, связанные с направленным транспортом в эпителиальных тканях животных (Jaffe, Nuccitelli, 1977; De Loof, 1985; Harold, 1986).
Задача представленного обзора ввести читателя в детали электрических процессов и явлений, сопровождающих в многоклеточных системах разделение между клетками функций акумуляции энергии в форме МП и расходования этой энергии на клеточные нужды. На примере гифы мицелиального гриба рассматриваются возможности упорядочивания взаимодействий внутриклеточных структур под влиянием локальных электрических полей, генерируемых и поддерживаемых разделением труда между клетками (рис. 1).
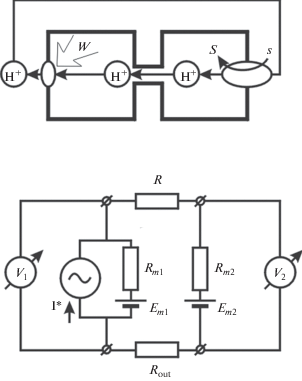
Рис. 1.
Разделение транспортных функций между клетками, связанными ПК. Вверху – Схема движения ионов H+, которые откачиваются ионным насосом с затратами энергии (W) через плазматическую мембрану левой клетки и возвращаются внутрь системы клеток путем транспорта субстрата (S), сопряженного с входом ионов H+ по электрохимическому градиенту. Внизу – Схема эквивалентного электрического кабеля, позволяющая производить количественные оценки. Насосы левой клетки генерируют электрический ток I*, расходуя энергию W. Rm1 и Rm2 – сопротивление мембран левой и правой клеток соответственно. Em1 и Em2 – диффузионные МП, создаваемые различием концентраций ионов между цитоплазмой и внеклеточной средой. R – сопротивление ПК между клетками. Rout – сопротивление наружной среды. V1, V2 – МП левой и правой клеток соответственно.
ЭЛЕКТРИЧЕСКАЯ СВЯЗЬ МЕЖДУ ЭЛЕКТРОНЕВОЗБУДИМЫМИ КЛЕТКАМИ
Во второй половине прошлого века была открыта, почти случайно, электрическая связь между электроневозбудимыми клетками (Kanno, Loewenstei, 1964). В ходе исследования электрических свойств ядерной мембраны клеток слюнной железы личинки дрозофилы с помощью двух микроэлектродов, через один из которых пропускали тестирующие импульсы электрического тока, оказалось, что при последовательном перемещении электродов из клетки в клетку импульсы регистрируются, когда электроды расположены в соседних клетках. Межклеточные каналы, по которым из клетки в клетку протекает электрический ток и свободно проходят ионы и мелкие молекулы, у разных организмов совсем не похожи друг на друга: у нитчатых цианобактерий это микроплазмадесмы, у растений – плазмадесмы, у животных – щелевые контакты, у грибов – септальные поры. Однако электрические свойства всех многоклеточных систем, связанных внутри себя такими проницаемыми контактами (ПК), описываются одними и теми же кабельными уравнениями, разработанными когда-то для описания электрических процессов в телеграфных кабелях, проложенных по дну Мирового океана.
В 40-х гг. прошлого века Ходжкин и Раштон (Hodgkin, Rushton, 1946) экспериментально показали, что такие одиночные волокна, как гигантский аксон кальмара, ведут себя подобно электрическому кабелю. В аксон вводили микроэлектрод и пропускали через него ток, создавая в этой точке изменение МП. С помощью второго микроэлектрода измеряли разность потенциалов на мембране на разных расстояниях от первого электрода. Потенциал спадал по экспоненте, и по графику спада потенциала можно было оценить характерные параметры кабеля. Измеряя напряжение на мембране непосредственно около токового электрода и зная силу пропускаемого тока, можно найти входное сопротивление волокна (Rвх). Исходя из оценки диаметра волокна, рассчитали сопротивление мембраны аксона, которое оказалось очень мало по сравнению с изоляцией технических кабелей, и удельное сопротивление аксоплазмы, которое, напротив, оказалось примерно в 25 млн раз выше, чем у меди.
Эта работа (Hodgkin, Rushton, 1946) была удостоена Нобелевской премии, а введение представлений кабельной теории в практику работы электрофизиологов способствовало бурному прогрессу в этой области. В частности, эти представления были успешно использованы при анализе электрических взаимодействий в разнообразных системах живых клеток, связанных ПК: многоклеточных микроорганизмах, развивающихся зародышах, сердечной, мышечной и других тканях (Беркинблит и др., 1981).
Наличие прямого диффузионного обмена между клетками позволяет им, сохраняя индивидуальную неприкосновенность наследственных молекул, решать часть жизненных проблем, объединяя низкомолекулярные ресурсы и распределяя обязанности между соседями (Loewenstein, 1984). При рассмотрении функциональной роли ПК весьма плодотворным может быть использование представлений об энергетических функциях ионных градиентов через плазматическую мембрану. Важная характеристика эквивалентного элeктрического кабеля – пространственная константа (λ). Это расстояние вдоль кабеля, на котором затухает в е раз приложенный в точке электрический потенциал. Величина λ у всех многоклеточных объектов лежит в пределах от нескольких десятков до нескольких сотен мкм, т.е. электрическая связь эффективна для ограниченного числа клеток (Беркинблит и др., 1981). Например, в гифах мицелиального гриба Neurospora crassa, длина клетки которых составляет 50–100 мкм, такая функционально связанная группа должна состоять из 4–6 клеток. Однако чтобы понять, какие именно задачи решают группы клеток, обобществляя свои низкомолекулярные ресурсы, необходимо оценить одновременно динамику обмена через межклеточные каналы и функциональные характеристики отдельных клеток, составляющих связанную группу, что технически не очень просто осуществить (рис. 2).
Рис. 2.
Схема экспериментальной оценки с помощью стеклянных микроэлектродов электрических характеристик, связанных с энергетическими процессами в ПМ, в эволюционно разных многоклеточных системах. а – Кончик трихома нитчатой цианобактерии Phormidium uncinatum с усилием “продавлен” через устье стеклянной микропипетки (чтобы предотвратить его смещение в ответ на засветку) в каплю дистиллированной воды. Внеклеточные электроды регистрировали между наружной каплей среды и дистиллированной водой в микропипетке сопротивление в несколько сотен МОм (Потапова и др., 1986). Узкий луч (d ≈ 20 мкм) фотосинтетически активного света (h√) вызывает гиперполяризацию освещенных клеток, которая распространяется вдоль трихома. б – Регистрация внутриклеточными микроэлектродами градиентов МП между клетками на верхушке вегетативной гифы мицелиального гриба Neurospora crassa. Указаны величины МП в мВ. в, г – Схемы распространения электрических токов между участками многоклеточной системы с разной активностью генераторов МП, обусловленной локальной засветкой трихома (в) или отсутствием протонных насосов у передних клеток гифы (г).
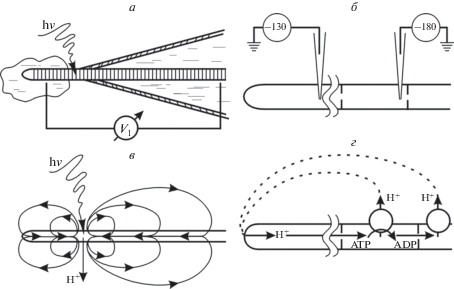
Например, в экспериментах с трихомом нитчатой цианобактерии Phormidium uncinatum оказались эффективны внеклеточные электрические отведения. Трихом – это покрытая слизевым чехлом цепочка из сотен клеток диаметром 5 мкм, которая движется под действием света. Локальное воздействие на 10–20 клеток трихома фотосинтетически активным светом вызывало гиперполяризацию плазматической мембраны в месте освещения и распространение электрических токов через ПК, приводя к гиперполяризации неосвещенных участков трихома (Потапова и др., 1986; Aslanidi, Shalapjenok, 1991).
Электрические параметры соседних клеток на верхушке растущей гифы N. crassa оценивали с помощью стандартных внутриклеточных микроэлектродов (Potapova et al., 1988; Belozerskaya, Potapova, 1993). Чтобы вводить тонкие стеклянные иголочки внутрь подвижного цилиндра диаметром 10–15 мкм, покрытого жестким хитиновым чехлом, приходилось тщательно подбирать твердость стекла, длину и угол наклона тонкой части микроэлектрода, а также прижимать верхушку гифы к поверхности агара стекляным крючком, закрепленным на микроманипуляторе (Belozerskaya, Potapova, 1993). Теоретический модельный анализ показал, что небольшая группа клеток на верхушке растущей вегетативной гифы N. crassa эффективно функционирует как единый ансамбль, способный успешно решать задачу энергетической кооперации (Асланиди и др., 1997; Смолянинов, Потапова, 2003).
ВОЗМОЖНОСТИ ЭНЕРГЕТИЧЕСКОЙ КООПЕРАЦИИ В СИСТЕМАХ ЖИВЫХ КЛЕТОК
В 80-х гг. прошлого века была разработана оригинальная математическая модель, связывающая энергетику и ионно-осмотический гомеостаз животной клетки (Aslanidi, Panfilov, 1986). В этой модели МП присутствует как гомеостазируемый параметр, т.е. модель учитывает тот факт, что при ухудшении энергообеспечения клетки в последнюю очередь лишаются энергии АТФ ионные насосы плазматической мембраны, так как у них константа связывания с АТФ ниже, чем у конкурентных внутриклеточных потребителей АТФ. Применение этой модели для анализа ситуации в многоклеточной системе с ПК показало, что если часть электрически связанных клеток окажется неспособной поддерживать свой ионный гомеостаз, то их “проблемы” могут быть решены ближайшими клетками с помощью электрической связи и ионных потоков через ПК. Однако при этом клеткам-генераторам придется тратить на “помощь соседям” собственные ресурсы АТФ (Асланиди и др., 1988, 1997).
Это модельное предсказание было проверено в экспериментах на смешанных культурах животных клеток с разной чувствительностью к блокатору ионных насосов клеточных мембран (Na+,K+-ATФаз) уабаину: высоко чувствительных к уабаину фибробластов человека и резистентных к нему (от природы) клеток мыши. Эксперименты показали, что клетки мыши и человека в смешанной монослойной культуре устанавливают друг с другом эффективные ПК. Благодаря этим ПК в присутствии 1 мкМ уабаина, полностью блокирующего ионные насосы фибробластов человека, у всей популяции клеток в смешанной культуре длительное время устойчиво поддерживаются в пределах нормы такие существенные показатели ионно-осмотического гомеостаза, как МП и внутриклеточные концентрации ионов Na+ и K+ (Aslanidi et al., 1991; Асланиди и др., 1991). Межклеточные взаимодействия в такой ситуации носят характер энергетической кооперации, при которой “экспорт” энергии из клеток с активными насосами сопоставим с суммарным клеточным энергопроизводством.
Исходя из значения электрического тока I*, генерируемого ионным насосом одиночной животной клетки и равному ~10−11 A (Веренинов, Марахова, 1986; Harold, 1986), можно оценить эффективность энергетической кооперации. Например, в экспериментах на смешанных культурах клеток человека и мыши регистрировалась разница между величинами МП (ΔМП) клеток-доноров и клеток-акцепторов, равная ~2 мВ (Асланиди и др., 1988). Если принять, что в среднем сопротивление ПК между двумя клетками, RПК, равно ~100 МОм (Chailakhyan et al., 1982; Graf et al., 1987), можно рассчитать величину межклеточного тока I**, вызывающего регистрируемое в эксперименте падение напряжения на сопротивлении контакта:
I** = ΔМП/RПК = 2 × 10−11 A, который соответствует току I*, генерируемому Na+, K+-насосом одиночной клетки.
Важно отметить, что во всем сообществе клеток с активными и неактивными ионными насосами поддерживаются не среднеарифметические значения между параметрами активных и неактивных клеток, а значения, присущие именно активным клеткам. Мы назвали это явление “эффектом лидера”, подчеркнув, что клетки с активными насосами обеспечивают нормальную жизнедеятельность соседей, поддерживая межклеточные ионные потоки за счет своих ресурсов АТФ. Сдвиг параметров ионно-осмотического гомеостаза происходит только после того, как у “лидеров” исчерпываются резервы увеличения мощности насосов (Асланиди и др., 1991).
Участие ПК в “энергетической поддержке” клеток одного типа клетками другого типа описано при ишемии миокарда (Bukauskas, 1982). В качестве естественной системы, реализующей технологию энергетической кооперации, можно рассмотреть растущую верхушку вегетативной гифы мицелиального гриба N. сrassa.
ЭЛЕКТРИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВЕРХУШКИ РАСТУЩЕЙ ГИФЫ N. crassa
В классических исследованиях на клетках N. crassa с использованием внутриклеточных микроэлектродов (Slayman,1965) было показано, что ингибиторы дыхания в течение 1 мин снижали МП от −200 до −30 мВ с восстановлением в течение 10 мин после отмывки игибитора. Было выдвинуто предположение, что H+-ATФаза грибной мембраны работает как генератор трансмембранного тока. Это предположение получило развитие в дальнейших электрофизиологических исследованиях (Slayman et al., 1973; Gradman et al., 1978), в частности при оценке величин МП и рН с помощью флуоресцентных красителей в экспериментах с мембранными везикулами, обогащенными H+-ATФазами (Perlin et al., 1984, 1986). Основные принципы мембранного транспорта в гифах мицелиального гриба N. crassa следуют хемиосмотической схеме Митчелла (Mitchell, 1962, 1966): первичные протонные насосы генерируют трансмембранный градиент ионов H+, который используется как источник энергии для накопления веществ трансмембранными вторичными белковыми транспортерами (Slayman et al., 1973; Slayman, Slayman, 1974; Slayman, 1977; Sanders et al., 1983; Rodrigues-Navarro et al., 1986; Blatt et al., 1987; Slayman et al., 1994).
В обзорной работе (Slayman, 1987) детально рассмотрены свойства ионных насосов плазматических мембран N. сrassa (H+-ATФаз) как генераторов очень сильных (по клеточным масштабам) электрических токов. Плотность молекул H+-ATФазы в плазматических мембранах клеток N. crassa составляет (2–3) × × 1011/см2. Следовательно, для поддержания электрического тока величиной 10 мкА/см2 (соответствующего переносу 6.2 × 1013 ионов на 1 см2 за 1 с) каждая молекула фермента (через которую при гидролизе одной молекулы ATФ перекачивается один протон) должна работать со скоростью 200–300 оборотов/с. Этот электрический ток создает и поддерживает высокую трансмембранную разность потенциалов (в среднем −180 мВ), которую и регистрируют в эксперименте с помощью внутриклеточных микроэлектродов (Slayman, 1965; Чайлахян и др., 1984). С использованием стандартных кабельных уравнений оценили величину пространственной константы λ (~511 мкм; Gradman et al., 1978). Кроме того, был сделан вывод, что при стехиометрии 1H+ : 1АТФ насосы должны потреблять 38–52% суммарной продукции АТФ (Gradman et al., 1978).
В электрофизиологических экспериментах (Slayman, Slayman, 1962; Potapova et al., 1988; Takeuchi et al., 1988) было охарактеризовано продольное электрическое поле на переднем конце растущей гифы N. crassa. По нашим измерениям с помощью внутриклеточных микроэлектродов на расстоянии 100 мкм (L1) от переднего конца гиф N. crassa величина МП равна приблизительно –130 мВ (Vm1), а на расстоянии 400 мкм (L2) – приблизительно –160 мВ (Vm2) (Potapova et al., 1988; Потапова, Бойцова, 1997; Potapova, 2012).
Исходя из этих величин, можно оценить напряженность электрического поля (Е) вдоль переднего конца гифы:
E = (Vm2 – Vm1)/(L2 – L1) = 30 мВ/300 мкм = 100 В/м.
В этом случае эквивалентную электрическую схему верхушки гифы можно представить в виде соединенных последовательно потребителей энергии, локализованных на участке длиной 0.2–0.3 мм (примерно 2–3 самых молодых сегмента), и электрических генераторов, локализованных в плазматической мембране более взрослых сегментов (Асланиди и др., 1997; Смолянинов, Потапова, 2003). При наличии электрической связи между соседними клетками, МП апикальных клеток поддерживаются на высоком уровне за счет работы H+-ATФаз мембран более дистальных клеток. В такой ситуации дистальные клетки расходуют энергию собственных пулов АТФ на поддержание через ПК (септальные поры у гифы) межклеточных электрических токов, которые составляют от трети до половины токов, генерируемых обычной взрослой клеткой через собственную плазматическую мембрану. С помощью техники прижизненных флуоресцентных меток в начале XXI в. было показано, что в плазматических мембранах апикальных клеток вегетативных гиф, действительно, отсутствуют H+-ATФазы (Riquelme et al., 2005; Fajardo-Somera et al., 2013).
В принципе, на верхушке гифы активно происходит митохондриальное дыхание, которое вырабатывает значительное количество АТФ и которое могло бы поддерживать работу H+-ATФаз непосредственно в собственных клетках, создавая таким образом движущую силу для работы расположенных здесь вторичных транспортеров. Однако природа пошла по пути разной транспортной специализации плазматической мембраны молодых апикальных и более взрослых клеток, позволяя апикальным клеткам экономить ресурсы АТФ и направлять их на обеспечение синтеза и работы цитоскелетных элементов. Таким образом, исследование N. сrassa позволило в прямом электрофизиологическом эксперименте продемонстрировать эффективность рассмотрения мембранного электрогенеза с позиций биоэнергетики для анализа функциональной роли ПК как механизма, обеспечивающего энергетическую кооперацию между соседними клетками. Локальные продольные токи и электрические поля, возникающие благодаря разделению труда между клетками по генерации и потреблению энергии МП, могут быть серьезным фактором самоорганизации системы электрически связанных клеток.
СТРУКТУРНАЯ УПОРЯДОЧЕННОСТЬ АПИКАЛЬНОГО СЕГМЕНТА РАСТУЩЕЙ ГРИБНОЙ ГИФЫ
Гифа N. crassa представляет собой цепочку многоядерных сегментов длиной 50–100 мкм, септальные поры между которыми свободно пропускают растворенные вещества и даже органеллы и поддерживают электрическую связь вдоль гифы. Растет и развивается гифа путем поляризованного верхушечного роста (ВР) – векторного удлинения верхушек со скоростью 20–30 мкм/мин и периодического образования ветвей, которые также удлиняются на верхушках и ветвятся (Davis, 2000). В ходе ВР из более взрослых отделов гифы к точке удлинения на переднем конце поступают многочисленные везикулы, которые содержат необходимые для роста гифы материалы и с высокой скоростью сливаются с плазматической мембраной переднего конца. Благодаря достижениям современной экспериментальной биологии накоплен большой объем данных о структуре и динамике внутриклеточных систем, принимающих участие в ВР вегетативных гиф N. crassa, составлены карты-схемы многих метаболических путей, описано большое количество молекул-участников, в том числе белков-регуляторов. В одном из недавних обзоров на эту тему (Steinberg et al., 2017) цитируется 346 источников, в которых описаны молекулярно-генетические детали процессов на переднем конце гифы: экзоцитоза и эндоцитоза, септирования и организации потоков цитоплазмы, тонкости транспорта по сети аппарата Гольджи. Авторы сравнивают белки и структуры, принимающие участие в процессе ВР, с оркестром, исполняющим понятную музыку по непонятной партитуре при неизвестном дирижере, особо подчеркивая, что до сих пор не ясны механизмы участия ядер в процессе ВР.
Особенное внимание исследователей приковано к структурно-функциональной организации переднего конца растущей гифы N. сrassa:
1) Непосредственно на расстоянии 1–2 мкм от переднего конца располагается Spitzenkorper, или центр распределения везикул (который состоит из везикул, рибосом, актиновых волокон и аморфного материала неизвестной природы) (Davis, 2000).
2) Передний участок длиной ~20–30 мкм – это зона скопления нитевидных митохондрий (Potapova, 2012; Потапова и др., 2013; Potapova, Golyshev, 2016).
3) На переднем участке отсутствуют ядра (зона, свободная от ядер) (Davis, 2000; Freitag et al., 2004).
4) Первая септальная перегородка образуется на расстоянии, не ближе чем ~150 мкм от точки роста гифы (Delgado-Álvarez et al., 2014; Потапова и др., 2016), так что длина апикального сегмента всегда больше, чем средняя длина следующих гифальных сегментов.
5) Н+-ATФазы – основные генераторы МП у N. сrassa – отсутствуют в апикальном сегменте гифы и встраиваются в плазматическую мембрану только за первой септальной перегородкой (Riquelme et al., 2005; Fajardo-Somera et al., 2013).
6) Значение МП на переднем участке длиной 150–200 мкм существенно ниже, чем в дистальной части гифы (Slayman, Slayman, 1962; Potapova et al., 1988; Belozerskaya, Potapova, 1993; Потапова, Бойцова, 1997).
7) На переднем участке длиной 100–150 мкм принципиально меняется характер движения микротрубочек (Mouriño-Pérez et al., 2006; Sugden et al., 2007; Held et al., 2010; Riquelme et al., 2011).
Изменение характера движения микротрубочек – очень важная особенность апикального сегмента гифы. Вдоль всей гифы микротрубочки встречаются в виде коротких палочек (длиной 5–10 мкм), которые свободно переносятся током цитоплазмы, проникая через септальные поры. В апикальном сегменте на переднем участке длиной 100–150 мкм микротрубочки образуют длинные тяжи, которые ориентируются строго параллельно оси гифы и перемещаются не потоком цитоплазмы, а с помощью собственной векторной сборки–разборки, требующей значительного расхода энергии в виде АТФ (Mouriño-Pérez et al., 2006; Held et al., 2010; Riquelme et al., 2011). В этой связи понятно, зачем на передних концах растущих гиф собираются нитевидные митохондрии и почему эффективность их скопления зависит от скорости удлинения гифы (Потапова и др., 2013). Коллеги из Великобритании (Sugden et al., 2007) количественно охарактеризовали работу микротрубочек по транспорту везикул к переднему концу растущей гифы N. сrassa. В рамках их математической модели упорядоченный ансамбль из ≈10 микротрубочек способен доставлять в зону роста достаточное количество везикул с материалами, чтобы обеспечить удлинение гифы со скоростью 25–30 мкм/мин. Однако возникает вопрос: чем и как регулируется образование упорядоченного ансамбля микротрубочек и митохондрий на переднем конце растущей гифы?
Возможно, что существенную роль в этом процессе играет локальное электрическое поле на переднем конце гифы. Изолированные микротрубочки в экспериментах in situ ориентируются и меняют скорость движения под влиянием электрического поля напряженностью 2 × 103 В/м (Böhm et al., 2005; Dujovne et al., 2008). По нашим оценкам (см. выше) напряженность электрического поля (Е) вдоль переднего конца гифы составляет 100 В/м. Эта величина на порядок меньше, чем в экспериментах in situ. Но может быть, в условиях живой клетки зарегистрированное нами электрическое поле также может влиять на ориентацию, расположение и скорость движения согласованного ансамбля микротрубочек и митохондрий. Во всяком случае, факт отсутствия в апикальном сегменте гифы Н+-ATФаз – основных генераторов МП у N.сrassa (Riquelme et al., 2005; Fajardo-Somera et al., 2013) – и поддержание за счет этого локального постоянного электрического поля, безусловно, следует учитывать при анализе механизмов самоорганизации внутриклеточных структур в этой области.
ФУНКЦИОНАЛЬНАЯ СВЯЗЬ ЭЛЕКТРИЧЕСКИХ ПРОЦЕССОВ В ТРИХОМАХ НИТЧАТЫХ ЦИАНОБАКТЕРИЙ С ЭНЕРГЕТИКОЙ
Способность к энергетической кооперации между клетками с помощью межклеточной электрической связи, по-видимому, появилась на заре эволюции миллиарды лет назад как структурно-функциональная база для разделения труда в трихомах нитчатых цианобактерий – первых многоклеточных организмов нашей планеты (Потапова, Кокшарова, 2020). Трихомы цианобактерий – это нити из сотен клеток, связанных межклеточными взаимодействиями. В трихомах некоторых цианобактерий в отсутствие азота развивается специализация клеток для решения разных функциональных задач: 1) фотосинтеза с выделением кислорода и 2) фиксации азота, для которой кислород является ингибитором. Таким образом, трихом превращается в некий организм с обменом продуктами фотосинтеза и фиксации азота между вегетативными клетками и гетероцистами.
Реализовать такое разделение труда нитчатые цианобактерии смогли за счет приобретения в ходе эволюции способности не просто создавать встроенные в мембраны структурно-функциональные белковые комплексы, но и пространственно разделять их вплоть до размещения в разных клетках. Объединение функционально связанных белков в такие комплексы и их размещение на расстоянии друг от друга в однотипной мембране или в разнотипных мембранах одной и той же клетки, а также распределение по разным клеткам – явление динамичное и зависящее как от состояния самих клеток, так и от условий внешней среды. В связи с этим возникает много вопросов о механизмах регуляции этой динамики. Например, вопрос: как конкретные белки находят свое место в разных мембранах? Ответа пока нет.
Цианобактерии – очень популярный лабораторный объект. В настоящее время достаточно полно изучены детали морфологии, физиологии и генетики межклеточных взаимодействий в трихомах (Flores et al., 2019). Для модельной цианобактерии, образующей гетероцисты, Anabaena sp. strain PCC 7120, охарактеризованы обязательные компоненты септальных контактов: белки SepJ, FraC и FraD, а также еще ряд белков, важных для формирования нормального количества межклеточных нанопор и их функционирования, включая некоторые амилазы, белки, связывающие пептидогликан, и несколько мембранных транспортеров. Специалисты по цианобактериям отмечают функциональное сходство септальных контактов между клетками в трихомах цианобактерий с щелевыми контактами животных, описанными в литературе (см. обзор: Herve, Derangeon, 2013).
При анализе функциональных свойств трихомов с разделением труда между вегетативными клетками и гетероцистами серьезную проблему представляет описание потоков энергии (Magnuson, 2019). В решении этой проблемы может помочь обращение к принципам мембранной энергетики и представлениям о возможности энергетической кооперации между клетками с помощью электрической связи через ПК (Потапова, Кокшарова, 2020). Мембранные системы вегетативных клеток конвертируют солнечную энергию в биохимическую посредством оксигенного фотосинтеза, создавая значительные по величине МП, с помощью которых происходит синтез АТФ. Фотосинтетические системы имеют близкий ферментный состав у цианобактерий, водорослей и высших растений. Но у водорослей и высших растений фотосинтез происходит в специальных органеллах (тилакоидах), а у цианобактерий – в разных зонах одной и той же непрерывной мембранной системы, объединяющей тилакоидные мембраны и плазматическую мембрану клетки (Mullineaux, 2014).
В тилакоидных и плазматических мембранах гетероцист не происходит оксигенного фотосинтеза, создающего МП, необходимый для работы АТФ-синтаз, но при этом функционирует АТФ-синтаза (Telor, Stewart, 1976; Ernst et al., 1983), активность которой, очевидно, поддерживается благодаря распространению через ПК гиперполяризации плазматической мембраны, генерируемой вегетативными клетками (Chailakhyan et al., 1982; Потапова и др., 1986). Изучение деталей строения АТФ-синтазы цианобактерий приводит к заключению, что для производста 1 молекулы АТФ требуется перенести через мембрану 4–5 ионов H+ (Muller, Hess 2017; Pogorelov et al., 2012), что ниже по эффективности, чем у митохондриальных АТФ-синтаз млекопитающих, но близко к тилакоидам растений. Можно ориентировочно оценить величину мощности, передаваемой вдоль трихома через межклеточные каналы. В экспериментах с локальном освещениeм от 2-х до 10 клеток трихома, фиксированного в устье микропипетки (рис. 2), мы регистрировали скачок разности потенциалов ΔV величиной около 20 мВ при сопротивлении микропипетки R = 400 Мом (Потапова и др., 1986; Aslanidi, Shalapjenok, 1991). Исходя из этих данных, можно оценить внеклеточный ток I = ΔV/R = 50 пА. Поскольку электрический ток в 1 пА переносит 6 × × 106 электрических зарядов за 1 с, а для синтеза 1 молекулы АТФ необходим перенос 4–5 “горячих” протонов через молекулу внутримембранной АТФ-синтазы (Pogorelov et al., 2012; Muller, Hess, 2017), можно заключить, что освещенные клетки обеспечивают темновым клеткам трихома возможность производить около 6 × 107 АТФ/с. Оборот АТФ в бактериальной клетке составляет в среднем (1–7) × × 107 АТФ/с (Chapman, Atkinson, 1977). Таким образом, передача энергии вдоль трихома может быть сопоставима с суммарным клеточным энергопроизводством.
ПРОБЛЕМЫ И ПЕРСПЕКТИВЫ
Одна из центральных задач современной биологии – понять, как живая клетка создает, поддерживает и воспроизводит свою пространственную структуру, устанавливая взаимодействия с соседними клетками и с окружающей средой. Известный микробиолог и биоэнергетик Харольд (Harold, 2001, 2005) утверждает, что новый продукт работы генома всегда оказывается в клетке с уже существующей структурой и вынужден работать под влиянием уже существующего порядка. В этом плане при анализе проблемы самоорганизации в любой небольшой группе клеток важно принимать во внимание вероятность наличия локальных электрических полей, которые создаются неравномерным распределением между клетками генераторов МП, расходующих энергию внутренних или внешних ресурсов, и потребителей энергии, аккумулированной в форме МП (рис. 1).
Такого рода электрические явления описаны для эволюционно различных организмов и по праву могут быть отнесены к универсальным естественным технологиям биологических систем, согласно представлениям Уголева (Уголев, 1987). У нитчатых цианобактерий, благодаря межклеточной электрической связи, фотосинтезирующие вегетативные клетки могут оказывать энергетическую поддержку фиксирующим азот гетероцистам (Потапова, Кокшарова, 2020). Неслучайно в нитях цианобактерий гетероцисты располагаются через каждые 10–15 вегетативных клеток (Herrero et al., 2016). Это достаточно удобно, чтобы эффективно использовать электрические кабельные свойства трихома.
Мицелиальные грибы приобрели в ходе эволюции уникальное свойство: H+-АТФазы (основные генераторы МП) отсутствуют в плазматической мембране апикального сегмента (Riquelme et al., 2005; Fajardo-Somera et al., 2013). Удлинение гифы диаметром 10–15 мкм со скоростью 20–30 мкм/мин обеспечивается путем экзоцитоза на переднем конце везикул, содержащих ферменты и предшественники синтезов клеточной стенки, со скоростью ~40 000 везикул/с (Davis, 2000). Везикулы поступают к растущему концу из мицелия с расстояний до 1 см с потоком цитоплазмы, но в апикальном сегменте их движение перестает быть потоком, а становится пошаговым движением по микротрубочкам (Mouriño-Pérez et al., 2006; Held et al., 2010; Riquelme et al., 2011). В рамках математической модели (Sugden et al., 2007) обеспечить такое движение может ансамбль из 10 микротрубочек, ориентированных вдоль оси гифы. Работа микротрубочек требует значительных ресурсов АТФ, так же, как и процессы, обспечивающие последующее слияние везикул с плазматической мембраной. В связи с этим устранение из апикального сегмента такого мощного конкурентного потребителя АТФ, как H+-АТФазы, – это эффективное конструктивное решение, тем более что благодаря электрической связи апикального сегмента с остальной гифой отсутствие генераторов МП на переднем участке гифы длиной ~200 мкм создает здесь сильное локальное электрическое поле (см. выше), которое безусловно должно способствовать упорядочиванию расположения и взаимодействий внутриклеточных молекул и частиц. Осталось понять, как это конструктивное решение запрограммировано в геноме.
В последние годы бурно обсуждается возможная роль локальных электрических полей в регуляции работы генома на клеточном уровне (Blackiston et al., 2009; Levin, 2014, 2017; Pai et al., 2015, 2016; Pietak, Levin, 2017; Cervera et al., 2018, 2020; Cao Lin et al., 2018; Fields et al., 2018). С этих позиций было бы полезно проанализировать более детально события, происходящие в апикальном сегменте растущей вегетативной гифы N. crassa, где высокая скорость удлинения гифы обеспечивается согласованным взаимодействием внутриклеточных структур в сильном локальном электрическом поле.
Несмотря на огромные массивы экспериментальных данных на молекулярно-генетическом и клеточном уровне о событиях, происходящих в апикальном сегменте, остается практически не освещенной роль ядер в ВР N. crassa (Borkovich et al., 2004; Riquelme et al., 2011, 2018; Steinberg et al., 2017). Технически неразрешимой оказывается задача наблюдать за поведением каждого из 20–30 динамичных и асинхронно делящихся ядер диаметром 2–3 мкм внутри гифального цилиндра диаметром 10–20 мкм, непрерывно удлиняющегося со скоростью 20–30 мкм/мин. Один из подходов к решению этой задачи – наблюдение за динамикой и делением ядер в экспериментах на проростках спор N. сrassa – зачатках вегетативных гиф, имеющих в первые 10 ч развития меньший диаметр и меньшую скорость удлинения, чем взрослая гифа (Roca et al., 2010). Мы предлагаем (как удобный экспериментальный подход) использовать изолированные верхушки вегетативных гиф N. сrassa, которые после отделения от материнского мицелия продолжают удлинение в прежнем направлении, но с меньшей скоростью и меньшим диаметром, чем у связанных с мицелием гиф. При этом сохраняются структурно-функциональные особенности организации апикального сегмента (Потапова и др., 2016, 2018).
В наши дни полностью расшифрованы геномы десятков организмов, описаны в деталях многие процессы на молекулярно-генетическом уровне, но мы все еще далеки от понимания, как записанные в геноме программы роста и развития реализуются на материальных носителях во времени и в пространстве. При дальнейших исследованиях в этой области важно учитывать, что с позиций биоэнергетики (Mitchell, 1962, 1966; Skulachev 1988; Скулачев и др., 2010) в многоклеточных системах возможно разделение труда между соседними клетками по запасанию и использованию энергии, аккумулированной в форме МП, при условии передачи энергии с помощью межклеточной электрической связи через ПК (Асланиди и др., 1988; Potapova, 1991; Potapova, Aslanidi, 1995). Такого типа разделение труда между клетками сопровождается генерацией и поддержанием локальных электрических полей, которые могут оказывать влияние на клеточную активность на молекулярном и генетическом уровне (Blackiston et al., 2009; Levin, 2014; Cervera et al., 2020) и быть количественно охарактеризованы (с помощью электрофизиологических технологий) и проанализированы в рамках представлений кабельной теории (Hodgkin, Rushton, 1946; Беркинблит и др., 1981).
Список литературы
Асланиди К.Б., Потапова Т.В., Чайлахян Л.М. 1988. Транспорт энергии через высокопроницаемые контактные мембраны. Биол. мембраны Т. 5. № 6. С. 613. (Aslanidi K.B., Potapova T.V., Chailakhyan L.M. 1988. Transport of energy through the high permeable contact membranes. Biol. Membr. (Russ.). V. 5. № 6. P. 613.)
Асланиди К.Б., Бойцова Л.Ю., Виноградова Т.Н., Кублик Л.Н., Марахова И.И., Мох В.Н., Потапова Т.В., Трепакова Е.К., Чайлахян Л.М. 1991. Поддержание ионно-осмотич. гомеостаза в многоклеточных системах животных: роль проницаемых контактов. Биол. мембраны. Т. 8. № 8. С. 837. (Aslanidi K.B., Boitzova L.Ju., Vinogradova T.A., Kublik L.N., Mokh V.P., Marachova I.I., Potapova T.V., Trepakova E.S., Chailakhyan L.M. 1992. Maintenance of ion-osmotic homeostasis in multicellular animal systems: The role of permeable junctions. Biol. Membr. (Russ.). V. 5. № 8. P. 1244.)
Асланиди К.Б., Асланиди О.В., Вачадзе Д.М., Морнев О.М., Потапова Т.В., Чайлахян Л.М., Штеманетян Е.Г. 1997. Анализ электрических явлений, сопровождающих рост гифы N. сrassa. Теория и эксперимент. Биол. мембраны. Т. 14. № 3. С. 285. (Aslanidi K.B., Aslanidi O.V., Vachadze D.M., Mornev O.A., Potapova T.V., Chailakhyan L.M., Shtemanetian E.G. 1997. Analysis of electrical phenomena accompanying the growth of Neurospora crassa hyphae. Membr. Cell Biol. (Russ.). V. 14. № 3. P. 349.)
Беркинблит М.Б., Божкова В.П., Бойцова Л.Ю., Миттельман Л.А., Потапова Т.В., Чайлахян Л.М., Шаровская Ю.Ю. 1981. Высокопроницаемые контактные мембраны. М.: Наука. 466 с. (Berkinblit M.B., Bozkova V.P., Boitzova L.Ju., Mittelman K.A., Potapova T.V., Chailakhyan L.M., Sharovskaya Yu. Yu. 1981. Highly Permeable Juction Membranes. M.: Nauka. 466 pp.)
Веренинов А.А., Марахова И.И. 1986. Ионный транспорт у клеток в культуре. Л.: Наука. 292 с. (Vereninov A.A., Marakchova I.I. 1986. Cell Ion Transport in Culture. L.: Nauka. 292 p.)
Потапова Т.В., Асланиди К.Б., Шалапенок А.А., Карнаухов В.Н., Чайлахян Л.М. 1986. Фотоэлектрическая активность и спектральные характеристики одиночного трихома цианобактерии Phormidium uncinatum. Докл. АН СССР. Т. 290. № 6. С. 912. (Potapova T.V., Aslanidi K.B., Shalapjenok A.A., Karnauhov V.N., Chailakhyan L.M. 1986. Photoelectric activity and spectral characteristics of individual trihome of cyanobacterium Phormidium uncinatum. Dokl. Acad. Nauk USSR V. 290. № 6. P. 912.)
Потапова Т.В., Бойцова Л.Ю. 1997. Структура, функция, управление. - Возможности экспериментального анализа в группах невозбудимых клеток, связанных проницаемыми контактами. Биол. мембраны. Т. 14. № 6. С. 661. (Potapova T.V., Boitzova L.Ju. 1998. Structure, function, regulation: experimental analysis in groups of non-exitable cells coupled via permeable junctions. Membr. Cell Biol. (Russ.). V. 11. № 6. P. 817.)
Потапова Т.В., Бойцова Л.Ю., Голышев С.А., Попинако А.В. 2013. Организация митохондрий в растущей гифе Neurospora crassa. Цитология. Т. 55. № 11. С. 826. (Potapova T.V., Boitzova L.Ju., Golyshev S.A., Popinako A.V. 2014. The organization of mitochondria in growing hyphae of Neurospora crassa. Cell Tiss. Biol. V. 7. P. 166.)
Потапова Т.В., Бойцова Л.Ю., Голышев С.А., Дунина-Барковская А.Я. 2016. Верхушечный рост Neurospora crassa при дефиците ресурсов: нарушение согласованности удлинения, ветвления и септирования. Цитология. Т. 58. № 8. С. 634. (Potapova T.V., Boitsova L.Yu., Golyshev S.A., Dunina-Barkovskaya A.Ya. 2016. Tip growth of Neurospora crassa upon resource shortage: disturbances of the coordination of elongation, branching, and septation. Cell Tiss. Biol. V. 10. P. 486.)
Потапова Т.В., Белозерская Т.А., Голышев С.А., Дунина-Барковская А.Я. 2018. Рост и развитие изолированных верхушек гиф Neurospora crassa в среде с сорбитом. Цитология. Т. 60. № 1. С. 42. (Potapova T.V., Belozerskaya T.A., Golyshev S.A., Dunina-Barkovskaya A.Ya. 2018. Growth and development of isolated hyphal tips of Neurospora crassa in the sorbitol-containing medium. Cell Tiss. Biol. V. 12. P. 256.)
Потапова Т.В., Кокшарова О.А. 2020. Нитчатые цианобактерии как прототип многоклеточных организмов. Физиология растений. Т. 67. № 1. С. 20. (Potapova T.V., Koksharova O.A. 2020. Filamentous cyanobacteria as a prototype of multicellular organisms. Russ. J. Plant Physiol. V. 67. №. 1. P. 20. https://doi.org/10.1134/S102144372001015X
Скулачев В.П. 1977. Аденозинтрифосфат и трансмембранный потенциал ионов водорода – две конвертируемые и транспортабельные формы энергии в живой клетке. Успехи соврем. биол. Т. 84. № 1. С. 165. (Skulachev V.P. 1977. Adenosine triphosphate and the transmembrane hydrogen ion potential – 2 convertible and transportable forms of energy in the living cell. Usp. Sovrem. Biol. (Russ.) V. 84. № 1. P. 165.)
Скулачев В.П., Богачев А.В., Каспаринский Ф.О. 2010. Мебранная биоэнергетика: учебное пособие. М.: Изд-во Московского университета. 368 с. (Skulachev V.P., Bogachev A.V., Kasparinsky F.O. 2010. Membrane bioenergetics. M: University Press. 368 p.)
Смолянинов В.В., Потапова Т.В. 2003. Оценка критической длины фрагмента гифы Neurospora crassa. Биол. мембраны. Т. 20. № 4. С. 304. (Smolianinov V.V., Potapova T.V. 2003. Estimation of the critical length of growing Neurospora crassa hyphae. Biol. membr. (Russ.). V. 20. №. 4. P. 304.)
Уголев А.М. 1987. Естественные технологии биологических систем. Л.: Наука. (Ugolev A.M. 1987. Natural technologies of biological systems. L.: Nauka).
Чайлахян Л.М., Левина Н.Н., Белозерская Т.А., Потапова Т.В. 1984. Изучение межклеточных взаимодействий у мицелиального гриба N. crassa в связи с фотоэлектрическими изменениями в мембранах. Биол. мембраны. Т. 1. № 1. С. 44. (Chailakhyan L.M., Levina N.N., Belozerskaya T.A., Potapova T.V. 1984. Investigation of intercellular interactions in mycelial fungus Neurospora crassa in connection with the photoelectric changes in membranes. Biol. membr. (Russ.). V. 1. № 1. P. 44.)
Aslanidi K.B., Panfilov A.V. 1986. The Boyle–Conway model including the effect of an electrogenic pump for nonexitable cells. Mathem. Biosci. V. 79. P. 45.
Aslanidi K.B., Shalapjenok A.A. 1991. Energetics of local cell-to-cell interactions in phototrophic organisms. In: Intercellular communication: Proceedings in nonlinear science. Manchester Univ. Press. P. 12.
slanidi K.B., Boitzova L.Ju., Chailakhyan L.M., Kublik L.N., Marachova I.I., Potapova T.V., Vinogradova T.N. 1991. Energetic cooperation via ion-permeable junctions in mixed cell cultures. FEBS Letters V. 283. P. 295
Belozerskaya T.A., Potapova T.V. 1993. Intrahyphal communication in segmented mycelium. Exper. mycol. V. 17. P. 157.
Blackiston D.J., McLaughlin K.A., Levin M. 2009. Bioelectric controls of cell proliferation: ion channels, membrane voltage and the cell cycle. Cell Cycle. V. 821. P. 3527.
Blatt M., Slayman C.L. 1987. Role of “active” potassium transport in regulation of cytoplasmic pH by non-animal cells. Proc. Natl. Acad. Sci. USA. V. 84. P. 2737.
Böhm K.J., Nikolaos E. Mavromatos N.E., Michette A., Stracke R., Unger E. 2005. Movement and alignment of microtubules in electric fields and electric-dipole-moment estimates. Electromag. Biol. Med. V. 24. P. 319.
Borkovich K.A., Alex L.A., Yarden O., Freitag M., Turner G.E., Read N.D., Seiler S., Bell-Pedersen D., Paietta J., Plesofsky N., Plamann M., Goodrich-Tanrikula M., Schulte U., Mannhaupt G., Nargang et al. 2004. Lessons from the genome sequence of Neurospora crassa: Tracing the path from genomic blueprint to multicellular organism. Microbiol. Mol. Biol. Rev. V. 68. P. 1.
Bukauskas F.F. 1982. Electrophysiology of the normal-to-hypoxic transition zone. Circ. Res. V. 51. P. 321.
Cao Lin, Liu Jie, Collinson J.M. Forrester J.V., McCaig C.D. 2018. Endogenous bioelectric currents promote differentiation of the mammalian lens. J. Cell Physiol. V. 233. P. 2202.
Cervera J., Manzanares J.A., Mafe S. 2018. Cell-cell bioelectrical interactions and local hetergeneities in genetic networks: a model for stabilization of sungle-cell states and multicellular oscillations. Phys. Chem. Chem. Phys. V. 20. P. 9343. https://doi.org/10.1039/C8CP00648B
Cervera J., Levin M., Mafe S. 2020. Bioelectric coupling of single-cell states in multicellular systems. J. Phys. Chem. Lett. V. 11. P. 3234. https://doi.org/10.1021/acs.jpclett.0c00641
Chailakhyan L.M., Glagolev A.N., Glagoleva T.N., Murvanidze G.M., Potapova T.V., Skulachev V.P. 1982. Intercellular power transmission along trichomes of cyanobacteria. Biochim. Biophys. Acta. V. 679. P. 60.
Chapman A.G., Atkinson D.E. 1977. Adenine nucleotide concentrations and turnover rates. Their correlation with biological activity in bacteria and yeast. Adv. Microb. Physiol. V. 15. P. 253.
Crane R.K. 1977. The gradient hypothesis and other models of carier-mediated active transport. Rev. Physiol. Pharmacol. V. 78. P. 99.
Davis R.H. 2000. Neurospora: Contributions of a model organism. Oxford Univ. Press.
Delgado-Álvarez D.L., Bartnicki-García S., Seiler S., Mouriño-Pérez R.R. 2014. Septum development in Neurospora crassa: The septal actomyosin tangle. PLOS One. V. 9. P. e96744. https://doi.org/10.1371/journal.pone.0096744
De Loof A. 1985. The cell as a miniature electrophoresis chamber. Comp. Biochem. Physiol. V. 80A. P. 453.
Dujovne I., van den Heuvel M., Shen Y., de Graaff M., Dekker C. 2008. Velocity modulation of microtubules in electric fields. Nano Lett. V. 8. P. 4217.
Ernst A., Bohme H., Boger P. 1983. Phosphorylation and nitrogenase activity in isolated heterocysts of Anabaena variabilis (ATCC-29413). Biochim. Biophys. Acta. V. 723. P. 83.
Fajardo-Somera R.A., Bowman B., Riquelme M. 2013. The plasma membrane proton pump PMA-1 is incorporated into distal parts of the hyphae independentely of the Spitzenkorper in Neurospora crassa. Eukaryotic Cell. V. 12. P. 1097.
Fields C., Levin M. 2017. Multiscale memory and bioelectric error correction in the cytoplasm-cytoskeleton-membrane system. WIREs Syst. Biol. Med., e1410. https://doi.org/10.1002/wsbm.1410
Flores E., Nieves-Morion M., Mullineaux C.W. 2019. Cyanobacterial septal junctions: properties and regulation. Life. V. 9. P. 1. https://doi.org/10.3390/life9010001
Freitag M., Hickey P.C., Raju N.B., Selker E.U., Read N.D. 2004. GFP as a tool to analyze the organization, dynamics and function of nuclei and microtubules in Neurospora crassa. Fungal Genet. Biol. V. 41. P. 897.
Gradman D, Hansen U-P, Long W.S., Slayman C.L., Warncke J. 1978. Current-voltage relationships for the plasma membrane and its principal electrogenic pump in Neurospora crassa. J. Membr. Biol. V. 39. P. 333.
Graf J., Handerson R.M., Krampholz B., Boyer J.L. 1987. Cell membranes and transepithelial voltages and resistances in isolated rat hepatocyte couplets. J. Membr. Biol. V. 95. P. 241.
Harold F.M. 1986. The vital force: A study of bioenergetics. N.-Y.: WH Freeman.
Harold F.M. 2001. The way of the cell: Molecules, organisms and the order of life. Oxford Univ. Press. 305 p.
Harold F. M. 2005. Molecules into cells: Specifying spatial architecture. Microbiol. Mol. Biol. Rev. V. 69. P. 544. https://doi.org/10.1128/MMBR.694.544-564
Held M., Edwards C., Nicolau D.V. 2010. Temporal and spatial in vivo optical analysis of microtubules in Neurospora crassa. In: Imaging, manipulation, and analysis of biomolecules, cells, and tissues. VIII. Proc. SPIE. 75680V.
Herrero A., Stavans J., Flores E. 2016. The multicellular nature of filamentous heterocyst-forming cyanobacteria. FEMS Microbiol. Rev. V. 40. P. 831. https://doi.org/10.1093/femsre/fuw029
Herve J.C., Derangeon M. 2013. Gap-junction-mediated cell-to-cell communication. Cell Tiss. Res. V. 352. P. 21.
Hodgkin A.L., Rushton W.A.H. 1946. The electrical constants of a crustacean nerve fibre. Proc. Roy. Soc. Lond. B. V. 133. P. 444.
Jaffe L. F., Nuccitelli R. 1974. An ultrasensitive vibrating probe for measuring steady extracellular currents. J. Cell Biol. V. 63. P. 614.
Kanno Y., Loewenstein W. R. 1964. Low-resistance coupling between gland cells. Some observation on intercellular contact membranes and intercellular space. Nature. V. 201. P. 194.
Levin M. 2014. Endogenous bioelectrical networks store non-genetic patterning information during development and regeneration. J. Physiol. V. 592. P. 2295. https://doi.org/10.1113/jphysiol.2014.271940
Loewenstein W.R. 1984. Cell individuality and connectivity, an evolutionary compromise. In: Individuality and determinism. (S.W. Fox ed.). N.Y.: Plenum Publ. Corp. P. 77.
Magnuson A. 2019. Heterocyst thylakoid bioenergetics. Life. V. 9. P. 13. https://doi.org/10.3390/life9010013
McLaughlin K.A., Levin M. 2018. Bioelectric signaling in regeneration: Mechanisms of ionic controls of growth and form. Dev Biol. V. 433. P. 177. https://doi.org/. Epub 2017 Dec 25https://doi.org/10.1016/j.ydbio.2017.08.032
Mitchell P. 1962. Metabolism, transport and morphogenesis: which drives which? J. Gen. Microbiol. V. 29. P. 25.
Mitchell P. 1966. Chemiosmotic coupling in oxidative and photosynthetic phosphorylation. Biol. Rev. Cambridge Philosoph. Soc. V. 41. P. 445.
Mourino-Perez R.R., Robertson R.W., Bartnicki-Garcia S. 2006. Microtubule dynamics and organization during hyphal growth and branching in Neurospora crassa. Fungal Gen. Biol. V. 43. P. 389.
Muller V., Hess V. 2017. The minimum biological energy quantum. Front. Microbiol. V. 8. P. 7.
Mullineaux C.W. 2014. Co-existence of photosythetic and respiratory activities in cyanobacterial thylakoid membranes. Biochim. Biophys. Acta. V. 1837. P. 503.
Pai V.P., Lemire J.M., Pare J.-F., Lin G., Chen Y., Levin M. 2015. Endogeneous gradients of resting potential instructively pattern embryonic neural tissue via Notch signaling and regulation of proliferation. J. Neurosci. V. 35. P. 4366.
Pai V.P., Martyniuk C.J., Echeverri K., Sundelacruz S., Kaplan D.L., Levin M. 2016. Genome-wide analysis reveals conserved transcriptional responses downstream of resting potential change in Xenopus embryos, axolotl regeneration, and human mesenchimal cell differentiation. (Open Access). https://doi.org/10.1002/reg2.48
Perlin D.S., Kasamo K., Brooker R.J., Slayman C.W. 1984. Electrogenic H+ translocation by the plasma membrane ATPase of Neurospora. J. Biol. Chem. V. 259. P. 7884.
Perlin D.S., San Francisco M.O.D., Slayman C.W., Rosen B.P. 1986. Proton-ATP stoichiometry of proton pumps from Neurospora crassa and Escherichia coli. Arch. Biochem. Biophys. V. 248. P. 53.
Pietak A., Levin M. 2017. Bioelectric gene and reaction networks: computational modelling of genetic, biochemical and bioelectrical dynamics in pattern regulation. J. R. Soc. Interface. V. 14. P. 20170425. https://doi.org/10.1098/rsif.2017.0425
Pogorelov D., Klyszejko A.L., Krasnoselska G.O., Heller E.M., Leone V., Langerd J.D., Vonck J., Muller D.J., Faraldo-Gomez J.D., Meier T. 2012. Engeneering rotor ring stoichiometries in the ATP synthase. Proc. Natl. Acad. USA. V. 109. P. E1599.
Potapova T.V. 1991. Energetic functions of permeable intercellular junctions. In: Intercellular communication. Manchester Univ Press. P. 143.
Potapova T.V. 2012. Cell-to-cell communication in the tip growth of mycelial fungi. In: Biocommunication in Fungi. Berlin, Heidelberg: Springer-Verlag. P. 103.
Potapova T.V., Aslanidi K.B. 1995. Energy coupling of adjacent cells as an universal function of cell-to-cell permeable junctions. Progress Cell Res. V. 4. P. 53.
Potapova T.V., Aslanidi K.B., Belozerskaya T.A., Levina N.N. 1988. Transcellular ionic currents studied by intracellular potential recordings in Neurospora crassa hyphae. (Transfer of energy from proximal to apical cells). FEBS Lett. V. 241. P. 173.
Potapova T.V., Golyshev S.A. 2016. Revisiting a special structural order of a growing tip of the Neurospora crassa hypha. Fungal Genom Biol. V. 6. P. 135. https://doi.org/10.4172/2165-8056.1000135
Riquelme M., Freitag M., Leon-Hing E.S., Bowman B. 2005. Live imaging of the secretory pathway in hyphae of Neurospora crassa. Fungal Genetics Conference. (2005) “XXIII Fungal Genetics Conference”. Fungal Genetics Reports. V. 52, Article 11. P. 52. https://doi.org/10.4148/1941-4765.1130
Riquelme M., Yarden O., Bartnicki-Garcia S., Bowman B., Castro–Longoria E., Free S.J., Fleibner A., Freitag M., Lew R., Mourino–Perez R., Plamann M., Rasmussen C., Richthammer C., Roberson R.W., Sanchez–Leon E., et al. 2011. Architecture and development of the Neurospora crassa hypha – a model cell for polarized growth. Fungal Biol. V. 115. P. 446. https://doi.org/10.1016/j.funbio.2011.02.008
Riquelme M., Aguirre J., Bartnicki-Garcia S., Braus G.H., Feldbrugge M., Fleig U., Hansberg W., Herrera-Estrella A., Kamper J., Kuck U., Mourino-Perez R.R., Takeshita N., Fisher R. 2018. Fungal morphogenesis, from the polarized growth of hyphae to complex reproduction and infection structures. Microbiol. Mol. Biol. Rev. V. 82. e00068. https://doi.org/10.1128/MMBR00068-17
Roca M.G., Kuo H-Ch., Lichius A., Freitag M., Read N.D. 2010. Nuclear denamics, mitosis and the cytoskeleton during the early stages of colony initiation in Neurospora crassa. Eukar. Cell V. 9. P. 1171. https://doi.org/10.1128/EC.00329-09
Rodriguez-Navarro A., Blatt M.R., Slayman C.L. 1986. A potassium-proton symport in Neurospora crassa. J. Gen. Physiol. V. 87. P. 649.
Sanders D., Slayman C.L., Pall M.L. 1983. Stoichiometry of H+/amino acid cotransport in Neurospora crassa revealed by current-voltage analysis. Biochim. Biophys. Acta. V. 735. P. 67.
Skulachev V.P. 1988. Membrane Bioenergetics. Berlin: Springer-Verlag. 442 pp.
Slayman C.L. 1965. Electrical properties of Neurospora crassa: effects of external cations on the intracellular potential. J. Gen. Physiol. V. 49. P. 69.
Slayman C.L. 1977. Energetics and control of transport in Neurospora. In: Water relations in membrane transport in plants and animals. N.Y.: Acad. Press. P. 69.
Slayman C.L. 1987. The plasma membrane ATPase of Neurospora: A proton-pumping electroenzyme. J. Bioenerget. Biomemb. V. 19. P. 1.
Slayman C.L., Slayman C.W. 1962. Measurements of membrane potential in Neurospora. Science. V. 136. P. 876.
Slayman C.L., Slayman C.W. 1974. Depolarization of the plasma membrane of Neurospora during active transport of glucose: Evidence for a proton-dependent cotransport system. Proc. Nat. Acad. Sci. USA. V. 71. P. 1935.
Slayman C.L., Long W.S., Lu C.Y.-H. 1973. The relation between ATP and an electrogenic pump in the plasma membrane of Neurospora crassa. J. Membr. Biol. V. 14. P. 305.
Slayman C.L., Bertl A., Blatt M.R. 1994. Partial reaction chemistry and charge displacement by the fungal plasma-membrane H+-ATPase. In: NATO ASI Series. V. H 89. Molecular and cellular mechanisms of H+-transport. Berlin Heidelberg: Springer-Verlag. P. 237.
Steinberg G., Penalva M.A., Riquelme M., Wosten H.A., Harris S.D. 2017. Cell biology of hyphal growth. Microbiol. Spectrum. V. 5, FUNK-0034-2016. https://doi.org/10.1128//microbiospec.FUNK-0034-2016
Sugden K.E.P., Evans M.R., Poon W.C.K., Read N.D. 2007. Model of hyphal tip growth involving microtubule-based transport. Phys. Rev. E Stat. Nonlin Soft Matter Phys. V. 75. P. 031909-1. https://doi.org/10.1103/PhysRevE.75.031909
Takeuchi Y., Schmid J., Caldwell J.H., Harold F.M. 1988. Transcellular ion currents and extension of Neurospora crassa hyphae. J. Membr. Biol. V. 101. P. 33.
Telor E., Stewart W.D.P. 1976. Photosynthetic electron transport, ATP synthesis and nitrogenase activity in isolated heterocysts of Anabaena cylindrica. Biochim. Biophys. Acta V. 423. P. 189.
Дополнительные материалы отсутствуют.


