Цитология, 2021, T. 63, № 1, стр. 88-93
Взаимодействие мономеров в ближне-инфракрасных флуоресцентных биомаркерах
О. В. Степаненко 1, *, О. В. Степаненко 1
1 Институт цитологии РАН
194064 Санкт-Петербург, Россия
* E-mail: sov@incras.ru
Поступила в редакцию 16.09.2020
После доработки 02.10.2020
Принята к публикации 03.10.2020
Аннотация
В настоящей работе мы проанализировали, как изменяется взаимодействие между мономерами в ближне-инфракрасных флуоресцентных биомаркерах iRFP713 и iRFP713/C15S/V256C при изменении сети водородных связей между хромофором и его белковым окружением в результате аминокислотной замены треонина в положении 204 на аланин (T204A) в микроокружении хромофора или при замене природного лиганда биливердина на фикоцианобилин. Обнаруженное ранее аллостерическое ингибирование ковалентного присоединения биливердина к мономеру iRFP713/C15S/V256C после ковалентного присоединения хромофора к другому мономеру белка существенно уменьшается при введении замены T204A. Аллостерического ингибирования ковалентного связывания фикоцианобилина с iRFP713/C15S/V256C не происходит, в отличие от связывания биливердина с этим белком. Напротив, замена биливердина на фикоцианобилин в iRFP713 приводит к усилению аллостерического ингибирования ковалентного связывания хромофора. Наши исследования свидетельствуют, что изменение внутримолекулярных связей между хромофором и остатками его микроокружения в биомаркерах, происходящее при замене хромофора или в результате аминокислотных замен, оказывает влияние на взаимодействие мономеров в биомаркере.
Предметом настоящего исследования являются димерные ближне-инфракрасные (NIR) биомаркеры, разработанные на основе бактериальных фитохромов – фотосенсорных белков, которые участвуют в свето-зависимой регуляции биологических процессов в клетках бактерий. NIR-биомаркеры состоят из двух доменов PAS (Per-ARNT-Sim) и GAF (cGMP PDE/AC/FhlA), которые вместе образуют так называемый хромофор-связывающий домен полноразмерных фитохромов. В состав N-концевого участка домена PAS входит цистеиновый остаток, который необходим для ковалентной фиксации хромофора, а в домене GAF находится карман для встраивания тетрапиррольного хромофора (Rodriguez et al., 2017). Комплексы NIR-биомаркеров с их лигандом биливердином (BV) нашли широкое применение в качестве генетически-кодируемых меток для прижизненной визуализации молекулярных процессов с высоким разрешением в реальном масштабе времени, происходящих в отдельных клетках и в целом организме (Rodriguez et al., 2017).
В фитохромах при фотоконверсии происходит передача структурных изменений от тетрапиррольного хромофора к хромофор-связывающему домену и далее последовательно к остальным доменам белка (Takala et al., 2014; Burgie et al., 20164; von Horsten et al., 2016). Кроме того, домены фоторецепторов, аминокислоты которых не контактируют с тетрапирролом в хромофор-связывающем домене напрямую, также влияют на процесс изомеризации хромофора (Burgie et al., 2017). Считается, что подобная связь между доменами фоторецепторов расширяет возможности регуляции процессов фотоактивации и темновой релаксации этих белков (Gourinchas et al., 2018).
Наши исследования также выявили влияние мономеров в NIR-биомаркерах на структуру друг друга, которое определяет характер связывания хромофора с отдельными мономерами белка (Stepanenko et al., 2016, 2017). Этот эффект заключается в том, что ковалентное связывание BV с остатком Cys в одном из мономеров биомаркера аллостерически ингибирует формирование ковалентной связи между встроенным в карман белка хромофором и остатком Cys второго мономера биомаркера. Характер связывания хромофора в NIR-биомаркеров оказывает существенное влияние их фотофизические свойства, в частности квантовый выход и стабильность, существенные для их использования в качестве генетически-кодируемых меток в клетке. Это определяет актуальность дальнейшего исследования межмономерных аллостерических эффектов в NIR-биомаркерах.
В настоящей работе мы анализировали, какое влияние оказывает изменение внутримолекулярных связей между хромофором и его белковым окружением в NIR-биомаркере на взаимодействие между мономерами. Для этого мы проанализировали, как изменяются спектры поглощения флуоресценции биомаркеров iRFP713 и iRFP713/C15S/V256C, имеющих цистеиновые остатки, способные к ковалентному присоединению BV, в разных доменах белка в нативном состоянии и под действием денатуранта при введении аминокислотной замены в положение 204 (замена треонина на аланин) и при изменении вида тетрапиррола.
МАТЕРИАЛ И МЕТОДИКА
Материалы. Гидрохлорид гуанидина (GdnHCl) и трис(гидроксиметил)аминометан (Tris) производства Sigma (США), а также фикоцианобилин (PCB, Frontier Scientific, США) использованы без дополнительной очистки. Концентрацию GdnHCl определяли с помощью рефрактометра Аббе (ЛОМО, Россия). Для определения концентрации PCB использовали коэффициент молярной экстинкции ${{\varepsilon }_{{662}}}$ = = 35.500 M−1 см−1 в денатурирующих условиях при высокой кислотности раствора (8 M, pH 2.0) (Glazer, Fang, 1973).
Выделение и очистка белков. Гены целевых биомаркеров, а именно белков iRFP713 и iRFP713/C15S/V256C и их мутантных форм, несущих аминокислотную замену треонина в положении 204 на аланин iR-FP713/T204A и iRFP713/C15S/V256C/T204A, с полигистидиновой меткой на N-конце клонированы в вектор pBAD/His-B (Invitrogen, США) по сайтам BglII и EcoRI, которым трансформировали штамм бактерий E. сoli LMG 194. Биомаркеры получены и очищены, как описано ранее (Stepanenko et al., 2016, 2019). Кратко, биомаркеры в апо- (т.е. в отсутствие хромофора) и холоформе (т.е. в комплексе с биливердином) получены при экпрессии только гена целевого белка и совместно с геном гемоксигеназы (НО) с вектора pWA23h-HO соответственно. Фермент HO обеспечивает синтез BV. Для экспрессии биомаркеров в апоформах использовали среду RM (48 мМ Na2HPO4, 22 мМ KH2PO4, 19 мМ NH4Cl, 8.5 мМ N-aCl, 2% казаминовых кислот, 1 мМ MgCl2, 1 мМ тиамин), содерждащую ампицилин. В состав культуральной среды для экспрессии биомаркеров в холоформе входили ампицилин и канамицин. Для индукции экспрессии биомаркера и НО использовали арабинозу и рамнозу соответственно. Клеточный лизат очищали с помощью афинной хроматографии на колонках His-GraviTrap (GE Healthcare, Швеция) и ион-обменной хроматографии на колонке MonoQ (GE HealthCare, Швеция). Чистоту полученных биомаркеров контролировали электрофоретически. Оптическая плотность в растворах белка не превышала 0.1, измерения выполнены в растворе 20 мM Tris/HCl, pH 8.0, содержащем 1 мM гидрохлорида трис(2-карбоксиэтил)фосфина (TCEP).
Спектрофотометрические измерения. Спектры поглощения биомаркеров измерены с использованием спектрофотометра U-3900H (Hitachi, Япония) и кварцевых кювет (101.016-QS, Hellma, Германия) с длиной оптического пути 5 мм.
Флуоресцентные измерения. Для измерений использовали спектрофлуориметр Cary Eclipse (Agilent, США) и кюветы 10 × 10 × 4 мм (Starna, США). Интенсивность флуоресценции BV и PCB корректировали на эффект вторичного внутреннего фильтра (Fonin et al., 2014).
Разворачивание белка. Разворачивание белка инициировали ручным смешением нативного белка с буферным раствором, содержащим необходимую концентрацию денатуранта. Равновесные значения оптической плотности и эллиптичности при 222 нм белков измеряли после инкубации белка в присутствии GdnHCl при 23°С в течение 24 ч. Значения доли нативных молекул белка получены в результате аппроксимации зависимостей эллиптичности при 222 нм белков от концентрации GdnHCl, выполненной в программе Sigma Plot (Systat Software Inc., USA) согласно уравнению:
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
План эксперимента. Известно, что в полноразмерных фитохромах и в NIR-биомаркерах на их основе контакты остатка в положении 204 с хромофором и другими аминокислотами играют ключевую роль в индуцированных светом процессах в этих белках (Toh et al., 2011; Auldridge et al., 2012; Bhattacharya et al. 2014; Velazquez Escobar et al.. 2014; Buhrke et al., 2016). Кроме того, наши предыдущие результаты свидетельствуют о том, что аминокислотная замена треонина в положении 204 на аланин (T204A) в биомаркере iRFP713 (Filonov et al., 2011) затрагивает внутрибелковые водородные связи вокруг хромофора (Stepanenko et al., 2020). Мы также показали, что замена BV на фикоцианобилин (PCB), который является кофактором фоторецепторов цианобактерий и представляет собой восстановленную форму BV (Frankenberg, 2003; Rockwell et al., 2017), в NIR-биомаркерах приводит к реорганизации сети внутримолекулярных водородных связей в хромофор-связывающем кармане этих белков (Stepanenko et al., 2019).
В настоящей работе мы проанализировали, как влияет замена аминокислоты треонина в положении 204 на аланин (T204A) и изменение вида тетрапиррола в iRFP713 на характер связывания хромофора в отдельных мономерах белка. Такой же анализ был выполнен для биомаркера iRFP713/C15S/V256C, в котором сайт ковалентного присоединения хромофора изменен с Cys15 в N-концевом участке PAS-доменов на Cys256 в GAF-доменах белка. Мы использовали предложенный нами ранее подход, который основан на совместном анализе формы спектра поглощения в видимой области спектра и структуры биомаркера при его разворачивании (Stepanenko et al., 2016). Подобный анализ ранее помог нам обнаружить, что некоторые NIR-биомаркеры содержат спектрально идентичные виды хромофора, которые по-разному связаны с белком (Stepanenko et al., 2016).
Характер связывания хромофора в NIR-биомаркерах, содержащих аминокислотную замену T204A. Длинноволновое положение спектров поглощения и флуоресценции биомаркера iRFP713/T204A свидетельствует о том, что в этом белке так же, как и в iRFP713, BV ковалентно связан с Cys15 (рис. 1а). Однако очень похожие спектральные свойства имеет BV, который встроен в карман GAF-домена, но не связан с белком ковалентно (Stepanenko et al., 2016). Поэтому мы провели анализ изменения формы спектра поглощения iRFP713/T204A и доли белка в нативном состоянии при его денатурации под действием GdnHCl. Обе зависимости имеют простую сигмоидальную форму, что указывает на то, что этот белок имеет в своем составе только одну форму хромофора – BV, ковалентно связанную с Cys15 (рис. 1б, в).
Рис. 1.
Спектральные свойства биомаркеров: iRFP713/T204A (верхний ряд), iRFP713/C15S/V256C/T204A в комплексе с BV (средний ряд) и iRFP713/PCB (нижний ряд). а – Спектры поглощения (точечные линии) и флуоресценции (сплошные линии) хромофора белка в отсутствие денатуранта (λвозб = 600–620 нм). б – Изменение спектров поглощения хромофора биомаркера в присутствии денатуранта; измерение проводили после инкубации белка в растворе GdnHCl различной концентрации (указана цветом кривых) в течение 24 ч. в – Изменение оптической плотности хромофора и структуры биомаркера при его разворачивании под действием GdnHCl; показаны зависимости оптической плотности раствора белка, измеренной в максимуме и на длинноволновом краю спектра поглощения хромофора, и зависимости доли белка в нативном состоянии (${{\alpha }_{N}},$ символы серого цвета) от концентрации денатуранта. За единицу принято значение оптической плотности (OD) при соответствующей длине волны нативного белка.
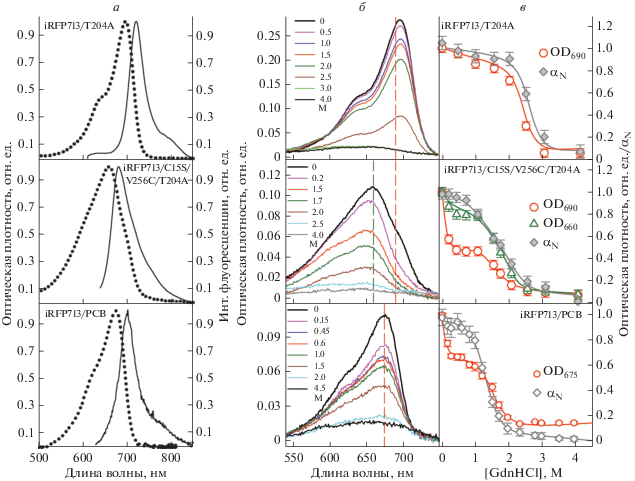
Коротковолновое положение спектров поглощения и флуоресценции iRFP713/C15S/V256C/T204A позволяет нам утверждать, что в состав этого белка входит преимущественно BV, образующий х-имическую связь с Cys256 (рис. 1а). Молекулы iR-FP713/C15S/V256C/T204A содержат еще один вид хромофора: BV, встроенный в белковую глобулу, но не зафиксированный химическими связями с цистеиновыми остатками белка. Об этом свидетельствуют длинноволновое плечо в спектрах поглощения (флуоресценции) iRFP713/C15S/V256C/T204A, сложный характер зависимостей оптической плотности белка от концентрации денатуранта и несовпадение зависимостей оптической плотности, измеренной в максимуме и на длинноволновом краю спектра поглощения белка (рис. 1б, в). Следует отметить, что длинноволновое плечо в спектре поглощения iR-FP713/C15S/V256C более выражено по сравнению с длинноволновым плечом в спектре поглощения iR-FP713/C15S/V256C/T204A (Stepanenko et al., 2016). Это означает, что доля BV, встроенного в белковую глобулу, но не присоединенного ковалентно к цистеиновым остаткам, в iRFP713/C15S/ V256C/T204A меньше, чем в iRFP713/C15S/V256C (рис. 1а). Полученные результаты свидетельствуют о том, что введение замены T204A в iRFP713/ C15S/V256C приводит к уменьшению межмономерного аллостерического ингибирования ковалентного присоединения BV к Cys256 в этом белке.
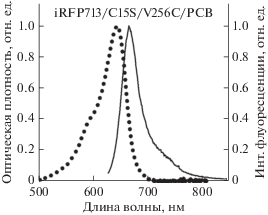
Характер связывания PCB в NIR-биомаркерах. Спектр поглощения в инфракрасной области спектра iRFP713/C15S/V256C/PCB (рис. 2) аналогичен спектрам поглощения фитохромов цианобактерий и растительных фитохромов, кофактором которых служит PCB (Hahn et al., 2006; Burgie et al., 2017). Это свидетельствует о том, что PCB при включении в карман GAF домена белка iRFP713/ C15S/V256C образует химическую связь с Cys256 и теряет одну двойную связь, что приводит к коротковолновому сдвигу его спектра поглощения по сравнению со свободным тетрапирролом. В спектре поглощения (флуоресценции) iRFP713/C15S/V256C/PCB отсутствуют длинноволновые плечи, т.е. этот биомаркер не содержит в своем составе хромофора, который не присоединен ковалентно к белку. Это говорит о том, что в данном случае не наблюдается аллостерического ингибирования ковалентного связывания PCB в мономерах iRFP713/C15S/V256C, которое характерно для комплексов этого белка с BV (Stepanenko et al., 2016).
Рис. 2.
Спектры поглощения и флуоресценции PCB в биомаркере iRFP713/C15S/V256C. Длина волны возбуждения – 620 нм.
При ковалентом присоединении PCB к Cys15 в iRFP713 образуется хромофор с необычно длинноволновыми спектрами поглощения и флуоресценции (рис. 1а), которые практически совпадают со спектрами поглощения и флуоресценции PCB в белке, не содержащем остатков цистеина, подходящих для ковалентного связывания тетрапиррола (Stepanenko et al,. 2019). Это означает, что на основании характера спектра поглощения iRFP713/PCB мы не можем сказать, входит ли в состав белка хромофор, не присоединенный к нему ковалентно.
Было изучено, как изменяется характер спектров поглощения при разворачивании iRFP713/PCB (рис. 1б, в). Зависимость оптической плотности в максимуме спектра поглощения iRFP713/PCB от концентрации GdnHCl имеет сложный характер. Наблюдается уменьшение оптической плотности iRFP713/PCB в области малых концентраций денатуранта, при которых белок сохраняет свою нативную структуру. Это говорит о высвобождении от iR-FP713/PCB хромофора, который не связан прочно с белком, т.е. не связан с ним ковалентно. Уменьшение оптической плотности iRFP713/PCB в области концентраций денатуранта от 1 до 2 М сопровождается разрушением структуры белка. Это свидетельствует о том, что в этих условиях происходит разрушение комплекса между iRFP713 и PCB, который ковалентно связан с Cys15. Эти данные указывают на наличие двух видов хромофора в составе iR-FP713/PCB. Таким образом, замена хромофора с BV на PCB в iRFP713 приводит к усилению аллостерического ингибирования связывания хромофора.
ЗАКЛЮЧЕНИЕ
Результаты настоящей работы указывают на то, что изменение внутримолекулярных связей между хромофором и остатками его микроокружения в биомаркерах, происходящее при замене хромофора или в результате аминокислотных замен, могут приводить к усилению или ослаблению аллостерического ингибирования ковалентного связывания хромофора с белком. В результате взаимного влияния мономеров в NIR-биомаркере могут образовываться димеры, содержащие в одном мономере белка хромофор, который ковалентно присоединен к остатку цистеина, и во втором мономере белка хромофор, который только встроен в хромофор-связывающий карман. Ранее было обнаружено образование ассиметричных комплексов полноразмерных фитохромов, в которых отдельные мономеры белка имеют различную структуру и отличаются конформацией лиганда (Tarutina et al., 2006; Yang et al., 2007; Essen et al., 2008; Rottwinkel et al., 2010; Burgie et al., 2017; Buhrke et al., 2018; Gourinchas et al., 2018; Gourinchas et al., 2019). Взаимное влияние мономеров в полноразмерных фитохромах может являться частью многоуровневой регуляции их активности.
Список литературы
Auldridge M.E., Satyshur K.A., Anstrom D.M., Forest K.T. 2012. Structure-guided engineering enhances a phytochrome-based infrared fluorescent protein. J. Biol. Chem. V. 287. P. 7000.
Bhattacharya S., Auldridge M. E., Lehtivuori H., Ihalainen J. A., Forest K. T. 2014. Origins of fluorescence in evolved bacteriophytochromes. J. Biol. Chem. V. 289. P. 32144.
Buhrke D., Kuhlmann U., Michael N., Hildebrandt P. 2018. The photoconversion of phytochrome includes an unproductive shunt reaction pathway. Chemphyschem. V. 19. P. 566.
Buhrke D., Velazquez Escobar F., Sauthof L., Wilkening S., Herder N., Tavraz N.N., Willoweit M., Keidel A., Utesch T., Mroginski M.A., Schmitt F.J., Hildebrandt P., Friedrich T. 2016. The role of local and remote amino acid substitutions for optimizing fluorescence in bacteriophytochromes: A case study on iRFP. Sci Rep. V. 6. P. 28444.
Burgie E.S., Bussell A.N., Lye S.H., Wang T., Hu W., McLoughlin K.E., Weber E.L., Li H., Vierstra R.D. 2017. Photosensing and thermosensing by phytochrome b require both proximal and distal allosteric features within the dimeric photoreceptor. Sci Rep. V. 7. P. 13648.
Burgie E.S., Zhang J., Vierstra R.D. 2016. Crystal structure of deinococcus phytochrome in the photoactivated state reveals a cascade of structural rearrangements during photoconversion. Structure. V. 24. P. 448.
Essen L.O., Mailliet J., Hughes J. 2008. The structure of a complete phytochrome sensory module in the Pr ground state. Proc. Natl. Acad. Sci. USA. V. 105. P. 14709.
Filonov G.S., Piatkevich K.D., Ting L.M., Zhang J., Kim K., Verkhusha V.V. 2011. Bright and stable near-infrared fluorescent protein for in vivo imaging. Nat. Biotechnol. V. 29. P. 757.
Fonin A.V., Sulatskaya A.I., Kuznetsova I.M., Turoverov K.K. 2014. Fluorescence of dyes in solutions with high absorbance. Inner filter effect correction. PLoS One. V. 9. P. e103878. https://doi.org/10.1371/journal.pone.0103878
Frankenberg N.F., Lagarias J.C. 2003. Biosynthesis and biological function of bilins. In: The porphyrin handbook. Chlorophylls and bilins: biosynthesis structure and degradation. N.Y.: Academic Press. V. 13. P. 211.
Glazer A.N., Fang S. 1973. Chromophore content of blue-green algal phycobiliproteins. J. Biol. Chem. V. 248. P. 659.
Gourinchas G., Etzl S., Winkler A. 2019. Bacteriophytochromes – from informative model systems of phytochrome function to powerful tools in cell biology. Curr. Opin. Struct. Biol. V. 57. P. 72.
Gourinchas G., Heintz U., Winkler A. 2018. Asymmetric activation mechanism of a homodimeric red light-regulated photoreceptor. Elife. V. 7. P. 1.
Hahn J., Strauss H.M., Landgraf F.T., Gimenez H.F., Lochnit G., Schmieder P., Hughes J. 2006. Probing protein-chromophore interactions in Cph1 phytochrome by mutagenesis. FEBS J. V. 273. P. 1415.
Rockwell N.C., Martin S.S., Li F.W., Mathews S., Lagarias J.C. 2017. The phycocyanobilin chromophore of streptophyte algal phytochromes is synthesized by HY2. New Phytol. V. 214. P. 1145.
Rodriguez E.A., Campbell R.E., Lin J.Y., Lin M.Z., Miyawaki A., Palmer A.E., Shu X., Zhang J., Tsien R.Y. 2017. The growing and glowing toolbox of fluorescent and photoactive proteins. Trends Biochem. Sci. V. 42. P. 111.
Rottwinkel G., Oberpichler I., Lamparter T. 2010. Bathy phytochromes in rhizobial soil bacteria. J. Bacteriol. V. 192. P. 5124.
Stepanenko O.V., Baloban M., Bublikov G.S., Shcherbakova D.M., Stepanenko O.V., Turoverov K.K., Kuznetsova I.M., Verkhusha V.V. 2016. Allosteric effects of chromophore interaction with dimeric near-infrared fluorescent proteins engineered from bacterial phytochromes. Sci. Rep. V. 6. P. 18750. https://doi.org/10.1038/srep18750
Stepanenko O.V., Stepanenko O.V., Kuznetsova I.M., Shcherbakova D.M., Verkhusha V.V., Turoverov K.K. 2017. Interaction of biliverdin chromophore with near-infrared fluorescent protein bphp1-fp engineered from bacterial phytochrome. Int. J. Mol. Sci. V. 18. P. 1009.
Stepanenko O.V., Stepanenko O.V., Shpironok O.G., Fonin A.V., Kuznetsova I.M., Turoverov K.K. 2019. Near-infrared markers based on bacterial phytochromes with phycocyanobilin as a chromophore. Int. J. Mol. Sci. V. 20. P. 6067.
Stepanenko O.V., Stepanenko O.V., Turoverov K.K., Kuznetsova I.M. 2020. Probing the allostery in dimeric near-infrared biomarkers derived from the bacterial phytochromes: The impact of the T204A substitution on the inter-monomer interaction. Int. J. Biol. Macromol. V. 162. P. 894.
Takala H., Bjorling A., Berntsson O., Lehtivuori H., Niebling S., Hoernke M., Kosheleva I., Henning R., Menzel A., Ihalainen J.A., Westenhoff S. 2014. Signal amplification and transduction in phytochrome photosensors. Nature. V. 509. P. 245.
Tarutina M., Ryjenkov D.A., Gomelsky M. 2006. An unorthodox bacteriophytochrome from Rhodobacter sphaeroides involved in turnover of the second messenger c-di-GMP. J. Biol. Chem. V. 281. P. 34751.
Toh K.C., Stojkovic E.A., van Stokkum I.H., Moffat K., Kennis J.T. 2011. Fluorescence quantum yield and photochemistry of bacteriophytochrome constructs. Phys. Chem. Chem. Phys. V. 13. P. 11985.
Velazquez Escobar F., Hildebrandt T., Utesch T., Schmitt F.J., Seuffert I., Michael N., Schulz C., Mroginski M.A., Friedrich T., Hildebrandt P. 2014. Structural parameters controlling the fluorescence properties of phytochromes. Biochemistry. V. 539. P. 20.
Von Horsten S., Strass S., Hellwig N., Gruth V., Klasen R., Mielcarek A., Linne U., Morgner N., Essen L.O. 2016. Mapping light-driven conformational changes within the photosensory module of plant phytochrome B. Sci. Rep. V. 6. P. 34366. https://doi.org/10.1038/srep34366
Yang X., Stojkovic E. A., Kuk J., Moffat K. 2007. Crystal structure of the chromophore binding domain of an unusual bacteriophytochrome, RpBphP3, reveals residues that modulate photoconversion. Proc. Natl. Acad. Sci. USA. V. 104. P. 1257.
Дополнительные материалы отсутствуют.


