Цитология, 2021, T. 63, № 1, стр. 53-62
Особенности повреждения астроцитов головного мозга под влиянием L-аминоадипиновой кислоты in vitro и in vivo
Д. Н. Воронков 1, А. А. Лыжин 1, Ю. В. Дикалова 1, *, А. В. Ставровская 1, Р. М. Худоерков 1, Л. Г. Хаспеков 1
1 Научный центр неврологии
125367 Москва, Россия
* E-mail: dzettaly@gmail.com
Поступила в редакцию 06.10.2020
После доработки 26.10.2020
Принята к публикации 28.10.2020
Аннотация
Известно, что L-аминоадипиновая кислота (L-AA) оказывает токсическое действие на астроглию. Цель работы – охарактеризовать морфологические изменения астроцитов in vitro и in vivo под действием L-AA. Оценивали действие L-AA в диапазоне концентраций 0.17–1.4 мМ на астроциты в первичных диссоциированных культурах коры головного мозга и мозжечка крыс, а так же при стереотаксическом введении (20 мкг) в стриатум крыс. Концентрации 0.35–1.4 мМ L-AA вызывали снижение экспрессии кислого глиофибриллярного белка (GFAP), повреждение и гибель астроцитов, пикноз и активацию лизосом (увеличение экспрессии LAMP2). На вторые сутки после введения L-AA в стриатум крыс формировалась обширная, лишенная GFAP-позитивного окрашивания область повреждения. Полученные данные показали перспективность использования L-аминоадипиновой кислоты для моделирования повреждения астроглии при нейродегенеративных заболеваниях.
Астроглия участвует как в ключевых нейрофизиологических процессах (модуляция синаптической передачи, энергетическая поддержка нейронов, нейровоспаление, регенерация и ремоделирование нервной ткани) (Verkhratsky, Nedergaard, 2018), так и в патогенезе ряда заболеваний (эпилепсия, депрессия, ишемический инфаркт мозга и нейродегенеративные патологии, такие как болезни Альцгеймера, Паркинсона и боковой амиотрофический склероз) (Pekny, Pekna, 2016; Хаспеков, Фрумкина, 2017; Verkhratsky, Nedergaard, 2018; McConnell et al., 2019).
Значительный интерес вызывают исследования, связанные с регуляцией функции астроцитов, для чего требуются экспериментальные модели их избирательного повреждения (Jäkel, Dimou, 2017). Одной из таких моделей может служить воздействие глиального токсина L-аминоадипиновой кислоты (L-AA), которая является структурным аналогом глутамата и метаболитом лизина. Изменение концентрации эндогенной L-AA рассматривается как потенциальный биомаркер инсулинрезистентности и диабета второго типа (Wang et al., 2013; Lee, 2019); биполярного расстройства (Watmuff et al., 2016).
L-аминоадипиновая кислота токсична для астроцитов (Olney et al., 1980; Huck et al., 1984; Brown, Kretzschmar, 1998; Billet et al., 2007; Śmiałowska et al., 2013). Ее энантиомером является D-аминоадипиновая кислота. Рацемическая смесь этих аминокислот повреждает в культуре ткани не только нейроглию, но и нейроны (Olney et al., 1980). В клетку L-AA переносят Na-зависимые транспортеры глутамата, но механизм ее токсического действия не выяснен. Известно, что L-AA угнетает синтез белка, снижает активность глутаминсинтетазы, экспрессию глиофибриллярного белка и белка S100b и активирует про-апоптотические каскады (Khurgel et al., 1996; Nishimura et al., 2000; O’Neil et al., 2019). L-AA повреждает не только астроциты ЦНС, но и другие клетки астроцитарного происхождения, например, Мюллеровские клетки сетчатки (Wang et al., 2016).
При интрацеребральном введении L-AA в амигдалу и префронтальную кору крыс наблюдали массивную дегенерацию астроцитов и депрессивно-подобное поведение животных (Banasr, Duman, 2008; Śmiałowska et al., 2013). Показано, что L-AA, повреждая астроциты, нарушает глутаматергическую передачу и провоцирует окислительный стресс (da Silva et al., 2017). Некоторые исследования указывают на неоднозначный характер действия L-AA. Например, в одной из работ показано отсутствие глиотоксического эффекта L-AA при введении в гиппокамп и стриатум (Saffran, Crutcher, 1987), а в другой работе отмечено массивное повреждение нейронов и генерализованные судороги при введении высоких доз токсина в гиппокамп крыс (Chang et al., 1997).
Избирательное токсическое повреждение астроцитов как экспериментальная парадигма (Jakel, Dimou, 2017), в отличие от аналогичных подходов, направленных на повреждение нейронов, не получило широкого распространения. Большинство современных работ, в которых используются глиотоксические свойства L-AA, связано с удалением астроцитов с целью снижения провоспалительного эффекта активированной астроглии. Так, введение L-AA подавляло нейровоспаление в черной субстанции мозга, вызываемое введением бактериальных липополисахаридов (O’Neil et al., 2019). На купризоновой модели рассеянного склероза L-AA усиливала ремиелинизацию (Madadi et al., 2019), а на модели повышенного внутриглазного давления у крыс – ослабляла ассоциированное с реактивным глиозом повреждение сетчатки (Wang et al., 2016). Было показано, что L-AA снижала глиальную активацию при трансплантации клеток сетчатки и влияла на дифференцировку глиальных клеток в ретинальные нейроны (Takeda et al., 2008; West et al., 2008). Снижение астроцитарной реакции обнаружили на модели геморрагического инфаркта, при ингибировании тромбин-индуцированной активации астроглии (Chiu et al., 2017). Вместе с тем, подавление астроцитов вызывает и негативный эффект, поскольку дегенерация астроцитов, под действием флуороцитрата, снижала возможности восстановления и компенсации на моделях паркинсонизма и ишемического инфаркта мозга (Hayakawa et al., 2010; Kuter et al., 2019), а на модели болезни Альцгеймера генетическое подавление астроцитов отягощало патологические изменения (Katsouri et al., 2020).
Цель настоящего исследования – охарактеризовать изменения астроцитов in vitro и in vivo под действием L-аминоадипиновой кислоты и уточнить используемые оптимальные дозы и сроки действия токсина для повреждения астроглии в эксперименте.
МАТЕРИАЛ И МЕТОДИКА
Первичные диссоциированные глиальные культуры клеток мозжечка и коры больших полушарий. Для получения культур клеток использовали потомство крыс Вистар, полученных из питомника “Столбовая” (Национальный центр биомедицинских технологий ФМБА России). Животных подвергали эвтаназии с помощью диэтилового эфира. У трех постнатальных 8-дневных крысят извлекали мозжечок, а у трех 10-дневных крыс – кору больших полушарий. Выбранный период соответствует окончанию волны постнатальной пролиферации астроцитов, наблюдающейся на первой неделе постнатального развития (Ge et al., 2012; Cerrato et al., 2018).
После удаления мозговых оболочек и промывки в фосфатном солевом буфере (PBS) мозжечок и кору иссекали скальпелем на мелкие фрагменты и помещали на 15 мин в термостат (37°C) в 0.25%-ный раствор трипсина. Фрагменты ткани промывали в среде для культивирования, содержавшей минимальную среду Игла, 10% эмбриональной бычьей сыворотки, 10 мМ буфера HEPES, 2 мМ глутамакса, 600 мг глюкозы и 25 мМ KCl. Среда для коры не содержала KCl. Фрагменты пятикратно пропускали через пастеровскую пипетку, после чего надосадочную жидкость переносили в центрифужную пробирку, процедуру повторяли до диссоциации ткани. Полученную суспензию центрифугировали 3 мин при 1000 об./мин, осадок ресуспендировали в среде для культивирования. Количество клеток мозжечка в суспензии, подсчитанное на счетчике Invitrogen Countess (Invitrogen, США) составляло 4–5 млн/мл. Клетки в суспензии коры не подсчитывали из-за массивного детрита. Суспензию по 150–200 мкл наносили на покровные стекла (24 × 24 мм), покрытые полиэтиленимином (0.5 мг/мл) и помещенные в чашки Петри диаметром 40 мм. Культивировали клетки в CO2 инкубаторе (NuAire, США) при 35.5°С, во влажной атмосфере с содержанием углекислоты 5%. Через 2 ч в чашки добавляли среду до 1.5 мл без KCl. Через 5 дней среду полностью заменяли новой, без KCl. При этом в последующие сутки нейроны мозжечка погибали, а культура коры очищалась от детрита и в обоих случаях наблюдалось развитие глии. На 12 день in vitro (DIV) в эксперименте с культурой коры или на 6 день in vitro (DIV) в эксперименте с культурой мозжечка вносили не более 10 мкл раствора L-AA на PBS так, чтобы конечная концентрация L-AA составила 0.17, 0.7, 0.35 или 1.4 мМ. Через сутки после внесения в культуру раствора L-AA, ее фиксировали 15 минут холодным 2% раствором формалина на PBS, после чего многократно промывали PBS и использовали для иммунофлуоресцентного мечения.
Стереотаксическое введение L-AA в стриатум. L-AA растворяли в 1M HCl в концентрации 120 мкг/мкл, и доводили до pH 7.3 с помощью 1М NaOH, после чего разбавляли 0.01М PBS (pH 7.2–7.4) до итоговой концентрации L-AA 20 мкг/мкл (Khurgel, 1996). Стереотаксическое введение L-AA проводили 12 крысам Вистар (получены из питомника “Столбовая”), самцам. Для премедикации применяли атропин в дозе 0.04 мг/кг подкожно. Для анестезии животным вводили Zoletil-100 в дозе 3 мг/100 г и ксиланит в дозе 3 мг/кг внутримышечно. С помощью двойного стереотаксического манипулятора (Stoelting, США) в правый стриатум животного (координаты по атласу Paxinos AP = 1.5; L = 2.5; V = 4.8), используя микрошприц (Hamilton, США), вводили 5 мкл раствора L-AA, а в левый стриатум вводили PBS в том же объеме. Равное количество (n = 4) животных выводили из эксперимента на вторые (48 ч), третьи (72 ч) и 12 сут после операции. Крыс наркотизировали хлоралгидратом, декапитировали гильотиной, извлекали мозг и фиксировали 24 ч погружением в 4%-ный формалин. Далее образцы пропитывали 30%-ным раствором сахарозы, заливали средой O.C.T. и готовили фронтальные замороженные срезы толщиной 10 мкм, на уровне стриатума.
Иммунофлуоресцентное мечение. Астроциты выявляли с помощью поликлональных кроличьих антител к глиофибриллярному белку GFAP (1 : 500), нейроны – с помощью моноклональных кроличьих антител к белку NeuN (1 : 400), а лизосомный белок LAMP2 – с помощью моноклональных мышиных антител (1 : 150). Срезы нагревали 15 мин в пароварке, помещая их в цитратный буфер pH = 6.0, для демаскировки антигена. Стекла с культурами не нагревали, но выдерживали 1 ч в PBS, содержавшем 0.1% Triton X-100 для пермеабилизации мембран, а затем инкубировали с первичными антителами во влажной камере 12 ч при комнатной температуре, промывали PBS. Далее для визуализации связывания срезы инкубировали 2 ч с вторичными антителами. Использовали соответствующие антитела (1 : 200) против иммуноглобулинов мыши или кролика, конъюгированные с флуорохромами CF555 или CF488 соответственно. Препараты заключали в cреду Fluoroshield, содержащую 0.0002% DAPI, и исследовали под микроскопами Nikon Eclipse Ni-u (Nikon, Япония) и Nikon SMZ25 (Nikon, Япония).
Морфометрия и анализ данных. Полученные изображения анализировали с помощью программы Nikon NIS Elements (Nikon, Япония). GFAP-позитивные астроциты в культуре подсчитывали вручную, на фотоизображениях, полученных при увеличении объектива 10×, изучали не менее 15 полей зрения с одного стекла. Интенсивность окрашивания оценивали на изображениях, полученных при одинаковых настройках микроскопа и камеры. Для выделенной области определяли среднюю яркость в условных единицах для 8-битного изображения (256 градаций). Для оценки иммуномечения LAMP2 выделяли профиль клетки (не менее 100 клеток) с помощью графического планшета Wacom (Wacom, Япония). Для оценки экспрессии GFAP при стереотаксическом введении выделяли область шириной 1 мм вокруг трека иглы (не менее чем на 5 срезах стриатума от одного животного). Статистическую обработку данных проводили в программе GraphPad Prism (GrafPad Soft, США). Полученные результаты от каждого животного усредняли. Для сравнения групп использовали дисперсионный анализ ANOVA, с апостерироным тестом Тьюки.
Использованные реактивы: фосфатный солевой буфер, минимальная среда Игла, глутамакс (Gibco, США); фосфатный солевой буфер (MP Biomedicals, США); раствор трипсина, буфер HEPES, глюкоза, полиэтиленимин, хлоралгидрат, Triton X-100, цитратный буфер, конъюгированные с CF488 антитела козы против иммуноглобулинов кролика, конъюгированные с CF555 антитела козы против иммуноглобулинов мыши, среда для заключения Fluoroshield с DAPI (Sigma, США); эмбриональная бычья сыворотка (HyClone, США); KCl, HCl, NaOH, сахароза (Химмед, Россия); L-аминоадипиновая кислота (Acros Organics, Бельгия); формалин (Гистолайн, Россия); атропин (ГНЦЛС, Украина); Zoletil-100 (Virbac, Франция); ксиланит (ОО НИТА-Фарм, Россия); O.C.T. compaund (Electron Microscopy Science, США); кроличьи антитела к глиофибриллярному белку GFAP (Abcam, ab7260, США); моноклональные антитела кролика к NeuN (Abcam, ab177487); моноклональные мышиные антитела к LAMP2 (Thermo Fisher, PA1-655, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При внесении L-AA в культуру клеток коры морфология GFAP-позитивных астроцитов резко изменялась, что выражалось в пикнозе ядер и разнообразных патологических изменениях формы клеток: размеры тел клеток и количество их отростков уменьшалось, а тела астроцитов деформировались (рис. 1а–д).
Рис. 1.
Повреждение астроцитов в культуре неокортекса под действием L-AA. а, в – Контроль, б, г – 0.7 мМ L-AA, д – 1.4 мМ L-AA. Масштабный отрезок – 50 мкм. а, б – Косое освещение (Nikon OCC contrast), в–д – выявление GFAP, ядра докрашены DAPI, г – число GFAP-позитивных астроцитов (клеток в поле зрения при увеличении объектива 10×), результаты представлены в виде среднее ± среднеквадратичное отклонение.
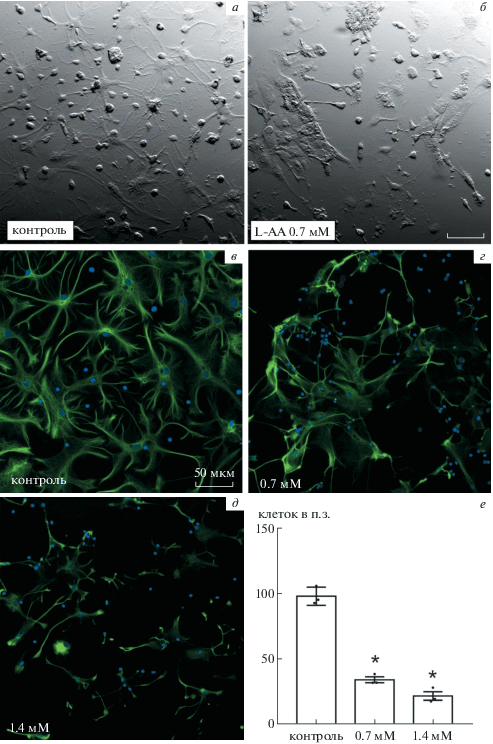
Количество GFAP-позитивных астроцитов в культуре клеток неокортекса статистически значимо снижалось (ANOVA, F = 159, p < 0.01) при использовании L-AA в концентрациях 0.7 и 1.4 мМ (рис. 1е). При более высокой концентрации токсина морфологические изменения были выражены сильнее (рис. 1в–д).
В эксперименте, выполненном на первичной культуре мозжечка, выявили сходные изменения. Под действием L-AA значимо снижалось как количество астроцитов (ANOVA, F = 38.5, p < 0.01), так и размеры (эквивалентный диаметр) их ядер (ANOVA, F = 158, p < 0.01). Эффект зависел от концентрации L-AA (табл. 1). Статистически значимое снижение числа астроцитов по сравнению с контролем обнаружили при всех концентрациях L-AA, тогда как средний эквивалентный диаметр их ядер при концентрации 0.17 мМ не менялся относительно контроля, а при концентрации 0.35 мМ – снижался лишь на 14%, что указывает на малую долю пикнотических ядер, по сравнению с концентрацией L-AA 1.4 мМ.
Таблица 1.
Изменения GFAP-позитивной астроглии в первичной культуре мозжечка под действием L-AA
| Экспериментальные группы | Эквивалентный диаметр ядер астроцитов, мкм | Число астроцитов (клеток на 0.25 мм2) |
Интенсивность окрашивания на LAMP2, усл. ед. яркости |
|---|---|---|---|
| Контроль | 13.7 ± 1.9 | 35.0 ± 13.9 | 19.3 ± 4.3 |
| L-AA (0.17 мМ) | 13.2 ± 2.4 | 20.8 ± 7.2а | 18.4 ± 3.8 |
| L-AA (0.35мМ) | 11.8 ± 2.6а, б | 16.7 ± 7.5а | 20.9 ± 4.9б |
| L-AA (1.4 мМ) | 7.7 ± 1.7а, б, в | 12.8 ± 7.2а, б | 25.0 ± 6.7а, б, в |
Так как токсическое влияние L-АА на астроциты, но не на нейроны, было ранее показано нами (Ставровская и др., 2019) и другими авторами (Huck et al., 1984, Khurgel et al., 1996, Brown, Kretzschmar, 1998), в настоящем исследовании мы не оценивали повреждение нейронов. Морфологические изменения астроглии мозжечка были сходны с изменениями астроцитов в культуре неокортекса, кроме того, были отмечены изменения в окрашивании на GFAP тел астроцитов и их отростков: часто дистальные отделы отростков астроцитов окрашивались на GFAP слабо, а структура сети промежуточных филаментов была нарушена. Отмечали сморщивание клеток, изменения формы отростков астроцитов (рис. 2г–е), что согласуется с данными других авторов (Huck et al., 1984).
Рис. 2.
Изменения астроцитов в культуре мозжечка под действием L-AA. а–в – Иммунофлуоресцентное выявление GFAP (зеленый цвет) и LAMP2 (красный цвет). Ядра докрашены DAPI. г–е – изменения формы астроцитов и структуры промежуточных филаментов. а, г – Контроль, б – 0.35 мМ L-AA, в, д, е – 1.4 мМ L-AA. Ув. об. 100×. Масштабный отрезок 25 мкм.
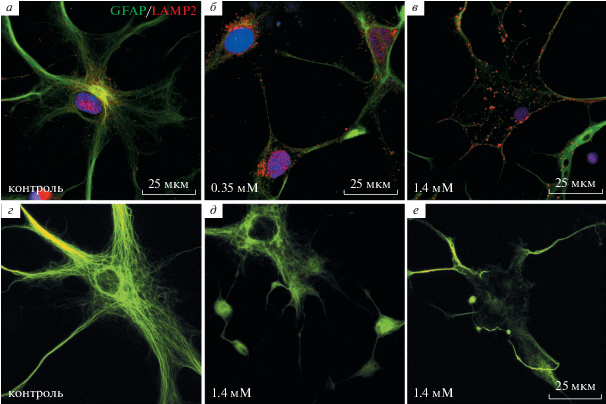
Хотя ранее сообщалось (Brown, Kretzschmar, 1998), что L-AA повреждает преимущественно астроциты 1-го типа в глиальных культурах коры, наши наблюдения не подтвердили различий в действии L-AA на астроциты разных типов, поскольку обнаруживали гибель астроцитов, имеющих разную морфологию. Кроме того, выявленный в нашей работе эффект L-AA был более выраженным при меньших концентрациях L-AA, чем в указанной работе (Brown, Kretzschmar, 1998).
По действием L-AA средняя интенсивность окрашивания на лизосомный белок LAMP2 в телах астроцитов увеличивалась (ANOVA F = 27.63, p < 0.01), что может указывать на повышение экспрессии LAMP2. Усиление окрашивания в виде пунктата в цитоплазме астроцитов обнаруживалось как у клеток с пикнозом, так и в астроцитах с неизмененными ядрами, при концентрации L-AA 0.35 мМ (табл. 1, рис. 2а–в).
Выявленное нами усиление иммуноокрашивания с помощью антител к маркеру лизосом LAMP2 позволяет предположить активацию лизосом. Это может объясняться как участием сохранных активированных астроцитов в фагоцитозе клеточного детрита (Morales et al., 2017; Morizawa et al., 2017) при токсическом действии L-AA, так и активацией аутофагально-лизосомного пути, который может иметь как протекторное значение, так и вносить вклад в повреждение астроцитов. Активация аутофагии в астроцитах показана в экспериментах на моделях фокальной ишемии и болезни Александера (Tang et al., 2008; Qin et al., 2010) и таких нейродегенеративных заболеваний как болезнь Паркинсона и Альцгеймера (Wang, Xu, 2020). Астроцитарный фагоцитоз в свою очередь так же может иметь значение в патогенезе нейродегенеративных заболеваний, поскольку устранение клеточного детрита может снижать вовлечение микроглии и сопутствующие негативные последствия (Iglesias et al., 2017).
В целом, наиболее выраженные эффекты воздействия L-AA на астроциты мозжечка обнаруживали при концентрациях 0.35 и 1.4 мМ. При использовании L-AA в концентрации 1.4 мМ число выявляемых астроцитов в культуре неокортекса, по сравнению с контролем, снижалось на 88%, а в культуре мозжечка – на 64%, и хотя эти результаты напрямую мало сопоставимы, они позволяют предположить, что астроциты коры более чувствительны к токсическому действию L-AA. Следует подчеркнуть, что L-AA повреждала астроциты неокортекса и мозжечка, несмотря на морфологические и нейрохимические различия между ними (Buffo, Rossi, 2013), и токсическое действие L-AA на культивируемые астроциты не зависело от наличия или отсутствия в клеточной культуре нервных клеток.
Эксперимент с интрацеребральным введением также подтвердил глиотоксическое действие L-AA на астроциты головного мозга (рис. 3). Через 48 ч после введения L-AA в стриатум наблюдали выраженное повреждение астроглии и формирование GFAP-негативной зоны в области введения (рис. 3а, е). Таким образом, имеющиеся в литературе данные (Saffran, Crutcher, 1987) об отсутствии токсического действия L-AA на астроциты стриатума при интрацеребральном введении не находят подтверждения в нашей работе. Важно отметить, что интрацеребральное введение L-AA вызывает одновременно как гибель астроглии, так и ее активацию по периферии пораженной зоны.
Рис. 3.
Гибель и замещение астроцитов при введении L-AA в стриатум. а – 48 ч после введения, б – 72 ч после введения, в – 12 сут после введения. Иммунофлуоресцентное выявление GFAP. Ув. об. 4×. г – Площадь, занимаемая GFAP-позитивными элементами, в процентах от поля зрения. Серые столбики – введение L-AA, белые столбики – контралатеральное полушарие, введение PBS. Данные представлены в виде среднее ± среднеквадратичное отклонение. * – достоверные отличия от противоположного полушария (p < 0.05), # – достоверные отличия от ипсилатерального полушария через 12 сут после введения L-AA (p < 0.05). ANOVA, апостериорный тест Тьюки. д, е – Область введения токсина через 72 ч после начала эксперимента при большем увеличении. Масштабный отрезок 100 мкм. Трек иглы отмечен звездочками. д – Иммунофлуоресцентное выявление NeuN, е – иммунофлуоресцентное выявление GFAP.
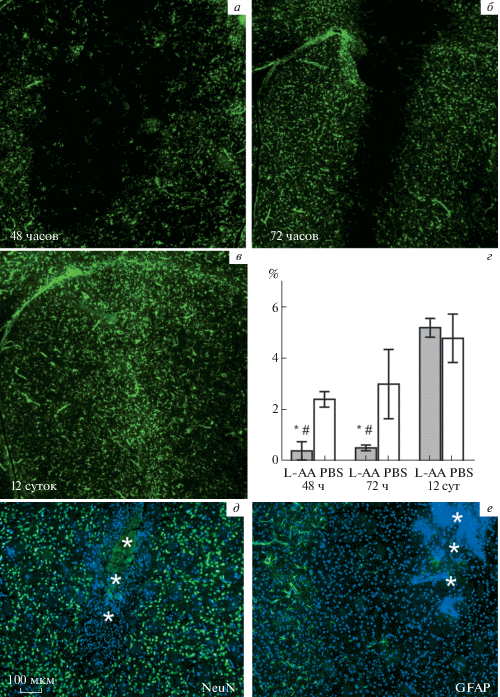
При однократном интрацеребральном введении погибшие астроциты быстро замещались новыми клетками, источником которых могло быть как деление астроглии in situ, в периферической зоне поражения, так и миграция астроцитарных предшественников из субвентрикулярной зоны (Buffo et al., 2008; Faiz et al., 2015). Через 72 ч после интрацеребрального введения область ослабленного окрашивания с помощью антител к GFAP в стриатуме уменьшалась, а через 12 сут она замещалась реактивными астроцитами, формирующими рубец вокруг трека иглы (рис. 3а–в). Зона некротических изменений была ограничена областью механического повреждения ткани иглой. Окрашивание с помощью антител к NeuN показало сохранность нейронов через 72 ч после введения токсина в непосредственной близости от трека иглы (рис. 3д), тогда как зона повреждения астроглии (рис. 3е) была существенно больше. Площадь, занимаемая GFAP-позитивной астроглией в области стриатума, прилегающей к треку иглы статистически значимо уменьшалась (ANOVA, F = 32.47, p < < 0.01) через 48 и 72 ч после введения L-AA, как по сравнению с контрольной областью (введение PBS в те же сроки), так и в сопоставлении с группой животных через 12 сут после введения L-AA.
Сочетание повреждения астроцитов и их активации – это важные характеристики интрацеребрального введения L-AA в нервную ткань мозга животного, поскольку они отражают процессы, происходящие при нейродегенеративных заболеваниях (Pekny, Pekna, 2016), и эти процессы не воспроизводятся на генетических моделях, связанных с удалением астроцитов (Jakel, Dimou, 2017; Liu et al., 2019).
Таким образом, астроциты новой коры, мозжечка и стриатума крыс чувствительны к токсическому действию L-AA. Эксперименты на первичных культурах клеток коры и мозжечка показали, что в диапазоне концентраций 0.35–1.4 мМ L-AA снижает экспрессию GFAP, приводит к повреждению и гибели астроцитов, вызывает пикноз и активацию лизосом. Через 2 сут после однократного введения в стриатум крыс 20 мкг L-AA на месте введения формируется обширная, лишенная GFAP-позитивной астроглии, область повреждения, которая к 12 сут после введения токсина замещается вновь образованными астроцитами, формирующими глиальный рубец.
Хотя введение L-AA непосредственно не приводило к гибели нейронов, что согласуется с данными об избирательном захвате L-AA астроцитами (Pow, 2001), повреждение астроцитов и, как результат, активация эксайтотоксических реакций и нарушение энергетического обмена могут отсрочено влиять на нейроны, что требует отдельного исследования. Наблюдающаяся активация астроглии и формирование рубца на поздних сроках после введения L-AA также приводят к перестройке глио-нейрональных взаимодействий и могут провоцировать функциональные нарушения нейронов. Однако, реактивный астроглиоз может оказывать как положительные, так и отрицательные эффекты на нейроны, в зависимости от условий (Sofroniew, 2009; Anderson et al., 2016).
Проведенная работа показала, что L-аминоадипиновая кислота может быть использована для повреждения астроцитов в диссоциированной культуре клеток мозжечка и неокортекса, и при интрацеребральном введении. Модель с введением L-аминоадипиновой кислоты может применяться для исследования повреждения астроцитов, их активации и восстановления популяции в разных условиях, для исследования роли астроцитарной дисфункции при нейродегенеративных заболеваниях, а так же возможностей регуляции провоспалительной реакции астроглии.
Список литературы
Ставровская А.В., Воронков Д.Н., Ольшанский А.С., Гущина А.С., Ямщикова Н.Г. 2019. Экспериментальный паркинсонизм при моделировании повреждения астроцитов стриатума. Анналы клинической и экспериментальной неврологии. Т. 13. № 3. С. 28. (Stavrovskaya A.V., Voronkov D.N., Ol’shansky A.S., Gushchina A.S., Yamshchikova N.G. 2019. Experimental parkinsonism in modeling striatal astrocyte damage. Annals of clinical and experimental neurology. V. 13. № 3. P. 28.)
Хаспеков Л.Г., Фрумкина Л.Е. 2017. Молекулярные механизмы, опосредующие участие глиальных клеток в пластических перестройках головного мозга при эпилепсии. Биохимия. Т. 18. № 3. С. 528 (Khaspekov L.G., Frumkina L.E. 2017. Molecular mechanisms mediating involvement of glial cells in plastic brain reorganization in epilepsy. Biochemistry. V. 18. № 3. P. 528.)
Anderson M.A., Burda J.E., Ren Y., Ao Y., O’Shea T.M., Kawaguchi R., Coppola G., Khakh B.S., Deming T.J., Sofroniew M.V. 2016. Astrocyte scar formation aids central nervous system axon regeneration. Nature. V. 532. P. 195.
Banasr M., Duman R.S. 2008. Glial loss in the prefrontal cortex is sufficient to induce depressive-like behaviors. Biol. Psychiatry. V. 64. P. 863.
Billet F., Costentin J., Dourmap N. 2007. Influence of glial cells in the dopamine releasing effect resulting from the stimulation of striatal δ-opioid receptors. Neuroscience. V. 150. P. 131.
Brown D.R., Kretzschmar H.A. 1998. The glio-toxic mechanism of alpha-aminoadipic acid on cultured astrocytes. J. Neurocytol. V. 27. P. 109.
Buffo A., Rite I., Tripathi P., Lepier A., Colak D., Horn A-P., Mori T., Götz M. 2008. Origin and progeny of reactive gliosis: A source of multipotent cells in the injured brain. PNAS. V. 105. P. 3581.
Buffo A., Rossi F. 2013. Origin, lineage and function of cerebellar glia. Prog. Neurobiol. V. 109. P. 42.
Cerrato V., Parmigiani E., Figueres-Oñate M., Betizeau M., Aprato J., Nanavaty I., Berchialla P., Luzzati F., de’Sperati C., López-Mascaraque L., Buffo A. 2018. Multiple origins and modularity in the spatiotemporal emergence of cerebellar astrocyte heterogeneity. PLOS Biol. V. 16. P. e2005513. https://doi.org/10.1371/journal.pbio.2005513
Chang Y.F., Cauley R.K., Chang J.D., Rao V.V. 1997. L-alpha-aminoadipate inhibits kynurenate synthesis in rat brain hippocampus and tissue culture. Neurochem. Res. V. 22. P. 825.
Chiu C.-D., Yao N.-W., Guo J.-H., Shen C.-C., Lee H.-T., Chiu Y.-P., Ji H.-R., Chen X., Chen C.-C., Chang C. 2017. Inhibition of astrocytic activity alleviates sequela in acute stages of intracerebral hemorrhage. Oncotarget. V. 8. P. 94 850.
da Silva J.C., Amaral A.U., Cecatto C., Wajner A., dos Santos Godoy K., Ribeiro R.T., de Mello Gonçalves A., Zanatta Â., da Rosa M.S., Loureiro S.O., Vargas C.R., Leipnitz G., de Souza D.O.G., Wajner M. 2017. α-Ketoadipic acid and α-aminoadipic acid cause disturbance of glutamatergic neurotransmission and induction of oxidative stress in vitro in brain of adolescent rats. Neurotox. Res. V. 32. P. 276.
Faiz M., Sachewsky N., Gascón S., Bang K.W.A., Morshead C.M., Nagy A. 2015. Adult neural stem cells from the subventricular zone give rise to reactive astrocytes in the cortex after stroke. Cell. Stem Cell. V. 17. P. 624.
Ge W.-P., Miyawaki A., Gage F.H., Jan Y.N., Jan L.Y. 2012. Local generation of glia is a major astrocyte source in postnatal cortex. Nature. V. 484. P. 376.
Hayakawa K., Nakano T., Irie K., Higuchi S., Fujioka M., Orito K., Iwasaki K., Jin G., Lo E. H., Mishima K., Fujiwara M. 2010. Inhibition of reactive astrocytes with fluorocitrate retards neurovascular remodeling and recovery after focal cerebral ischemia in mice. J. Cereb. Blood. Flow. Metab. V. 30. P. 871.
Huck S., Grass F., Hortnagl H. 1984. The glutamate analogue alpha-aminoadipic acid is taken up by astrocytes before exerting its gliotoxic effect in vitro. J. Neurosci. V. 4. P. 2650.
Iglesias J., Morales L., Barreto G.E. 2017. Metabolic and inflammatory adaptation of reactive astrocytes: role of PPARs. Mol. Neurobiol. V. 54. P. 2518. https://doi.org/10.1007/s12035-016-9833-2
Jäkel S., Dimou L. 2017. Glial cells and their function in the adult brain: a journey through the history of their ablation. Front. Cell. Neurosci. V. 11. https://doi.org/10.3389/fncel.2017.00024
Katsouri L., Birch A.M., Renziehausen A.W.J., Zach C., Aman Y., Steeds H., Bonsu A., Palmer E.O.C., Mirzaei N., Ries M., Sastre M. 2020. Ablation of reactive astrocytes exacerbates disease pathology in a model of Alzheimer’s disease. Glia. V. 68. P. 1017.
Khurgel M., Koo A.C., Ivy G.O. 1996. Selective ablation of astrocytes by intracerebral injections of a-aminoadipate. Glia. V. 16. P. 351.
Kuter K., Olech Ł., Głowacka U., Paleczna M. 2019. Astrocyte support is important for the compensatory potential of the nigrostriatal system neurons during early neurodegeneration. J. Neurochem. V. 148. P. 63.
Lee H.J., Jang H.B., Kim W.H., Park K.J., Kim K.Y., Park S.I., Lee H.J. 2019. 2-Aminoadipic acid (2-AAA) as a potential biomarker for insulin resistance in childhood obesity. Sci. Rep. V. 9. P. 13610. https://doi.org/10.1038/s41598-019-49578-z
Liu F., Dai S., Feng D., Peng X., Qin Z., Kearns A.C., Huang W., Chen Y., Ergün S., Wang H., Rappaport J., Bryda E.C., Chandrasekhar A., Aktas B., Hu H., et al. 2019. Versatile cell ablation tools and their applications to study loss of cell functions. Cell. Mol. Life Sci. V. 76. P. 4725.
Madadi S., Pasbakhsh P., Tahmasebi F., Mortezaee K., Khanehzad M., Boroujeni F.B., Noorzehi G., Kashani I.R. 2019. Astrocyte ablation induced by L-a-aminoadipate (L-AAA) potentiates remyelination in a cuprizone demyelinating mouse model. Metab. Brain Dis. V. 34. P. 593.
McConnell H.L., Li Z., Woltjer R.L., Mishra A. 2019. Astrocyte dysfunction and neurovascular impairment in neurological disorders: Correlation or causation? Neurochem. Int. V. 128. P. 70.
Morales I., Sanchez A., Rodriguez-Sabate C., Rodriguez M. 2017. Striatal astrocytes engulf dopaminergic debris in Parkinson’s disease: A study in an animal model. PLoS One. V. 12 P. e0185989. https://doi.org/10.1371/journal.pone.0185989
Morizawa Y.M., Hirayama Y., Ohno N., Shibata S., Shigetomi E., Sui Y., Nabekura J., Sato K., Okajima F., Takebayashi H., Okano H., Koizumi S. 2017. Reactive astrocytes function as phagocytes after brain ischemia via ABCA1-mediated pathway. Nat. Commun. V. 8. P. 28. https://doi.org/10.1038/s41467-017-00037-1
Nishimura R.N., Santos D., Fu S.T., Dwyer B.E. 2000. Induction of cell death by L-alpha-aminoadipic acid exposure in cultured rat astrocytes: relationship to protein synthesis. Neurotoxicology. V. 21. P. 313.
O’Neill E., Chiara Goisis R., Haverty R., Harkin A. 2019. L-alpha-aminoadipic acid restricts dopaminergic neurodegeneration and motor deficits in an inflammatory model of Parkinson’s disease in male rats. J. Neurosci. Res. V. 97. P. 804.
Olney J.W., de Gubareff T., Collins J.F. 1980. Stereospecificity of the gliotoxic and anti-neurotoxic actions of alpha-aminoadipate. Neurosci. Lett. V. 19. P. 277.
Pekny M., Pekna M. 2016. Reactive gliosis in the pathogenesis of CNS diseases. Biochim. Biophys. Acta. V. 1862. P. 483.
Pow D.V. 2001. Visualising the activity of the cystine-glutamate antiporter in glial cells using antibodies to aminoadipic acid, a selectively transported substrate. Glia. V. 34. P. 27.
Qin A.P., Liu C.F., Qin Y.Y., Hong L.Z., Xu M., Yang L., Liu J., Qin Z.H., Zhang H.L. 2010. Autophagy was activated in injured astrocytes and mildly decreased cell survival following glucose and oxygen deprivation and focal cerebral ischemia. Autophagy. V. 6. P. 738.
Saffran B.N, Crutcher K.A. 1987. Putative gliotoxin, α-aminoadipic acid, fails to kill hippocampal astrocytes in vivo. Neurosci. Lett. V. 81. P. 215.
Śmiałowska M, Szewczyk B, Woźniak M, Wawrzak-Wleciał A, Domin H. 2013. Glial degeneration as a model of depression. Pharmacol. Reports. V. 65. P. 1572.
Sofroniew M.V. 2009. Molecular dissection of reactive astrogliosis and glial scar formation. Trends Neurosci. V. 32. P. 638. https://doi.org/10.1016/j.tins.2009.08.002
Takeda M., Takamiya A., Jiao J.W., Cho K.S., Trevino S.G., Matsuda T., Chen D.F. 2008. Alpha-aminoadipate induces progenitor cell properties of müller glia in adult mice. Investig. Opthalmology Vis. Sci. V. 49. P. 1142. https://doi.org/10.1167/iovs.07-0434
Tang G., Yue Z., Talloczy Z., Goldman J.E. 2008. Adaptive autophagy in Alexander disease-affected astrocytes. Autophagy. V. 4. P. 701.
Verkhratsky A., Nedergaard M. Physiology of astroglia. 2018. Physiol. Rev. V. 98. P. 239.
Wang J.-L., Xu C.-J. 2020. Astrocytes autophagy in aging and neurodegenerative disorders. Biomed. Pharmacother. V. 122. P. 109691. https://doi.org/10.2147/DDDT.S105362
Wang T.J., Ngo D., Psychogios N., Dejam A., Larson M.G., Vasan R.S., Ghorbani A., O’Sullivan J., Cheng S., Rhee E.P., Sinha S., McCabe E., Fox C.S., O’Donnell C.J., Ho J.E. et al., 2013. 2-Aminoadipic acid is a biomarker for diabetes risk. J. Clin. Invest. V. 123. P. 4309.
Wang X., Su J., Ding J. et al. 2016. α-Aminoadipic acid protects against retinal disruption through attenuating Muller cell gliosis in a rat model of acute ocular hypertension. Drug Des. Devel. Ther. V. 10. P. 3449.
Watmuff B., Berkovitch S.S., Huang J.H., Iaconelli J., Toffel S., Karmacharya R. 2016. Disease signatures for schizophrenia and bipolar disorder using patient-derived induced pluripotent stem cells. Mol. Cell Neurosci. V. 73. P. 96.
West E.L., Pearson R.A., Tschernutter M., Sowden J.C., MacLaren R.E., Ali R.R. 2008. Pharmacological disruption of the outer limiting membrane leads to increased retinal integration of transplanted photoreceptor precursors. Exp. Eye Res. V. 86. P. 601.
Дополнительные материалы отсутствуют.


