Цитология, 2021, T. 63, № 3, стр. 244-255
Определение активности цитостатиков в 3D-условиях культивирования в сравнении с монослойной культурой
Е. В. Кудан 1, *, С. П. Кудан 2, С. Ш. Каршиева 1, 3, Ю. Д. Хесуани 1, В. А. Миронов 1, 4, Е. А. Буланова 1
1 Лаборатория биотехнологических исследований “3Д Биопринтинг Солюшенс”
115409 Москва, Россия
2 Школа №1568 им. Пабло Неруды
127221 Москва, Россия
3 Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина Минздрава России
115478 Москва, Россия
4 Первый Московский государственный медицинский университет им. И.М. Сеченова Минздрава России
(Сеченовский университет)
119991 Москва, Россия
* E-mail: koudan1980@gmail.com
Поступила в редакцию 28.12.2020
После доработки 19.01.2021
Принята к публикации 21.01.2021
Аннотация
Селективный скрининг лекарственных средств с использованием моделей in vitro на основе монослойных 2D-культур широко используется в фармакологии, однако впоследствии полученные данные не всегда хорошо коррелируют с результатами клинических исследований. В связи с этим всe большее распространение получают 3D-модели, отражающие все виды межклеточных взаимодействий и взаимодействие клеток с внеклеточным матриксом, позволяющие адекватнее моделировать специфическую архитектуру ткани. Одной из таких моделей являются трехмерные сфероиды. В настоящей работе проведена оценка антипролиферативной и цитотоксической активности препаратов цисплатина, доксорубицина, фторурацила и этопозида на клеточных линиях Vero CCL-81 и HEK293 в условиях 2D- (монослойная культура) и 3D-культивирования (сфероиды). Сравнительный анализ антипролиферативной (IC50) и цитотоксической (CC50) активности цитостатиков для этих двух методов культивирования показал, что антипролиферативная активность была выше в условиях 2D-, в то время как цитотоксичность эффективнее выявлялась в условиях 3D-культивирования. Пониженная антипролиферативная активность препаратов в 3D-условиях может быть объяснена большей устойчивостью клеток к действию агентов благодаря физиологическим условиям культивирования. При этом более выраженное проявление цитотоксических эффектов в условиях 3D по сравнению с 2D позволяет предположить, что использование сфероидов будет способствовать выявлению ранней токсичности на стадии доклинических исследований in vitro. Наши данные показали, что при тестировании лекарственных средств необходимо учитывать тип клеток, скорость их пролиферации, а в случае сфероидов дополнительно подбирать их оптимальный диаметр для клеток каждого типа.
Многие перспективные кандидаты на лекарственные средства отсеиваются на стадии клинических исследований из-за несовершенства существующих тест-систем доклинического скрининга in v-itro, использующих исключительно монослойные культуры (Brajša et al., 2016a; Fang, Eglen, 2017). При культивировании в 2D-условиях клетки вынуждены адаптироваться к плоской поверхности, приобретая уплощенную распластанную форму, нехарактерную для клеток в живом организме. Кроме того, в монослойной культуре отсутствует большая часть видов межклеточных контактов и контактов клеток с внеклеточным матриксом. Это приводит к нарушению клеточного метаболизма, кинетики клеточного цикла и влияет на функциональность клеток. Например, гепатоциты, культивируемые в монослое, теряют признаки биохимической специализации за один цикл репликации, при этом в составе сфероидов остаются в дифференцированном состоянии длительное время (Thomas et al., 2005; Jasmund et al., 2007). В настоящее время появляется все больше исследований, посвященных созданию трехмерных моделей, более точно отражающих архитектуру тканей и органов (Pampaloni et al., 2007; Baker, Chen, 2012; Bissell, 2017).
Среди 3D-структур можно выделить два основных типа: 1) трехмерные структуры на основе каркасов из биополимеров (коллагена, матригеля, фибрина и т.п.), содержащие внутри клетки; 2) сфероиды, представляющие собой шарообразные агрегаты, сформированные одним или несколькими типами клеток (Langhans, 2018). В последнее время стремительно развиваются методики получения органоидов, представляющих собой микроструктуры, спонтанно образуемые при культивировании в слое гидрогеля кусочков тканей, эмбриональных стволовых клеток или индуцированных плюрипотентных стволовых клеток (Lancaster, Knoblich, 2014; Fatehullah et al., 2016).
Обсуждая возможность использования 3D-структур в качестве моделей для доклинического скрининга, следует помнить о ряде требований, предъявляемых к in vitro моделям. Они должны быть относительно недорогими, простыми, хорошо воспроизводимыми, т.е. стандартизованными; их создание не должно занимать много времени. С этой точки зрения очевидно, что сфероиды являются наиболее перспективными 3D-структурами для создания in vitro моделей. Использование трехмерных каркасов из биополимеров не позволяет унифицировать и масштабировать процесс производства 3D-структур, а также не подразумевает автоматическую количественную оценку образцов.
Формирование органоидов является очень длительным и дорогостоящим процессом и не может быть использовано на начальных стадиях доклинического скрининга. В противоположность этому формирование сфероидов в большинстве случаев занимает 24 ч и происходит в многолуночных культуральных планшетах, совместимых с любыми автоматическими системами дозирования, визуализации и анализа (Monjaret et al., 2016; Eke et al., 2016). Варьирование первоначального количества клеток в сфероиде позволяет влиять на диаметр сфероида и скорость пролиферации клеток внутри сфероида (Koudan et al., 2020). Известно, что расстояние, на которое возможно проникновение кислорода и питательных веществ, составляет 100–150 мкм (Kinney et al., 2014). Это означает, что для эффективного проникновения лекарственных препаратов и красителей в сфероид, а также отсутствия некроза в центре сфероида, его диаметр не должен превышать 200–250 мкм. Также не менее важным параметром является скорость пролиферации клеток в сфероиде. Особенно это важно при тестировании цитостатиков, действие которых основано на подавлении пролиферации клеток.
Известно, что не все типы клеток пролиферируют внутри сфероидов (Koudan et al., 2020). Для настоящей работы были выбраны клеточные линии Vero CCL-81 и HEK293, сохраняющие способность к пролиферации в условиях 3D-культивирования. В работе исследована антипролиферативная и цитотоксическая активность цисплатина, доксорубицина, фторурацила и этопозида на монослойной культуре и в сфероидах, сформированных из клеточных линий Vero CCL-81 и HEK293. Сравнительный анализ активности цитостатиков в условиях 2D и 3D показал, что сфероиды оптимального диаметра, состоящие из пролиферирующих клеток, могут являться отличным дополнением к существующим 2D-моделям для тестирования лекарственных средств in vitro.
МАТЕРИАЛ И МЕТОДИКА
Формирование сфероидов. В работе использовали клетки линий HEK293 и Vero CCL-81 (из коллекции ATCC). Клетки культивировали в среде DMEM (Gibco, США), содержащей 2 мМ L-глутамина (Панэко, Россия) и 1-кратный раствор антибиотика-антимикотика (Gibco, США) с добавлением 10% (v/v) фетальной бычьей сыворотки (Gibco, США) при 37°C и 5% CO2. Для снятия клеток с подложки использовали раствор Версена (Панэко, Россия) и 0.25% раствор трипсина−ЭДТА (Gibco, США).
Сфероиды получали с помощью агарозных форм и с помощью 96-луночных планшетов с низкоадгезивным покрытием. Оба метода используют один и тот же принцип формирования сфероидов, а именно: в условиях неадгезивной поверхности клетки не прикрепляются и не распластываются на субстрате, а взаимодействуют друг с другом, устанавливая межклеточные контакты и образуя сфероиды.
Формирование сфероидов с помощью агарозных форм проводили с использованием микро-молдов для создания агарозных форм (Microtissues, США) согласно протоколу производителя. Готовили 2%-ный раствор агарозы (Хеликон, Россия) в фосфатно-солевом буферном растворе (Gibco, США). Вносили в микро-молды для создания агарозных форм по 450 мкл расплавленной агарозы. После застывания агарозы (~4 мин) переворачивали микро-молды и извлекали образовавшиеся агарозные формы. Готовили суспензию клеток в культуральной среде с концентрацией 337 000 кл./мл. В каждую агарозную форму, содержащую 256 ячеек, вносили по 190 мкл суспензии. Таким образом, итоговая концентрация составляла 250 клеток на ячейку или 250 клеток на сфероид. Агарозные формы с клетками помещали в ячейки 12-луночных планшетов, содержащие культуральную среду, и инкубировали при 37°C и 5% CO2 в течение 24 ч для формирования сфероидов.
Для формирования сфероидов с помощью 96-луночных планшетов с низкоадгезивным покрытием использовали планшеты фирмы Corning (США). Готовили суспензию клеток в культуральной среде с концентрацией 2500 кл./мл. В каждую ячейку планшета вносили по 100 мкл суспензии. Для формирования сфероидов планшеты инкубировали при 37°C и 5% CO2 в течение 24 ч.
Изучение кинетики роста сфероидов. Для формирования сфероидов нами был использован метод их получения при помощи агарозных форм, так как он позволяет получить большее количество статистических данных для анализа по сравнению с методом формирования в планшетах. Сфероиды получали с помощью агарозных форм согласно процедуре, описанной выше. Для формирования сфероидов использовали следующие концентрации клеток: 2000, 1000, 500 и 250 клеток на сфероид. Для изучения кинетики роста тканевых сфероидов проводили оценку их диаметров на протяжении 7 сут. Для этого фотографировали сфероиды во временных точках 1, 2, 3, 4 и 7 сут с помощью инвертированного микроскопа Nikon Eclipse Ti-S (Nikon, Япония).
Оценка жизнеспособности клеток с помощью тест-системы CellTiter-Glo 3D и путем измерения диаметров сфероидов. С помощью 96-луночных планшетов с низкоадгезивным покрытием сформировали сфероиды с первоначальной концентрацией 250 клеток на 1 сфероид. Для формирования монослоя с такой же концентрацией клеток в каждую ячейку 96-луночных культуральных планшетов с плоским дном посадили по 250 клеток. Через 24 ч к клеткам в монослое и к сфероидам добавили препараты в тестируемых концентрациях (10–3–10–8 М для цисплатина, доксорубицина и этопозида (Эбеве Фарма, Австрия) и 10–2–10–7 М для фторурацила (Тева, Нидерланды), шаг разбавления 3.16) и культивировали в течение 72 ч. Через 72 ч фотографировали сфероиды с помощью инвертированного микроскопа Nikon Eclipse Ti-S (Nikon, Япония) для последующего расчета диаметров сфероидов, после чего в каждую лунку планшетов добавляли CellTiter-Glo 3D (Promega, США) в соотношении 1 : 1 по объему и инкубировали на протяжении 30 мин (для клеток) или 90 мин (для сфероидов).
Тест-система CellTiter-Glo 3D включает в себя белок-люциферазу, его субстрат люциферин и лизирующий буфер. В присутствии клеточного АТФ люцифераза катализирует окисление люциферина в возбужденный оксилюциферин. Переход оксилюциферина из возбужденного состояния в основное сопровождается испусканием люминесценции, интенсивность которой прямо пропорциональна количеству молекул клеточного АТФ в растворе, то есть количеству живых метаболически активных клеток. Люминесценцию оксилюциферина измеряли с помощью мультифункционального ридера Victor X3 (Perkin Elmer, США), далее абсолютные значения люминесценции нормализовали следующим образом: cигнал люминесценции клеток или сфероидов, необработанных цитостатиками, принимали за 100% жизнеспособности. Относительную жизнеспособность рассчитывали как процентное отношение сигналов люминесценции обработанных и необработанных цитостатиками клеток или сфероидов. Для каждого цитостатика рассчитывали IC50 – концентрацию, при которой относительная жизнеспособность равна 50%.
Объем сфероидов пропорционален количеству живых клеток в сфероиде и может служить показателем жизнеспособности сфероидов. Расчет диаметров сфероидов проводили в программе ImageJ 1.48v software (NIH, Bethesda, MD). Объем сфероидов (V, мкм3) рассчитывали по формуле: V = 1/6πd3, где d – диаметр сфероидов. При нормализации за 100% принимали объем сфероидов, необработанных цитостатиками. Относительный объем сфероидов рассчитывали как процентное отношение объемов обработанных и необработанных цитостатиками сфероидов. Для каждого цитостатика рассчитывали IC50 – концентрацию, при которой относительный объем сфероидов равен 50%.
Оценка жизнеспособности клеток с помощью резазурина. С помощью агарозных форм, содержащих 256 углублений и помещенных в ячейки 12-луночных планшетов (по 1 форме в каждую ячейку), формировали сфероиды с первоначальной концентрацией 250 клеток на 1 фероид. Для формирования монослоя с такой же концентрацией клеток в каждую ячейку 12-луночных планшетов рассевали по 64 000 клеток (256 × 250 клеток). Через 24 ч к клеткам в монослое и к сфероидам добавляли препараты в тестируемых концентрациях и культивировали в течение 72 ч.
Для оценки жизнеспособности клеток использовали натриевую соль резазурина (Sigma, США). Резазурин представляет собой нетоксичный краситель, который восстанавливается за счет аэробного дыхания метаболически активных клеток до флуоресцирующего резоруфина, интенсивность флуоресценции которого прямо пропорциональна количеству живых клеток. Во все лунки добавляли 0.02%-ный раствор натриевой соли резазурина в питательной среде в соотношении 1:10 по объему и инкубировали на протяжении 6 ч (для клеток) или 18 ч (для сфероидов). Интенсивность флуоресценции резоруфина измеряли с помощью мультифункционального ридера Victor X3 (Perkin Elmer, США), длина волны возбуждения составляла 555 нм, длина волны испускания составляла 580 нм, далее абсолютные значения флуоресценции нормализовали следующим образом: сигнал флуоресценции клеток или сфероидов, необработанных цитостатиками, принимали за 100% жизнеспособности. Относительную жизнеспособность рассчитывали как процентное отношение сигналов флуоресценции обработанных и необработанных цитостатиками клеток или сфероидов. Для каждого цитостатика рассчитывали значение IC50.
Оценка цитотоксичности тестируемых препаратов. С помощью 96-луночных планшетов с низкоадгезивным покрытием формировали сфероиды с первоначальной концентрацией 250 клеток на сфероид. Для формирования монослоя с такой же концентрацией клеток в каждую ячейку 96-луночных культуральных планшетов с плоским дном рассеивали по 250 клеток. При формировании сфероидов и монослоя в клеточные суспензии добавляли реагент CellTox Green (Promega, США) в соотношении 1 : 500 по объему. CellTox Green содержит краситель, который проникает в мертвые клетки через поврежденную мембрану и связывается с ДНК, что вызывает разгорание флуоресценции, интенсивность которой пропорциональна количеству мeртвых клеток. Через 24 ч к клеткам в монослое и к сфероидам, содержащим реагент CellTox Green, добавляли один из препаратов в тестируемой концентрации (см. выше) и культивировали в течение 72 ч. Через 72 ч фотографировали сфероиды с помощью инвертированного флуоресцентного микроскопа Nikon Eclipse Ti-S (Nikon, Япония). Интенсивность флуоресценции измеряли с помощью мультифункционального ридера Victor X3 (Perkin Elmer, США), длина волны возбуждения составляла 485 нм, длина волны испускания составляла 535 нм. Для цитостатиков рассчитывали СC50 – концентрацию, при которой выполнялось равенство: (Ft – Fmin)/(Fmax – Fmin) × 100% = = 50%, где Ft – сигнал флуоресценции для тестируемой концентрации, Fmin – минимальный сигнал флуоресценции, соответствующий сигналу для клеток или сфероидов, необработанных цитостатиками, Fmax – максимальный сигнал флуоресценции, соответствующий сигналу для клеток или сфероидов, обработанных лизирующим буфером, вызывающим 100%-ную гибель клеток или сфероидов.
Анализ данных. Обработку экспериментальных данных и статистический анализ проводили в программе GraphPad Prism 5 (GraphPad Software). Все исследуемые концентрации препаратов тестировали в квадруплетах. Рассчитывали значения концентраций IC50 и CC50 методом нелинейной регрессии с использованием трехпараметрической модели доза–эффект. Все эксперименты проводили в четырех независимых повторах. В качестве описательных статистик в работе приведены среднее арифметическое и стандартное отклонение (SD). Для сравнения количественных признаков в группах применяли критерий Манна–Уитни. Достоверным уровнем отличий считали вероятность не менее 95% (р < 0.05).
РЕЗУЛЬТАТЫ
Кинетика роста сфероидов. С помощью агарозных форм были сформировны сфероиды из клеточных линий HEK293 и Vero CCL-81, используя различные первоначальные концентрации клеток: 250, 500, 1000 и 2000 клеток на 1 сфероид. Через 24 ч для обеих линий для всех концентраций клеток наблюдали образование сфероидов округлой формы с четкими краями и едиными размерами в пределах одной концентрации. В течение первых суток зависимость объёма сфероидов (значения которого оценивали, измеряя его диаметр) от первоначальной концентрации клеток была линейной (рис. 1).
Рис. 1.
Фазово-контрастные изображения сфероидов из клеток Vero CCL-81 (а) и HEK293 (в) и зависимость их объeма V (б, г) от концентрации клеток через 1 сут после внесения клеточной суспензии в агарозные формы. Показаны средние значения и их стандартные отклонения (n = 512).

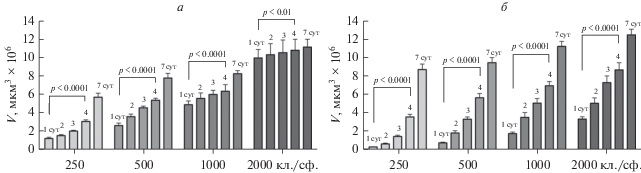
Конечной целью действия всех цитостатиков является ингибирование пролиферации клеток. В связи с этим, для использования сфероидов в качестве адекватной 3D-модели in vitro важно подобрать концентрацию клеток, при которой будет наблюдаться пролиферация клеток в сфероидах. С этой целью мы изучили кинетику роста сфероидов, сформированных из клеточных линий HEK293 и Vero CCL-81, в зависимости от первоначальных концентраций клеток. Полученные результаты представлены на рис. 2. Для обеих клеточных линий наблюдается обратная зависимость скорости роста объема сфероида от первоначальной концентрации клеток. Максимальная скорость роста наблюдается для наименьшей концентрации, составляющей 250 клеток на 1 сфероид. Проведено сравнение объемов сфероидов на 4-е и 1-е сут культивирования, поскольку цитостатики добавляли к 1-суточным сфероидам и культивировали в течение 72 ч. Показано, что различия между значениями объемов являются статистически достоверными для всех концентраций обеих клеточных линий. На основе полученных данных для дальнейших экспериментов была выбрана первоначальная концентрация 250 клеток на сфероид.
Рис. 2.
Кинетика роста объема сфероидов (V), сформированных из Vero CCL-81 (а) и HEK293 (б). По горизонтали показано число клеток в 1 сфероиде (кл./сф.), показаны средние значения и стандартные отклонения (n = 512). Для сравнения величин V в группах (1-е и 4-е сут) применяли критерий Манна–Уитни.
Влияние цитостатиков на пролиферацию клеток. Существует большое количество реагентов, позволяющих оценить жизнеспособность клеток или сфероидов. Однако ни один из них не является идеальным. Поэтому для оценки влияния цитостатиков на пролиферацию клеток мы использовали три разных метода: с помощью тест-системы CellTiter-Glo 3D, с помощью натриевой соли резазурина, а также на основе измерения диаметров сфероидов.
Тест-система CellTiter-Glo 3D основана на измерении количества молекул клеточного АТФ в АТФ-зависимой люциферазной реакции. Окисление люциферина люциферазой в присутствии клеточного АТФ приводит к образованию оксилюциферина. Реакция сопровождается люминесценцией, сигнал которой пропорционален количеству живых метаболически активных клеток. Кривые зависимости относительной жизнеспособности клеток от концентрации тестируемых препаратов представлены на рис. 3. Рассчитанные из кривых значения IC50 приведены в таб. 1.
Рис. 3.
Кривые зависимости относительной жизнеспособности Vero CCL-81 (верхний ряд) и HEK293 (нижний ряд) от концентрации цитостатиков, полученные с помощью тест-системы CellTiter-Glo 3D. Штриховая кривая (кружки) – клетки, сплошная (треугольники) – сфероиды. Показаны средние значения и их стандартные отклонения (n = 4). Для всех случаев, кроме цисплатина и фторурацила для HEK293, различия между значениями IC50 для клеток и сфероидов достоверны (р < 0.05, критерий Манна–Уитни).
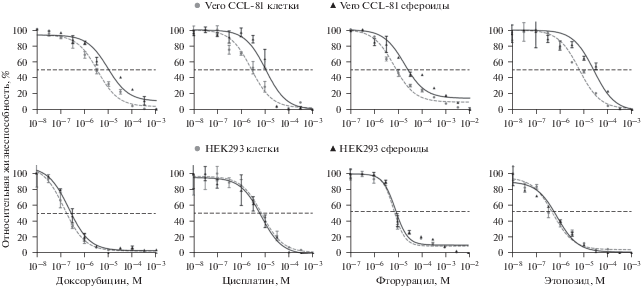
Сравнение полученных значений IC50 показало, что в случае Vero CCL-81 антипролиферативная активность препаратов для монослоя клеток выше, чем для сфероидов. В случае HEK293 доксорубицин и этопозид демонстрируют незначительное снижение активности при тестировании на сфероидах, в то время как для цисплатина и фторурацила не наблюдается заметной разницы в активности между 2D- и 3D-вариантами.
Резазурин – кислотно-основной индикатор синего цвета, который в присутствии метаболически активных клеток необратимо восстанавливается до розового флуоресцирующего резоруфина. Наблюдаемый флуоресцентный сигнал прямо пропорционален количеству живых клеток. Кривые зависимости относительной жизнеспособности клеток от концентрации тестируемых препаратов представлены на рис. 4. Рассчитанные из кривых значения IC50 приведены в табл. 1.
Рис. 4.
Кривые зависимости относительной жизнеспособности Vero CCL-81 (верхний ряд) и HEK293 (нижний ряд) от концентрации цитостатиков, полученные с помощью резазурина. Штриховая кривая (кружки) – клетки, сплошная (треугольники) – сфероиды. Показаны средние значения и их стандартные отклонения, n = 4. Для всех случаев различия между значениями IC50 для клеток и сфероидов достоверны (р < 0.05, критерий Манна–Уитни).
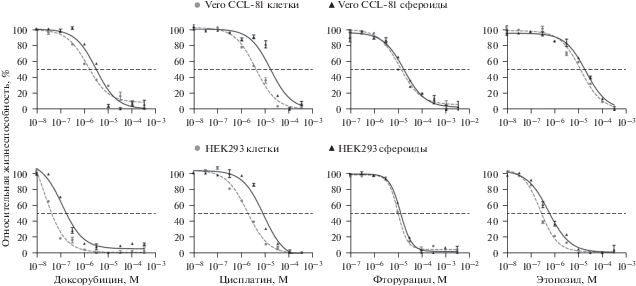
Таблица 1.
Антипролиферативная активность препаратов (IC50) для клеток Vero CCL-81 и HEK293 в монослое и в составе сфероидов. Оценка с помощью трех тестов
| Оценка с помощью тест-системы CellTiter-Glo 3D; IC50, мкМ (М ± SD) | ||||
|---|---|---|---|---|
| Соединение | Vero CCL-81 | HEK293 | ||
| клетки | сфероиды | клетки | сфероиды | |
| Доксорубицин | 3.5 ± 0.3 | 9.3 ± 1.9 | 0.15 ± 0.02 | 0.23 ± 0.03 |
| Цисплатин | 2.7 ± 0.3 | 11.0 ± 0.8 | 7.5 ± 1.8 | 6.9 ± 2.2 |
| Фторурацил | 6.7 ± 0.9 | 18.0 ± 4.0 | 7.0 ± 0.7 | 8.1 ± 0.8 |
| Этопозид | 6.4 ± 0.5 | 26.1 ± 3.5 | 0.49 ± 0.1 | 0.73 ± 0.08 |
| Оценка с помощью резазурина; IC50, мкМ (М ± SD) | ||||
| Соединение | Vero CCL-81 | HEK293 | ||
| клетки | сфероиды | клетки | сфероиды | |
| Доксорубицин | 1.4 ± 0.3 | 3.1 ± 0.2 | 0.02 ± 0.01 | 0.12 ± 0.02 |
| Цисплатин | 3.8 ± 0.3 | 15.9 ± 1.3 | 1.7 ± 0.2 | 8.1 ± 0.3 |
| Фторурацил | 11.9 ± 1.5 | 17.9 ± 1.9 | 10.4 ± 0.4 | 13.5 ± 0.5 |
| Этопозид | 12.5 ± 1.0 | 20.4 ± 1.3 | 0.24 ± 0.03 | 0.55 ± 0.05 |
| Оценка путем измерения диаметров сфероидов; IC50, мкМ (М ± SD) | ||||
| Соединение | Vero CCL-81 | HEK293 | ||
| клетки | сфероиды | клетки | сфероиды | |
| Доксорубицин | − | 9.3 ± 1.4 | − | 0.27 ± 0.04 |
| Цисплатин | − | 10.4 ± 1.5 | − | 5.5 ± 1.3 |
| Фторурацил | − | 7.3 ± 0.8 | − | 5.8 ± 0.4 |
| Этопозид | − | 12.9 ± 4.5 | − | 0.35 ± 0.06 |
При оценке антипролиферативной активности с помощью резазурина для обеих клеточных линий наблюдается снижение активности всех препаратов в условиях 3D-культивирования по сравнению с 2D. При этом наиболее заметные различия значений IC50 получены для цисплатина.
Анализ сфероидов по многим параметрам является технически более сложной задачей, чем анализ монослоя клеток. Однако некоторые виды исследований для сфероидов могут быть проведены даже проще, чем для монослоя клеток, благодаря их форме. Так, оценить пролиферацию клеток в сфероидах можно и без использования каких-либо реагентов и красителей. Для этого достаточно измерить диаметры сфероидов при разных концентрациях тестируемых препаратов. На основе диаметров можно рассчитать объемы сфероидов, которые прямо пропорциональны количеству живых клеток в сфероиде. Кривые зависимости относительного объема сфероидов от концентрации тестируемых препаратов представлены на рис. 5. Рассчитанные из кривых значения IC50 приведены в табл. 1.
Рис. 5.
Кривые зависимости относительного объeма сфероидов из Vero CCL-81 и HEK293 от концентрации цитостатика. Штриховая кривая (кружки) – Vero CCL-81, сплошная (треугольники) – HEK293. Показаны средние значения и их стандартные отклонения (n = 4). Для всех случаев, кроме фторурацила, различия между значениями IC50 для сфероидов из Vero CCL-81 и HEK293 достоверны (р < 0.05, критерий Манна–Уитни).
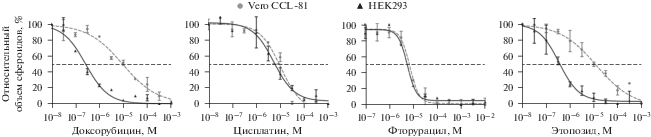
Сравнение полученных значений IC50 показало, что фторурацил демонстрирует одинаковую антипролиферативную активность на обеих клеточных линиях, цисплатин чуть более активен в отношении клеток HEK293, а доксорубицин и этопозид гораздо более активны в отношении HEK293, чем Vero CCL-81.
Цитотоксичность цитостатиков. Для оценки цитотоксичности цитостатиков использовали реагент CellTox Green, действие которого основано на изменении целостности мембраны клеток вследствие клеточной смерти. CellTox Green содержит краситель, не способный проникнуть в живые клетки, но свободно проникающий в мертвые клетки через поврежденную мембрану. При связывании красителя с ДНК мертвой клетки наблюдается разгорание флуоресценции. Наблюдаемый флуоресцентный сигнал прямо пропорционален количеству мертвых клеток. Полученные результаты представлены в табл. 2 и на рис. 6.
Таблица 2.
Цитотоксическая активность препаратов (CC50) для клеток Vero CCL-81 и HEK293 в монослое и в составе сфероидов
| Соединение | CC50, мкМ (М ± SD) | |||
|---|---|---|---|---|
| Vero CCL-81 | HEK293 | |||
| клетки | сфероиды | клетки | сфероиды | |
| Доксорубицин | 18 ± 4 | 17 ± 3 | 24 ± 7 | 25 ± 6 |
| Цисплатин | >100 | 60 ± 8 | >100 | >100 |
| Фторурацил | >1000 | >1000 | >1000 | >1000 |
| Этопозид | 620 ± 70 | 300 ± 60 | >1000 | 97 ± 15 |
Рис. 6.
Фазово-контрастные и флуоресцентные изображения клеточных сфероидов из Vero CCL-81 (а) и HEK293 (б), обработанных цитостатиками и окрашенных с помощью CellTox Green.
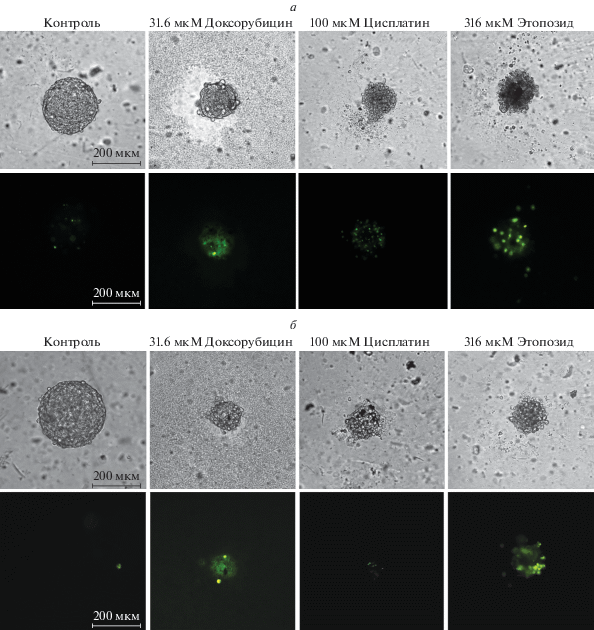
Как видно из табл. 2 , фторурацил не токсичен на обеих клеточных линиях как в 2D, так и в 3D. Цисплатин нетоксичен на HEK293 и клетках Vero CCL-81 и слаботоксичен на сфероидах из Vero CCL-81. Этопозид проявляет незначительную токсичность при высоких концентрациях. Доксорубицин проявляет заметную токсичность, причем значение CC50 (~20 мкМ) приблизительно одинаково для обеих клеточных линий и обоих способов культивирования. На рис. 6 приведены изображения сфероидов, обработанных препаратами в концентрациях, близких к CC50, мертвые клетки окрашены с помощью CellToxGreen.
ОБСУЖДЕНИЕ
Сфероиды привлекают широкое внимание исследователей в качестве моделей in vitro для скрининга лекарственных препаратов. Несмотря на значительный прогресс, достигнутый в области биофабрикации, визуализации и анализа трехмерных структур, работа со сфероидами все еще вызывает определенные сложности по сравнению с работой на монослойной культуре клеток.
В настоящей статье описана процедура формирования и последующего анализа сфероидов с помощью двух различных методов. Показано, что наряду с использованием достаточно дорогих 96-луночных планшетов с низкоадгезивным покрытием и коммерческого реагента CellTiter-Glo, возможно удешевление процесса за счет формирования сфероидов с помощью агарозных форм и их анализа посредством натриевой соли резазурина. Полученные значения IC50 для цитостатиков близки по значениям, что свидетельствует о сравнимой предиктивности обоих методов.
Для скрининга большого количества химических соединений мы рекомендуем формировать сфероиды с помощью коммерческих 96-луночных или 384-луночных планшетов с низкоадгезивным покрытием, так как планшеты хорошо совместимы с роботическим оборудованием, обеспечивают образование сфероидов единого стандартного диаметра, позволяют оперировать маленькими объемами реагентов и красителей. Единственным минусом метода является высокая стоимость планшетов. Формирование сфероидов с помощью агарозных форм целесообразно проводить в тех случаях, когда последующий анализ предполагает использование низко чувствительных реагентов или требуется большое количество статистических данных. Одна агарозная форма позволяет сформировать 256 сфероидов, поэтому тестирование каждой концентрации препарата на одной агарозной форме в 256 раз увеличивает порог чувствительности анализа. Дополнительным преимуществом данного метода является его низкая стоимость. Однако метод не совместим с роботическими системами дозирования.
При формировании сфероидов особое внимание следует уделять первоначальному числу клеток в сфероиде, т.к. оно задает скорость пролиферации клеток и, соответственно, финальный диаметр и объем сфероидов. В сфероидах большого диаметра (больше 250 мкм) развивается некроз, поскольку кислород и питательные вещества не достигают центра сфероида. Соответственно при тестировании цитотоксической активности лекарственных препаратов невозможно отделить гибель клеток под действием препарата от гибели клеток вследствие некроза. Кроме того, сами лекарственные вещества и красители также могут не доходить до центра сфероида, что неизбежно повлияет на результаты эксперимента. Учитывая вышесказанное, очевидно, что использование сфероидов маленького диаметра более предпочтительно. В настоящей работе проведена оценка кинетики роста сфероидов в зависимости от первоначальной концентрации клеток и подобрана оптимальная концентрация, обеспечивающая формирование на 4-е сут сфероидов с диаметром, не превышающим 250 мкм (V ≤ 8.2 × 106 мкм3).
Сравнение значений IC50 и CC50, полученных для Vero CCL-81 и HEK293, независимо от методов культивирования, демонстрирует различную активность цитостатиков на этих двух клеточных линиях (табл. 1, 2 ). Доксорубицин и этопозид значительно более эффективно тормозят пролиферацию HEK293, чем Vero CCL-81, при этом цитотоксический эффект на обеих клеточных линиях одинаков для всех препаратов. Учитывая, что обе клеточные линии представляют собой почечный эпителий, такой результат может объясняться тем, что антипролиферативная активность препаратов напрямую зависит от скорости пролиферации клеток, которая в случае HEK293 в 4 раза выше, чем в случае Vero CCL-81. Полученные нами данные хорошо согласуются с результатами работы, в которой установлено, что один и тот же препарат может проявлять разную активность в зависимости от выбранной для теста клеточной линии (Brajša et al., 2016b), что еще раз подтверждает необходимость обращать внимание на тип клеток при тестировании препаратов.
Сравнительный анализ активности препаратов на монослое клеток и на сфероидах показал, что в большинстве случаев антипролиферативный эффект цитостатиков более выражен в 2D-условиях (табл. 1), при этом их цитотоксическая активность ярче проявляется в 3D (табл. 2 ). Наши данные по антипролиферативной активности цитостатиков в монослое клеток хорошо согласуются с результатами работ, в которых оценивали активность тех же препаратов в 2D-условиях на тех же клеточных линиях (Quispe-Mauricio et al., 2009; Hall et al., 2011; Li et al., 2011; Sangmalee et al., 2016; Gupta et al., 2019; Valsalam et al., 2019; Wu et al., 2020). Более высокая активность цитостатиков в условиях 2D по сравнению с 3D может быть связана с более высокой доступностью клеток в монослое для тестируемых веществ.
Таким образом, нами проведена оценка антипролиферативной и цитотоксической активности четырех цитостатиков на клетках Vero CCL-81 и HEK293 в условиях 2D- и 3D-культивирования. Согласно нашим данным, цитостатики проявляли в 3D-условиях такую же или меньшую антипролиферативную активность по сравнению с 2D-условиями, но были более токсичны. Можно предположить, что использование 3D-культур при разработке новых лекарственных средств позволит выявить потенциальную токсичность препарата на ранних стадиях доклинических исследований. Полученные нами данные показывают, что сфероиды могут быть использованы для оценки эффективности лекарственных препаратов in vitro, как более точно отражающие архитектуру ткани и обеспечивающие более физиологичное окружение для клеток. Нами предложены два возможных алгоритма формирования и анализа сфероидов, один из которых является дорогим, чувствительным, быстрым и совместимым с роботическим оборудованием на всех стадиях процесса, другой – более дешевый, позволяющий получить большое количество статистических данных, но менее чувствительный, не роботизируемый и более медленный на стадии анализа. Для получения адекватных данных об активности химических соединений всегда следует учитывать восприимчивость клеточной культуры, скорость пролиферации клеток, а в случае сфероидов дополнительно подбирать оптимальный диаметр для каждой используемой клеточной линии, чтобы гарантировать отсутствие некроза и полное проникновение тестируемых веществ. Развитие методов формирования и анализа сфероидов в совокупности с развитием персонализированного подхода может вывести доклинические исследования, а также подбор эффективных доз препарата при клиническом применении на качественно новый уровень. При выборе таргетной терапии для конкретного пациента наилучшую предиктивную способность будут иметь сфероиды, сформированные из аутологичных клеток.
Список литературы
Baker B.M., Chen C.S. 2012. Deconstructing the third dimension – how 3D culture microenvironments alter cellular cues. J. Cell Sci. V. 125. P. 3015.
Bissell M.J. 2017. Goodbye flat biology – time for the 3rd and the 4th dimensions. J. Cell Sci. V. 130. P. 3.
Brajša K., Trzun M., Zlatar I., Jelić D. 2016a. Three-dimensional cell cultures as a new tool in drug discovery. Period. boil. V. 118. P. 59.
Brajša K., Vujasinović I., Jelić D., Trzun M., Zlatar I., Karminski-Zamola G., Hranjec M. 2016b. Antitumor activity of amidino-substituted benzimidazole and benzimidazo[1,2-a]quinoline derivatives tested in 2D and 3D cell culture systems. J. Enzyme Inhib. Med. Chem. V. 31. P. 1139–45.
Eke I., Hehlgans S., Sandfort V., Cordes N. 2016. 3D matrix-based cell cultures: Automated analysis of tumor cell survival and proliferation. Int J Oncol, V. 48. P. 313–321.
Fang Y., Eglen R.M. 2017. Three-Dimensional Cell Cultures in Drug Discovery and Development. SLAS Discovery. V. 22. P. 456.
Fatehullah A., Tan S.H., Barker N. 2016. Organoids as an in vitro model of human development and disease. Nat. Cell Biol. V. 18. P. 246.
Gupta G., You Y., Hadiputra R., Jung J., Kang D.K., Lee C.Y. 2019. Heterometallic BODIPY-based molecular squares obtained by self-assembly: Synthesis and biological activities. ACS Omega. V. 4. P. 13200.
Hall M.D., Brimacombe K.R., Varonka M.S., Pluchino K.M., Monda J.K., Li J., Walsh M.J., Boxer M.B., Warren T.H., Fales H.M., Gottesman M.M. 2011. Synthesis and structure-activity evaluation of isatin-β-thiosemicarbazones with improved selective activity toward multidrug-resistant cells expressing P-glycoprotein. J. Med Chem. V. 54. P. 5878.
Jasmund I., Schwientek S., Acikgöz A., Langsch A., Machens H.G., Bader A. 2007. The influence of medium composition and matrix on long-term cultivation of primary porcine and human hepatocytes. Biomol. Eng. V. 24. P. 59.
Kinney M.A., Hookway T.A., Wang Y., McDevitt T.C. 2014. Engineering three-dimensional stem cell morphogenesis for the development of tissue models and scalable regenerative therapeutics. Ann. Biomed. Eng. V. 42. P. 352.
Koudan E.V., Gryadunova A.A., Karalkin P.A., Korneva J.V., Meteleva N.Y., Babichenko I.I., Volkov A.V., Rodionov S.A., Parfenov V.A., Pereira F.D.A.S., Khesuani Y.D., Mironov V.A., Bulanova E.A. 2020. Multiparametric analysis of tissue spheroids fabricated from different types of cells. Biotechnol. J. V. 15. P. e1900217.
Lancaster M. A., Knoblich J. A. 2014. Organogenesis in a dish: modeling development and disease using organoid technologies. Science. V. 345. P. 1 247 125.
Langhans S.A. 2018. Three-dimensional in vitro cell culture models in drug discovery and drug repositioning. Front. Pharmacol. V. 9. P. 6.
Li Y., Revalde J.L., Reid G., Paxton J.W. 2011. Modulatory effects of curcumin on multi-drug resistance-associated protein 5 in pancreatic cancer cells. Cancer Chemother. Pharmacol. V. 68. P. 603.
Monjaret F., Fernandes M., Duchemin-Pelletier E., Argento A., Degot S., Young J. 2016. Fully automated one-step production of functional 3d tumor spheroids for high-content screening. J. Lab. Autom. V. 21. P. 268.
Pampaloni F., Reynaud E.G., Stelzer E.H. 2007. The third dimension bridges the gap between cell culture and live tissue. Nat. Rev. Mol. Cell Biol. V. 8. P. 839.
Quispe-Mauricio A., Callacondo D., Rojas J., Zavala D., Posso M., Vaisberg A. 2009. Actividad citotoxica de physalis peruviana (aguaymanto) en cultivos celulares deadenocarcinoma colorectal, prostata y leucemia mieloide cronica (Cytotoxic effect of physalis peruviana in cell culture of colorectal and prostate cancer and chronic myeloid leukemia). Rev. Gastroenterol. Peru. V. 29 P. 239.
Sangmalee S., Laorpaksa A., Sritularak B., Sukrong S. 2016. Bioassay-guided isolation of two flavonoids from derris scandens with topoisomerase ii poison activity. Biol. Pharm. Bull. V. 39. P. 631.
Thomas R.J., Bhandari R., Barrett D.A., Bennett A.J., Fry J.R., Powe D., Thomson B.J., Shakesheff K.M. 2005. The effect of three-dimensional co-culture of hepatocytes and hepatic stellate cells on key hepatocyte functions in vitro. Cells Tissues Organs. V. 181. P. 67.
Valsalam S., Agastian P., Arasu M.V., Al-Dhabi N.A., Ghilan A.M., Kaviyarasu K., Ravindran B., Chang S.W., Arokiyaraj S. 2019. Rapid biosynthesis and characterization of silver nanoparticles from the leaf extract of Tropaeolum majus L. and its enhanced in vitro antibacterial, antifungal, antioxidant and anticancer properties. J. Photochem. Photobiol. B. V. 191. P. 65.
Wu C.P., Lusvarghi S., Tseng P.J., Hsiao S.H., Huang Y.H., Hung T.H., Ambudkar S.V. 2020. MY-5445, a phosphodiesterase type 5 inhibitor, resensitizes ABCG2-overexpressing multidrug-resistant cancer cells to cytotoxic anticancer drugs. Am. J. Cancer Res. V. 10. P. 164.
Дополнительные материалы отсутствуют.


