Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 490, № 1, стр. 3-8
СИНТЕЗ бифункциональных производных каликс[4]арена в стереоизомерной форме конус с азидоалкильными фрагментами
В. А. Бурилов 1, *, Р. И. Гарипова 1, С. Е. Соловьева 2, член-корреспондент РАН И. С. Антипин 1
1 Казанский (Приволжский) федеральный университет
Казань, Россия
2 Институт органической и физической химии
им. А.Е. Арбузова Федерального исследовательского центра “Казанский научный центр Российской академии наук”
Казань, Россия
* E-mail: ultrav@bk.ru
Поступила в редакцию 20.11.2019
После доработки 20.11.2019
Принята к публикации 20.11.2019
Аннотация
Разработана методика хлорметилирования липофильных дистально ди-О-замещенных производных каликс[4]арена, позволяющая получать ди-хлорметилпроизводные каликс[4]арены с длинноцепочечными алкильными фрагментами в конфигурации конус с высокими выходами. На основе хлорметилированных производных с высокими выходами получены аммониевые/имидазолиевые соли, содержащие пропилазидные фрагменты. Структура всех полученных соединений установлена методами одномерной и двумерной ЯМР-, ИК-спектроскопии, МАЛДИ-спектрометрии. Полученные молекулы в дальнейшем могут быть использованы в качестве прекурсоров политриазольных/полиимидазолиевых полимерных частиц – перспективных носителей для металлокомплексного катализа.
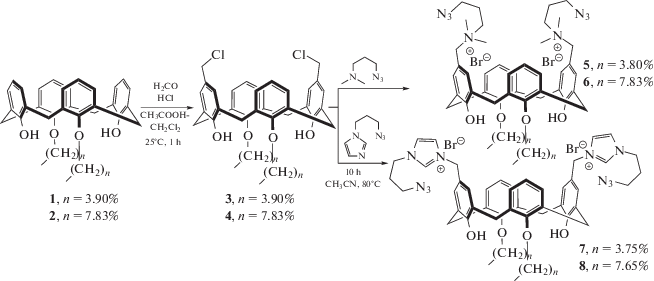
В последние годы в гомогенном катализе все большее распространение получили комплексы переходных металлов с N-гетероциклическими карбеновыми (NHC) лигандами [1, 2]. Благодаря легкости синтеза, широким возможностям введения различных донорных/акцепторных групп, дополнительных центров координации, а также устойчивости к влаге и кислороду воздуха NHC-лиганды постепенно заменяют традиционные фосфиновые лиганды. Еще одним трендом современного катализа является “гетерогенизация” хорошо себя зарекомендовавших металлокомплексов на носителе для получения высокоактивных каталитических систем с возможностью многократного повторного использования [3]. Мы предлагаем новый супрамолекулярный подход к формированию “закрепленных” NHC-лигандов, заключающийся в последовательной самосборке амфифильных макроциклов в коллоидную наночастицу в водном растворе с последующей ковалентной фиксацией частицы в условиях реакции азид-алкинового циклоприсоединения, что позволит контролировать морфологию полученного носителя и вводить различные NHC-фрагменты как в макроцикл, так и в спейсер. Каликс[4]арены, благодаря своим уникальным структурным особенностям [4, 5], возможности получения амфифильных структур [6, 7] и закрепления сразу нескольких NHC-фрагментов на одной молекуле [8], являются перспективной платформой для синтеза амфифильных макроциклов с необходимыми для последующей сшивки азидными группами в головной части молекулы. В связи с этим целью данной работы является синтез амфифильных производных n-трет-бутилкаликс[4]арена, содержащих заряженные имидазолиевые/аммонийные и азидоалкильные фрагменты в стереоизомерной форме конус.
Исходные дистально замещенные макроциклы 1 и 2 были получены взаимодействием исходного каликс[4]арена с соответствующими алкилгалогенидами (бутил/октил). Далее они были селективно функционализированы в пара-положение ароматических колец, имеющих свободные фенольные группы, двумя хлорметильными заместителями. Существующая литературная методика хлорметилирования каликсаренов [9] оказалась неэффективной для липофильных макроциклов. В связи с этим была проведена оптимизация экспериментальных условий, в первую очередь растворителя, для проведения данной реакции в случае липофильных каликс[4]аренов. Оказалось, что использование смеси уксусной кислоты и дихлорметана 1 : 1 позволяет уже через час получать продукты 3 и 4 с выходами 80–90% (схема 1).
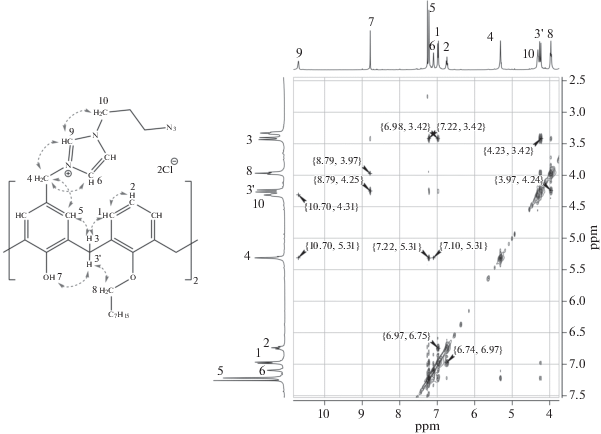
В ЯМР 1Н спектрах соединений 3 и 4 появляются новые сигналы протонов хлорметиленового фрагмента при ~4.5 м.д, а протоны бензольного кольца при хлорметиленовом фрагменте проявляются в виде синглета при ~7.0 м.д. Примечательно, что в МАЛДИ масс-спектре макроциклы 3 и 4 отщепляют две молекулы хлороводорода, что обусловлено легкостью образования хинон-метидных структур п-хлорметилфенолами [10]. Полученные макроциклы 3 и 4 были введены в реакцию с 3-азидо-N,N-диметилпропан-1-амином и 1-(3-азидопропил)-1H-имидазолом в ацетонитриле. Целевые продукты 5–8 были выделены уже через 10 ч с высокими выходами. Структура продуктов 5–8 была установлена с использованием комплекса физических методов. Так, в ЯМР 1Н спектрах соединений 5 и 6 появляется новый сигнал протонов метильных групп при ~3.0 м.д в виде синглета и серия сигналов метиленовых протонов азидопропильного фрагмента. В МАЛДИ масс-спектре макроциклы 5 и 6 отщепляют две молекулы 3-азидо-N,N-диметилпропан-1-амина аналогично исходным хлорметилпроизводным 3 и 4. Присутствие в молекулах 5 и 6 азидной группы подтверждалось присутствием в ИК-спектре характеристичной полосы при 2102 см–1, соответствующей валентным ассиметричным колебаниям азидной группы. В ЯМР 1Н спектрах соединений 7 и 8 помимо новых сигналов метиленовых протонов азидопропильного фрагмента появляются также сигналы протонов имидазолиевого фрагмента в виде уширенных синглетов при 7.78, 7.81 и 9.26 м.д. (7) или при 7.08, 7.21 и 10.84 м.д. (8). Структура макроцикла 8 была дополнительно исследована методом двумерной ЯМР 1Н–1Н NOESY спектроскопии (рис. 1).
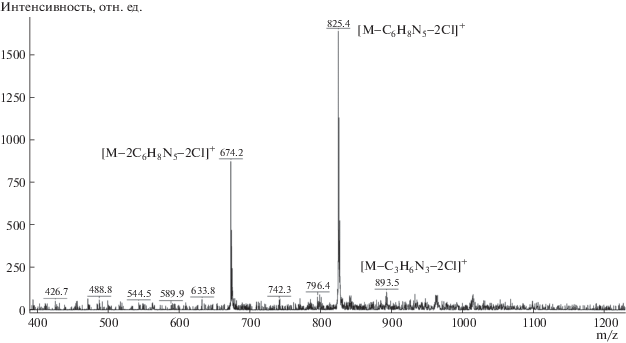
Наличие интенсивных кросс-пиков между сигналами протонов гидроксильной группы и оксиметиленового фрагмента с протоном 3' метиленового спейсера макроцикла (δ = 8.79, 3.97 и 4.25 м.д. соответственно), а также кросс-пиков между сигналами ароматических протонов 5 и 1 макроцикла (δ = 7.22 и 7.00) однозначно указывает на конфигурацию конус макроцикла 8. В МАЛДИ масс-спектре макроцикл 7 отщепляет лишь одну молекулу 1-(3-азидопропил)-1H-имидазола, в случае же макроцикла 8 присутствуют сигналы, соответствующие отщеплению одной и двух молекул 1-(3-азидопропил)-1H-имидазола (рис. 2).
Таким образом, впервые были получены аммониевые/имидазолиевые соли каликс[4]арена, содержащие пропилазидные фрагменты, которые в дальнейшем могут быть использованы в качестве прекурсоров политриазольных/полиимидазолиевых полимерных частиц – перспективных носителей для металлокомплексного катализа.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворители марок х.ч. и ч.д.а. перед применением очищали по известным методикам [11]. В работе использовались коммерчески доступные реагенты из каталогов фирм Sigma-Aldrich и Alfa-Aesar. 25,27-дигидрокси-26,28-дибутокси-каликс[4]- арен 1, 25,27-дигидрокси-26,28-диоктилокси-каликс[4]арен 2, [12], 3-азидо-N,N-диметилпропан-1-амин [13] и 1-(3-азидопропил)-1H-имидазол [14] были синтезированы по литературным методикам. Чистоту веществ контролировали методом ТСХ на пластинках Merck UV 254 с проявлением в УФ-свете лампы VL-6.LC. ЯМР-эксперименты выполнены на спектрометре Avance 400 Nanobay (“Bruker”). Масс-спектры MALDI получены на масс-спектрометре UltraFlex III TOF/TOF в линейном режиме с фиксированием положительно заряженных ионов, в качестве матрицы использовали п-нитроанилин. Лазер Nd : YAG, λ = 355 нм. Температура плавления веществ определялась с помощью прибора Stuart SMP10. ИК-спектры образцов в таблетках KBr были записаны на спектрометре Bruker Vector-22.
Общая методика хлорметилирования 1 и 2. 0.4 ммоль каликс[4]арена 1 или 2 и 0.17 г (5.5 ммоль) параформа растворили в смеси уксусной кислоты (7 мл) и хлористого метилена (7 мл). Через реакционный сосуд барботировали газообразный хлороводород в течение 1 ч, после чего реакционную смесь залили водой (20 мл), целевой продукт экстрагировали хлористым метиленом (3 · 20 мл). Продукты 3, 4 были получены в виде порошка бледно-желтого цвета.
11,23-дихлорметил-25,27-дигидрокси-26,28-дибутокси-каликс[4]арен 3. Выход 90%. Tпл(разл) = = 209°C. ИК (KBr) νmax, cм–1: 1483 (C=C), 2931 (CH2), 2959 (CH3), 3318 уш. с (ОН). МАЛДИ (m/z): 561 [M–2HCl]+, 743 [M–2HCl + 2Na + PNA]+. 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м.д., J/Гц): 1.09 т (6H, СH3, J = 7.3), 1.73–1.83 м (4H, СH2), 1.99–2.08 м (4H, СH2), 3.38 д (4H, Ar–СH2–Ar, J = 12.9), 4,00 т (4H, СH2O, J = 6.4), 4,29 д (4H, Ar–СH2–Ar, J = 12.9), 4.51 с (4H, СH2Cl), 6,78 т (2H, HAr, J = 7.6), 6.93 д (4H, HAr, J = 7.6), 7.08 с (4H, HAr), 8.48 с (2H, OH). 13C{1Н} ЯМР (100.6 МГц, CDCl3, 25°C, δ, м.д.): 14.22; 19.52; 31.52; 32.36; 47.08; 125.55; 128.46; 129.12; 129.18; 133.25.
11,23-дихлорметил-25,27-дигидрокси-26,28-диоктилокси-каликс[4]арен 4. Выход 83%. Tпл(разл) = = 118°C. ИК (KBr) νmax, cм–1: 1484 ср. (C=C), 2926 с. νas(CH2), 2855 с. νs(CH2), 3331 уш.с (ОН). МАЛДИ (m/z): 676 [M–2HCl]+. 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м.д., J/Гц): 0.88 т (6H, СH3J = 6,4), 1.18–1.46 м (16H, СH2), 1.60–1.78 м (4H, СH2), 1.96–2.08 м (4H, СH2), 3.34 д (4H, Ar–СH2–Ar, J = = 12.9), 3.99 т (4H, СH2O, J = 6,4), 4.28 д (4H, Ar–СH2–Ar, J = 12.9), 4.51 с (4H, СH2Cl), 6.74 т (2H, HAr, J = 7.3), 6.93 д (4H, HAr, J = 7.4), 7.08 с (4H, HAr), 8.48 с (2H, OH). 13C{1Н} ЯМР (100.6 МГц, CDCl3, 25°C, δ, м.д.): 14.29; 22.85; 26.13; 29.51; 29.64; 30.14; 31.52; 32.11; 47.10; 125.52; 127.83; 128.49; 129.10; 129.15; 133.26.
Общая методика кватернизации 3-азидо-N,N-диметилпропан-1-амина соединениями 3 и 4. 0.14 ммоль 3 (4) и 0.08 г (0.56 ммоль) 3-азидо-N,N-диметилпропан-1-амина растворили в 3 мл ацетонитрила. Реакционную смесь перемешивали при 80°С в течение 10 ч, после чего реакционную смесь упарили досуха на роторном испарителе, целевой продукт высадили диэтиловым эфиром (15 мл), полученный осадок отфильтровали на воронке Шотта и сушили в вакуум-эксикаторе над P2O5.
11,23-бис[((3-азидопропил)диметиламмония)метил]-25,27-дигидрокси-26,28-дибутокси-каликс [4]арена дихлорид 5. Выход 80%. Тпл (разл) = 197°С. ИК (KBr) νmax, cм–1: 1461 ср. (C=C), 2102 с. νas(N3), 2932 с. νas(CH2), 2872 с. νs(CH2), 2959 с. νas(CH3), 3357 уш.с (ОН). МАЛДИ (m/z): 562 [M–2(C5H12N4)–2Cl]+. 1H ЯМР (400 МГц, DMSO-d6, 25°C, δ, м.д., J/Гц): 1.08 т (6H, СH3,J = 7.2), 1.72–1.86 м (4H, СH2), 1.91–2.10 м (8H, СH2+CH2(aз)), 2.90 с (12H, СH3) 3.16–3.28 м (4H, СH2(аз)), 3.44–3.56 м (8H, Ar–СH2–Ar +СH2), 4.01 т (4H, СH2O, J = 5.7), 4.20 д (8H, Ar–СH2–Ar, J = 12.8), 4,35 с (4H, СH2N), 6.84 т (2H, HAr, J = 7.5), 7.08 д (4H, HAr, J = 7.6), 7.38 с (4H, HAr), 8.94 с (2H, OH). 13C{1Н} ЯМР (100.6 МГц, DMSO-d6, 25°C, δ, м.д.): 13.98; 18.87; 21.87; 30.29; 31.82; 48.06; 49.08; 60.43; 66.66; 76.49; 118.30; 125.73; 128.13; 128.98; 133.38; 133.50; 151.83; 154.46.
11,23-бис[((3-азидопропил)диметиламмония)метил]-25,27-дигидрокси-26,28-диоктилокси-каликс[4]арена дихлорид 6. Выход 83%. Тпл(разл) = = 183°С. ИК (KBr) νmax, cм–1: 1461 ср. (C=C), 2102 с. νas(N3), 2928 с. νas(CH2), 2857 с. νs(CH2), 3333 уш.с (ОН). МАЛДИ (m/z): 674 [M–2(C5H12N4)–2Cl]+. 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м.д., J/Гц): 0.89 т (6H, СH3,J = 6,0), 1.26–1.51 м (16H, СH2), 1.64–1.80 м (8H, СH2), 1.97–2.11 м (4H, СH2), 3.16 с (12H, СH3(аз)), 3.34–3.43 м (4H, СH2(аз)), 3.45 д (4H, Ar–СH2–Ar, J = 13.0), 3.52–3.59 м (4H, СH2(аз)), 4.00 т (4H, СH2O, J = 6,0), 4.27 д (4H, Ar–СH2–Ar, J = 13.0), 4.71 с (4H, СH2Cl), 6.78 уш. т (2H, HAr), 7.01 уш. д (4H, HAr), 7.34 с (4H, HAr), 8.98 с (2H, OH). 13C{1Н} ЯМР (100.6 МГц, CDCl3, 25°C, δ, м.д.): 14.26; 22.82; 26.08; 29.46; 29.62; 30.13; 31.07; 48.29; 49.77; 60.66; 68.09; 117.45; 125.38; 125.94; 128.49; 129.06; 129.47; 133.32; 133.59; 152.06; 155.68.
Общая методика кватернизации 1-(3-азидопропил)-1H-имидазола соединениями 3 и 4. Смесь 0.25 ммоль 3 или 4 и 0.08 г (0.6 ммоль) N,N-диметил(3-азидо)пропиламина растворили в 4 мл ацетонитрила. Реакционную смесь перемешивали при 80oС в течение 10 ч, после чего реакционную смесь упаривали досуха на роторном испарителе, целевой продукт высадили этилацетатом (15 мл), полученный осадок отфильтровали на воронке Шотта и сушили в вакуум-эксикаторе над P2O5.
11,23-бис[3((1-(3-азидопропил))-1H-имидазолия]-25,27-дигидрокси-26,28-дибутокси-каликс[4]арена дихлорид 7. Выход 75%. Тпл(разл) = 176°С. ИК (KBr) νmax, cм–1: 1460 ср. (C=C), 2099 с. νas(N3), 2932 с. νas(CH2), 2872 с. νs(CH2), 3333 уш.с (ОН). МАЛДИ, m/z: 713 [M–C6H9N5–2Cl]+. 1H ЯМР (400 МГц, DMSO-d6, 25°C, δ, м.д., J/Гц): 1.06 т (6H, СH3,J = = 6.7), 1.60–1.84 м (4H, СH2), 1.83–2.13 м (8H, СH2 + CH2(aз)), 3.36–3.55 м (8H, Ar–СH2–Ar + + СH2), 3.97 уш.т (4H, СH2O), 4.11–4.37 м (8H, Ar–СH2–Ar + СH2), 5.20 с (4H, СH2Cl), 6.80 т (2H, HAr, J = 7.0), 7.05 д (4H, HAr, J = 7,2), 7.28 с (4H, HAr), 7.78 уш. с (2H, HIm), 7.81уш. с (2H, HIm), 8.68 с (2H, OH), 9.26 с (2H, C–NH–C). 13C{1Н} ЯМР (100.6 МГц, CDCl3, 25°C, δ, м.д.): 14.22; 19.49; 29.35; 31.38; 32.32; 47.47; 48.09; 53.38; 121.39; 122.10; 123.07; 125.66; 129.28; 129.40; 129.77; 133.12; 137.60; 152.07; 154.75.
11,23-бис[3((1-(3-азидопропил))-1H-имидазолия]-25,27-дигидрокси-26,28-диоктилокси-каликс[4]- арена дихлорид 8. Выход 65%. Тпл(разл) = 180°С. ИК (KBr) νmax, cм–1: 1459 ср. (C=C), 2099 с. νas(N3), 2855 с. νs(CH2), 2927 с. νas(CH2), 3363 уш.с (ОН). МАЛДИ, m/z: 893 [M–C3H6N3–2Cl]+, 825 [M–C6H9N5–2Cl]+, 674 [M–2(C6H9N5)–2Cl]+. 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м.д., J/Гц): 0.88 т (6H, СH3, J = 6.6), 1.23–1.50 м (16H, СH2), 1.59–1.74 м (4H, СH2), 1.99–2.15 м (8H, СH2), 3.32–3.46 м (8H, Ar–СH2–Ar + СH2(аз.)), 3.97 т (4H, СH2O, J = 6.4), 4.26 д (4H, Ar–СH2–Ar, J = 12,9), 4.35 уш.т (4H, СH2N, J = 6.79), 5.32 с (4H, ArСH2), 6.75 т (2H, HAr, J = 7.5), 6.94 д (4H, HAr, J = 7.5), 7.08 уш.с (2H, HIm), 7.21 уш. с (6H, Har + HIm), 8.78 с (2H, OH), 10.84 с (2H, C–NH–C). 13C{1Н} ЯМР (100.6 МГц, CDCl3, 25°C, δ, м.д.): 14.22; 22.77; 26.04; 29.07; 29.42; 29.57; 30.08; 31.32; 32.03; 47.33; 48.08; 53.00; 121.77; 122.37; 123.59; 125.57; 129.16; 129.40; 129.74; 136.72; 152.10; 154.59.
Список литературы
Beletskaya I.P., Alonso F., Tyurin V. The Suzuki-Miyaura Reaction after the Nobel Prize // Coord. Chem. Rev. 2019. V. 385. P. 137–173.
Nolan S.P., editor. N-Heterocyclic Carbenes in Synthesis. Weinheim: Wiley-VCH, 2006.
Sommer W.J., Weck M. Supported N-heterocyclic Carbene Complexes in Catalysis // Coord. Chem. Rev. 2007. V. 251. № 5–6. P. 860–873.
Neri P., Sessler J.L., Wang M.-X. Editors. Calixarenes and Beyond. Netherlands: Springer, 2016.
Solovieva S.E., Burilov V.A., Antipin I.S. Thiacalix[4]arene’s Lower Rim Derivatives: Synthesis and Supramolecular Properties // Macroheterocycles. 2017. V. 10. № 2. P. 134–146.
Yakimova L.S., Gilmanova L.H., Evtugyn V.G., et al. Self-assembled Fractal Hybrid Dendrites from Water-soluble Anionic (thia)calix[4] arenes and Ag+ // J. Nanoparticle Res. 2017. V. 19. № 5. P. 173–183.
Burilov V.A., Nugmanov R.I., Ibragimova R.R., et al. ‘Click Chemistry’ in the Synthesis of New Amphiphilic 1,3-alternate thiacalixarenes // Mendeleev Commun. 2015. V. 25. № 3. P. 177–179.
Yang, J., Liu, J., Wang, Y., Wang, J. Synthesis, Structure and Catalysis/Applications of N-heterocyclic Carbene Based on Macrocycles // J. Incl. Phenom. Macrocycl. Chem. 2018. V. 90. № 1–2. P. 15–37.
Huang Zh.-T., Wang G.-Q., Yang L.-M., et al. The Selective Chloromethylation of 25, 27-Dihydroxy-26, 28-Dimethoxycalix{4}arene and Nucleophilic Substitution Therefrom // Synth. Commun. 1995. V. 25. № 8. P. 1109–1118.
Regnouf-de-Vains J., Berthalon S., Lamartine R.J. Electrospray Mass Spectrometric Evidence of Calixarene p-quinone Methide Formation // Mass Spectros. 1998. V. 33. P. 968–970.
Armarego W.L.F., Chai C.L. Editors. Purification of Laboratory Chemicals. New York: Elsevier, 2009.
Arduini A., Fabbi M., Mantovani M., et al. Calix[4]arenes Blocked in a Rigid Cone Conformation by Selective Functionalization at the Lower Rim // J. Org. Chem. 1995. V. 60. № 5. P. 1454–1457.
Dash J., Waller Z.A.E., Pantos G.D., et al. Synthesis and Binding Studies of Novel Diethynyl-Pyridine Amides with Genomic Promoter DNA G-Quadruplexes // Chem. Eur. J. 2011. V. 17. № 16. P. 4571–4581.
Wijtmans M., de Graaf Ch., de Kloe Enade G., Istyastono P., et al. Triazole Ligands Reveal Distinct Molecular Features That Induce Histamine H4 Receptor Affinity and Subtly Govern H4/H3 Subtype Selectivity // J. Med. Chem. 2011. V. 54. P. 1693–1703.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах