Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 490, № 1, стр. 9-14
СИНТЕЗ И ОПТОЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА НОВЫХ СТАТИСТИЧЕСКИХ ТЕРПОЛИМЕРОВ НА ОСНОВЕ ДИКЕТОПИРРОЛОПИРРОЛЬНЫХ И БЕНЗОДИТИАЗОЛХИНОКСАЛИНОВЫХ СТРУКТУР ДЛЯ ПОЛИМЕРНЫХ СОЛНЕЧНЫХ ФОТОЭЛЕМЕНТОВ
М. Л. Кештов 1, *, С. А. Куклин 1, И. О. Константинов 1, И. Е. Остапов 1, Е. Е. Махаева 2, академик РАН А. Р. Хохлов 2, Чжиюань Се 3, Г. Д. Шарма 4
1 Институт элементоорганических соединений
имени А.Н. Несмеянова Российской академии наук
Москва, Россия
2 Московский государственный университет
имени М.В. Ломоносова
Москва, Россия
3 Чанчуньский институт прикладной химии, Академия наук Китая
Чанчунь, Китай
4 Институт информационных технологий LNM, физический факультет
Джамдоли, Джайпур, Индия
* E-mail: keshtov@ineos.ac.ru
Поступила в редакцию 06.12.2019
После доработки 06.12.2019
Принята к публикации 06.12.2019
Аннотация
Разработаны и синтезированы два новых бинарных полимера (Р16, Р20), а также три статистических терполимера (P17, P18, P19) с различными соотношениями акцепторов A1 (ДПП) и A2 (БTTХ) в полимерной цепи. Исследованы их оптические и электрохимические свойства. Статистические терполимеры (P17, P18, P19) обладают более широкими спектрами поглощения по сравнению с соответствующими бинарными D-A-сополимерами (Р16, Р20). Показано, что положение полос поглощения и энергетические уровни могут быть легко скорректированы путем изменения мольных сотношений двух различных акцепторных звеньев в полимерной цепи терполимеров. Синтезированные случайные терполимеры могут быть использованы в качестве эффективных донорных материалов для полимерных фуллереновых и нефуллереновых солнечных фотоэлементов.
В связи с исчерпанием традиционных источников энергии и загрязнением окружающей среды необходимы новые возобновляемые энергетические ресурсы в качестве альтернативы традиционным ископаемым топливам. Солнечная энергия привлекает большое внимание из-за ее неисчерпаемых и экологически чистых достоинств. Полимерные солнечные элементы (ПСФ) становятся перспективной технологией возобновляемой энергии [1–3]. Хотя эффективность ПСФ за последние несколько лет была впечатляющей (15–16% для однослойных [2] и 17% для тандемных ПСФ [3]), она все еще далека от неорганических аналогов. Этот прогресс в основном достигнут благодаря разработке новых донорно-акцепторных (D-A) сополимеров [4]. Благодаря разумному сочетанию различных донорных и акцепторных единиц оптоэлектронные свойства, такие как HOMO- и LUMO-уровни, а также оптическая ширина запрещенной зоны могут быть рационально настроены [5]. Однако среди огромного количества чередующихся D-A-сополимеров только ограниченное число было успешно разработано для высоко эффективных фотовольтаических устройств. В большинстве случаев указанные D-A-полимеры не показывают широкого поглощения, вместо этого максимумы абсорбции смещаются в красную область спектра, уменьшая количество поглощенных фотонов в видимой области и в конце концов ограничивая фототок.
Одной из привлекательных стратегий расширения поглощения солнечного спектра сопряженных полимеров является разработка статистических терполимеров на основе сополимеризации одной электронодонорной единицы и двух различных электроноакцепторных групп [6], или двух различных доноров и одного акцептора [7]. При соответствующем выборе строительных блоков добавление третьего компонента в D-A-сополимеры позволит тонко настроить оптические, электрические и фотовольтаические свойства благодаря синергетическим эффектам каждого из трех компонентов. Эффективность более 10% была реализована среди статистических (D–A1–D–A2) терполимеров на основе системы PBDT–T [8]. Однако удачные примеры статистических терполимеров с широким поглощением света и высокими значениями эффективности ограничены, а сравнение статистических терполимеров различного состава с их бинарными исходными полимерами производилось редко.
В этой статье мы сообщаем о новых случайных терполимерах типа D–А1–D–А2 на основе одного электронодонорного алкилзамещенного бензодитиофена (БДТ) (Д) и двух электроноакцепторных блоков пирроло[3,4-с]пиррол-1,4-диона (ДПП) (A1) и бис[1,3]тиазоло[4,5-f:5',4'-h]тиено[3,4-b]хиноксалина (БTTХ) (A2). Сочетание двух электроноакцепторных единиц (ДПП) и (БТTХ) с различными электроноакцепторными способностями может привести к широкому диапазону поглощения в интервале от 300 до 1100 нм. Кроме того, оба блока были успешно использованы в D-A-сополимерах для получения высокоэффективных ПСФ. ДПП широко используется как A-блок в D-A-сополимерах для ПСФ благодаря его уникальным свойствам, таким как высокий коэффициент экстинкции, сильная электроноакцепторная способность и молекулярная планарность [9]. D-A-сополимеры на основе ДПП также демонстрируют сильное поглощение внутримолекулярного переноса заряда (ICT), что приводит к поглощению до ближней инфракрасной области спектра, особенно при 600–900 нм, благодаря наличию сильных электроноакцепторных бис[1,3]тиазоло[4,5-f:5',4'-h]тиено[3,4-b]хиноксалиновых колец и сильных π–π-взаимодействий. Между тем предыдущие наши работы продемонстрировали, что еще более важно, что полимеры, содержащие БТTХ, обладают очевидным сильным поглощением при 300–600 и 650–1100 нм, тогда как сополимеры БДТ–ДПП имеют полосы поглощения в интервале 600–900 нм. Исходя из вышеизложенных соображений комбинация электроноакцепторных блоков ДПП и БТTХ в полимере может быть привлекательной для комплементарного и широкого поглощения. Систематически меняя мольные соотношения двух различных акцепторов с различными электроноакцепторными способностями ДПП(А1)/БТTХ(А2), энергетические уровни и запрещенные зоны можно тонко настроить для обеспечения широкого поглощения и подходящих энергетических уровней. На основании вышеизложенного мы ввели БТTХ-акцепторную группу в случайные терполимеры и синтезировали три новых терполимера P17, P18 и P19 (схема 1). Эти полимеры демонстрируют широкие диапазоны поглощения между 300–1100 нм и обнаруживают гораздо более широкие поглощения, чем известные случайные терполимеры, что имеет большой потенциал для улучшения производительности ПСФ и изучения композиционного эффекта случайных терполимеров.
РЕЗУЛЬТАТЫ И ДИСКУССИИ
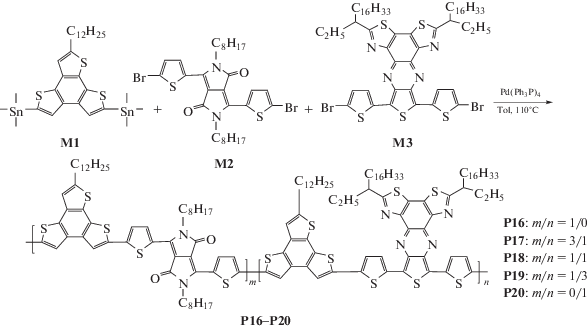
На схеме 1 представлены структуры мономеров, целевых сополимеров и пути их синтеза. Мономеры 5,8-бис(триметилстаннил)-2-додецилбензо[1,2-b:3,4-b':6,5-b'']тритиофен (М1), 3,6-бис(5-бромтиофен-2-ил)-2,5-бис(2-этилгексил)пирроло[3,4-с]пиррол-1,4(2Н,5Н)-дион (М2) и 8,10-бис(5-бромтиофен-2-ил)-2,5-ди(нонадекан-3-ил)бис[1,3]тиазоло[5,4-f:4',5'-h]тиено[3,4-b]хиноксалин (М3) были синтезированы в соответствии с процедурами, предложенными в литературе [11]. Статистические тройные сополимеры синтезировали в условиях реакций кросс-сочетания Стилле сополимеризацией трех мономеров М1, М2 и М3 с различными мольными соотношениями в присутствии Pd(PPh3)4 в качестве катализатора согласно схеме 1.
Для исследования влияния состава сополимеров на свойства случайных терполимеров были синтезированы три случайных терполимера (Р17, Р18 и P19) с различными мольными соотношениями акцепторных мономеров М2 и М3 (0.75/0.25, 0.50/0.50 и 0.25/0.75). Биполимеры, содержащие только одну акцепторную единицу P16 (ДПП) и P20 (БTTХ), были также синтезированы для сравнения в соответствии с процедурой, описанной ранее. Полученные полимеры подвергали последовательно экстракции метанолом, гексаном, ацетоном и хлороформом. P16–Р20 были получены путем осаждения хлороформной фракции в метанол. Все полимеры показывают умеренную растворимость в органических растворителях, таких как хлороформ, хлорбензол и о-дихлорбензол. Состав и строение случайных терполимеров охарактеризовали с помощью элементного анализа и ЯМР-спектроскопии.
Молекулярные массы (Mn), (Mw) и полидисперсность (PDI) сополимеров определяли с помощью гель-проникающей хроматографии (ГПХ), используя хлорбензол в качестве элюента, а полистирол – стандарта. Все сополимеры демонстрируют сходные среднечисловые молекулярные массы, которые меняются в диапазоне 11.02–21.75 кДa с полидисперсностью в пределах 1.20–2.51, что гарантирует сопоставимость их характеристик (табл. 1).
Таблица 1.
Некоторые физико-химческие характеристики полимеров P16–Р20
| Полимер (m/n) | Выход, % | Mn, кДа1 | Mw, кДа2 | PDI3 | T5%, °C4 |
|---|---|---|---|---|---|
| P16 (1/0) | 81 | 21.75 | 32.82 | 1.51 | 403 |
| P17 (3/1) | 88 | 20.15 | 26.29 | 1.30 | 423 |
| P18 (1/1) | 77 | 14.36 | 36.04 | 2.51 | 389 |
| P19 (1/3) | 77 | 13.86 | 16.58 | 1.20 | 391 |
| P20 (0/1) | 74 | 11.02 | 16.50 | 1.50 | 403 |
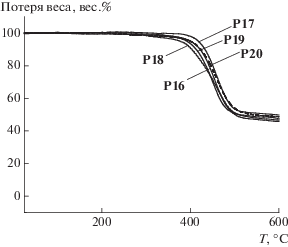
Для оценки термостабильности сопряженных полимерных материалов были проведены термогравиметрические исследования (ТГА). Из кривых TГА (рис. 1) видно, что все полимеры демонстрируют высокую термостабильность, превышающую 380°С, что важно для их применения в ПСФ и других оптоэлектронных устройствах.
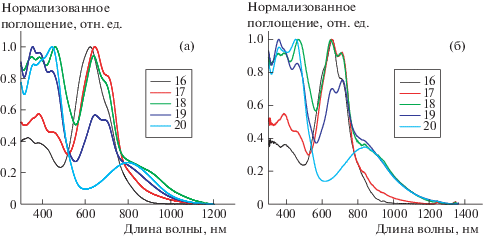
Спектры поглощения сополимеров в растворе и тонких пленках показаны на рис. 2, а соответствующие данные приведены в табл. 2.
Таблица 2.
Оптические и электрохимические свойства полимеров P16–Р20
| Полимер | λмакс (раствор), нм1 | λмакс (пленка), нм2 | EHOMO3, эВ | ELUMO4, эВ | $E_{g}^{{{\text{oпт}}}}$*, эВ |
|---|---|---|---|---|---|
| P16 | 352, 385, 462, 648 | 393, 657 | –5.19 | –3.82 | 1.37 |
| P17 | 386, 650 | 388, 657, 709 | –5.14 | –3.81 | 1.33 |
| P18 | 335, 386, 621 | 388, 469, 651, 709 | –5.13 | –4.00 | 1.13 |
| P19 | 355, 385, 645, 695 | 357, 463, 657, 715 | –5.12 | –4.00 | 1.12 |
| P20 | 360, 445, 807 | 359, 448, 836 | –5.11 | –4.00 | 1.11 |
Биполимер P16, в котором только ДПП был включен в качестве акцепторного блока (A1), проявляет две полосы поглощения. Первая – в диапазоне 350–500 нм, что объясняется локализованными π−π*-переходами, а вторая, более широкая полоса при 500−900 нм в длинной области, соответствует внутримолекулярному переносу заряда (ICT) между донорными и акцепторными блоками. Биполимер Р20, содержащий только БТTХ-блок в качестве акцепторного звена (A2), проявляет локализованные π–π*-переходы при 300–600 нм, в то время как полоса поглощения между 600 и 1100 нм приписывается ICT между BТTQ- и BDT-фрагментами. Как показано на рис. 2, P20 характеризуется поглощением, которое простирается до ближней ИК-области, с оптической шириной запрещенной зоны 1.11 эВ, в то время как P16 имеет оптическую ширину запрещенной зоны 1.37 эВ. Ясно, что D-A-полимер со структурой, содержащей БТTХ в качестве акцепторной единицы, имеет большую длину сопряжения и лучшую π-делокализацию электронов и, следовательно, более узкую ширину запрещенной зоны, чем при включении ДПП в качестве акцепторной единицы.
Введя эти два акцепторных блока в D-A сопряженный полимер и систематически меняя соотношения этих двух компонентов (1/0; 0.75/0.25; 0.5/0.5; 0.25/0.75; 0/1), мы настроили абсорбционные свойства и ширину запрещенной зоны полученных терполимеров. Значения оптической ширины запрещенной зоны ($E_{g}^{{{\text{oпт}}}}$) Р16–Р20, рассчитанные из начала спектров поглощения пленок, составляют 1.37; 1.33; 1.13; 1.12 и 1.11 эВ соответственно. Результаты показывают, что включение двух разных электроноакцепторных единиц в один и тот же полимер (P17–P19) является эффективным методом контроля оптической ширины запрещенной зоны и расширения полос поглощения.
Как показано на рис. 1, все терполимеры содержат две полосы поглощения, соответствующие двум различным ICT-состояниям, которые и возникли из двух отдельных акцепторных единиц. Полоса поглощения при 500–900 нм была отнесена к ICT ДПП D-A-структуры, в то время как полосу поглощения 600–1100 нм приписывают ICT БТTХ D-A-полимерной структуре. Сополимер P17 (ДПП/БТTХ = 0.75/0.25) демонстрирует немного более широкое поглощение, чем гомополимер PI6, в то же время максимум поглощения почти такой же, как у Р16. Случайный терполимер P18 (ДПП/БТTХ = 0.50/0.50) проявляет более широкое поглощение в диапазоне 300–1100 нм, в то время как терполимер P19 (ДПП/БТTХ = 0.25/0.75) демонстрирует более слабую интенсивность и узкий диапазон поглощения, чем P18. Отметим, что P18 с его сильным и широким поглощением имеет большой потенциал для увеличения фототока ПСФ.
Как сообщалось ранее, основным недостатком D-A-сополимеров является часто наблюдаемое красное смещение профиля поглощения в длинноволновую область вместо истинного расширения как в видимой, так и в ближней инфракрасной областях. Такое красное смещение может препятствовать увеличению плотности тока короткого замыкания и в конечном итоге эффективности ПСФ. Интересно, что описанные сополимеры имеют относительно сильное поглощение во всей видимой и ближней ИК-областях, когда отношение ДПП к БТTХ составляет 0.5/0.5 (рис. 2). Профиль поглощения, полученный из двух комплементарных ICT-полос поглощения, генерируется двумя различными акцепторными звеньями в сополимерах. Эта уникальная особенность поглощения может привести к улучшению характеристик полимеров в области фотоэлектрического применения. Благодаря синергетическому эффекту каждой единицы статистические терполимеры Р17–Р19 имеют более широкое поглощение, от 300 до 1100 нм, чем соответствующие бинарные полимеры, что способствует улучшению светопоглощения. Следовательно, правомерно ожидать увеличения числа фотонов, что может привести к увеличению плотности тока короткого замыкания фотогальванического устройства.
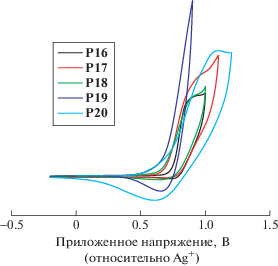
Электрохимические свойства сополимеров были исследованы методом циклической вольтамметрии (CV) для определения уровней энергии HOMO и LUMO и влияния соотношения ДПП/БТTХ блоков на электрохимические свойства полимеров. Bu4NPF6 в ацетонитриле (0.1 М) использовали в качестве электролитной системы. Уровни HOMO полимеров рассчитывали из начала потенциала электрохимического окисления (рис. 3). Ag/AgCl-электрод сравнения был откалиброван по ферроцен/ферроцению Fc/Fc+, окислительно-восстановительный потенциал которого составляет 0.36 относительно Ag/Ag+. HOMO P16-P20-полимеров определяли согласно уравнению EHOMO = –(4.44 + Eoк, нач) (эВ). Уровни LUMO были оценены как ELUMO = EHOMO + $E_{g}^{{{\text{oпт}}}}$, где $E_{g}^{{{\text{oпт}}}}$ – оптическая ширина запрещенной зоны полимера (табл. 2). HOMO-уровни энергии сополимеров Р16–Р20 состава 1/1/0; 1/0, 75/0, 25; 1/0, 5/0, 5; 1/0, 25/0, 75 и 1/0/1 были оценены как –5.19, –5.14, –5.13, –5.12 и –5.11 эВ соответственно в зависимости от соотношения ДПП к БTTХ, что означает, что они варьируют в зависимости от силы модулированных ICT, полученных от электроноакцепторных единиц с различными электроноакцепторными способностями (табл. 2). Уровни LUMO P16–P20 равны –3.82, –3.81, –4.00, –4.00, –4.00 эВ соответственно. Уровни HOMO и LUMO в этих терполимерах демонстрируют, что они могут быть использованы в качестве донора в активном слое фуллереновых и нефуллереновых солнечных фотоэлементов.
Рис. 3.
Циклические вольтаммограммы окисления полимеров P16–Р20 при сканировании со скоростью 80 мВ/с.
Таким образом, мы разработали и синтезировали три статистических терполимера (P17, P18, P19) с различными отношениями акцепторов A1 (ДПП) и A2 (БTTХ) в полимерной цепи, исследовали их оптические и электрохимические свойства и сравнили с D-A-бинарными сополимеры P16 (БTT–ДПП) и P20 (БTT–БTTХ). Статистические терполимеры продемонстрировали более широкие спектры поглощения по сравнению с соответствующими бинарными D-A-сополимерами. Следовательно, оптическое поглощение может быть легко скорректировано путем изменения отношения двух различных акцепторных звеньев в полимерной цепи. Синтезированные Р17-Р19 случайные терполимеры могут быть использованы в качестве эффективных донорных материалов полимерных фуллереновых и нефуллереновых солнечных фотоэлементов.
Список литературы
Li Yaowen, Xu G., Cui C., Li Yongfang. Flexible and Semitransparent Organic Solar Cells // Adv. Energy Mater. 2018. V. 8. 170179.
Xu X., Feng K., Bi Z., Ma W., Zhang G., Peng Q. Single-Junction Polymer Solar Cells with 16.35 Efficiency Enabled by a Platinum (II) Complexation Strategy // Adv. Mater. 2019. V. 31. 1901872.
Meng L., Zhang Y., Wan X., Li C., Zhang X., Wang Y., Ke X., Xiao Z., Ding L., Xia R. Organic and Solution Processed Tandem Solar Cells with 17.3% Efficiency // Science. 2018. V. 361. P. 1094–1098.
Mu C., Liu P., Ma W., Hunag F., Facchetti A., Ade H., Yan H. High Efficiency All Polymer Solar Cells Based on a Pair of Crystalline Low Bandgap Polymers // Adv. Mater. 2014. V. 26. P. 7224–7230.
Kim H., Lim B., Heo H., Nam G., Lee H., Lee J.Y., Lee J., Lee Y. High Efficiency Organic Photovoltaics with Two Dimensional Conjugated Benzodithiophene Based Regioregular Polymers // Chem. Mater. 2017. V. 29, P. 4301–4310.
Li Ch., Chen Zh., Wu F., Chen L., Chen Y. Random Copolymers Containing Tetrafluorophenylene Unit with Deep HOMO Energy Levels for Solar Cell Applications // Synthetic Metals. 2017. V. 226. P. 71–79.
Yun H.-J., Cho J., Chung D.S., Kim Y.-H., Kwon S.-K. Comparative Studies on the Relations between Composition Ratio and Charge Transport of Diketopyrrolopyrrole Based Random Copolymers // Macromolecules. 2014. V. 47. P. 7030–7035.
Wu W., Shi L., Hu Y., Chen L., Hu T., Zhang Y., Yuan Z., Chen Y. Additive Free Nob-fullerene Organic Solar Cells with Random Copolymer as Donor over 9% Power Conversion Efficiency // Chinese Chem. Lett. 2019. V. 30. № 6. P. 1161–1167.
Yi Zh., Wang Sh., and Liu Y. Design of High-Mobility Diketopyrrolopyrrole-Based π-Conjugated Copolymers for Organic Thin-Film Transistors // Adv. Mater. 2015. V. 27. P. 3589–3606.
Woo C.H., Beaujuge P.M., Holcombe T.W., Lee O.P., Fréchet J.M.J. Incopration of Furan into Low Bandgap Polymers for Efficient Solar Cells // J. Am. Chem. Soc. 2010. V. 132. P. 15547–15549.
Keshtov M.L., Kuklin S.A., Konstntinov I.O., Ostapov I.E., Godovsky D.Y., Mkahaeva E.E., Xie Z., Sharma G.D. Conjugated Random Terpolymers Based on Benzodithiophene, Deketopyrrolopyrrole, and 8,10 bis(thiophen-2yl)-2,5-di(nonadecane-3-yl)bis[1.3]thiazolo[4,5-f-5',4'-h]thieno[3,4-b]quinoxaline for Efficient Polymer Solar Cells // J. Polymer Sci. Part A. Polymer Chem.https://doi.org/10.1002/pola.29412
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах