Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 490, № 1, стр. 15-18
СЕЛЕКТИВНЫЙ “NAKED-EYE” ХЕМОСЕНСОР НА ОСНОВЕ ФЛУОРЕСЦЕИНА ДЛЯ ОПРЕДЕЛЕНИЯ КАТИОНОВ Pd2+
Л. Д. Попов 1, О. Ю. Карлутова 2, Е. Н. Шепеленко 3, А. Д. Дубоносов 3, *, И. Н. Щербаков 1, В. А. Брень 2, академик РАН В. И. Минкин 2
1 Южный федеральный университет
Ростов-на-Дону, Россия
2 Научно-исследовательский институт физической и органической химии Южного федерального университета
Ростов-на-Дону, Россия
3 Федеральный исследовательский центр Южный научный центр Российской академии наук
Ростов-на-Дону, Россия
* E-mail: aled@ipoc.sfedu.ru
Поступила в редакцию 05.11.2019
После доработки 05.11.2019
Принята к публикации 05.11.2019
Аннотация
Синтезирован высокочувствительный и селективный хемосенсор для определения катионов палладия (II) на основе дифенилфосфинового производного N-аминофлуоресцеина. Детектирование иона Pd2+ сопровождается контрастным хромогенным naked-eye-эффектом, обусловленным появлением ярко-красной окраски раствора в ацетонитриле и увеличением интенсивности флуоресценции в 88 раз.
Палладий широко используется в различных отраслях промышленности, входит в состав наиболее важных катализаторов в современном синтезе [1, 2]. Это приводит к значительному увеличению содержания его катионов в почвах, растениях, речной и морской воде. Имеются также серьезные доказательства негативного влияния палладия на здоровье человека [3, 4]. В связи с этим возрастает потребность в экспресс-анализе содержания катионов Pd2+ в различных объектах, однако, по-прежнему, в этих целях продолжают использовать в основном дорогостоящие методы, требующие предварительной подготовки образцов, такие как атомно-абсорбционная спектрометрия, атомно-эмиссионная спектрометрия с индуктивно-связанной плазмой и др. [5]. Альтернативой является создание молекулярных хемосенсоров, как правило, эмиссионного типа [6–8].
Ранее была установлена способность производных красителей ксантенового ряда к координации с переходными металлами с образованием флуоресцентных окрашенных комплексов [6, 9, 10]. Мы осуществили синтез дифенилфосфинового производного флуоресцеина 1 конденсацией о-дифенилфосфинобензальдегида с N-аминофлуоресцеином [11] в бутаноле (схема 1). Согласно принципу ЖМКО [12], наличие в молекуле 1 трехвалентного фосфора должно способствовать координации с “мягкими” кислотами Льюиса типа Pd2+. Известно также, что наличие в молекуле электронодонорных центров P–N–O способствует образованию комплексов с палладием (II) [13].
Строение соединения 1 установлено на основании данных ИК-, ЯМР-спектроскопии, а также элементного анализа. Характерные полосы колебаний групп C=O и C=N наблюдаются при 1686 и 1634 см–1 соответственно. В спектре ЯМР 1Н синглетный сигнал протонов групп OH проявляется в области слабого поля при 9.83 м.д. Электронные спектры поглощения соединения 1 не содержат полос в видимой области спектра, что соответствует закрытой спиролактамной форме [6].
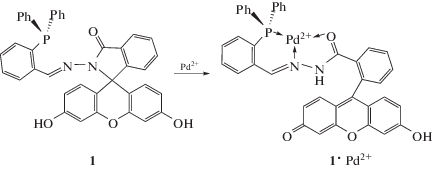
Хемосенсорная активность синтезированного дифенилфосфинового производного N-аминофлуоресцеина была изучена в растворе в ацетонитриле при добавлении солей Na+, K+, Ca2+, Ba2+, Zn2+, Hg2+, Cu2+, Cd2+, Ni2+, Co2+, Pb2+, Eu3+, Dy3+ в виде перхлоратов или ацетатов. Указанные катионы чрезвычайно слабо влияют на характер поглощения, тогда как в присутствии даже небольших количеств Pd(OAc)2 (~10–6 M) происходит изменение бесцветной окраски раствора на ярко-красную, обусловленную появлением нового длинноволнового максимума 481 нм (рис. 1). Анионы в виде солей тетрабутиламмония (TBAX, X = F, Cl, Br, I, CN, SCN, AcO, NO3, HSO4, H2PO4) также не вызывают заметного изменения спектральных свойств. Очевидно, что наблюдаемый контрастный “naked-eye” эффект следует отнести к раскрытию спирокольца и образованию комплекса 1 . Pd2+ (схема 2) [6, 10]. Одновременно происходит увеличение интенсивности флуоресценции 559 нм (I/I0 = 88), рис. 1. Малоинтенсивная флуоресценция свободного хемосенсора в области 550–560 нм связана с незначительным содержанием таутомерной открытой формы флуоресцеина 1 в растворе [14] (рис. 1, кривая 1').
Рис. 1.
Cпектры поглощения и флуоресценции соединения 1 в ацетонитриле (C = 2.5 × 10–5 M) до (1, 1') и после (2, 2') добавления Pd(OAc)2 (C = 2.5 × 10–5 M), λвозб = 470 нм.
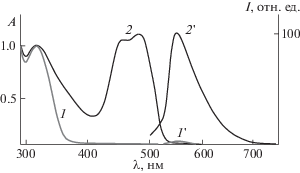
По данным спектрофотометрического титрования и метода изомолярных серий отношение компонентов образовавшихся комплексов составляет 1 : 1 (рис. 2), что характерно для большинства известных лигандов ксантенового типа [6, 9, 10], а предел чувствительности соединения 1 по отношению к катионам палладия (II) составляет 5.5 нМ.
Рис. 2.
Изменение величины оптической плотности соединения 1 на длине волны 480 нм в ацетонитриле при добавлении ионов Pd2+. Суммарная концентрация [1] + [Pd2+] = 2.5 × 10–5 M.
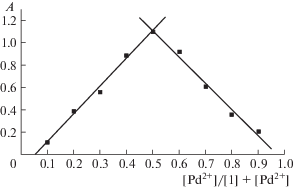
Селективность дифенилфосфинового производного N-аминофлуоресцеина 1 по отношению к катионам Pd2+ была исследована в смесях со многими конкурирующими ионами (рис. 3, 4). Полученные результаты свидетельствуют о высокой хромогенной и флуорогенной селективности полученного хемосенсора.
Рис. 3.
Относительное изменение интенсивности поглощения соединения 1 (C = 2.5 × 10–5 M) в ацетонитриле на длине волны 480 нм при добавлении конкурирующих катионов металлов (C = 2.5 × 10–5 M). Серые столбики – 1 + Mn+, черные – 1 + Pd2+ + Mn+. 1 – Pd2+, 2 – Na+, 3 – K+, 4 – Ba2+, 5 – Zn2+, 6 – Hg2+, 7 – Cu2+, 8 – Cd2+, 9 – Ni2+, 10 – Co2+, 11 – Eu3+, 12 – смесь Hg2+, Cu2+, Cd2+ и Eu3+.
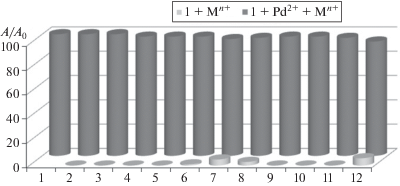
Рис. 4.
Относительное изменение интенсивности флуоресценции соединения 1 (C = 2.5 × 10–5 M) в ацетонитриле при добавлении конкурирующих катионов металлов (C = 2.5 × 10–5 M), λвозб 470 нм, λнабл 560 нм. Серые столбики – 1 + Mn+, черные – 1 + Pd2+ + Mn+. 1 – Pd2+, 2 – Na+, 3 – K+, 4 – Ba2+, 5 – Zn2+, 6 – Hg2+, 7 – Cu2+, 8 – Cd2+, 9 – Ni2+, 10 – Co2+, 11 – Eu3+, 12 – смесь Hg2+, Cu2+, Cd2+ и Eu3+.
Таким образом, дифенилфосфиновое производное N-аминофлуоресцеина представляет собой высокоэффективный селективный “naked-eye” хромогенный и флуорогенный сенсор для определения катиона палладия (II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Спектры ЯМР 1Н регистрировали на спектрометре Bruker DPX-250 в ДМСО-d6. В качестве внутреннего стандарта использовались остаточные сигналы протонов дейтерорастворителя (2.50 м.д.). ИК-спектры регистрировали с помощью спектрометра Excalibur 3100 FT-IR (“Varian Medical Systems”) методом нарушенного полного внутреннего отражения с использованием кристалла ZnSe. Электронные спектры поглощения сняты на спектрофотометре Varian Cary 100, спектры люминесценции измерены на спектрофлуориметре Varian Cary Eclipse. Для приготовления растворов использовали ацетонитрил спектральной чистоты, перхлораты и ацетаты металлов (Aldrich). Температуру плавления измеряли в стеклянных капиллярах на приборе ПТП-М (“ЛАБТЕХ”, Россия). Элементный анализ выполнен классическим методом [15].
2-((2-(Дифенилфосфино)безилиден)амино)-3',6'-дигидроспиро[изоиндолин-1,9'-ксантен]-3-он (1). К горячей суспензии N-аминофлуоресцеина [11] (0.5 г, 1.4 ммоль) в бутаноле (10 мл) добавляли раствор (0.4 г, 1.4 ммоль) о-дифенилфосфинобензальдегида в бутаноле (2 мл). В полученную смесь добавляли каталитическое количество п-толуолсульфокислоты и кипятили 5 ч. Выпавший осадок отфильтровывали, промывали бутанолом и перекристаллизовывали из этанола. Белый аморфный осадок. Тпл 298–299°С. Выход 66%. ИК-спектр (ν, см–1): 3384 (OH), 3266 (OH), 1686 (С=О), 1634 (С=N), 1621, 1604, 1502, 1447, 1300, 1269, 1236, 1159, 1106, 995, 860, 757, 745, 694. Спектр ЯМР 1Н (ДМСО-d6, δ, м.д., J/Гц): 6.39 с (4Н); 6,61 с (2Н); 6.77 дд (1H, J = 4.5, J = 7.2); 6.98–7.10 м (5H); 7.23–7.42 м (8H); 7.57 м (2H); 7.66 дд (1H, J = 4, J = 7); 7.88 д (1H, J = 7); 7.56 д (1H, J = = 6); 9.83 с (2H, OH).
Найдено, %: С 75.9; H 4.0; N 5.0; P 4.7. C39H27N2O4P.
Вычислено, %: С 75.75; H 4.37; N 4.53; P 5.00.
Список литературы
Chen X., Engle K.M., Wang D.H., et al. // Angew. Chem. Int. Ed. 2009. V. 48. P. 5094–5115.
Zeni G., Larock R.C. // Chem. Rev. 2004. V. 104. P. 2285–2310.
Wiseman C.L.S., Zereini F. // Sci. Total Environ. 2009. V. 407. P. 2493–2500.
Iavicoli I., Fontana L., Bergamaschi A. In: Encyclopedia of Environmental Health, 1st ed. / J. Nriagu, Ed. Oxford: Elsevier Science, 2011. P. 307–314.
Zhitenko L.P., Kiseleva I.N., Khomutova E.G. // Inorganic Materials. 2016. V. 52. P. 1370–1376.
Chen X., Pradhan T., Wang F., et al. // Chem. Rev. 2012. V. 112. P. 1910–1956.
Ashwin B.C.M.A., Sivaraman G., Stalin T., et al. // J. Photochem. Photobiol. B. 2018. V. 183. P. 302–308.
Chen T., Wei T., Zhang Z., et al. // Dyes Pigm. 2017. V. 140. P. 392–398.
Zheng H., Zhan X.-Q., Bian Q.-N., et al. // Chem. Commun. 2013. V. 49. P. 429–447.
Kaur B., Kaur N., Kumar S. // Coord. Chem. Rev. 2018. V. 358. P. 13–69.
Zhang J., Zhang L., Wei Y., et al. // Spectrochim. Acta A. 2014. V. 122. P. 731–736.
Pearson R.G. // Coord. Chem. Rev. 1990. V. 100. P. 403–425.
Crociani B., Antonaroli S., Burattini M., et al. // Dalton Trans. 2010. V. 39. P. 3665–3672.
Liu C., Huang S., Yao H., et al. // RSC Adv. 2014. V. 4. P. 16109–16114.
Гельман Н.Э., Терентьева Н.А., Шанина Г.М., Кипаренко Л.М., Резл В. Методы количественного органического элементного микроанализа. М.: Химия, 1987. 295 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах