Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 490, № 1, стр. 41-46
РАЗРАБОТКА В ИНТЕРЕСАХ МЕДИЦИНЫ И СЕЛЬСКОГО ХОЗЯЙСТВА БИОРАЗЛАГАЕМОГО ПОЛИМЕРА НА ОСНОВЕ ВЫСОКОМОЛЕКУЛЯРНОГО ПОЛИЛАКТИДА: МЕХАНИЧЕСКИЕ СВОЙСТВА И БИОСОВМЕСТИМОСТЬ
М. А. Севостьянов 1, 2, 3, *, М. А. Каплан 1, Е. О. Насакина 1, Л. А. Шатова 4, А. М. Царева 1, А. А. Колмакова 1, Е. В. Карадулева 5, А. В. Куликов 6, Р. М. Саримов 7, А. В. Шкирин 7, С. В. Гудков 2, 7, 8, А. П. Глинушкин 2, член-корреспондент РАН А. Г. Колмаков 1, А. С. Баикин 1
1 Институт металлургии и материаловедения
им. А.А. Байкова Российской академии наук
Москва, Россия
2 Всероссийский научно-исследовательский институт фитопатологии
Московская обл., Большие Вязёмы, Россия
3 Филиал “Угреша” государственного университета “Дубна”
Московская обл., Дзержинский, Россия
4 Воронежский государственный технический университет
Воронеж, Россия
5 Институт биофизики клетки Российской академии наук
Московская обл., Пущино, Россия
6 Институт теоретической и экспериментальной биофизики Российской академии наук
Московская обл., Пущино, Россия
7 Инcтитут общей физики им. А.М. Пpоxоpова Российской академии наук
Москва, Россия
8 Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
* E-mail: cmakp@mail.ru
Поступила в редакцию 21.10.2019
После доработки 21.10.2019
Принята к публикации 21.10.2019
Аннотация
Эффективность систем с контролируемым высвобождением активных веществ во многом определяется свойствами материалов, используемых в качестве матрицы. Коллективом авторов разработана технология получения биоразлагаемых полимерных пленок на основе высокомолекулярного полилактида с необходимыми для медицинского и сельскохозяйственного применения свойствами. Создана технология включения в пленки из высокомолекулярного полилактида активных веществ (гентамицин сульфат, линкомицин гидрохлорид, цефотаксим). В работе исследованы механические свойства полученных полимеров и их биосовместимость. Установлено, что изготовленные на основе высокомолекулярного полилактида пленки имеют высокие прочностные показатели (предел текучести порядка 49 МПа, предел прочности 54 МПа). С увеличением концентрации активных веществ прочностные показатели полимерных пленок линейно уменьшаются. Как на клеточных культурах, так и с помощью моделей имплантирования полимеров животным показано, что полученные полимеры являются биосовместимыми.
Разработка систем контролируемого высвобождения и доставки активных веществ на основе биоразлагаемых полимеров является одним из наиболее актуальных, перспективных и быстро растущих направлений химической технологии [1]. Новые полимерные материалы с такими уникальными свойствами в настоящее время необходимы во многих областях деятельности человека. В данном исследовании разработана технология получения такого полимерного материала из высокомолекулярного полилактида в интересах медицины и сельского хозяйства. В медицине полимеры, способные к длительному высвобождению активных веществ, прежде всего нужны для систем контролируемой доставки фармацевтических препаратов и для покрытия имплантатов [2]. Локальное высвобождение лекарственных веществ из биодеградируемых покрытий имплантатов способно предотвращать целый ряд послеоперационных осложнений, возникающих после имплантации. Для стентов это предотвращение рестеноза, тромбоза, обрастания и т.д. Для более массивных имплантатов – это, главным образом, предупреждение воспалительных реакций [3]. Также одной из основных задач таких полимеров является увеличение показателя биосовместимости имплантатов в целом. В агропромышленном комплексе системы с контролируемым высвобождением и доставкой активных веществ необходимы для сохранения урожая, например, для обработки фруктов, или как материалы, используемые на защищенных грунтах [4]. Поскольку и в первом, и во втором случаях полимерный материал напрямую или опосредованно может контактировать с организмом человека, необходимо обеспечить его биосовместимость. Системы контролируемой доставки активных веществ кроме свойства биосовместимости должны иметь необходимые физико-химические и механические свойства (прочность, эластичность, стабильность, газопроницаемость и т.п.).
Как мы показали ранее [5], одним из наиболее перспективных материалов для получения систем с контролируемой доставкой активных веществ является высокомолекулярный полилактид. Полилактид представляет собой алифатический полиэфир, мономером которого является 2-гидроксипропановая кислота (молочная кислота). Данное соединение представляет собой одноосновную карбоновую кислоту с тремя атомами углерода, содержащую гидроксильную группу. В настоящее время высокомолекулярный полилактид получают в основном при помощи поликонденсации 2-гидроксипропановой кислоты с последующей полимеризацией. Производство полилактида ведется из возобновляемых ресурсов, зачастую из силосообразующих сельскохозяйственных культур, что позволяет считать полилактид материалом, “дружелюбным” к окружающей среде. Полимеры на основе полилактида применяют для создания фармацевтических препаратов и их покрытий, в технологиях капсулирования, при изготовлении сорбентов и средств направленной терапии [6]. Нужно отметить, что ряд полимеров на основе полилактида используется в медицине для производства хирургических нитей, имплантатов, в том числе используемых для устранения дефектов хрящевой ткани [7]. Поиск и тестирование новых областей применения продуктов на основе полилактида продолжается до сих пор [8–10]. Нами создан ряд технологических решений получения биодеградируемых полимерных мембран и покрытий с заданными свойствами на основе высокомолекулярного полилактида, однако степень биосовместимости таких мембран пока не известна. Также не известно, годятся ли механические свойства получаемых мембран и покрытий для их применения в медицине и сельском хозяйстве. Цель данной работы заключалась в исследовании механических свойств и биосовместимости новых полимеров на основе высокомолекулярного полилактида.
Для создания основы полимерного материала использовали поли-D,L-лактид (“Sigma”, США) молекулярной массой 170–185 кДа, в качестве растворителя – хлороформ (“Иреа 2000”, Россия). Полилактид растворяли при постоянном перемешивании до гомогенного состояния в течение 1 ч при 80°С при объемном соотношении полилактид : хлороформ 1 : 100. Активные вещества размешивали в растворе полилактида после его остужения до 30°С. В качестве активных веществ для депонирования в полимер использовали гентамицин сульфат (“Мосагроген”, Россия), линкомицин гидрохлорид (“Акрихин ХФК”, Россия) и цефотаксим (“Красфарма”, Россия) в массовом соотношении 1, 3, 5 и 8%. Полимерные пленки изготавливали методом литья с последующим высушиванием под вакуумом. Полученные биодеградируемые полимерные пленки с активными веществами хранили в герметичной сухой емкости в темноте при комнатной температуре. Применяемые нами активные вещества являются антибиотиками разных групп. Гентамицин сульфат имеет широкий спектр действия, принадлежит к аминогликозидной группе, подавляет синтез белка у бактерий. Цефотаксим также эффективен в отношении многих бактерий, принадлежит к группе цефалоспоринов, ингибирует рост клеточной стенки бактерий. Линкомицин активен в отношении аэробных грамположительных бактерий, принадлежит к группе линкозамидов, подавляет бактериальный синтез белка.
Исследование механических свойств полимеров осуществляли с помощью универсальной испытательной машины Instron 3382 (США) со скоростью перемещения траверсы 10 мм/мин. Испытания полимерных пленок с определением относительного удлинения, предела текучести и прочности при растяжении проводились согласно ГОСТ 14236-81. Показано, что при увеличении концентрации антибиотиков величина относительного удлинения уменьшается. Необходимо отметить, что изменения относительного удлинения при увеличении концентрации антибиотиков в полимере довольно близки и в целом соответствуют виду y = 4.4 – bx, где y – показатель относительного удлинения, х – это концентрация антибиотика в процентах, используемая при изготовлении полимера и b – это коэффициент (–0.13 < < b < –0.05). Показатель относительного удлинения убывает в ряду гентамицин > цефотаксим > > линкомицин.
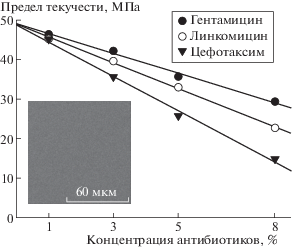
Исследована зависимость предела текучести полимерных пленок на основе высокомолекулярного полилактида от концентрации антибиотиков (рис. 1). Показано, что при увеличении концентрации антибиотиков в мембране предел ее текучести уменьшается. Изменение предела текучести для различных антибиотиков при увеличении их концентрации в целом имеет вид y = 49 – bx, где y – показатель предела текучести, х – это концентрация антибиотика в процентах, используемая при изготовлении полимера, и b – это коэффициент (–4.3 < b < –2.5). Показатель предела текучести убывает в ряду гентамицин > линкомицин > > цефотаксим.
Рис. 1.
Предел текучести полимеров на основе высокомолекулярного полилактида с добавками активных веществ в разных концентрациях. Вкладка: фотография поверхности полимера на основе высокомолекулярного полилактида.
Исследована зависимость предела прочности полимерных пленок на основе высокомолекулярного полилактида от концентрации антибиотиков (рис. 2). Показано, что при увеличении концентрации антибиотиков в мембране предел прочности уменьшается. Изменение предела прочности для различных антибиотиков при увеличении их концентрации в целом имеет вид y = = 54 – bx, где y – показатель предела прочности, х – это концентрация антибиотика в процентах, используемая при изготовлении полимера, и b – это коэффициент (–4.3 < b < –2.5). Показатель предела прочности также убывает в ряду гентамицин > линкомицин > цефотоксим.
Рис. 2.
Предел прочности полимеров на основе высокомолекулярного полилактида с добавками активных веществ в разных концентрациях. Вкладка: фотография среза полимера на основе высокомолекулярного полилактида.
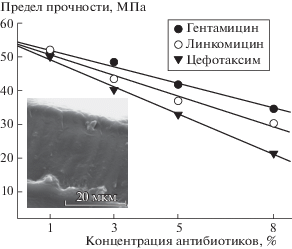
На рис. 1 и 2 изображены электронные фотографии полимера на основе высокомолекулярного полилактида с гентамицином в концентрации 8%. Как можно убедиться, и на поверхности полимера, и на его срезе не наблюдается каких-либо дефектов или неоднородностей. Структура полимера является упорядоченной. Предполагается, что полимеры с высокой степенью упорядоченности мономеров относительно друг друга обладают большей прочностью, долговечностью. Ранее в работе [6] определены показатели предела текучести и предела прочности полимеров на основе полилактида с аналогичными активными веществами. Полученные в данной работе полимеры превосходят их примерно в два раза. В целом можно утверждать, что нами получены пленки с механическими свойствами, превосходящими прямые аналоги. Несмотря на то, что полученные полимеры обладали существенной прочностью и эластичностью, об их биосовместимости было мало что известно.
При исследовании биосовместимости полимерных пленок на основе высокомолекулярного полилактида использовали как культуры клеток, так и тесты с животными. Большая часть опытов проведена с культурой клеток SH-SY5Y [11], подробности экспериментальной работы опубликованы ранее [12]. Данные о влиянии полимерных пленок на основе высокомолекулярного полилактида на жизнеспособность клеток представлены в табл. 1. Показано, что образцы поверхностей материалов не отличались от контрольных образцов. Все использованные в работе образцы материалов не оказывали достоверного токсического действия на клетки, растущие на этих материалах в течение трех суток. Таким образом, показано, что все использованные в работе полимерные пленки не оказывали краткосрочного токсического воздействия на клетки, обрастающие эти поверхности de novo.
Таблица 1.
Токсичность поверхностей полимерных пленок на основе высокомолекулярного полилактида, содержащих антибиотики
| Антибиотик | Концентрация антибиотика (%) | Количество живых клеток (%) | Количество мертвых клеток (%) |
|---|---|---|---|
| Контроль (стекло) | 96.0 ± 1.0 | 4.0 ± 1.0 | |
| Гентамицин | 1 | 96.4 ± 1.7 | 3.6 ± 1.7 |
| 3 | 95.9 ± 1.2 | 4.1 ± 1.2 | |
| 5 | 94.5 ± 1.8 | 5.5 ± 1.8 | |
| 8 | 94.6 ± 1.4 | 5.4 ± 1.4 | |
| Линкомицин | 1 | 96.3 ± 0.8 | 3.7 ± 0.8 |
| 3 | 94.9 ± 1.2 | 5.1 ± 1.2 | |
| 5 | 95.1 ± 2.1 | 4.9 ± 2.1 | |
| 8 | 95.0 ± 1.6 | 5.0 ± 1.6 | |
| Цефотаксим | 1 | 96.6 ± 1.8 | 3.4 ± 1.8 |
| 3 | 95.6 ± 1.0 | 4.4 ± 1.0 | |
| 5 | 95.3 ± 1.5 | 4.7 ± 1.5 | |
| 8 | 95.3 ± 1.4 | 4.7 ± 1.4 | |
Кроме краткосрочного токсического воздействия определен митотический индекс клеток, культивируемых на разных полимерных пленках. Митотический индекс показывает, какой процент клеток в культуре находится в состоянии деления, т. е. интенсивность деления культуры клеток. Чем выше значение митотического индекса, тем интенсивнее протекает процесс деления клеток. Значения показателя митотического индекса на поверхностях изучаемых образцов представлены на рис. 3.
Рис. 3.
Процент клеток, находящихся в процессе деления, на поверхностях полимеров на основе высокомолекулярного полилактида с добавками активных веществ в разных концентрациях.
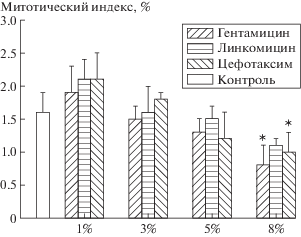
Показано, что значения митотического индекса клеток при выращивании на культуральном стекле примерно 1.6%. На всех типах полимерных пленок, содержащих 5 и менее процентов антибиотиков, митотический индекс клеток имел сопоставимые значения. Более того, при концентрации антибиотика 1% имелась тенденция к увеличению значения индекса. При концентрациях гентамицина и цефотаксима в полимерах 8% значения митотического индекса несколько уменьшаются.
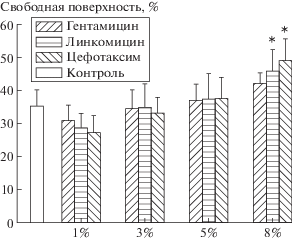
С помощью морфологического анализа культур клеток исследована степень заселенности поверхностей полимеров клетками (рис. 4). Установлено, что поверхности исследуемых полимеров пригодны для прикрепления и распластывания клеток. На поверхности всех образцов через трое суток культивирования не формируется сплошной слой из клеток, наблюдаются только отдельные элементы такого слоя. На поверхности контрольных образцов из культурального стекла также не происходит формирования сплошного слоя, клетки занимают только 65% доступной для роста поверхности. В среднем на всех исследуемых образцах клетки занимают от 60 до 70% доступной для роста поверхности. Исключением являются полимеры, содержащие 8% антибиотиков. В этом случае наибольшие незанятые поверхности наблюдаются на полимерах, содержащих 8% линкомицина (55%) и цефотаксима (50%).
Рис. 4.
Степень заселенности клетками поверхностей полимеров на основе высокомолекулярного полилактида с добавками активных веществ в разных концентрациях.
На заключительном этапе биологических испытаний проводилась подкожная имплантация полимерных пленок самцам крыс линии Вистар [13]. В послеоперационном периоде все животные чувствовали себя удовлетворительно и были выведены из эксперимента через 60 суток после операции. По периферии образцов, изготовленных из высокомолекулярного полилактида, наблюдается формирование зрелой соединительно-тканной капсулы. Капсула характеризуется превалированием внеклеточных компонентов над клеточными, регулярным расположением волокон и отсутствием сосудов. Указанные параметры согласуются с признаками частичной инволюции капсулы по периферии всего имплантированного фрагмента. Структура и толщина капсулы являются стандартными для такого типа резорбируемых образцов и свидетельствуют о признаках биосовместимости фрагментов в целом.
Таким образом, полученные нами полимерные пленки на основе высомолекулярного полилактида являются биосовместимыми, при этом их механические свойства соответствуют требованиям, предъявляемым к материалам, используемым для покрытий имплантатов. Важно отметить, что согласно обзорной работе [14] полимерные пленки на основе высокомолекулярного полилактида проявляют большую биосовместимость по сравнению с аналогичными полимерами, полученными в других коллективах ранее. Аналогичные утверждения можно делать и о механических характеристиках, полученных на основе высокомолекулярного полилактида пленок [15].
Список литературы
Zaidi S.A. // Drug Deliv. 2016. V. 23. P. 2262–2271.
Peres C., Matos A.I., Conniot J., et al. // Acta Biomater. 2017. V. 48. P. 41–57.
Sullivan M.P., McHale K.J., Parvizi J., et al. // Bone Joint. J. 2014. V. 96. P. 569–573.
Vu K.D., Hollingsworth R.G., Leroux E., et al. // Food Res. Int. 2011. V. 44. P. 198–203.
Баикин А.С., Каплан М.А., Насакина Е.О. и др. // ДАН. 2019. Т. 489. № 2. С. 152–156.
Севостьянов М.А., Насакина Е.О., Баикин А.С. и др. // Перспективные материалы. 2018. № 11. С. 39–49.
Штильман М.И. Полимеры медико-биологического назначения. М.: ИКЦ “Академкнига”, 2006. 400 с.
Bukharova T.B., Antonov E.N., Popov V.K., et al. // Bull. Exp. Biol. Med. 2010. V. 149. P. 148–153.
Li Z., Jiang Z., Zhao L., et al. // Mater. Sci. Eng. C. 2017. V. 81. P. 443–451.
Ramphul H., Bhaw-Luximon A., Jhurry D. // Carbohydr. Polym. 2017. V. 178. P. 238–250.
Sevostyanov M.A., Baikin A.S., Shatova L.A., et al. // Dokl. Chem. 2018. V. 482. P. 204–206.
Garmash S.A., Smirnova V.S., Karp O.E., et al. // J. Environ. Radioact. 2014. V. 127. P. 163–170.
Sevost'yanov M.A., Nasakina E.O., Baikin A.S., et al. // J. Mater. Sci. Mater. Med. 2018. V. 29. P. 33.
Ramot Y., Haim-Zada M., Domb A.J., et al. // Adv. Drug. Deliv. Rev. 2016. V. 107. P. 153–162.
Farah S., Anderson D.G., Langer R. // Adv. Drug. Deliv. Rev. 2016. V. 107. P. 367–392.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


