Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 492-493, № 1, стр. 35-41
Синтез нового класса макроциклических фосфорсодержащих три- и дипероксидов с участием лантаноидных катализаторов
Н. Н. Махмудиярова 1, *, И. Р. Ишмухаметова 1, А. Г. Ибрагимов 1, член-корреспондент РАН У. М. Джемилев 1
1 Институт нефтехимии и катализа
Российской академии наук
Уфа, Россия
* E-mail: natali-mnn@mail.ru
Поступила в редакцию 05.06.2020
После доработки 06.07.2020
Принята к публикации 28.07.2020
Аннотация
Разработан перспективный метод синтеза нового класса макроциклических фосфорсодержащих три- и дипероксидов каталитической реакцией рециклизации гептаоксадиспироалканов, пентаоксаканов и пентаоксадиспироалканов с фенилфосфином и последующим окислением реакционной массы с помощью Н2О2.
В мировой литературе опубликованы методы синтеза и изучение биологической активности азотсодержащих ди- и трипероксидов, в молекуле которых атом азота находится непосредственно в пероксидном цикле [1–3], а также имеются данные по получению сера- [4], кремнийсодержащих [5] пероксидов. В качестве пероксидных аналогов фосфорных соединений известны озонид трифенилфосфита [6, 7], фосфодиоксираны [8–10], бис(фосфонил)пероксиды [11], пероксиэфиры фосфорной кислоты [12], которые применяются в качестве источника синглетного кислорода в реакциях окисления олефинов [6]. Повышенный интерес к химии и фармакологии органических пероксидов обусловлен обнаруженной у последних противомалярийной [13] и противоопухолевой [14] активностью. Особое влияние на развитие исследований в этой области оказало широкое практическое применение в терапии малярии природного пероксида – артемизинина [15]. К настоящему времени синтезированы пероксидные соединения различной структуры и широко изучены их биологические свойства: гексаоксонаны [16], тетраоксаны [17], озониды [18], триоксаны [19], которые обладают противомалярийной активностью, сопоставимой или превосходящей активность артемизинина [15].
На момент начала наших исследований сведения о методах синтеза макроциклических фосфорсодержащих три- и дипероксидов в литературе полностью отсутствовали.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Одномерные спектры 1Н и 13С ЯМР, а также двумерные гомо- (COSY) и гетероядерные (1H–13C HSQC, 1H–13C HMBC) спектры зарегистрированы на спектрометре Bruker Avance 500 (500 МГц для ядер 1Н, 126 МГц для ядер 13С, если не указано иначе) в CDCl3 при 25°C по стандартным методикам фирмы Bruker (Германия), внутренний стандарт ТМС. Mасс-спектры MALDI TOF/TOF положительных ионов (матрица – синапиновая кислота) записаны на масс-спектрометре Bruker АutoflexTM III Smartbeam. Подготовка проб для регистрации масс-спектров проведена по методике “сухой капли”: в отдельной пробирке смешивали растворы матричного и анализируемого веществ в соотношениях от 50 : 1 до 100 : 1, после этого каплю раствора наносили на мишень и сушили потоком теплого воздуха. Пробу с мишени переводили в газовую фазу с помощью лазерных импульсов (200 импульсов с частотой 100 Гц). В качестве источника лазерного излучения применяли твердотельный УФ-лазер с длиной волны излучения 355 нм. Контроль за ходом реакций осуществляли методом тонкослойной хроматографии (ТСХ) на пластинах Sorbfil (ПТСХ-АФ-В), элюент гексан : EtOAc = 10 : 1, проявление в парах I2.
Исходный фенилфосфин (Acros) использовали в виде 60% раствора в гексане. Тетрагидрофуран, гексан, EtOAc, петролейный эфир, Et2O (марки “ч.”) перегоняли перед использованием. Пероксид водорода марки “тех.”, концентрация 31.6%. Реагенты I2, MgSO4 марки “ч.”. Синтез гептаоксадиспироалканов 1, 4, 5 [2] и пентаоксаканов 8–11 [1] осуществлен согласно описанным методикам.
Реакция рециклизации гептаоксадиспироалканов и пентаоксаканов с фенилфосфином в присутствии катализатора La(NO3)3 · 6H2O. Общая методика. В трехгорлую колбу, снабженную магнитной мешалкой, в инертной среде загружали ТГФ (5 мл), La(NO3)3 · 6H2O (0.5 ммоль) и гептаоксадиспироалканы 1, 4, 5 (пентаоксаканы 8–11) (10 ммоль). Смесь перемешивали при 20°С в течение 1 ч, затем добавляли фенилфосфин (10 ммоль), полученную реакционную массу перемешивали в течение 5 ч при 20°С. Для окисления образовавшихся в условиях реакции циклических трипероксифосфинов добавляли H2O2 (5 мл) и CH2Cl2 (5 мл). Органический слой отделяли, сушили над безводным MgSO4 и концентрировали для последующего выделения стабильных при комнатной температуре циклических трипероксифосфиноксидов 3, 6, 7 и дипероксифосфиноксидов 12–15. Продукты реакции очищали с помощью колоночной хроматографии на SiO2, используя в качестве элюэнта смесь петролейный эфир : Et2O = = 10 : 1. Ход реакций контролировали с помощью тонкослойной хроматографии, элюэнт – смесь гексан : EtOAc = 5 : 1, визуализацию проводили парами йода.
16-фенил-6,7,13,14,18,19-гексаокса-16-фосфадиспиро[4.2.48.75]нонадекан 16-оксид 3. Б/ц масло; 0.34 г (выход 90%). 1H ЯМР (400 MГц, CDCl3, 25°C, δ, м. д.): 1.35–1.37 (м, 8Н, CH2), 1.92–2.12 (м, 8H, CH2), 3.69–4.12 (м, 4Н, CH2), 7.16–7.54 (м, 5Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 21.9, 26.5, 67.5 (д, J = 27 Гц), 107.5, 128.1 (д, J = = 10 Гц), 130.7 (д, J = 10 Гц), 132.47, 157.6. 31P ЯМР (500 MГц, CDCl3, 25°C, δ, м. д.): 20.4. MALDI TOF/TOF, m/z: 383 [M–H]+.
3,12-диметил-18-фенил-7,8,15,16,20,21-гексаокса-18-фосфадиспиро[5.2.59.76]геникозан 18-оксид 6. Б/ц масло; 0.29 г (выход 68%). 1H ЯМР (400 MГц, CDCl3, 25°C, δ, м. д.): 0.83–0.88 (м, 6Н, CH3), 1.35–1.40 и 2.10–2.13 (м, 10H, CH2, CH), 1.14–1.18 и 1.48–1.54 (м, 8H, CH2), 3.89–4.29 (м, 4Н, CH2), 7.45–7.74 (м, 5Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 21.4, 29.1, 30.6, 34.6, 67.7 (д, J = 36 Гц), 107.7, 128.8 (д, J = 11 Гц), 131.0 (д, J = = 10 Гц), 132.1, 158.2. 31P ЯМР (500 МГц, CDCl3, 25°C): δ = 22.0. MALDI TOF/TOF, m/z: 439 [M–H]+.
20-фенил-8,9,17,18,22,23-гексаокса-20-фосфадиспиро[6.2.610.77]трикозан 20-оксид 7. Б/ц масло; 0.34 г (выход 79%). 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м. д.): 1.12–1.92 (м, 24Н, CH2), 3.78–4.21 (м, 4Н, CH2), 7.38–7.81 (м, 5Н, CH). 13C ЯМР (100 МГц, CDCl3, 25°C, δ, м. д.): 24.1, 30.3, 32.8, 67.6 (д, J = 33 Гц), 106.0, 128.4 (д, J = 11 Гц), 130.5 (д, J = 10 Гц), 132.5, 158.9. 31P ЯМР (500 МГц, CDCl3, 25°C, δ, м. д.): 23.2. MALDI TOF/TOF, m/z: 439 [M–H]+.
9-фенил-6,7,11,12-тетраокса-9-фосфаспиро[4.7]до- декан 9-оксид 12. Б/ц масло; 0.28 г (выход 94%). 1H ЯМР (400 MГц, CDCl3, 25°C, δ, м. д.): 1.86–1.94 (м, 4Н, CH2), 2.15–2.18 (м, 4H, CH2), 3.74–3.76 (м, 4Н, CH2), 7.39–7.49 (м, 2Н, CH), 7.55–7.58 (м, 1Н, CH), 7.74–7.82 (м, 2Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 25.5, 33.8, 67.8 (д, J = 30 Гц), 107.3, 128.6 (д, J = 11 Гц), 130.7 (д, J = 11 Гц), 132.9, 163.9. 31P ЯМР (500 MГц, CDCl3, 25°C, δ, м. д.): 25.1. MALDI TOF/TOF, m/z: 283 [M–H]+.
10-фенил-7,8,12,13-тетраокса-10-фосфаспиро[5.7]тридекан 10-оксид 13. Б/ц масло; 0.27 г (выход 90%). 1H ЯМР (400 MГц, CDCl3, 25°C, δ, м. д.): 1.43–1.48 (м, 2Н, CH2), 1.54–1.60 (м, 4H, CH2), 1.76–1.89 (м, 4H, CH2), 3.94–4.12 (м, 4Н, CH2), 7.46–7.47 (м, 2Н, CH), 7.54–7.56 (м, 1Н, CH), 7.74–7.78 (м, 2Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 22.4, 25.3, 29.8, 67.7 (д, J = 30 Гц), 106.1, 128.7 (д, J = 10 Гц), 130.7 (д, J = 11 Гц), 132.9, 163.3. 31P ЯМР (500 MГц, CDCl3, 25°C, δ, м. д.): 23.2. MALDI TOF/TOF, m/z: 297 [M–H]+.
3-метил-10-фенил-7,8,12,13-тетраокса-10-фосфаспиро[5.7]тридекан 10-оксид 14. Б/ц масло; 0.27 г (выход 87%). 1H ЯМР (400 МГц, CDCl3, 25°C, δ, м. д.): 0.83–0.93 (м, 3Н, CH3), 1.40–1.44 и 2.12–2.15 (м, 5H, CH2, СН), 1.12–1.21 и 1.54–1.57 (м, 4H, CH2), 3.90–4.06 (м, 4Н, CH2), 7.14–7.76 (м, 5Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 21.4, 29.1, 30.7, 31.6, 67.7 (д, J = 30 Гц), 107.8, 128.7 (д, J = 11 Гц), 130.8 (д, J = 10 Гц), 132.9, 163.0. 31P ЯМР (500 MГц, CDCl3, 25°C, δ, м. д.): 24.4. MALDI TOF/TOF, m/z: 311 [M–H]+.
11-фенил-8,9,13,14-тетраокса-11-фосфаспиро[6.7]тетрадекан 11‑оксид 15. Б/ц масло; 0.25 г (выход 83%). 1H ЯМР (400 MГц, CDCl3, 25°C, δ, м. д.): 1.03–1.55 (м, 10Н, CH2), 1.97–2.11 (м, 4H, CH2), 3.58–3.97 (м, 4Н, CH2), 7.05–7.22 (м, 3Н, CH), 7.44–7.50 (м, 2Н, CH). 13C ЯМР (100 MГц, CDCl3, 25°C, δ, м. д.): 24.4, 25.3, 26.8, 41.4, 67.4 (д, J = 30 Гц), 105.7, 128.3 (д, J = 11 Гц), 130.3 (д, J = = 10 Гц), 132.9, 163.3. 31P ЯМР (500 MГц, CDCl3, 25°C, δ, м. д.): 23.2. MALDI TOF/TOF, m/z: 311 [M–H]+.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В связи с высокой противомалярийной активностью пероксидных гетероциклов [13, 14], а также отсутствием в литературе сведений о методах синтеза циклических фосфорсодержащих трипероксидов, целью данного исследования являлась разработка селективного метода синтеза неописанных в литературе замещенных гексаоксафосфациклоалканов. В основу исследования положена ранее осуществленная нами реакция рециклизации гептаоксадиспироалканов с первичными ариламинами в присутствии Sm‑содержащих катализаторов [2], приводящая к устойчивым азатрипероксидам. Мы предположили, что при замене анилина на фенилфосфин в реакциях с гептаоксадиспироалканами удастся осуществить синтез циклических фосфорсодержащих трипероксидов.
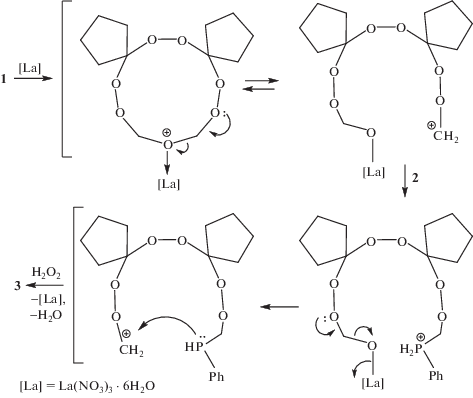
Для проверки этого предположения нами была проведена реакция рециклизации гептаокса-спироалканов [2] с фенилфосфином с участием Sm‑содержащих катализаторов. В результате было установлено, что реакция рециклизации 6,7,13,14,16,18,19-гептаоксадиспиро[4.2.48.75]нонадекана [2] 1 с фенилфосфином 2 под действием Sm(NO3)3 · 6H2O в качестве катализатора в течение 6 ч при комнатной температуре в растворителе Et2O и последующим окислением реакционной массы с помощью H2O2 приводит к обра-зованию циклического 16-фенил-6,7,13,14,18,19-гексаокса-16-фосфадиспиро[4.2.48.75]нонадекан 16-оксида 3 практически с количественным выходом (схема 1).
Схема 1.
Синтез соединения 3. Стадии реакции: 1) – рециклизация, 2) –окисление циклического трипероксифосфина.
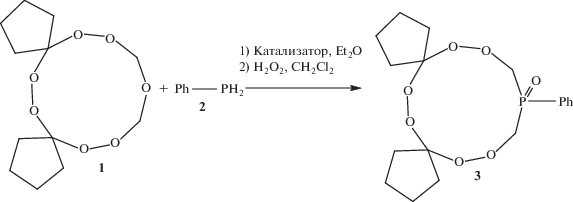
В отсутствие катализатора реакция не проходит (табл. 1). При проведении реакции с участием в качестве катализатора La(NO3)3 · 6H2O после обработки реакционной массы Н2О2, используемой в качестве окислителя, выход циклического трипероксифосфиноксида 3 составил 90%. Как следует из табл. 1, применение в качестве катализаторов солей лантанидов способствует образованию продукта 3 с выходами 78–87%. Кислоты Льюиса (AlCl3, BF3 · 6H2O, апротонный I2, фосфорномолибденовая кислота), кислоты Бренстеда (HCl, H2SO4), которые применяются в синтезе циклических пероксидов [5], не проявили высокой каталитической активности при получении фосфорсодержащего трипероксида 3 (табл. 1). Из числа испытанных катализаторов наибольшую активность проявляет La(NO3)3 · 6H2O (выход соединения 3 составил 90%, табл. 1). Реакцию проводили в Et2O из-за хорошей растворимости в последнем исходного 6,7,13,14,16,18,19-гептаоксадиспиро[4.2.48.75]нонадекана 1. Данные спектров 1Н и 13С ЯМР соединения 3 подтверждают его строение. В частности, мультиплетный сигнал при δ 3.69–4.12 м. д., а также дублетный сигнал углеродного атома при δ 67.5 м. д., свидетельствуют о наличии фрагмента –P(О)–CH2–O– в цикле. Данные сигналы отражают процесс циклической интерконверсии в растворе, поэтому мы наблюдаем набор сигналов с близкими химическими сдвигами для каждого из индивидуальных соединений. Эффект расщепления сигналов ЯМР атомов цикла обусловлен, очевидно, наличием при комнатной температуре поликомпонентного конформационного равновесия, которое можно предположить на основании литературных данных по идентификации известных трипероксидов [2]. Мультиплеты при δ 1.35–1.37, 1.92–2.12 и 7.16–7.54 м. д. относятся к циклопентановому и фенильному кольцам 16-фенил-6,7,13,14,18,19-гексаокса-16-фосфадиспиро[4.2.48.75]нонадекан 16-оксида 3, а сигнал sp3‑гибридизованного атома углерода, несущего две кислородные функции, проявляется в области δ 107.5 м. д. В масс-спектре MALDI-TOF TOF соединения 3 присутствует пик молекулярного иона m/z 383 [M–H]+ (55%).
Таблица 1.
Влияние природы катализатора на выход продукта 3 (концентрация катализатора 5 мол. %, 20°С, 6 ч, Et2O)
| Катализатор | Выход 3, % | Катализатор | Выход 3, % |
|---|---|---|---|
| La(NO3)3 · 6H2O | 90 | Sm(NO3)3 · 6H2O | 70 |
| Er(OAc)3 · 4H2O | 87 | BF3 · 6H2O | 25 |
| Ho(NO3)3 · 5H2O | 86 | CsOH | 15 |
| TbCl3 · 6H2O | 85 | AlCl3 | <10 |
| PrCl3 · 6H2O | 84 | I2 | <10 |
| NdCl3 · 6H2O | 83 | H2SO4 | <10 |
| GdCl3 · 6H2O | 80 | Фосфорномолибденовая кислота | <10 |
| Eu(NO3)3 · 6H2O | 80 | НСl | <10 |
| DyCl3 · 6H2O | 78 | – | 0 |
Для синтеза новых спиросочлененных циклических фосфорсодержащих трипероксидов в реакции с фенилфосфином 2 были использованы гептаоксадиспироалканы [2]: 3,12-диметил-7,8,15,16,18,20,21-гептаоксадиспиро-[5.2.59.76]геникозан 4 и 8,9,17,18,20,22,23-гептаоксадиспиро[6.2.610.77]трикозан 5 (схема 2).
Схема 2.
Синтез соединения 3. Условия реакции: [La(NO3)3 · 6H2O] = 5 мол. %, 20°С, 6 ч. Стадии реакции: 1) – рециклизация, 2) – окисление циклического трипероксифосфина.
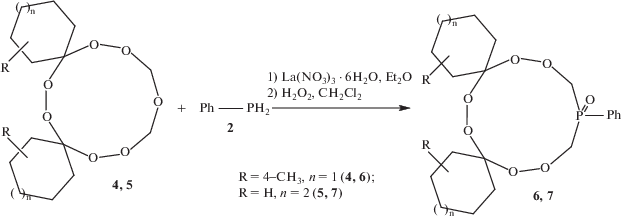
Проведение реакции рециклизации гептаоксадиспироалканов 4, 5 и последующее окисление образовавшихся циклических трипероксифосфинов с помощью H2O2 позволили осуществить синтез 3,12-диметил-18-фенил-7,8,15,16,20,21-гекса-окса-18-фосфодиспиро[5.2.59.76]геникозан 18-оксида 6 и 20-фенил-8,9,17,18,22,23-гексаокса-20-фосфодиспиро[6.2.610.77]трикозан 20-оксида 7 с выходами 68 и 79% соответственно. Продукты выделены в чистом виде фильтрованием реакционной массы через тонкий слой силикагеля и последующим упариванием растворителя. Структуры синтезированных фосфатрипероксидов надежно установлены методами 1Н и 13С ЯМР, MALDI-TOF/TOF спектроскопии.
Согласно [20, 21] можно предположить, что вероятный механизм реакции образования соединения 3 включает координирование геминального атома кислорода к иону центрального атома катализатора с раскрытием гептаоксаканового цикла. Нуклеофильное присоединение фенилфосфина 2 к образовавшемуся карбокатиону приводит к образованию иона фосфония, последующее отщепление молекулы воды и элиминирование иона металла способствует внутримолекулярной циклизации с формированием после окисления перекисью водорода целевого продукта 3 (схема 3).
Для расширения области применения разработанного метода синтеза тетраоксафосфациклоалканов мы изучили влияние строения исходных пентаоксаканов на реакцию рециклизации. В качестве пентаоксаканов [1] использовали 6,7,9,11,12-пентаоксаспиро[4.7]додекан 8, 7,8,10,12,13-пентаоксаспиро[5.7]тридекан 9, 4-метил-7,8,10,12,13-пентаоксаспиро[5.7]тридекан 10, 8,9,11,13,14-пентаоксаспиро[6.7]тетрадекан 11 (схема 4).
Схема 4.
Реакция рециклизации пентаоксаканов. Условия реакции: [La(NO3)3 · 6H2O] = 5 мол. %, 20°С, 6 ч). Стадии реакции: 1) – рециклизация, 2) – окисление циклического трипероксифосфина.
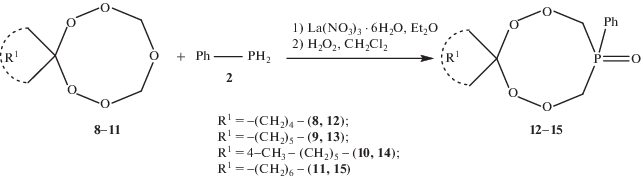
Установили, что в разработанных условиях выход фосфиноксиддипероксидов 12–15 составил 83–94%.
Таким образом, разработан высокоселективный метод синтеза нового класса макроциклических фосфорсодержащих три- и дипероксидов, представляющих практический интерес для создания современных противомалярийных препаратов. Предложенный метод открывает новые перспективы для разработки методов синтеза других гетероатом- и металлсодержащих три- и дипероксидов многоцелевого назначения.
Список литературы
Makhmudiyarova N.N., Khatmullina G.M., Rakhimov R.Sh., et al. The first example of catalytic synthesis of N-aryl-substituted tetraoxazaspiroalkanes // Tetrahedron. 2016. V. 72. P. 3277–3281. https://doi.org/10.1016/j.tet.2016.04.055
Makhmudiyarova N.N., Ishmukhametova I.R., Tyumkina T.V., et al. Synthesis of N-aryl-hexaoxazadispiroalkanes using lanthanide catalysts // Tetrahedron Lett. 2018. V. 59. P. 3161–3164. https://doi.org/10.1016/j.tetlet.2018.07.010
Makhmudiyarova N.N., Ishmukhametova I.R., Dzhemileva L.U., et al. Synthesis and anticancer activity novel dimeric azatriperoxides // RSC Adv. 2019. V. 9. P. 18923–18929. https://doi.org/10.1039/C9RA02950H
Makhmudiyarova N., Ishmukhametova I., Dzhemileva L., D’yakonov V., Ibragimov A., Dzhemilev U. First example of catalytic synthesis of cyclic S-containing di- and triperoxides // Molecules. 2020. V. 25. P. 1874. https://doi.org/10.3390/molecules25081874
Arzumanyan A.V., Novikov R.A., Terent’ev A.O., et al. Nature chooses rings: Synthesis of silicon-containing macrocyclic peroxides // Organometallics. 2014. V. 33. P. 2230–2246. https://doi.org/10.1021/om500095x
Bartlett P.D., Lonzetta C.M. Successive displacements of phenoxy by methoxy groups in triphenyl phosphite ozonide: Mechanism of the accelerated singlet oxygen formation with pyridine and methanol // J. Am. Chem. Soc. 1983. V. 105. P. 1984–1988. https://doi.org/10.1021/ja00345a054
Itzstein M., Jenkins I.D. A novel phosphorus → oxygen phenyl migration: triphenylphosphine dioxide as a reaction intermediate // J. Chem. Soc., Chem. Commun. 1983. P. 164–165. https://doi.org/10.1039/C19650000587
Ho D.G., Gao R., Celaje J., et al. Phosphadioxirane: A peroxide from an ortho-substituted arylphosphine and singlet dioxygen // Science. 2003. V. 302. P. 259–263. https://doi.org/10.1126/science.1089145
Mardyukov A., Niedek D., Schreiner P.R. Preparation and characterization of parent phenylphosphinidene and its oxidation to phenyldioxophosphorane, the elusive phosphorous analogue of nitrobenzene // J. Am. Chem. Soc. 2017. V. 139. № 14. P. 5019–5022. https://doi.org/10.1021/jacs.7b01639
Zhang D., Gao R., Afzal S., et al. Intramolecular arene epoxidation by phosphadioxiranes // Org. Lett. 2006. V. 8. P. 5125–5128. https://doi.org/10.1021/ol0622007
Korth H.-G., Lommes P. The mechanistic diversity of the thermal and photochemical decomposition of bis(phenylphosphonoy1) peroxides: concerted polar, homolytic, and electron-transfer processes on the reactivity of (phenylphosphonoyl)oxyl radicals // Chem. Ber. 1992. V. 125. P. 2419–2437. https://doi.org/10.1002/cber.19921251114
Sosnovsky G., Zaret E.H. Reactions of tert-butylperoxy esters. VIII. Preparation of dialkyl tert-butylperoxy phosphates // J. Org. Chem. 1969. V. 34. P. 968–970. https://doi.org/10.1021/jo01256a042
Klayman D.L. Artemisia annua: From weed to respectable antimalarial plant // ACS Symp. Ser. 1993. V. 534. P. 242–255. https://doi.org/10.1021/bk-1993-0534.ch017
Vil’ V.A., Yaremenko I.A., Ilovaisky A.I., Terent’ev A.O. Synthetic strategies for peroxide ring construction in artemisinin // Molecules. 2017. V. 22. P. 117–136. https://doi.org/10.3390/molecules22010117
Dong Y., Chollet J., Matile H., et al. Spiro and dispiro-1,2,4-trioxolanes as antimalarial peroxides: Charting a workable structure-activity relationship using simple prototypes // J. Med. Chem. 2005. V. 48. P. 4953–4961. https://doi.org/10.1021/jm049040u
O’Neil P.M. The therapeutic potential of semi-synthetic artemisinin and synthetic endoperoxide antimalarial agents // Expert Opin. Investig. Drugs, 2005. V. 14. P. 1117–1128. https://doi.org/10.1517/13543784.14.9.1117
Tang Y., Dong Y., Wittlin S., et al. Weak base dispiro-1,2,4-trioxolanes: Potent antimalarial ozonides // Bioorg. Med. Chem. Lett. 2007. V. 17. 1260–1265. https://doi.org/10.1016/j.bmcl.2006.12.007
Dong Y., Wittlin S., Sriraghavan K., et al. The Structure-activity relationship of the antimalarial ozonide arterolane (OZ277) // J. Med. Chem. 2010. V. 53. № 1. P. 481–491. https://doi.org/10.1021/jm901473s
Padmanilayam M., Scorneaux B., Dong Y., et al. Antimalarial activity of N-alkyl amine, carboxamide, sulfonamide, and urea derivatives of a dispiro-1,2,4-tri-oxolane piperidine // Bioorg. Med. Chem. Lett. 2006. V. 16. P. 5542–5545. https://doi.org/10.1016/j.bmcl.2006.08.046
Pearson R.G. Hard and soft acids and bases // J. Am. Chem. Soc. 196. V. 85. P. 3533–3539. https://doi.org/10.1021/ja00905a001
Denekamp C., Gottlieb L., Tamiri T., et al. Two separable conformers of TATP and analogues exist at room temperature // Org. Lett. 2005. V. 7. P. 2461–2464. https://doi.org/10.1021/ol050801c
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах