Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 492-493, № 1, стр. 64-69
Условия синтеза и структура слоистых манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd)
Л. Б. Ведмидь 1, 2, *, О. М. Федорова 1, член-корреспондент РАН В. Ф. Балакирев 1
1 Институт металлургии Российской академии наук
Екатеринбург, Россия
2 Уральский федеральный университет
Екатеринбург, Россия
* E-mail: elarisa100@mail.ru
Поступила в редакцию 29.04.2020
После доработки 25.06.2020
Принята к публикации 28.07.2020
Аннотация
В данной работе впервые предложены условия синтеза поликристаллических слоистых манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd) орторомбической структуры (пространственная группа Fmmm), имеющих определенную кислородную нестехиометрию: температура, парциальное давление кислорода в газовой атмосфере, продолжительность нагрева. Методами высокотемпературной рентгенографии и дифференциальной сканирующей калориметрии определены температурные границы фазового перехода: из орторомбической структуры (пространственная группа Fmmm) в тетрагональную (пространственная группа I4/mmm). Температура структурного перехода увеличивается с ростом атомного номера входящего в манганит редкоземельного металла.
Перовскиты редкоземельных элементов (РЗМ) Ln2BaMn2O7 (Ln = РЗМ), имеющие слоистую структуру Руддлесдена–Поппера (РП) и относящиеся к гомологической фазе AO(ABO3)2, впервые были синтезированы Deshizeaux Cheruy и Joubert [1]. Соединения, относящиеся к этому структурному типу, представляют значительный интерес благодаря ряду уникальных свойств, одним из которых является эффект колоссального магнитосопротивления [2, 3]. При температурах выше комнатной они проявляют свойства парамагнетиков [4]. Это дает возможность применения их в различных областях электроники. Свойства этих оксидов могут быть обусловлены соотношением поливалентных ионов марганца [5]. Варьировать содержание кислорода в образцах можно изменением давления кислорода при изотермическом отжиге материалов или изменением температуры заключительного отжига, при фиксированном давлении кислорода в газовой среде. Поэтому основными параметрами, оказывающими влияние на структуру и стабильность сложных оксидов, являются температура, газовая атмосфера синтеза и его продолжительность. Последовательность термических трансформаций перовскитов Ln2BaMn2O7 при изменении условий синтеза изучали Kamegashira с соавторами [6–12].
Синтез однофазных оксидов достаточно сложен, так как при нагреве в них наблюдается ряд фазовых структурных превращений, которые зависят от парциального давления кислорода во время нагрева, скорости охлаждения образцов и других факторов. Изменение в кристаллической структуре может оказывать влияние на функциональные свойства манганитов. Поэтому актуально стоит задача разработки условий синтеза манганитов Ln2BaMn2O7 и исследование их устойчивости при изменении внешних параметров. Ранее синтез, традиционно, проводили из исходных компонентов Ln2O3, BaCO3 и Mn2O3, смешанных в соответствующем молярном соотношении [1, 6–12]. Смесь прессовали в таблетки и спекали в температурном диапазоне 800–1200°С в течение 24 ч в атмосфере очищенного аргона с одновременным удалением продукта реакции CO2. На следующем этапе таблетки спекали в изотермических условиях при температуре 1350°С в течение 48 ч в атмосфере аргона, затем медленно охлаждали до комнатной температуры. В результате были получены монокристаллы и поликристаллические образцы Ln2BaMn2O7 (Ln = Pr, Nd, Sm, Eu, Gd, Tb), имеющие различную структуру от орторомбической до тетрагональной. Одним из недостатков этого способа синтеза является достаточно высокая температура спекания при значительной общей продолжительности процесса. Вторым – образование побочного продукта реакции – газа CO2 – и необходимость его отведения. Третьим – отсутствие возможности контроля величины парциального давления кислорода при спекании. Целью работы на первом этапе являлось преодоление этих недостатков, т.е. оптимизация условий синтеза гомогенных манганитов РЗМ Ln2BaMn2O7 – δ (Ln = Pr, Nd), а также определение их структурных термических переходов. На сегодняшний день достаточно хорошо изучены свойства (структурные, магнитные) слоистых Sr-содержащих манганитов LnSr2Mn2O7 (Ln = La, Nd, Gd) [2–4, 13], но сведения о физических свойствах Ba-содержащих фаз РП, необходимые для их практического применения, малочисленны. Поэтому в дальнейшем запланировано изучение физических свойств Ln2BaMn2O7 – δ (Ln = Pr, Nd) с целью практического применения.
В настоящей работе для синтеза Ba-содержащих фаз РП Ln2BaMn2O7 – δ (Ln = Pr, Nd) впервые использован способ термической обработки соответствующих оксидов в газовой среде с фиксированным пониженным содержанием кислорода и предварительной коррекцией атомного соотношения катионов металлов в исходной смеси. Впервые установлены условия получения орторомбических слоистых манганитов Pr2BaMn2O7 – δ и Nd2BaMn2O7 – δ с определенной кислородной нестехиометрией и определены границы их термической стабильности.
МАТЕРИАЛЫ И МЕТОДЫ
Синтез соединений Ln2BaMn2O7 – δ (Ln = Pr, Nd) проведен по керамической технологии из оксидов Nd2O3, Pr6O11 (Merck Aldrich, 99.9%), Mn2O3 (Sigma Aldrich, 99.9%) и BaO2 квалификации “ос. ч.”. Для удаления адсорбированной влаги исходные компоненты предварительно прокаливали при Т = 500°С в течение 8 ч, затем их необходимое количество тщательно перемешивали, прессовали при давлении 150 МПа в таблетки и подвергали двухстадийной термической обработке, с последующим охлаждением внутри печи со скоростью 5 град./мин в установке, описанной в [14]. В качестве газовой среды использовали смесь аргона и кислорода с автоматическим поддержанием на протяжении всего опыта значения парциального давления кислорода $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{}}$ = 10–5 атм. Продолжительность первой стадии термической обработки составила 24 ч при Т = 900°С, второй – 48 ч при Т = 1300°С. Фазовый состав исходных образцов и продуктов их диссоциации исследовали на дифрактометре XRD-7000 (Shimadzu, Япония) в Cu Kα-излучении в диапазоне углов 20°–70° по 2θ с шагом 0.03° и выдержкой в точке 2 с. Точность рентгенографического определения содержания фаз составляет 2%. Высокотемпературные рентгеновские исследования проведены с помощью приставки НА-1001 (Shimadzu, Япония) при нагреве в интервале температур 20–350°С для Ln2BaMn2O7 (Ln = Pr, Nd). Скорость нагрева 10 град./мин, выдержка при каждой температуре 10 мин. Съемка проводилась в диапазоне углов 20°–70° по 2θ с шагом 0.02° и выдержкой в точке 1.5 сек. Параметры ячейки определяли с помощью программы “Рентгеноструктурный табличный процессор” (RTP) [15], в качестве модели орторомбической структуры использовали данные [10]. Изучение термических свойств образцов выполнено на приборе синхронного термического анализа STA 449 F3 Jupiter (NETZSCH, Германия). Эксперимент проведен в режиме линейного нагрева от комнатной температуры до 500°C со скоростью 5 град./мин, в атмосфере аргона. В качестве контейнера использовали тигли из Al2O3 c крышками, погрешность измерения температуры составляет не более ±1.5°С. Абсолютное содержание кислорода в образцах определяли в вакуумной циркуляционной установке [16]. Для этого их предварительно взвешивали, затем нагревали до 800°C и выдерживали при этой температуре в течение 70 ч в атмосфере с парциальным давлением кислорода $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{}}$ = 10–25 атм. Это обеспечило их восстановление до стабильных оксидов. Полнота восстановления подтверждена с помощью рентгенофазового анализа (РФА) закаленных продуктов этого процесса. Для расчетов принято, что потеря массы после восстановления вызвана только удаленным кислородом, продукты восстановления являются стехиометрическими.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На первой стадии синтеза при Т = 900°С происходит образование центров основной (целевой) фазы Ln2BaMn2O7 – δ и промежуточных соединений Ln0.7Ba0.3MnO3 и Ln2O3 (Ln = Pr, Nd) (рис. 1а). Увеличение продолжительности термообработки не приводит к получению гомогенного продукта синтеза или увеличению центров образования целевой фазы и поэтому нецелесообразно; проведение синтеза при Т < 900°С ведет к уменьшению количества синтезируемого манганита. Вторая стадия синтеза осуществлялась при температуре 1300°С в течение 48 ч, при этом происходило окончательное формирование целевой фазы. При стехиометрическом соотношении компонентов основным продуктом синтеза, по данным РФА, являлась целевая фаза, наряду с которой идентифицировалась примесная фаза оксида РЗМ Ln2O3 (Ln = Pr, Nd). На рис. 1б это представлено на примере оксида Nd2BaMn2O7 – δ.
Рис. 1.
Дифрактограммы образца Nd2BaMn2O7 – δ, после (а) первой (Т = 900°С) и (б) второй (Т = 1300°С) стадий синтеза. Обозначения фаз: 1 – Nd0.7Ba0.3MnO3, 2 – Nd2O3, 3 – Nd2BaMn2O7–δ, 4 – Mn2O3. Стрелками обозначены центры зарождения целевой фазы.
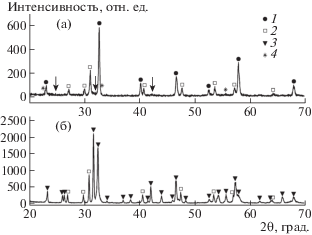
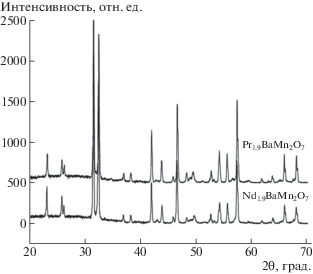
Для получения гомогенного продукта было необходимо изменить содержание того компонента, который присутствовал дополнительно к основной фазе. Поэтому cоотношение исходных компонентов скорректировали, чтобы выполнялось условие атомного соотношения катионов Nd : Ba : Mn = 1.9 : 1.0 : 2.0. Полученные двухстадийным отжигом по описанным условиям поликристаллические манганиты Ln2BaMn2O7 – δ (Ln = Pr, Nd), являются гомогенными. Они имеют орторомбическую структуру и принадлежат к пространственной группе (пр. гр.) Fmmm (рис. 2).
Рис. 2.
Дифрактограммы гомогенных оксидов Ln2BaMn2O7 – δ (Ln = Pr, Nd), полученных при температуре 1300°С.
Кислородная нестехиометрия манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd) определена статическим методом [16] путем восстановления водородом до стабильных оксидов по схеме:
Таблица 1.
Кристаллографические данные гомогенных манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd)
| Соединение | Пространственная группа | Параметры ячейки | |
|---|---|---|---|
| $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{}}$ = 10–5 атм | $P_{{{{{\text{O}}}_{{\text{2}}}}}}^{{}}$ = 10–5.2 атм | ||
| Pr2BaMn2O6.97 | Fmmm | a = 5.4957(1) | a = 5.4982(1) |
| b = 5.5055(2) | b = 5.5074(2) | ||
| c = 20.66(1) | c = 20.65(1) | ||
| V = 625.05(1) | V = 625.4(1) | ||
| Nd2BaMn2O6.97 | Fmmm | a = 5.5098(2) | a = 5.5043(1) |
| b = 5.5139(2) | b = 5.5137(2) | ||
| c = 20.62(1) | c = 20.59(1) | ||
| V = 626.37(1) | V = 624.8(1) | ||
Температурные трансформации в манганитах Ln2BaMn2O7 – δ (Ln = Pr, Nd) исследованы методами высокотемпературной рентгенографии (ВРФА) и дифференциальной сканирующей калориметрии (ДСК).
В образцах Ln2BaMn2O7 – δ (Ln = Pr, Nd) обнаружен переход из орторомбической структуры в тетрагональную Fmmm → I4/mmm (рис. 3), температуры перехода указаны штриховой линией по данным высокотемпературного рентгенофазового анализа. На кривых ДСК этот переход проявляется эндотермическими эффектами в диапазоне температур 250–330°С (рис. 4), сопровождающимися незначительной убылью массы (кривые изменения массы), свидетельствующими о потере кислорода образцами. Соответственно, кислородная нестехиометрия увеличивается, индекс при кислороде становится равен 6.93. При этом для выполнения условия электронейтральности в манганитах часть ионов Mn3+ переходит в Mn2+. Ионный радиус последних больше, чем у Mn3+, поэтому наблюдается некоторое увеличение объемов элементарных ячеек образцов (рис. 3). Причем скорость роста объема ячеек для обоих образцов до границы структурного перехода выше, чем после перехода (рис. 3). Это является косвенным подтверждением изменения поливалентного соотношения Mn2+/Mn3+ во время перехода, связанного с изменением содержания кислорода в образцах. Вероятно, причиной структурного перехода Fmmm → I4/mmm является понижение содержания кислорода в манганитах под воздействием температуры, приводящее к упорядочению в слоях катионов. Аналогичный эффект характерен для родственных кислород-дефицитных манганитов [17, 18]. Следует отметить, что при уменьшении ионного радиуса редкоземельного металла температура перехода несколько увеличивается. Это подтверждается данными [8]. Также различия в ионных радиусах бария и редкоземельных металлов могут влиять на структурные искажения и стабильность манганитов Ln2BaMn2O7 – δ.
Рис. 3.
Температурные зависимости объемов и параметров элементарных ячеек образцов Pr2BaMn2O7 – δ и Nd2BaMn2O7 – δ.
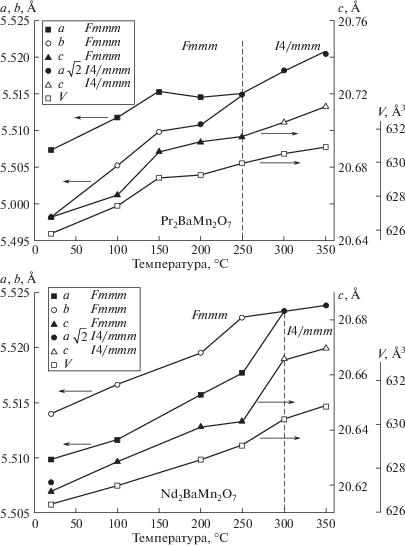
Рис. 4.
Кривые изменения массы (Δm) и теплового потока (ДСК) при нагреве манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd) в атмосфере аргона со скоростью 5 град./мин.
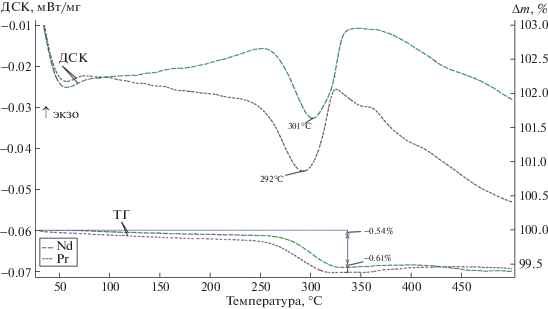
Определенная нами методами ВРФА и ДСК температура перехода для образца Nd2BaMn2O7 – δ несколько выше, чем в [8] и может зависеть от кислородной нестехиометрии образца и скорости нагрева при исследовании. Увеличение температуры фазового перехода в структуре слоистых манганитов в ряду Pr → Nd может быть связано с изменением длин связей Mn–O, обусловленным эффектом лантаноидного сжатия [11].
ЗАКЛЮЧЕНИЕ
Исследование процесса образования манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd) обеспечивает понимание этапов образования промежуточных и целевых фаз синтеза. В работе впервые определены условия формирования манганитов Ln2BaMn2O7 – δ (Ln = Pr, Nd) орторомбической структуры (пр.гр. Fmmm), имеющих определенную кислородную нестехиометрию. Методами ДСК и ВРФА установлены температурные границы фазовых переходов Fmmm → I4/mmm орторомбических слоистых манганитов Pr и Nd. Установлено, что температура перехода из орторомбической в тетрагональную фазу увеличивается с уменьшением ионного радиуса редкоземельного элемента.
Список литературы
Deshizeaux Cheruy M.N. and Joubert J. C. Donnees cristallographiqes sur une nouvelle serie de manganites mixtes de terre rare et d’alcalino-terreux // J. Solid State Chem. 1981. V. 40. P. 14–19.
Battle P.D., Blundell S.J., Green M.A., Hayes W., Honold M., Klehe A.K., Laskey N.S., Millburn J.E., Murphy L., Rosseinsky M.J., Samarin N.A., Singleton J., Sluchanko N.E., Sullivan S.P., Vente J.F. Colossal magnetoresistance in Sr2 – xNd1 + xMn2O7 (x = 0.0, 0.1) // J. Phys.: Condens. Matter. 1996. V. 8. L427–L434.
Uporov S.A., Mitrofanov V.Ya., Fedorova O.M., Yankin A.M. Influence of thermal processing on magnetotransport characteristics of NdSr2Mn2O7 + δ // Mater. Res. Bull. 2015. V. 67. P. 201-206.
Shimono A., Hayashi K., Kamegashira N. Measurements of magnetic susceptibilities of BaLn2Mn2O7 phases (Ln = Rare earth elements) // Mater. Chem. Phys. 1991. V. 28. P. 175-190.
Missyul A.B., Zvereva I.A., Palstra T.T.M. The formation of the complex manganites LnSr2Mn2O7 (Ln = La, Nd, Gd) // Mat. Res. Bull. 2012. V. 47. №. 12. P. 4156–160.
Kamegashira N., Nakano H., Chan G., Meng J. Phase behavior of rare earth manganites // J. Rare Earths. 2004. V. 22. № 5. P. 582–585.
Kamegasira N., Meng J., Fujita K., Satoh H., Shishido T., Nakajima K. Study on the phase behavior on BaEu2Mn2O7 through heat treatment of a single crystal // J. Alloys Compd. 2006. V. 408–412. P. 603–607.
Nakano H., Satoh H., Kamegashira N., Ishizawa N. Phase behavior of layered manganites BaLn2Mn2O7 (Ln = rare earth) // Phys. Status Solidi C. 2006. V. 3. № 8. P. 2812–2815.
Meng J., Satoh H., Kamegashira N. Crystal structure refinement of tetragonal BaTb2Mn2O7 // J. Alloys Compd. 1996. V. 244. P. 75–78.
Ueno S., Kamegashira N. Crystal and X-ray diffraction data for orthorhombic BaNd2Mn2O7 phase // Powder Diffr. 1997. V.12. P. 103-105.
Nakano H., Kamegashira N. Novel phase transition in BaPr2Mn2O7 // J. Rare Earths. 2006. V. 24. № 1(S). P. 1–3.
Meng J., Satoh H., Ishida M., Kamegashira N. Phase transition of BaNd2Mn2O7 // J. of Alloys and Compounds. 2006. V. 408–412. P. 1182–1186.
Федорова О.М., Ведмидь Л.Б., Упоров С.А. Влияние кислородной нестехиометрии на фазовое расслоение, структуру и магнитные свойства сложного оксида NdSr2Mn2O7 ± δ // Перспективные материалы. 2020. № 2. С. 14–21.
Ведмидь Л.Б., Янкин А.М., Козин В.М., Федорова О.М. Динамический метод исследования гетерогенных равновесий // ЖФХ. 2017. Т. 91. № 8. С. 1273–1276.
Программа RTP (Ренгеноструктурный табличный процессор, версия 3,3 а, г. Copyright: freeware / К.И.Чеботарев [и др.]. Москва. 2002. 2014.http://slavic.me/rtp/index.htm
Yankin A.M., Balakirev V.F., Vedmid’ L.B., Fedorova O.M. A static method for studying heterogeneous equilibria // Russ. J. Phys. Chem. A. 2003. V. 77. № 11. P. 1899–1902.
Trukhanov S.V., Troyanchuk I.O., Hervieu M., Szymczak H., Bärner K. Magnetic and electrical properties of LBaMn2O6 – γ (L = Pr, Nd, Sm, Eu, Gd, Tb) manganites // Phys. Rev. B 66. 2002. 184424–10.
Trukhanov S.V., Khomchenko V.A., Karpinsky D.V., Silibin M.V., Trukhanov A.V., Lobanovsky L.S., Szymczak H., Botez C.E., Troyanchuk I.O. A‑site ordered state in manganites with perovskite-like structure based on optimally doped compounds Ln0.70Ba0.30MnO3 (Ln = Pr, Nd) // J. Rare Earths. 2019. V. 37. P. 1242–1249.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах


