Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 494, № 1, стр. 15-20
О влиянии природы заместителей на антимикробную активность водорастворимых ацилгидразонов на платформе изатина
А. В. Богданов 1, *, А. Д. Волошина 1, А. Р. Хаматгалимов 1, Н. В. Терехова 1, член-корреспондент РАН В. Ф. Миронов 1
1 Институт органической и физической химии
им. А.Е. Арбузова ФИЦ Казанский научный центр Российской академии наук
Казань, Россия
* E-mail: abogdanov@inbox.ru
Поступила в редакцию 23.06.2020
После доработки 06.07.2020
Принята к публикации 02.09.2020
Аннотация
На примере некоторых аммониевых изатин-3-ацилгидразонов с использованием простых молекулярных дескрипторов и квантово-химических расчетов выявлена зависимость уровня антимикробной активности от объема и электронной природы заместителей в бензильном фрагменте. Показано, что для проявления активности ключевыми факторами являются строение и электронная природа заместителей в положении 1 и липофильность соединений данного ряда.
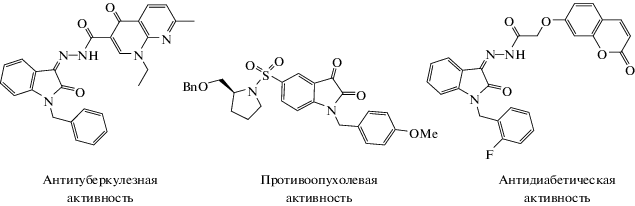
Гетероциклическая платформа оксиндола встречается во многих биологически активных соединениях и относится к классу “привилегированных структур” [1]. Среди многообразия соединений, содержащих этот структурный мотив, наиболее широко исследуемым является изатин (индолин-2,3-дион). Легкость модификации по карбонильной группе, ароматическому фрагменту и атому азота обусловливает большие возможности и перспективы его применения в медицине, органическом синтезе и химии функциональных материалов [2–6] с возможностью управления свойствами его производных в результате модификации того или иного реакционного центра. Известно, что многочисленные производные изатина проявляют различные виды биологической активности, такие как противораковая [7], антитуберкулезная [8], антимикробная [9] и фунгицидная [10]. Одним из наиболее изучаемых классов являются изатин-5-сульфонамиды, которые обладают свойством ингибирования каспаз – ключевых апоптотических ферментов. Функционализация оксиндольного цикла гидразонным фрагментом зачастую приводит к проявлению данными соединениями новых видов активности (схема 1). При этом следует отметить существенное влияние строения заместителей на периферии гетероциклической платформы на уровень и тип физиологического действия.
В этом контексте одной из главных проблем, ограничивающих проведение большего спектра биологических исследований, является плохая растворимость целевых соединений в биосовместимых растворителях, и прежде всего в воде. Одним из решений этой задачи может являться введение в структуру производного изатина солевого фрагмента, в качестве источника которого могут выступать реагенты Жирара – гидразиды, содержащие положительно заряженный атом азота.
Высокая реакционная способность карбонильной группы изатина в положении 3 позволяет разрабатывать подход к получению водорастворимых аммониевых изатин-3-ацилгидразонов [11–14]. Исследования антимикробной активности указывают на высокий потенциал нескольких рядов этих соединений в дизайне и поиске эффективных и нетоксичных антимикробных агентов.
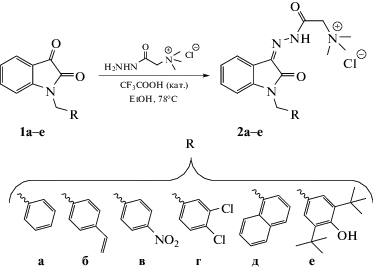
В данной работе представлен синтез ряда новых триметиламмониевых изатин-3-ацилгидразонов, содержащих различные по строению и электронной природе заместители в бензильном фрагменте (схема 2).
Строение полученных соединений было подтверждено данными 1Н и 13С ЯМР, ИК-спектроскопии и масс-спектрометрии МАЛДИ (табл. 1).
Таблица 1.
Спектральные характеристики и константы соединений 2а–еа
| Соединениеб | 1H ЯМР (CDCl3, δ, м. д., J, Гц); 13С ЯМР (CDCl3, δ, м. д.); ИК (ν, см–1); MALDI TOF, m/z |
|---|---|
| 2а | Желтый порошок, выход 84%. 1Н ЯМР: 7.69 (д, 1H, J 7.6, Наром), 7.21–7.28 (м, 6H, Наром), 7.05 (д. д, 1H, J 7.1, 8.2, Наром), 6.78 (д, 1Н, J 8.1, Наром), 5.11 (с, 2H, С(О)CН2), 4.87 (с, 2H, NCН2), 3.50 (с, 9Н, NСН3). 13С ЯМР: 158.2, 150.3, 138.6 138.4, 130.8, 130.4, 127.7, 126.10, 126.06, 125.7, 124.2, 117.8, 110.7, 77.2, 67.0, 43.6. ИК: 3400 (νNH), 2954 (νCH), 2926 (νAr–H), 1710 (νC=O), 1678 (νC=O), 1615 (νC=C). MALDI TOF: 351 [M–Cl]+. Тпл 248°С. Элементный анализ. Найдено, %: C, 61.90; H, 5.87; N, 14.40. Вычислено для C20H23ClN4O2, %: C, 62.09; H, 5.99; N, 14.48. |
| 2б | Желтый порошок, выход 93%. 1Н ЯМР: 7.66 (уш. с, 1H, Наром), 7.39–7.37 (м, 3H, Наром), 7.29 (д, 2Н, J 7.9, Наром), 7.14 (т, 1H, J 7.4, Наром), 6.98 (д, 1Н, J 7.9, Наром), 6.65 (д. д, 1Н, J 17.6, 11.0, СН=СН2), 5.75 (д, 1Н, J 17.6, СН=СН2), 5.22 (д, 1Н, J 11.0, СН=СН2), 4.90 (с, 2H, NCН2), 3.99 (с, 2H, С(О)CН2), 3.30 (с, 9Н, NСН3). 13С ЯМР: 166.7, 161.3, 143.7, 137.5, 136.6 136.0, 135.6, 133.0, 128.5, 127.2, 124.4, 122.1, 119.5, 115.6, 111.2, 62.8, 54.6, 40.0. ИК: 3433 (νNH), 3010 (νCH), 2937 (νAr–H), 1678 (νC=O), 1615 (νC=C). MALDI TOF: 377 [M–Cl]+. Тпл 230°С. Элементный анализ. Найдено, %: C, 63.85; H, 6.00; N, 13.39. Вычислено для C22H25ClN4O2, %: C, 63.99; H, 6.10; N, 13.57. |
| 2в | Желтый порошок, выход 90%. 1Н ЯМР: 8.03–7.99 (м, 2H, Наром), 7.64 (д, 1Н, J 7.7, Наром), 7.42–7.32 (м, 3H, Наром), 7.14 (д. д, 1H, J 7.8, 7.5, Наром), 6.81 (м, 1Н, Наром), 4.93 (с, 2H, С(О)CН2), 4.75 (с, 2H, NCН2), 3.41 (с, 9Н, NСН3). 13С ЯМР: 166.4, 160.9, 147.3, 143.5, 143.1, 135.4, 132.6, 128.8, 124.1, 123.9, 121.5, 119.1, 110.7, 62.2, 53.9, 42.5. ИК: 3412 (νNH), 2972 (νCH), 2902 (νAr–H), 1710 (νC=O), 1692 (νC=O), 1613 (νC=C). MALDI TOF: 397 [M–Cl]+. Тпл 247°С (разл.). Элементный анализ. Найдено, %: C, 55.50; H, 5.01; N, 16.09. Вычислено для C20H22ClN5O4, %: C, 55.62; H, 5.13; N, 16.22. |
| 2г | Желтый порошок, выход 95%. 1Н ЯМР: 7.71 (д, 1H, J 1.9, Наром), 7.66 (м, 1H, Наром), 7.62 (д, 1H, J 8.3, Наром), 7.45 (д. д, 1H, J 8.0, 1.7, Наром), 7.38 (д, 1H, J 8.3, Наром), 7.19 (д, 1H, J 7.7, Наром), 7.12 (д, 1H, J 8.0, Наром), 5.00 (ушир. с, 4H, NCН2, С(О)CН2), 3.35 (ушир. с, 9Н, NСН3). 13С ЯМР: 168.1, 165.0, 142.9, 136.8, 132.3 131.3, 130.9, 130.4, 129.6, 127.8, 123.5, 121.1, 110.5, 61.8, 53.5, 41.6. ИК: 3408 (νNH), 3018 (νCH), 2937 (νAr–H), 1702 (νC=O), 1677 (νC=O), 1613 (νC=C). MALDI TOF: 419 [M–Cl]+. Тпл 221°С (разл.). Элементный анализ. Найдено, %: C, 52.59; H, 4.50; N, 12.09. Вычислено для C20H21Cl3N4O2, %: C, 52.71; H, 4.64; N, 12.29. |
| 2д | Желтый порошок, выход 97%. 1Н ЯМР: 12.66 (ушир. с, 1H, NН), 8.23 (д, 1H, J 9.3, Наром), 8.00 (д. д, 1H, J 8.5, 1.1, Наром), 7.89 (д, 1H, J 8.2, Наром), 7.70–7.58 (м, 3H, Наром), 7.44 (д. д, 1H, J 8.0, 7.3, Наром), 7.40 (д. д. д, 1H, J 7.9, 7.9, 1.1, Наром), 7.35 (д, 1H, J 7.3, Наром), 7.18 (д. д, 1H, J 7.6, 7.6, Наром), 7.01 (д, 1H, J 8.0, Наром), 5.49 (с, 2H, NCН2), 5.01 (ушир. с, 2H, С(О)CН2), 3.36 (ушир. с, 9Н, NСН3). 13С ЯМР: 166.5, 159.8, 143.8, 138.3, 133.7, 132.8, 130.7, 130.5, 129.1, 128.6, 127.1, 126.6, 125.7, 124.7, 123.9, 123.3, 121.5, 119.2, 111.1, 62.4, 54.1, 41.4. ИК: 34248 (νNH), 3057 (νCH), 2961 (νAr–H), 1718 (νC=O), 1688 (νC=O), 1612 (νC=C). MALDI TOF: 401 [M–Cl]+. Тпл 200°С. Элементный анализ. Найдено, %: C, 65.87; H, 5.58; N, 12.71. Вычислено для C24H25ClN4O2, %: C, 65.97; H, 5.77; N, 12.82. |
| 2е | Все физико-химические характеристики и константы совпали с описанными ранее в [16]. |
а Эксперименты ЯМР были проведены на спектрометрах Avance-400 и 600 (Bruker, Германия) в растворе CDCl3 или ДМСО-d6 при температуре 30°С. Спектры ИК снимали на Фурье-спектрометре Vector 22 (Bruker, Германия) в таблетках KBr. Масс-спектры регистрировали на масс-спектрометре MALDI‑TOF Ultraflex III (Bruker, Германия). Элементный анализ выполнен на анализаторе EuroVector 2000 CHNS-O (Италия). В работе использованы штаммы микроорганизмов Staphylococcus aureus ATCC 209p, Bacillus cereus ATCC 8035. б2а, хлорид 2-[2-(1-бензил-2-оксоиндолин-3-илиден)гидразинил]-N,N,N-триметил-2-оксоэтиламмония; 2б, хлорид N,N,N-триметил-2-оксо-2-{2-[2-оксо-1-(4-винилбензил)индолин-3-илиден]гидразинил}этиламмония; 2в, хлорид N,N,N-триметил-2-оксо-2-{2-[2-оксо-1-(4-нитробензил)индолин-3-илиден]гидразинил}этиламмония; 2г, хлорид 2-{2-[1-(3,4-дихлорбензил)-2-оксоиндолин-3-илиден]гидразинил}-N,N,N-триметил-2-оксоэтан-1-аммония; 2д, хлорид N,N,N-триметил-2-{2-[1-(нафталин-1-илметил)-2-оксоиндолин-3-илиден]гидразинил}-2-оксоэтиламмония.
Наличие в структуре соединений 2 гидразонного фрагмента подтверждается присутствием в спектрах 1H ЯМР сигналов протонов NH-группы в области 12 м. д., интенсивных синглетов протонов метильных групп в области 3.30–3.50 м. д. и уширенных сигналов метиленовых протонов гидразонного фрагмента в области 5 м. д. Кроме того, в спектрах ИК присутствуют полосы поглощения в области 3400 см–1, соответствующие колебаниям связи N–H. В масс-спектрах соединений 2а–е, зарегистрированных в положительной моде, детектируются пики, соответствующие массам катионной части молекул.
Исследование антимикробной активности полученных соединений показало сильную зависимость уровня активности от строения заместителей в бензильном фрагменте (табл. 2).
Так, производные 2в,г, содержащие электроноакцепторный заместитель (нитро-группу или атом хлора), не проявляли активности против золотистого стафилококка и Bacillus cereus. Наиболее активным в отношении данных патогенов оказалось соединение 2е, превосходящее препарат сравнения – хлорамфеникол – в отношении Staphylococcus aureus (Sa) в 18 раз и Bacillus cereus (Bc) в 4 раза.
Мы предположили, что проявление антимикробной активности может зависеть, прежде всего, от липофильности представителей данного ряда производных изатина. Полученный ряд соединений был оценен при помощи простых молекулярных дескрипторов, рассчитанных с использованием сервиса Molinspiration [15], которые широко используются для анализа биологически активных соединений (табл. 3).
Таблица 3.
Антимикробная активность и некоторые расчетные данные для соединений 2а–е
| Соединение | Saа | Bcа | Mб | logPв | Vг |
|---|---|---|---|---|---|
| 2а | – | – | 386.88 | –1.66 | 330.53 |
| 2б | 303 | – | 412.92 | –0.81 | 358.26 |
| 2в | – | – | 431.88 | –1.70 | 396.43 |
| 2г | 550 | – | 455.76 | –0.38 | 357.60 |
| 2д | 143 | – | 436.94 | –0.50 | 374.52 |
| 2е | 7.6 | 30.3 | 515.10 | 1.39 | 470.92 |
На основании полученных данных можно сделать вывод, что определяющим фактором является липофильность (log P) исследуемых соединений, что объясняет результаты, полученные для соединений 2а,в, и наибольшую активность для соли 2е в отношении как Sa, так и Bc. Интересно соотношение структура–активность для производных 2в–д, в случае которых значения минимальных ингибирующих концентраций (МИК) изменяется немонотонно. Видно, что введение в бензильный фрагмент атомов хлора приводит к снижению активности в сравнении с алифатическими заместителями производных 2б и 2г, несмотря на большее значение log P. Данную зависимость, вероятно, можно объяснить сольватационными эффектами в отношении более полярной молекулы соединения 2г в водной среде, что и приводит к снижению ее активности. Однако данный вопрос требует дополнительных исследований.
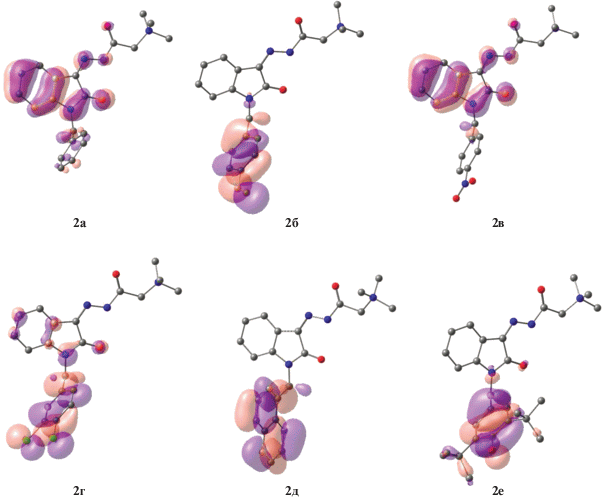
Квантово-химические расчеты (Gaussian 16/B3LYP/6-31+G*) показали, что введение заместителей к атому азота в гетероциклическом фрагменте влияет на состав и энергии граничных орбиталей. Так, в случаях соединений 2а,в ВЗМО локализована на гетероциклическом фрагменте, в то время как для соединений 2б,г–е основной вклад в нее вносят атомные орбитали заместителей (рис. 1).
Это приводит к изменению энергии ВЗМО, а также размера энергетической щели ВЗМО–НВМО, которая в случаях соединений 2а,в,г предсказывалась выше (табл. 4).
Таблица 4.
Размер энергетической щели ВЗМО-НВМО (эВ), молярный объем (Vm, см3/моль), молекулярный объем (Vmol, ×10–22 см3)
| ВЗМО-НВМО | Vm | Vmol | |
|---|---|---|---|
| 2а | 3.40 | 264.47 | 4.39 |
| 2б | 2.78 | 313.62 | 5.21 |
| 2в | 3.44 | 276.73 | 4.59 |
| 2г | 3.33 | 282.82 | 4.69 |
| 2д | 2.57 | 293.47 | 4.87 |
| 2е | 2.58 | 336.63 | 5.59 |
Кроме того, наблюдается корреляция между объемом катионов солей и антимикробной активностью. Так, соединения 2б,д,е с большими молярным и молекулярным объемами и проявляют активность (табл. 4).
Таким образом, комплексный подход с использованием квантово-химических расчетов и компьютерного моделирования и экспериментальных данных позволил выявить зависимость антимикробной активности от строения аммониевых изатин-3-ацилгидразонов. При этом было установлено, что, чем выше липофильность и объем молекулы данных соединений, тем выше их антимикробная активность.
Список литературы
Welsch M.E., Snyder S.A., Stockwell B.R. // Curr. Opin. Chem. Biol. 2010. V. 14. P. 347–361.
Xu Zh., Zhang Sh., Gao Ch., et al. // Chinese Chem. Lett. 2017. V. 28. P. 159–167.
Zhang Y.-Zh., Du H.-Zh., Liu H.-L., et al. // Arch. Pharm. Chem. Life Sci. 2020. V. 353. e1900299.
Bogdanov A.V., Musin L.I., Mironov V.F. // Arkivoc. 2015. V. 6. P. 362–392.
Bogdanov A.V., Mironov V.F. // Synthesis. 2018. V. 50. P. 1601–1609.
Decker M., editor. Design of Hybrid Molecules for Drug Development. Elsevier, 2017. 352 p.
Limpachayaporn P., Schäfers M., Haufe G. // Future Med. Chem. 2015. V. 7. P. 1173–1196.
Kumar S.B., Ravinder M., Kishore G., et al. // Med. Chem. Res. 2014. V. 23. P. 1934–1940.
Al-Wabli R.I., Zakaria A.S., Attia M.I. // Molecules 2017. V. 22. P. 1958–1973.
Wang J., Tan H., Li Y., et al. // J. Agric. Food Chem. 2011. V. 59. P. 9892–9900.
Bogdanov A.V., Kadomtseva M.E., Bukharov S.V., et al. // Russ. J. Org. Chem. 2020. V. 56. P. 555–558.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., et al. // J. Fluorine Chem. 2019. V. 227. P. 109345.
Pashirova T.N., Bogdanov A.V., Zaripova I.F., et al. // J. Mol. Liq. 2019. V. 290. P. 111220.
Bogdanov A.V., Zaripova I.F., Voloshina A.D., et al. // ChemistrySelect 2019. V. 4. P. 6162–6166.
http://www.molinspiration.com
Bogdanov A.V., Zaripova I.F., Voloshina A.D., et al. // Monatsh. Chem. 2018. V. 149. P. 111–117.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах