Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 494, № 1, стр. 45-49
Физико-химические основы комбинированной энергоресурсоэффективной технологии переработки стоков производства кальцинированной соды
Академик РАН В. П. Мешалкин 1, 2, Н. С. Шулаев 2, *, Н. А. Быковский 2, В. М. Аристов 1
1 Российский химико-технологический университет
им. Д.И. Менделеева
Москва, Россия
2 ФГБОУ ВО Уфимский государственный нефтяной технический университет
Стерлитамак, Россия
* E-mail: nshulayev@rambler.ru
Поступила в редакцию 23.07.2020
После доработки 06.08.2020
Принята к публикации 03.09.2020
Аннотация
Производство кальцинированной соды аммиачным методом сопровождается образованием сточных вод, основной объем которых – дистиллерная жидкость, содержащая до 100 г/л хлорида кальция и до 50 г/л хлорида натрия. В работе описан высокоэффективный электрохимический метод утилизации дистиллерной жидкости с получением гидроксида кальция, гидроксида натрия и соляной кислоты. Предложен процесс, состоящий из двух стадий, на первой стадии производится обработка дистиллерной жидкости щелочью с получением гидроксида кальция и фильтрата, содержащего хлорид натрия. На второй стадии фильтрат перерабатывается в мембранном электролизере с получением растворов гидроксида натрия и соляной кислоты. Показано, что процесс обработки дистиллерной жидкости щелочью необходимо осуществлять при мольном отношении CaCl2 : NaOH равном 1 : 1.25. Переработка фильтрата в мембранном электролизере позволяет получить гидроксид натрия с концентрацией до 4320 г/л и соляную кислоту с концентрацией 148 г/л.
Кальцинированная сода является одним из основных многотоннажных продуктов неорганического синтеза. Объем производства кальцинированной соды оценивается более чем 54 млн т. Из них в России в 2019 г. произведено 3.383 млн т. Кальцинированная сода используется в цветной металлургии, химической, нефтехимической, целлюлозно-бумажной промышленности, а также при производстве стекла и моющих средств [1, 2].
При производстве кальцинированной соды одним из основных промышленных отходов является дистиллерная жидкость, составляющая около 90% от объема всех сточных вод в производстве кальцинированной соды аммиачным методом. В расчете на 1 т кальцинированной соды образуется до 10 м3 дистиллерной жидкости, содержащей около 100 г/л хлорида кальция и около 50 г/л хлорида натрия.
Усредненный состав дистиллерной жидкости и ее токсичность представлены в табл. 1.
Таблица 1.
Ионный состав дистиллерной жидкости и кратность превышения рыбохозяйственных ПДК
| Ион | Cl– | Na+ | Ca2+ | SO$_{4}^{{2 - }}$ | NH$_{4}^{ + }$ |
|---|---|---|---|---|---|
| Концентрация, г/л | 112.6 | 30.1 | 43.8 | 0.56 | 0.13 |
| Значение ПДК, г/л | 0.3 | 0.12 | 0.18 | 0.1 | 0.5 × 10‒3 |
| Кратность превышения ПДК | 375 | 251 | 243 | 5.6 | 0.26 |
Анализ данных табл. 1 показал, что дистиллерная жидкость обладает значительной токсичностью. Наибольшее превышение нормативов качества воды наблюдается по ионам хлора. Соблюдение кратности разведения при утилизации дистиллерной жидкости по ионам хлора обеспечит соблюдение качества воды по другим показателям.
Вместе с тем высокое содержание хлоридов кальция и натрия в дистиллерной жидкости позволяет использовать ее в качестве сырья для получения химической продукции [3, 4].
В статье представлены результаты экспериментальных исследований по переработке дистиллерной жидкости с получением гидроксида кальция, едкого натра и соляной кислоты без дополнительного привлечения химических реагентов.
Процесс переработки дистиллерной жидкости состоял из обработки ее гидроксидом натрия, фильтрации и последующей переработки фильтрата в электролизере с ионообменными мембранами. Для проведения исследований использовалась дистиллерная жидкость, содержащая 129.6 г/л хлорида кальция и 34.7 г/л хлорида натрия. Исследование процесса извлечения кальция из дистиллерной жидкости при ее обработке едким натром проводились при различных мольных соотношениях CaCl2 : NaOH.
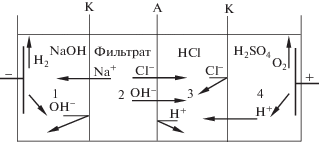
Определение выхода по току кислоты и щелочи и удельных затрат электроэнергии (вторая стадия) осуществлялось в четырехкамерном мембранном электролизере с рабочей поверхностью мембран 14.1 см2 (рис. 1) в статическом режиме (без протока жидкостей в камерах).
В каждую камеру помещалось по 60 мл растворов: в камеру 1 – 0.1 н. раствор NaOH, в камеру 2 – фильтрат, полученный после отделения гидроксида кальция, в камеру 3 – 0.1 н. раствор HCl, в камеру 4 – 0.1 н. раствор H2SO4. Количество электричества, пропущенное через электролизер, во всех экспериментах оставалось постоянным и составляло 16.2 кКл. Направленное движение ионов при подаче напряжения показано стрелками на рис. 1. В результате происходило извлечение ионов Na+ и Cl‒ из камеры 2 и концентрирование раствора NaOH в катодной камере 1, а раствора HCl ‒ в камере 3 электролизера.
Для определения предельно достижимых концентраций генерируемых растворов щелочи и соляной кислоты, проводились эксперименты в электролизере с циркуляцией фильтрата и раствора H2SO4 (рис. 2).
Рис. 2.
Схема проточного электролизера: “‒” – анод; “+” ‒ катод; К – катионообменная мембрана; А – анионообменная мембрана.
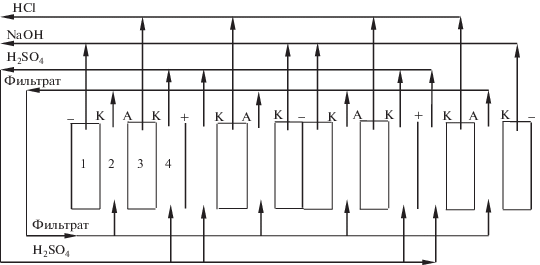
Электролизер состоит из пяти ячеек, разделенных электродными пластинами. Каждая ячейка, в свою очередь, состоит из четырех камер, выполненных из пластин поливинилхлорида толщиной 2 мм и разделенных ионообменными мембранами. Рабочая поверхность каждой мембраны составляет 60 см2. Через камеры 2 циркулировал фильтрат. Объем фильтрата во всех опытах оставался постоянным и составлял 1 л. В анодных камерах (камера 4) циркулировал 0.1 н. раствор H2SO4. Катодные камеры (камера 1) и камеры 3 выполнены не проточными. На начальном этапе катодные камеры заполнялись 0.1 н. раствором NaOH, а камеры 3 – 0.1 н. раствором HCl. Растворы щелочи и соляной кислоты, генерируемые в камерах 1 и 3 аппарата, по мере накопления собирались в соответствующих емкостях.
В табл. 2 приведены результаты экспериментальных исследований зависимости степени осаждения Са(ОН)2 из дистиллерной жидкости при различном соотношении CaCl2 : NaOH на первой стадии процесса.
Таблица 2.
Зависимость степени осаждения Ca(OH)2 от мольного соотношения CaCl2 : NaOH
| Мольное отношение CaCl2 : NaOH | 1 : 2 | 1 : 2.25 | 1 : 2.5 | 1 : 2.75 |
| Степень осаждения кальция, % | 92.28 | 99.98 | 99.98 | 99.99 |
| Остаточная концентрация NaOH, г/л | 0.4 | 10.1 | 22.4 | 31.8 |
Как следует из проведенных исследований, при мольном отношении CaCl2 : NaOH = 1: 2 степень осаждения Ca(OH)2 составила 92.28%. При увеличении мольного отношения CaCl2 : NaOH ≥ 1: 2.25 полнота осаждения Ca(OH)2 достигала 99.98%. Таким образом, установлено, что количество NaOH, необходимое для практически полного извлечения кальция из дистиллерной жидкости, соответствует мольному отношению CaCl2 : NaOH = = 1 : 2.25.
После обработки дистиллерной жидкости гидроксидом натрия и удаления осадка гидроксида кальция остается фильтрат, состав которого приведен в табл. 3.
В табл. 4 приведены значения выхода по току (отношение массы вещества, полученного в процессе электролиза, к массе вещества, выделяемого в соответствии с законом Фарадея) и удельные затраты электроэнергии на процесс извлечения ионов натрия и хлора из фильтрата в зависимости от плотности тока (вторая стадия).
Таблица 4.
Выход по току и затраты электроэнергии на переработку фильтрата в мембранном электролизере
| Плотность тока, мА/см2 | Выход по току, % | Затраты электроэнергии, Вт ч/моль | ||
|---|---|---|---|---|
| Na+ | Cl‒ | на извлечение Na+ | на извлечение Cl‒ | |
| 35.4 | 83.1 | 75.8 | 111.3 | 112.0 |
| 70.8 | 80.5 | 75.2 | 222.1 | 226.3 |
| 106.2 | 82.6 | 80.2 | 317.6 | 325.9 |
| 141.5 | 79.8 | 72.9 | 447.6 | 458.5 |
| 176.9 | 81.3 | 78.0 | 549.5 | 568.7 |
Как следует из приведенных данных, увеличение плотности тока не влияет на значения выхода по току для ионов Na+ и Cl‒, а определяет время обработки и затраты электроэнергии. Установлено, что энергетические затраты на выделение ионов хлора на 2‒19 Вт ч/моль превышают затраты на выделение ионов натрия, что объясняется совместным извлечением из фильтрата ионов хлора и гидроксила. Таким образом, энергозатраты на переработку 1 т дистиллерной жидкости при плотности тока 35.4 мА/см2 составят 922 МДж. Для сравнения: переработка 1 т дистиллерной жидкости по технологии, описанной в работе [5], составляет 1680 МДж, что превышает энергозатраты по предлагаемой нами технологии в 1.24 раза.
На рис. 3 приведена зависимость концентрации гидроокиси натрия, генерируемой в катодной камере (камера 1) электролизера, изображенного на рис. 2, от времени при различной плотности тока. Видно, что с возрастанием плотности тока скорость увеличения концентрации (ΔC/Δt) NaOH также нарастает. Так, при плотности тока 33.3 мА/см2 отношение ΔC/Δt = 55 г/(л ч), при плотности тока 66.7 мА/см2 – ΔC/Δt = 77.5 г/(л ч), а при плотности тока 100 мА/см2 – ΔC/Δt = = 175 г/(л ч).
Рис. 3.
Зависимость концентрации гидроокиси натрия, генерируемой в катодной камере электролизера, от времени. Плотность тока, мА/см2: 33.3 (кривая 1), 66.7 (кривая 2), 100.0 (кривая 3).
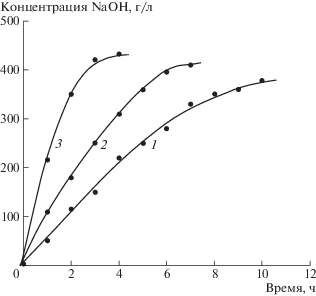
Предельная концентрация щелочи в катодной камере в зависимости от плотности тока в электролизере представлена в табл. 5.
Таблица 5.
Предельная концентрация NaOH в католите
| Плотность тока, мА/см2 | 33.3 | 66.7 | 100.0 |
| Концентрация, г/л | 378 | 410 | 432 |
Одним из объяснений такой зависимости является то, что с увеличением плотности тока возрастает температура электролита, что приводит к уменьшению количества молекул воды, сольватированных на ионах натрия, переносимых через мембрану.
На рис. 4 приведена зависимость концентрации соляной кислоты, генерируемой в камерах 3 электролизера, от времени обработки при различной плотности тока. Так же, как и в случае со щелочью, скорость роста концентрация HCl и ее максимальное значение зависит от мембранной плотности тока. Так, при плотности тока 33.3 мА/см2 скорость возрастания концентрации соляной кислоты составляет 12.3 г/(л ч). Увеличение мембранной плотности тока до 100.0 мА/см2 сопровождается возрастанием скорости увеличения концентрации соляной кислоты до 36.1 г/(л ч).
Рис. 4.
Зависимость концентрации HCl, генерируемой в камере 3 электролизера от времени. Плотность тока, мА/см2: 33.3 (кривая 1), 66.7 (кривая 2), 100.0 (кривая 3).
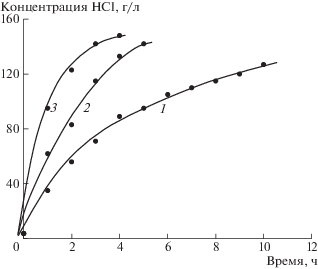
Предельные концентрации соляной кислоты в камере 3 электролизера, достигнутые в экспериментах, представлены в табл. 6.
Таблица 6.
Зависимость максимальной концентрации HCl от плотности тока в камере 3 электролизера
| Плотность тока, мА/см2 | 33.3 | 66.7 | 100.0 |
| Концентрация, г/л | 127 | 142 | 148 |
Изменение концентрации ионов Na+ и Cl‒ соответственно в камерах 1 и 3 электролизера можно описать уравнением:
где С0 – максимальная концентрация ионов Na+ и Cl– в камерах 1 и 3 электролизера соответственно; С – текущая концентрация ионов Na+ и Cl‒ в камерах 1 и 3 электролизера соответственно; V – объем камер концентрирования; ${v}$ – скорость движения ионов через мембрану; S – площадь мембраны.Скорость движения ионов через мембрану можно оценить по плотности тока:
где j – плотность тока; Ze – заряд иона; n – концентрация ионов.Решение уравнения (1) с учетом (2) можно представить в виде:
Введем коэффициент, определяемый параметрами электролизера, зарядом иона и его концентрацией:
где l – толщина камер электролизера.В табл. 7 представлены значения коэффициента K, рассчитанные по уравнению (4) и определенные по экспериментальным результатам (табл. 5, 6).
Таблица 7.
Экспериментальные и расчетные значения коэффициента K
| Камера концентрирования NaOH | Камера концентрирования HCl | ||
|---|---|---|---|
| Kэксп, мА ч/см2 | Kтеор, мА ч/см2 | Kэксп, мА ч/см2 | Kтеор, мА ч/см2 |
| 91.1 | 85.0 | 82.3 | 78.3 |
Достаточно хорошее соответствие расчетных и экспериментальных значений коэффициента K указывает на то, что разработанная модель для расчета концентрации веществ, генерируемых в камерах концентрирования электролизера, может использоваться при проектировании аппаратов большой производительности.
Проведенные исследования показали, что предлагаемый электрохимический метод утилизации дистиллерной жидкости – основного отхода производства кальцинированной соды ‒ представляется весьма перспективным, так как позволяет решать не только экологические проблемы, но и предлагает технологию производства товарных продуктов: Ca(OH)2, NaOH и HCl.
Список литературы
Steinhauser G. Cleaner production in the Solvay Process: general strategies and recent developments // J. Clean. Prod. 2008. V. 16. №7. P. 833‒841.
Шатов А.А. Производство кальцинированной соды ‒ от прошлых к новым технологиям // Научное обозрение. Фундаментальные и прикладные исследования. 2017. № 1. URL: http://www.scientificreview.ru/ru/article/view?id=8 (дата обращения: 03.09.2020).
Быковский Н.А., Пучкова Л.Н., Фанакова Н.Н. Электрохимическая переработка дистиллерной жидкости аммиачно-содового производства // Бутлеровские сообщения. 2015. Т. 43. № 7. С. 122‒126.
Патент 2476386 РФ, МПК C02F 9/06, Быковский Н.А., Даминев Р.Р., Курбангалеева Л.Р., Фанакова Н.Н.Способ переработки дистиллерной жидкости аммиачно-содового производства / заявитель и патентообладатель ФГБОУ ВО “Уфимский государственный нефтяной технический университет”. № 2011138179/05; заявл. 16.09.2011; опубл. 27.02.2013, Бюл. № 6.
Ткач Г.А. Производство соды по малоотходной технологии: монография / Г.А. Ткач, В.П. Шапорев, В.М. Титов. Харьков: ХГПУ, 1998. 429 с.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах