Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 494, № 1, стр. 9-14
Синтез и исследование психотропных свойств 1-замещенных 4-амино-5-оксопролинов
А. Ю. Вигоров 1, В. П. Краснов 1, 2, *, И. А. Низова 1, Л. Ш. Садретдинова 1, Г. Л. Левит 1, Т. В. Матвеева 1, П. А. Слепухин 1, Д. А. Бакулин 3, Н. С. Ковалев 3, член-корреспондент РАН И. Н. Тюренков 3, академик РАН В. Н. Чарушин 1, 2
1 Институт органического синтеза
им. И.Я. Постовского Уральского отделения
Российской академии наук
Екатеринбург, Россия
2 Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
3 Кафедра фармакологии и фармации Института НМФО Волгоградского государственного медицинского университета Министерства здравоохранения Российской Федерации
Волгоград, Россия
* E-mail: ca@ios.uran.ru
Поступила в редакцию 04.08.2020
После доработки 24.08.2020
Принята к публикации 02.09.2020
Аннотация
Методом нуклеофильного замещения брома в диметиловом эфире (2S,4RS)-4-бром-N-фталоилглутаминовой кислоты с последующим выделением преобладающего (2S,4S)-диастереомера и удалением защитных групп получены 1-замещенные (2S,4S)-4-амино-5-оксопролины. Изучены психотропные свойства полученных соединений при однократном введении экспериментальным животным. 4-Амино-1-(4-бромфенил)- и, особенно, 4‑амино-1-(4-аминофенил)-5-оксопролины проявили выраженную анксиолитическую активность в тесте “приподнятый крестообразный лабиринт”. (2S,4S)-4-Амино-5-оксопролины, содержащие 4‑метилфенильный, 4-бромфенильный, 4-аминофенильный и 2,3-диметил-5-оксо-1-фенил-3-пиразолин-4-ильный заместители в положении 1, проявили ноотропную активность: улучшали формирование и сохранение памятного следа в тесте “условная реакция пассивного избегания” и “тесте экстраполяционного избавления”.
Тревожно-депрессивные состояния, по данным Всемирной организации здравоохранения, являются самыми распространенными психическими заболеваниями, которые не только ухудшают качество жизни, но и являются причиной развития соматической патологии [1]. Дементные нарушения часто сопутствуют и усложняют лечение психических заболеваний, что с учетом старения населения делает актуальным разработку новых препаратов для коррекции подобных расстройств.
5-Оксопролин (пироглутаминовая кислота) нашел широкое применение в клинической и экспериментальной фармакологии. Пироглутамат повышает биодоступность многих вводимых веществ, таких как Mg2+, 2-(диметиламино)этанол и пирролидон. Пироглутамат магния используется в неврологической практике для купирования судорог, тиков, подергиваний [2]. В экспериментальных исследованиях установлено, что пироглутамат в сочетании с 2-(диметиламино)этанолом улучшает и восстанавливает память, повышает способность к обучаемости и понижает уровень тревожности [3, 4].
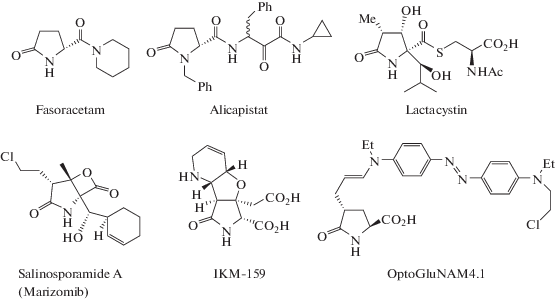
Среди производных 5-оксопролина известны соединения, обладающие психотропной активностью, например, фасорацетам (Fasoracetam, Nippon Shinyaku, Япония) (рис. 1) применяется для улучшения памяти, снижения симптомов депрессии и синдрома дефицита внимания и гиперактивности, а также для смягчения возрастного спада когнитивных функций [5]. Аликапистат (Alicapistat, AbbVie, США) – селективный ингибитор синтеза кальпаина – может найти применение в лечении болезни Альцгеймера [6].
Соединения, обладающие психотропной активностью, известны и среди С(4)-производных 5-оксопролина (рис. 1). Например, соединение IKM-159 и его аналоги – ингибиторы AMPA-рецепторов [7], соединение OptoGluNAM4.1 – антагонист NMDA-рецепторов [8]. Циклические амиды C(4)-замещенных 5-оксопролинов исследовались как антагонисты P2X7-рецептора (возможное применение для лечения воспалительных и неврологических заболеваний) [9].
В настоящее время в литературе отсутствуют данные о психотропной активности производных 4-амино-5-оксопролина. В связи с этим представлялось актуальным исследование психотропных свойств производных 5-оксопролина с целью возможного создания на их основе средств для лечения психоневрологических патологий и последствий нарушения мозгового кровообращения.
Целью данной работы был синтез и исследование психотропной активности ряда 1-замещенных 4-амино-5-оксопролинов.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
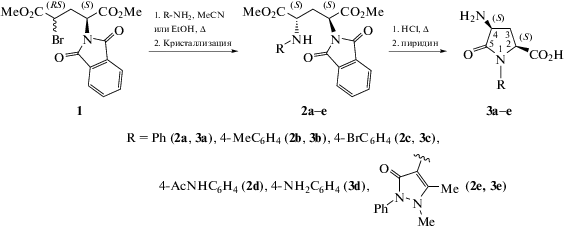
Нуклеофильное замещение атома брома в диметиловом эфире (2S,4RS)-4-бром-N-фталоилглутаминовой кислоты 1 в результате взаимодействия с первичными ароматическими аминами (анилин, 4‑метиланилин, 4-броманилин, 4-ацетамидоанилин и 4-аминоантипирин) в качестве нуклеофилов проведено по методу [10] (схема 1).
Исходное соединение 1 представляет собой смесь (2S,4S)- и (2S,4R)-диастереомеров в соотношении 60 : 40 (по данным спектроскопии 1H ЯМР и ВЭЖХ). В результате реакции образуются диметиловые эфиры (2S,4RS)-4-ариламино-N-фталоилглутаминовых кислот 2а–e в виде смеси диастереомеров. Соотношение (2S,4S)- и (2S,4R)-диастереомеров в продуктах реакции составляет (79‒74) : (21‒26) (по данным спектроскопии 1H ЯМР и ВЭЖХ) и слабо зависит от строения взятого в реакцию ароматического амина и растворителя (ацетонитрил или этанол). Индивидуальные (2S,4S)-диастереомеры 2а–d выделены дробной кристаллизацией из этанола с выходами 36‒50%, считая на соединение 1; соединение 2е выделено переосаждением водой из ацетона по методу [11] с выходом 40%, считая на соединение 1 (схема 1).
Кислотный гидролиз диметиловых эфиров 2а–e по методу [11] приводит к удалению сложноэфирных групп, фталоильной группы и к замыканию лактамного цикла с образованием аминокислот 3а–e с выходами 74‒85% (схема 1).
Аминокислоты 3a–d представляют собой бесцветные мелкокристаллические вещества, растворимые в ДМСО, воде, водных растворах кислот и оснований, малорастворимые в этаноле и нерастворимые в хлороформе и бензоле.
Строение аминокислот 3a и 3e установлено нами ранее [11]. Строение аминокислот 3b‒d подтверждено данными спектроскопии 1Н и 13С ЯМР (в сравнении с известными соединениями 3а и 3е), масс-спектрометрии высокого разрешения и элементного анализа.
Поскольку биологическое действие веществ существенно зависит от их конфигурации, особое внимание уделяли синтезу целевых соединений в энантиомерно чистой форме. Ранее нами было показано, что нуклеофильное замещение брома в диметиловом эфире (2S,4RS)-4-бром-N-фталоилглутаминовой кислоты 1 под действием ароматических аминов не сопровождается рацемизацией С(2)-асимметрического центра [12, 13] и приводит, после разделения диастереомеров, к энантиомерно чистым диметиловым эфирам (2S,4S)-4-ариламино-N-фталоилглутаминовых кислот. Отсутствие рацемизации в процессе нуклеофильного замещения было продемонстрировано нами на примере диметилового эфира (2S,4S)-2а, энантиомерная чистота которого (ee > 99%) была подтверждена методом ВЭЖХ на хиральной неподвижной фазе в сравнении с рацемическим трео-диастереомером (2R*,4R*)-2а, специально синтезированным из рацемического соединения 1 по методу [14]. Кислотный гидролиз для удаления защитных групп также не сопровождается рацемизацией [11]. Это позволило получить соединения 3a–e в виде индивидуальных (2S,4S)-диастереомеров. Следует особо отметить устойчивость лактамного цикла соединений 3а–е в кислой среде (в растворе 6 M HCl) [11]. Гидролитическая устойчивость лактамов такого типа изучена нами ранее методом спектроскопии 1Н ЯМР [15].
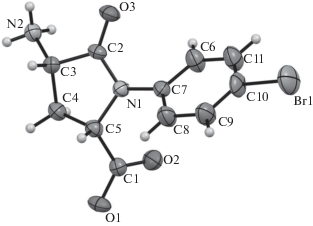
Строение аминокислоты 3с было также подтверждено данными РСА. Монокристаллы, полученные кристаллизацией из 95% водного этанола, представляют собой сольват с EtOH и H2O (1 : 1 : 1). Общий вид молекулы показан на рис. 2.
Кристаллографические данные: C13H19BrN2O5, моноклинная сингония, пространственная группа P21. Параметры элементарной ячейки при T = = 295(2) K: a = 6.1278(6) Å, b = 8.1090(6) Å, c = = 15.7801(10) Å, β = 97.073(7)°. Молекула соединения 3с находится в цвиттер-ионной форме и имеет (2S,4S)-конфигурацию, что подтверждено эффектом аномального рассеяния. Данные РСА депонированы в Кембриджском банке структурных данных (номер CCDC 2019536).
Исследование психотропной активности соединений 3a–e проведено на 56 крысах-самцах линии Wistar (ФГУП “ПЛЖ “Рапполово”, Ленинградская обл., Россия) массой 240–260 г (возраст 5‒6 мес.). В виварии животные акклиматизировались в течение 14 дней перед началом эксперимента при температуре 20 ± 2°C и влажности 40–60% в условиях стандартного 12-и часового цикла “день–ночь” со свободным доступом к пище и питьевой воде (ad libitum). Все эксперименты проводились в соответствии со стандартами исследований на животных, установленными законодательством Российской Федерации и техническими стандартами EASC по надлежащей лабораторной практике (ГОСТ Р 53434-2009 и ГОСТ Р 51000.4-2011).
Соединения вводили внутрибрюшинно (в/б) за 30 мин до поведенческих экспериментов в эквимолярных дозах, определенных как наиболее эффективные в предварительных экспериментах (8, 8, 10, 12 и 13 мг/кг для соединений 3a, 3b, 3c, 3d и 3e соответственно). Исследуемые соединения относятся к классу малотоксичных веществ (LD50 > 3.5 г/кг). Продолжительность тестов составляла 3 мин. В тесте “открытое поле” (ОП) оценивали двигательную активность (по количеству пересеченных квадратов) и ориентировочно-исследовательскую активность животных (по сумме актов стоек и числу обследованных отверстий-норок). В тесте “приподнятый крестообразный лабиринт” (ПКЛ) оценивали уровень тревожности животных: фиксировали суммарное время, проведенное в открытом рукаве и количество актов свешиваний с края открытого рукава. Возможное влияние соединений на формирование и воспроизведение памятного следа было оценено в тесте “условная реакция пассивного избегания” (УРПИ) и “тесте экстраполяционного избавления” (ТЭИ), в которых после этапа обучения проверяли сохранность памятного следа о выученном навыке через 24 ч и 7 суток. В тесте УРПИ фиксировали латентный период (ЛП) захода из ярко освещенного отсека (аверсивной среды) в темный отсек с электродным полом, на который подавали напряжение только на этапе обучения (U = 40 В, I < 50 мА). В ТЭИ на каждом этапе фиксировали ЛП подныривания под край погруженного на 2 см в воду (t = 18–19°C) цилиндра, в который сверху помещалась крыса (оценивалась скорость решения экстраполяционной задачи) [16]. В качестве препарата сравнения использовали фенибут (Усолье-Сибирский химфармзавод, Россия) (20 мг/кг, в/б), обладающий анксиолитической и ноотропной активностью и применяющийся для коррекции тревожных, когнитивных и астенических расстройств.
В тесте ОП в группе животных, получавших соединение 3b, двигательная активность была незначимо выше по сравнению с контрольной (p > 0.05) (табл. 1). Ориентировочно-исследовательская активность была значимо выше только в группе, получавшей фенибут.
Таблица 1.
Показатели двигательной* и ориентировочно-исследовательской** активности в тесте “открытое поле” (n = 8)
| Группа | Двигательная активность | Ориентировочно-исследовательская активность |
|---|---|---|
| Контроль | 35.6 ± 5.3 | 15.5 ± 2.1 |
| 3a | 34.9 ± 5.2 | 8.2 ± 1.9 |
| 3b | 43.3 ± 6.1 | 12.6 ± 3.3 |
| 3c | 37.8 ± 6.0 | 13.0 ± 4.7 |
| 3d | 40.6 ± 4.1 | 14.0 ± 2.2 |
| 3e | 34.0 ± 6.7 | 14.0 ± 2.9 |
| Фенибут | 33.7 ± 4.0 | 22.0 ± 2.8*** |
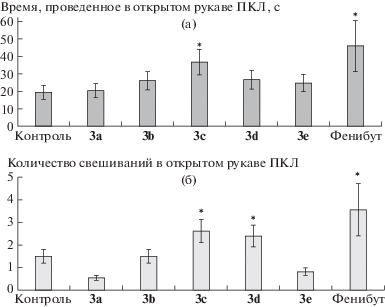
В тесте ПКЛ в группах, которые получали соединения 3c,d, а также препарат сравнения фенибут, показатели тревожности – суммарное время, проведенное в открытом рукаве (3c) и количество актов свешиваний в нем (3c,d) – значимо отличались от показателей в контрольной группе (рис. 3), что указывает на наличие анксиолитической активности, более выраженной у соединения 3c.
Рис. 3.
Продолжительность нахождения крыс в открытых рукавах (а) и число свешиваний в открытом рукаве (б) в тесте “приподнятый крестообразный лабиринт” (ПКЛ) (n = 8). * Различия статистически значимы по сравнению с группой “Контроль” при p < 0.05 по критериям Краскела–Уоллиса и Дана.
В тесте УРПИ спустя 7 дней после обучения в группах, получавших соединения 3a‒c и фенибут, ни одно животное не зашло в темный отсек (который для них более предпочтителен, чем светлая, ярко освещенная площадка) после формирования памятного следа о нанесении болевого раздражителя.
В ТЭИ в группах, получавших соединения 3b–e и фенибут, животные лучше обучались, а спустя 24 ч за более короткое время решали задачу избавления от аверсивной (холодной) воды. Эти данные свидетельствуют о когнитивном потенциале соединений 3b‒e (табл. 2).
Таблица 2.
Латентный период (ЛП) захода в темный отсек (ТО) с электродным полом в тесте “условная реакция пассивного избегания” (УРПИ). Латентный период подныривания в тесте “экстраполяционного избавления” (ТЭИ) (n = 8)
| Группа | ЛП захода в ТО (УРПИ), секунды | ЛП подныривания (ТЭИ), секунды | ||||
|---|---|---|---|---|---|---|
| обучение | через 24 ч | через 7 сут | обучение | через 24 ч | через 7 сут | |
| Контроль | 37.0 ± 12.3 | 172.8 ± 8.6 | 163.0 ± 16.3 | 40.4 ± 8.1 | 21.2 ± 4.2 | 10.3 ± 5.2 |
| 3a | 50.7 ± 10.1 | 180.0 ± 0.0 | 180.0 ± 0.0 | 27.6 ± 5.5 | 31.0 ± 6.2 | 26.4 ± 5.3 |
| 3b | 55.0 ± 11.0 | 180.0 ± 0.0 | 180.0 ± 0.0 | 5.1 ± 1.0* | 8.0 ± 4.0* | 4.5 ± 2.3 |
| 3c | 51.1 ± 10.2 | 149.1 ± 14.9 | 180.0 ± 0.0 | 12.5 ± 2.5* | 11.8 ± 2.9* | 5.0 ± 2.5 |
| 3d | 67.6 ± 13.5 | 175.6 ± 17.6 | 164.5 ± 16.5 | 12.6 ± 2.5* | 5.9 ± 2.9* | 5.0 ± 2.5 |
| 3e | 48.3 ± 9.7 | 180.0 ± 0.0 | 165.1 ± 15.0 | 8.1 ± 1.6* | 4.3 ± 2.1* | 4.5 ± 2.3 |
| Фенибут | 67.8 ± 22.6 | 154.4 ± 25.6 | 180.0 ± 0.0 | 6.8 ± 0.9* | 5.0 ± 1.7* | 2.6 ± 0.4 |
Таким образом, в результате реакции нуклеофильного замещения брома в диметиловом эфире (2S,4RS)-4-бром-N-фталоилглутаминовой кислоты действием первичных ариламинов с последующим выделением преобладающего (2S,4S)-диастереомера и удалением защитных групп получены (2S,4S)-изомеры 1-замещенных 4-амино-5-оксопролинов. Проведено изучение психотропных свойств синтезированных соединений в экспериментах на животных. Установлено, что 4-амино-1-(4-бромфенил)-5-оксопролин 3c и в большей степени 4-амино-1-(4-аминофенил)-5-оксопролин 3d проявляют выраженное анксиолитическое действие в тесте “приподнятый крестообразный лабиринт”, а производные 5-оксопролина, содержащие 4-метилфенильный, 4-бром- фенильный, 4-аминофенильный и 2,3-диметил-5-оксо-1-фенил-3-пиразолин-4-ильный заместители (соединения 3b‒e), обладают ноотропной активностью (улучшают формирование и сохранение памятного следа) по результатам “теста экстраполяционного избавления”. Выявленное соединение-лидер 3c сопоставимо с референтным препаратом (фенибут) по анксиолитической и ноотропной активности, но при этом не проявляет активирующего действия, что может рассматриваться как недостаток, но в ряде случаев при купировании тревожного состояния незначительный активирующий эффект может оказаться нежелательным, поэтому исследуемые производные 5-оксопролина являются перспективными для дальнейшего изучения в качестве средств с противотревожным и ноотропным действием.
Список литературы
Depression. World Health Organization [Электронный ресурс]. URL: https://www.who.int/news-room/fact-sheets/detail/depression (дата обращения: 25.08.2020).
Громова О.А., Торшин И.Ю., Калачева А.Г., Федотова Л.Э., Рудаков К.В. // Журнал неврологии и психиатрии им. С.С. Корсакова. 2016. Т. 116. № 12. С. 96–103.
Naftalin R.J., Cunningham P., Afzal-Ahmed I. // Br. J. Pharmacol. 2004. V. 142. № 3. P. 594–608.
Сысоев Ю.И., Титович И.А., Оковитый С.В., Лала-ев Б.Ю., Болотова В.Ц., Кимаев А.Н., Загладки-на Е.В. // Фармация. 2019. Т. 68. № 1. С. 48–55.
Malykh A.G., Sadaie M.R. // Drugs. 2010. V. 70. № 3. P. 287–312.
Jantos K., Kling A., Mack H., Hornberger W., Moeller A., Nimmrich V., Lao Y., Nijsen M. // Bioorg. Med. Chem. Lett. 2019. V. 29. № 15. P. 1968–1973.
Chiba M., Ishikawa Y., Sakai R., Oikawa M. // ACS Comb. Sci. 2016. V. 18. № 7. P. 399–404.
Rovira X., Trapero A., Pittolo S., Zussy C., Faucherre A., Jopling C., Giraldo J., Pin J.-P., Gorostiza P., Goudet C., Llebaria A. // Cell Chem. Biol. 2016. V. 23. № 8. P. 929–934.
Homerin G., Lipka E., Rigo B., Millet R., Dezitter X., Furman C., Ghinet A. // Tetrahedron. 2017. V. 73. № 35. P. 5327–5336.
Низова И.А., Краснов В.П., Коротовских О.В., Алексеева Л.В. // Изв. АН СССР. Сер. хим. 1989. № 12. С. 2781–2785.
Krasnov V.P., Nizova I.A., Vigorov A.Yu., Matveeva T.V., Levit G.L., Slepukhin P.A., Ezhikova M.A., Kodess M.I. // Eur. J. Org. Chem. 2008. № 10. P. 1802–1810.
Краснов В.П., Королева М.А., Евстигнеева Н.Г., Низова И.А. // Изв. АН. Сер. хим. 1995. № 4. С. 656–659.
Krasnov V.P., Vigorov A.Yu., Nizova I.A., Matveeva T.V., Grishakov A.N., Bazhov I.V., Tumashov A.A., Ezhikova M.A., Kodess M.I. // Eur. J. Org. Chem. 2007. № 25. P. 4257–4266.
Krasnov V.P., Bukrina I.M., Zhdanova E.A., Kodess M.I., Korolyova M.A. // Synthesis. 1994. № 9. P. 961–964.
Вигоров А.Ю., Низова И.А., Тумашов А.А., Ежикова М.А., Кодес М.И., Краснов В.П. // Изв. АН. Сер. хим. 2014. № 6. С. 1317–1321.
Куркин Д.В., Морковин Е.И., Осадченко Н.А., Кнышова Л.П., Бакулин Д.А., Абросимова Е.Е., Горбуно-ва Ю.В., Тюренков И.Н. // Фармация и фармакология. 2019. Т. 7. № 5. С. 291–299.
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах