Доклады Российской академии наук. Химия, науки о материалах , 2020, T. 494, № 1, стр. 32-36
Новые фото- и ионохромные бензотиазолилзамещенные спиробипираны
Е. В. Соловьева 1, Н. А. Волошин 1, А. В. Чернышев 1, *, Ю. С. Реутова 1, А. В. Метелица 1
1 Научно-исследовательский институт физической
и органической химии Южного федерального университета
Ростов-на-Дону, Россия
* E-mail: anatoly@ipoc.sfedu.ru
Поступила в редакцию 13.05.2020
После доработки 05.09.2020
Принята к публикации 22.09.2020
Аннотация
Синтезированы новые фотохромные спиробипираны, содержащие бензотиазольную группу в 2H-хроменовом фрагменте. Реакция спиробипиранов с ионами металлов Co2+, Ni2+, Zn2+, Cu2+ приводит к образованию интенсивно окрашенных комплексов мероцианиновой формы, длинноволновые полосы поглощения которых лежат при λ > 600 нм.
Среди фотохромных соединений спиропираны интенсивно исследуются благодаря широким возможностям модификации их структуры [1], а также возможности создания на их основе полифункциональных молекулярных систем [2]. Наличие хелатирующих заместителей в орто-положении к пирановому атому кислорода спиропиранов способствует образованию комплексных соединений с ионами металлов [3–5], а фотохромные свойства образующихся комплексов открывают возможность применения спиропиранов в качестве фотоуправляемых сенсоров ионов и молекул [6–8]. Большинство исследованных к настоящему времени координационно-активных спиропиранов относятся к индолиновой серии, а их комплексные соединения характеризуются поглощением в видимой области спектра до 600 нм. Вместе с тем, актуальным для биологических применений является получение фотоактивируемых сенсоров ионов металлов, аналитический сигнал которых лежит в области λ > 600 нм, что значительно снижает потери от поглощения тканями [9]. Поэтому перспективным представляется синтез и исследование координационно-активных спиропиранов с гетереновым фрагментом, отличным от индолинового. Одним из классов таких соединений являются спиробипираны симметричного и несимметричного строения. Несмотря на то, что термохромные и фотохромные свойства спиробипиранов хорошо изучены [10, 11], примеры комплексообразования их с ионами металлов немногочисленны. Описана серия симметричных 3,3'-диметил-2,2'спироби(2H-1-бензопиранов), содержащих в положениях 8 и 8' остатки иминодикарбоновых кислот. Cпиробипираны образовывали, по данным ЯМР-спектроскопии, комплексные соединения в бесцветной циклической форме с ионами Ca2+, Mg2+, Sr2+ и не демонстрировали изменения окраски при комплексообразовании. Так же следует отметить отсутствие фотохромных свойств при комнатной температуре как у исходных лигандов, так и у их комплексов [12, 13].
В этой связи цель данной работы заключалась в синтезе и исследовании новых несимметричных спиробипиранов, несущих координационно активный фрагмент. Новые несимметричные спиробипираны (СБП), содержащие бензотиазольный заместитель в нафтопирановом фрагменте, были получены конденсацией солей бензопирилия 1–3 с бензотиазол-замещенным гидроксинафтойным альдегидом 4 в уксусной кислоте, выделением образующихся солей о‑гидроксинафтилвинильных производных 5–7 и обработкой последних аммиаком, которая приводит к образованию СБП 8–10 (схема 1).
nbnek
Строение полученных соединений установлено методами ЯМР-спектроскопии (1Н ЯМР, 13С ЯМР, 15N ЯМР) и подтверждено данными элементного анализа.
Спектры 1Н ЯМР СБП 8–10 содержат сигналы метильной (для соединений 8, 9) и метоксильной (для соединения 10) групп, лежащие в сильном поле, и несколько групп взаимосвязанных сигналов протонов в слабопольной области спектра, относящихся к бензопирановому, нафтопирановому и бензотиазольному фрагментам. Протоны метильной группы в положении 3' бензопиранового фрагмента проявляются в виде дублета (J = = 1.5 Гц) в области 2.11–2.13 м. д., а протон в положении 4' проявляется в виде мультиплета в области 6.67–6.77 м. д. в результате дальней спин-спиновой связи. Отсутствие сигналов протонов пирановых фрагментов в областях спектра, характерных для открытой мероцианиновой формы [14], свидетельствует, что синтезированные СБП 8–10, в отличие от индолиновых аналогов [15], находятся в растворе CDCl3 полностью в спироциклической форме. В спектре 13С ЯМР соединения 8 сигнал атома углерода метильной группы в положении 3 бензопиранового фрагмента проявляется при δ 19.50 м. д. Сигнал атома углерода в положении 4 бензопиранового фрагмента проявляется при δ 123.91 м. д., сигнал атома углерода 2-C двойной связи нафтопиранового фрагмента – при δ 119.84 м. д. Сигналы атомов углерода в положениях 1-С, 4''-C однозначно идентифицируются в двумерных спектрах 1H–13C HSQC, 1H–13C HMBC, но, так как значения сигналов совпадают, то в спектре 13С ЯМР проявляются в виде одного пика при δ 122.68 м. д.
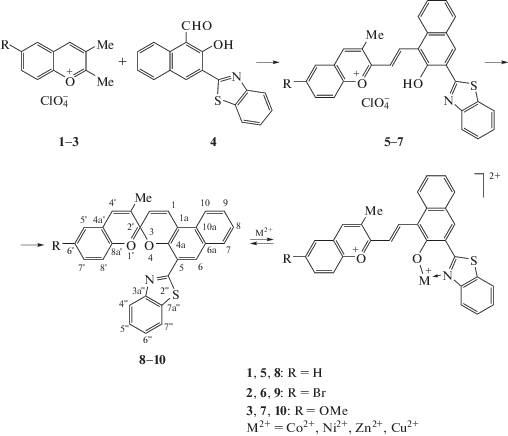
Растворы СБП 8–10 в ацетоне бесцветны вследствие сдвига равновесия в сторону циклической формы. Поглощение спироциклической формы СБП 8–10 представлено двумя полосами – интенсивной (ε = 18280–20480 М–1 см–1) с максимумом на 342 нм и малоинтенсивной (ε = 3110–3420 М–1 см–1) с максимумом на 382 нм. Заместители в бензопирановой и нафтопирановой частях молекулы практически не оказывают влияния на положение и интенсивность полос циклической формы. Исходная циклическая форма демонстрирует слабоинтенсивную флуоресценцию с максимумом в области 423–427 нм. Облучение растворов соединений 8–10 УФ-светом вызывает окрашивание растворов. В спектрах поглощения появляются полосы с максимумами при 554–585 нм, относящиеся к мероцианиновым формам (рис. 1). При прекращении облучения наблюдается обратная термическая реакция рециклизации мероцианинов в циклические формы. Примечательно, что времена релаксации лежат в диапазоне 13–600 с (табл. 1), что на два порядка превышает соответствующие значения для аналогичных индолиновых производных [15].
Рис. 1.
СБП 8 в ацетоне до облучения УФ-светом и в процессе облучения. Спектр поглощения УФ-светом (λобл = 365 нм), C(8) = 4.7 × 10–4 М, временной интервал между спектрами 40 с, Т = 293 К.
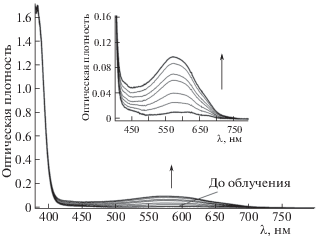
Таблица 1.
Спектральные и кинетические свойства СБП 8‒10 в растворе ацетона, Т = 293 К
| СБП | Циклическая форма | Окрашенная форма | |||
|---|---|---|---|---|---|
| $\lambda _{{\max }}^{{{\text{abs}}}}$, нм (ε × × 10–3, M–1 cм–1) | $\lambda _{{\max }}^{{{\text{fl}}}}$, нм | $\lambda _{{\max }}^{{{\text{abs}}}}$, нм | τ, с | Ea, кДж/моль | |
| 8 | 342 (20.12), 366 (5.35) пл., 382 (3.42) | 426 | 573 | 102 | 50.2 |
| 9 | 345 18.28) пл., 365 (5.27) пл., 382 (3.11) | 423 | 566 | 600 | 49.1 |
| 10 | 342 (20.48) пл., 366 (5.26) пл., 382 (3.37) | 427 | 585 | 13 | 42.1 |
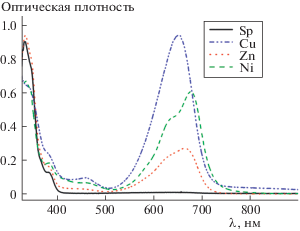
Добавление в растворы СБП 8, 10 в ацетоне перхлоратов Co2+, Ni2+, Zn2+, Cu2+ вызывало интенсивное окрашивание вследствие образования комплексов мероцианиновой формы (схема 1). Их длинноволновые полосы поглощения характеризуются максимумами в области 650–700 нм (рис. 2). В случае спиробипирана 9 реакция образования окрашенных комплексов протекала только с ионами Ni2+, Cu2+. В сравнении с индолиновым аналогом [16], новые СБП 8–10 проявляют ионохромный отклик в более длинноволновой области, а батохромный сдвиг при замене индолинового фрагмента бензопирановым составляет 50–100 нм. Растворы комплексов соединений 8–10 оказались устойчивыми к облучению светом (λобл = 578 нм).
Рис. 2.
Спектр поглощения СБП 8 в ацетоне до и после добавки солей металлов, C(8) = 4.48 × 10–5 М, C(M2+) = 3 × 10–4 M.
Таким образом, были получены новые фотохромные несимметричные спиробипираны, содержащие бензотиазольную группу в нафтопирановом фрагменте, способные в присутствии ионов металлов Co2+, Ni2+, Zn2+, Cu2+ образовывать интенсивно окрашенные комплексы мероцианиновой формы, длинноволновые полосы поглощения которых лежат при λ > 600 нм.
Спектры 1Н и 13С ЯМР регистрировали на спектрометрах “Varian Unity-300” (США) (300 МГц, 1Н) и Bruker “AVANCE-600” (Германия) (600 МГц, 1H; 150 МГц, 13С; 60 МГц, 15N) в CDCl3 при 20°C, отнесение сигналов проведено относительно остаточных сигналов дейтерорастворителя (1H ЯМР: 7.24 м. д., 13С ЯМР: 77.2 м. д.), значения δ измеряли с точностью до 0.01 м. д., КССВ – до 0.1 Гц. Элементный анализ проводили на CHN-анализаторе Kovo (Чехия). Температуры плавления определяли на нагревательном столике Boetius (Германия). Электронные спектры поглощения и кинетические кривые исследуемых соединений регистрировали на спектрофотометре “Agilent 8453” (США) с приставкой для термостатирования образцов. Фотолиз растворов осуществлялся системой “Newport” (США) на основе ртутной лампы мощностью 200 Вт с набором интерференционных светофильтров. Для приготовления растворов использовали ацетон спектральной степени чистоты. Альдегид 4 получали по методике [15]. Соединения 1–3 получали по методикам [17, 18].
2-(3'-метилспиро[бензо[f]хромен-3,2'-хромен]-5-ил)бензо[d]тиазолы 8–10 (общая методика). К кипящему раствору соли пирилия 1–3 (1 ммоль) в 10 мл ледяной уксусной кислоты прибавляли 0.31 г (1 ммоль) альдегида 4, кипятили 2 ч и выдерживали 12 ч при ~20°C. Выпавший осадок отфильтровывали, промывали эфиром, сушили и использовали далее без дополнительной очистки. В суспензию полученной соли 5–7 в 15 мл бензола пропускали ток сухого аммиака до растворения осадка, растворитель упаривали, остаток очищали колоночной хроматографией на Al2O3 (элюент – бензол) и перекристаллизовывали.
2-(3'-метилспиро[бензо[f]хромен-3,2'-хромен]-5-ил)бензо[d]тиазол 8. Выход 57%. Т. пл. 175–177°C (гептан : толуол = 2 : 1). 1Н ЯМР (600 МГц, CDCl3), δ, м. д.: 2.11 (3H, д, J = 1.5 Гц, 3'-Me); 6.24 (1H, д, J = 10.0 Гц, 2-H); 6.75–6.76 (1H, м, 8'-H); 6.77–6.78 (1H, м, 4'-H); 7.01 (1H, д.т, J = 7.5 Гц, 1.1, 6'-H); 7.07 (1H, д.т, J = 7.8 Гц, 1.7, 7'-H); 7.26 (1H, д.д, J = 7.4 Гц, 1.8, 5'‑H); 7.28 (1H, д.д.д, J = 8.1 Гц, 7.1, 1.3, 6''-H); 7.41 (1H, д.д.д, J = 8.3 Гц, 7.1, 1.2, 5''-H); 7.45 (1H, д.д.д, J = 8.0 Гц, 6.8, 1.1, 8-H); 7.60 (1H, д.д.д, J = 8.4 Гц, 6.8, 1.3, 9-H); 7.65–7.67 (1H, м, 7''-H); 7.71 (1H, д, J = 10.0 Гц, 1-H); 7.97 (1H, д, J = 8.3 Гц, 7-H); 8.04 (1H, д, J = 8.1 Гц, 4''-H); 8.13 (1H, д, J = 8.4 Гц, 10-H); 8.98 (1H, c, 6-H). 13C ЯМР (150 MГц, CDCl3), δ, м. д.: 19.50 (3'-Me), 98.74 (2'/3-C), 113.16 (1a-С), 116.51 (8'-C), 119.84 (2-C), 121.13 (10-C), 121.17 (7''-C), 121.41 (4a'-C), 122.10 (6'-C), 122.52 (5-C), 122.68 (1-С, 4''-C), 123.91 (4'-C), 124.52 (6''-C), 124.83 (8-C), 125.76 (5'-C), 125.80 (5''-C), 128.23 (9-C), 128.94 (7'-C), 129.01 (6a-C), 129.36 (3'-C), 129.93 (7-C), 130.27 (6-C), 130.57 (10a-C), 136.60 (7a''‑C), 145.95 (4a'-C), 149.86 (8a'-C), 152.05 (3a''-C), 162.67 (2''-С). 15N ЯМР (60 MГц, CDCl3), δ, м. д.: 301.51 (3''-N). Найдено, %: C 78.26; H 4.19; N 3.21. Вычислено для C29H19NO2S, %: C 78.18; H 4.30; N 3.14.
2-(6'-бром-3'-метилспиро[бензо[f]хромен-3,2'-хромен]-5-ил)бензо[d]тиазол 9. Выход 50%. Т. пл. 246–248 °C (гептан : толуол = 2 : 3). 1Н ЯМР (300 МГц, CDCl3), δ, м. д.:2.13 (3H, д, J = 1.5 Гц, 3'-Me); 6.25 (1H, д, J = 10.0 Гц, 2-H); 6.68 (1H, д.д, J = 8.6, 0.6 Гц, 8'-H) 6.72–6.74 (1H, м, 4'‑H); 7.19 (1H, д.д, J = 8.6, 2.4 Гц, 7'-H); 7.35 (1H, д.д.д, J = 8.2, 7.2, 1.2 Гц, 6''-H); 7.41 (1H, д.д.д, J = 8.3, 7.1, 1.2 Гц, 5''-H); 7.43 (1H, д, J = 2.4 Гц, 5'-H); 7.48 (1H, д.д.д, J = 8.1, 6.7, 1.1 Гц, 8-H); 7.64 (1H, д.д.д, J = 8.5, 6.9, 1.4 Гц, 9-H); 7.75 (1H, д, J = 10.0 Гц, 1-H); 7.76 (1H, д.д.д, J = 7.9, 1.3, 0.7 Гц, 7''-H); 8.00 (1H, д.д.д, J = 8.2, 1.3, 0.7 Гц, 7-H); 8.07 (1H, д.д.д, J = = 1.0, 1.8, 8.2 Гц, 4''-H); 8.15 (1H, д, J = 8.5 Гц, 10‑H); 8.99 (1H, c, 6‑H). Найдено, %: C 66.55; H 3.39; N 2.56. Вычислено для C29H18BrNO2S, %: C 66.42; H 3.46; N 2.67.
2-(3'-метил-6'-метоксиспиро[бензо[f]хромен-3,2'-хромен]-5-ил)бензо[d]тиазол 10. Выход 54%. Т. пл. 202–204°C (гептан : толуол = 1 : 2). 1Н ЯМР (300 МГц, CDCl3), δ, м. д.: 2.13 (3H, д, J = 1.5 Гц, 3'-Me); 3.81 (3H, с, 6'-OMe); 6.26 (1H, д, J = 10.0 Гц, 2-H); 6.65 (1H, д.д, J = 8.8, 2.8 Гц, 7'‑H); 6.71 (1H, д, J = 8.8 Гц, 8'-H); 6.75-6.77 (1H, м, 4'-H); 6.84 (1H, д, J = 2.8 Гц, 5'-H); 7.31 (1H, д.д.д, J = 8.2, 7.2, 1.2 Гц, 6''-H); 7.45 (1H, д.д.д, J = 8.3, 7.1, 1.3 Гц, 5''-H); 7.47 (1H, д.д.д, J = 8.1, 6.7, 1.1 Гц, 8-H); 7.63 (1H, д.д.д, J = 8.4, 6.9, 1.4 Гц, 9-H); 7.73 (1H, д, J = 10.0 Гц, 1-H); 7.68–7.71 (1H, м, 7''-H); 7.98–8.01 (1H, м, 7-H); 8.06 (1H, д.д.д, J = 1.0, 1.7, 8.1 Гц, 4''-H); 8.15 (1H, д, J = 8 Гц, 10-H); 8.99 (1H, c, 6'-H). Найдено, %: C 75.86; H 4.52; N 2.87. Вычислено для C30H21NO3S, %: C 75.77; H 4.45; N 2.95.
Список литературы
Klajn R. Spiropyran-based dynamic materials // Chem. Soc. Rev. 2014. V. 43. P. 148–184. https://doi.org/10.1039/C3CS60181A
Feringa B.L., Browne W.R. (Eds.). Molecular Switches (second ed.). Weinheim.: Wiley, 2011.
Paramonov S.V., Lokshin V., Fedorova O.A. Spiropyran, chromene or spirooxazine ligands: insights into mutual relations between complexing and photochromic properties // J. Photochem. Photobiol. C: Photochem. Rev. 2011. V. 12. P. 209–236. https://doi.org/10.1016/j.jphotochemrev.2011.09.001
Atabekyan L.S., Chibisov A.K. Phototransformation of pyridine-containing nitrosubstituted spiropyran in the presence of metal ions // High Energy Chem. 2018. V. 52. P. 230–235. https://doi.org/10.1134/S0018143918030025
Gao M., Shen B., Zhou J., Kapre R., Louie A. Y., Shaw J.T. Synthesis and comparative evaluation of photoswitchable magnetic resonance imaging contrast agents // ACS Omega. 2020. V. 5. P. 14759−14766. https://doi.org/10.1021/acsomega.0c01534
Ausaf Ali A., Kharbash R., Kim Y. Chemo- and bio-sensing applications of spiropyran and its derivatives—A review // Anal. Chim. Acta. 2020. V. 1110. P. 199–223. https://doi.org/10.1016/j.aca.2020.01.057
Heng S., Reineck P., Vidanapathirana A.K., Pullen B.J., Drumm D.W., Ritter L.J., Schwarz N., Bonder C.S., Psaltis P.J., Thompson J.G., Gibson B.C., Nicholls S.J., Abell A.D. Rationally designed probe for reversible sensing of zinc and application in cells // ACS Omega. 2017. V. 2. P. 6201−6210. https://doi.org/10.1021/acsomega.7b00923
Feuerstein T.J., Müller R., Barner-Kowollik C., Roesky P.W. Investigating the photochemistry of spiropyran metal complexes with online LED-NMR // Inorg. Chem. 2019. V. 58. P. 15479−15486. https://doi.org/10.1021/acs.inorgchem.9b02547
Zhang Y., Zhou Q., Tian Na, Li C., Wang X. Ru(II)-complex-based DNA photocleaver having intense absorption in the phototherapeutic window // Inorg. Chem. 2017. V. 56. P. 1865−1873. https://doi.org/10.1021/acs.inorgchem.6b02459
Bertelson R.C. / in Brown, G.H., (Ed.), Photochromism.; Techniques of Chemistry, Vol. III; Wiley-Interscience: New York, 1971. pp. 45–431.
Lu N.T., Nguyen V.N., Kumar S., McCurdy A. Substituent effects on thermal decolorization rates of bisbenzospiropyrans // J. Org. Chem. 2005. V. 70. P. 9067–9070. https://doi.org/10.1021/jo051449j
McCurdy A., Kawaoka A.M., Thai H., Yoon S.C. Synthesis and characterization of a novel calcium-selective chelator // Tetrahedron Lett. 2001. V. 142. P. 7763–7766. https://doi.org/10.1016/S0040-4039(01)01677-X
Kumar S., Chau C., Chau, G., McCurdy A. Synthesis and metal complexation properties of bisbenzospiro-pyran chelators in water // Tetrahedron. 2008. V. 64. P. 7097–7105. https://doi.org/10.1016/j.tet.2008.05.083
Gabbut C.D., Hepworth J.D., Heron B.M. An NMR investigation of the merocyanine dyes generated by protolysis of some novel spironaphthopyranoindoles // Dyes and Pigm. 1999. V. 42. P. 35–43. https://doi.org/10.1016/S0143-7208(99)00007-8
Волошин Н.А., Чернышев А.В., Метелица А.В., Гае-ва Е.Б., Минкин В.И. Спиропираны и спирооксазины. Сообщение 8. 5'-(1,3-Бензотиазол-2-ил)замещенные cпиро[индолин-2,3'-нафтопираны]: синтез, спектральные и фотохромные свойства // Изв. АН. Сер. хим. 2011. № 9. С. 1888–1893.
Ростовцева И.А., Чернышев А.В., Ткачев В. В., Алдошин С.М., Волошин Н.А., Метелица А.В., Макарова Н.И., Минкин В.И. Спиропираны и спирооксазины. Сообщение 11. Комплексообразование фотохромного 5-(1,3-бензотиазол-2-ил) замещенного 1',3'-дигидроcпиро[бензо[f]хромен-3,2´индола] с ионами металлов // Изв. АН. Сер. хим. 2015. № 3. С. 677–682.
Schiele C., Wilhelm A., Hendriks D., Stepec M., Paal G. Über o-Hydroxyarylvinylpyryliumsalze-I // Tetrahedron. 1968. V. 24. P. 5029–5036. https://doi.org/10.1016/S0040-4020(01)88412-X
Löwenbein A., Katz W. Über substituierte spiro-Dibenzopyrane // Chem. Ber. 1926. V. 59. P. 1377–1383. https://doi.org/10.1002/cber.19260590704
Дополнительные материалы отсутствуют.
Инструменты
Доклады Российской академии наук. Химия, науки о материалах